Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae v.14 n.2 Medellín jul./dez. 2007
EVALUACIÓN DE UN SISTEMA DE FERMENTACIÓN EXTRACTIVA PARA LA PRODUCCIÓN DE ÁCIDO LÁCTICO UTILIZANDO SUERO DE LECHE COMO SUSTRATO
EVALUATION OF AN EXTRACTIVE FERMENTATION SYSTEM FOR THE PRODUCTION OF LACTIC ACID USING WHEY AS SUBSTRATE
Nedher SÁNCHEZ R.1, Diana M. RAMÍREZ L. 1, Arley D. ZAPATA Z.1*
1Facultad de Ciencias, Universidad Nacional de Colombia, Sede Medellín. Calle 59A Número 63-20. Medellín - Colombia.
RESUMEN
En este trabajo se aplica la técnica de fermentación extractiva in situ para la producción y separación de ácido láctico, usando suero de leche como sustrato y Lactobacillus delbrueckii spp. bulgaricus. La técnica consiste en el uso de una fase orgánica en contacto con el medio de cultivo, permitiendo así la extracción directa de un compuesto a medida que éste se produce durante la fermentación. Se utiliza una fase orgánica compuesta por un solvente no polar (hexano, heptano e iso-octano) y tributil fosfato, TBP como agente extractante. Se realizaron pruebas iniciales de toxicidad de la fase orgánica sobre el microorganismo y de capacidad extractiva de ácido láctico, encontrándose que con hexano-TBP se obtienen los mejores resultados. Posteriormente se realiza la fermentación extractiva, para la cual se utiliza un diseño central compuesto, cuyos factores fueron: pH, % (v/v) de TBP en la fase orgánica y % (v/v) de la fase acuosa. Se analizan como variables respuesta la concentración de ácido láctico en el medio de cultivo (ALFA) y el coeficiente de partición Kd, presentando los modelos matemáticos que describen su comportamiento. Se encuentra que el pH es el factor más significativo durante el proceso.
Palabras clave: Ácido láctico, fermentación extractiva, toxicidad, Lactobacillus delbrueckii spp. bulgaricus.
ABSTRACT
In this work the technique of in situ extractive fermentation is applied for the production and separation of lactic acid, using whey as substrate and Lactobacillus delbrueckii spp. bulgaricus. The technique consists on the use of an organic phase in contact with a culture medium that allows the direct extraction of a compound as it is produced during the fermentation. The organic phase used is composed by a non polar solvent (hexane, heptane and iso-octane) and tributyl phosphate, TBP as extracting agent. Toxicity of the organic phase onto the microorganism and its extracting capacity of lactic acid are tested, and finding that the best results were obtained with hexane-TBP. Later on, the extractive fermentation was carried out with a central composite design using pH, % (v/v) of TBP in the organic phase and % (v/v) the water phase as factors. The response variable analyzed were the concentration of lactic acid in the culture medium (ALFA) and the partition coefficient Kd, displaying the mathematical models that describe their behavior. It finding that pH is the more significant factor during the process.
Keywords: Lactic acid, extractive fermentation, toxicity, Lactobacillus delbrueckii spp. bulgaricus.
INTRODUCCIÓN
La obtención de ácido láctico (AL) por medios fermentativos ha sido ampliamente estudiada a nivel mundial, buscando un aumento, tanto técnico como económico, en la productividad del proceso. Con este fin, la evaluación de diferentes medios de cultivo simples o complejos, ha sido de mucho interés (1), (2). Entre los medios complejos, el suero de leche presenta gran importancia para la producción de AL, debido tanto a su alto contenido de lactosa, como al hecho de ser un subproducto industrial generado en grandes cantidades, que muchas veces ocasiona problemas de contaminación ambiental (3).
De la misma manera, los estudios de separación y purificación del AL han tenido un marcado interés, debido a que por sus propiedades fisicoquímicas se hace difícil la destilación y cristalización del mismo, lo cual hace de esta etapa del proceso una de las más complejas y costosas (4-5). La ruta clásica para la recuperación del AL a partir de los caldos fermentativos se basa en la precipitación del lactato de calcio por medio de la adición de Ca(OH)2, después de haber sido separada la biomasa. Posteriormente la sal es filtrada y el resto del material es tratado con ácido sulfúrico, produciendo de esta forma ácido libre y CaSO4 (6). Este proceso tiene algunas desventajas: es discontinuo, se requieren largos tiempos de operación, y los costos de inversión y operación son elevados (4,6,7).
La inhibición por producto es el principal obstáculo en la fermentación láctica, ya que limita el rendimiento que se puede lograr durante el proceso (8). Para contrarrestar este efecto se han propuesto distintas estrategias, una de ellas es el empleo de tecnologías de fermentación que permitan retirar el producto del medio a medida que se forma (9-10). Una de las técnicas con la que se puede lograr este objetivo es la fermentación extractiva in situ, en la cual una fase orgánica insoluble en el medio, extrae el metabolito de interés a medida que éste se produce durante la fermentación. Esta fase orgánica comúnmente se compone de un agente extractante, comúnmente derivados organofosfóricos como el tributil fosfato, TBP, o aminas de alto peso molecular, y de un solvente que puede ser tolueno, keroseno, heptano, hexano, iso-octano, etcétera. El papel que cumple el agente extractante es atrapar el producto de interés y complejarlo, transfiriéndolo de esta manera a la fase orgánica. El solvente, por otra parte, ayuda a controlar la densidad, viscosidad
tensión superficial de la fase orgánica, con lo cual se minimiza la solubilidad de la misma en la fase acuosa (11). Algunos autores, la mayoría a partir de medios de cultivos sintéticos, han estudiado la fermentación extractiva del ácido láctico, usando diferentes solventes y agentes extractantes (6,12-17). De igual manera, otros autores han hecho estudios sobre la producción de ácido láctico a partir de medios complejos como el suero de leche (18 - 19).
Los aspectos técnicos más relevantes en el estudio de la fermentación extractiva son: la toxicidad que la fase orgánica puede generar sobre el microorganismo y la capacidad de extracción que presenta esta fase sobre el metabolito de interés (20). Igualmente el pH del medio es un factor primordial en el estudio, ya que influye tanto en el proceso fermentativo como en el extractivo (11). El presente trabajo tiene por objetivo evaluar estos factores sobre la producción fermentativa y la separación de AL a escala de laboratorio, utilizando como sustrato suero de leche.
MATERIALES Y MÉTODOS
Reactivos
Ácido dinitrosalicílico (DNS) marca Sigma. Hexano, heptano, iso-octano y tributil fosfato (TBP) marca J.T. Baker. Ácido sulfúrico, ácido clorhídrico, ácido láctico e hidróxido de sodio marca Merck. Todos los reactivos son grado analítico.
Técnicas de análisis
Concentración de ácido láctico en la fase acuosa: Fue determinada por HPLC, usando para ello un cromatógrafo Agilent Serie 1100 con una columna de intercambio iónico con relleno de divinilbenceno. Los parámetros de la cromatografía son, volumen de inyección: 5 µl, flujo de la fase móvil: 0.5 ml/min, fase móvil: ácido sulfúrico 0.005 N, temperatura de operación de la columna: 25 0C, longitud de onda del detector: 214 nm. La curva de calibración se hizo usando ácido láctico al 99% de pureza (21).
Concentración de ácido láctico en la fase orgánica: Fue determinada utilizando la técnica de titulación por retroceso. El ácido fue desalojado de la fase orgánica usando una solución de NaOH 0.1 N y luego el exceso de base se tituló con una solución de HCl 0.1 N (12), (22).
Concentración de biomasa: Se cuantificó por densidad óptica medida a 525 nm, la cual fue relacionada con la concentración por medio de la técnica de peso seco. Se utilizó un espectrofotómetro Shimadzu UV-Visible - 160 (19).
Concentración de azúcares reductores: Fue determinada por el método colorimétrico del ácido dinitrosalicílico (DNS). La absorbancia fue medida a 575 nm, utilizando un espectrofotómetro Shimadzu UV-Visible - 160, (23).
Fermentación control
Medio de cultivo: Se utilizó el suero de leche proveniente de la planta procesadora de lácteos de la Universidad Nacional de Colombia, Sede Medellín. Este suero fue desproteinizado por calentamiento a reflujo durante 10 minutos, luego de haber sido ajustado su pH a un valor de 5.5, (equivalente a su punto isoeléctrico), con lo cual precipitan las proteínas permitiendo separarlas (24). Luego se esteriliza el medio a 20 psig y 121 0C durante 15 minutos, para su utilización.
Condiciones de inoculación: Se utilizó Lactobacillus delbrueckii spp. bulgaricus, de la casa comercial CHR HANSEN'S LABORATORY INC, Hørsholm - Dinamarca. El liofilizado fue activado en suero de leche estéril e incubado a 43 °C durante 5 horas, tiempo en el que se llega a la fase exponencial. Este cultivo fue usado como inóculo para las fermentaciones.
Condiciones de fermentación: Se empleó un agitador rotatorio New Brunswick Scientific serie Innova 4400, con control de temperatura. Fueron usados 40 ml de medio de cultivo en erlenmeyers de 50 ml, con lo cual se conserva una cabeza de aire mínima, manteniendo de esta forma condiciones anaeróbicas. Las condiciones de operación fueron, pH inicial del medio 5.5, temperatura 43 °C, velocidad de agitación 125 rpm, concentración inicial de azúcares reductores 60 g/L y concentración inicial de inóculo 4 g/L (3), (17).
Prueba de toxicidad
El procedimiento se hizo según la técnica propuesta por Demirci y Choudhury (17), (14), la cual consiste en una fermentación en la que el medio de cultivo está en contacto con una pequeña cantidad de solución orgánica en relación volumétrica 20:1. Para esta prueba se realiza una fermentación bajo las mismas condiciones que fueron descritas en la fermentación control, adicionando 2 mL de una solución orgánica formada por hexano-TBP, heptano-TBP o iso-octano-TBP. Se realizó un diseño experimental con arreglo factorial de dos factores; tipo de solvente (hexano, heptano e iso-octano) y concentración de TBP en la fase orgánica expresada como % (v/v), cuyos niveles fueron 15% y 30%, definidos a partir de trabajos realizados por otros autores (12,17). Los experimentos se hicieron por triplicado, usando como variable respuesta la concentración de AL obtenida. La influencia de los factores y sus interacciones fueron evaluadas por medio de un análisis de varianza.
Prueba de capacidad extractiva
Para esta prueba se preparó una solución de AL en suero de leche a una concentración de 100 g/L. Este ácido se sometió a un proceso de calentamiento con reflujo a 60 °C por 12 h, con lo cual se logra su despolimerización, llegando así a simular las mismas condiciones que se presentan con el ácido láctico obtenido un proceso fermentativo (15). La metodología consistió en la combinación de 25 ml de la solución de AL preparada (fase acuosa), con 25 ml de una solución formada por un solvente orgánico y TBP (fase orgánica), generando dos fases inmiscibles con un volumen total de 50 ml (50% de fase acuosa). El volumen de fase orgánica fue variado en otros ensayos usando solo 12.5 ml, dando así un volumen total de 37.5 ml (67% de fase acuosa). Se realizó un diseño experimental con arreglo factorial de tres factores; tipo de solvente (hexano y heptano), % de TBP (15% y 30%) y % de fase acuosa (50% y 67%). Se trabajó bajo las mismas condiciones de agitación, temperatura y tiempo de las pruebas anteriores. Los experimentos se hicieron por triplicado usando como variable respuesta el % de recuperación de ácido láctico por parte de la fase orgánica, definido por medio de la ecuación que se muestra a continuación. La influencia de los factores y sus interacciones fueron evaluadas por medio de un análisis de varianza.

Fermentación extractiva
Se utilizó un diseño de experimentos central compuesto, que consiste en un diseño factorial completo 2k, donde k es el número de factores a analizar, además de n0 puntos centrales (n0 >1), y también de dos puntos axiales sobre cada eje de los factores, a una distancia a (a =2k/4) a partir del punto central. El número total de experimentos está dado por: N = 2k +2k + n0 (25).
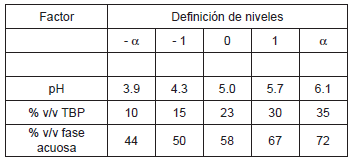
Los factores utilizados en este experimento fueron; % de TBP, % de fase acuosa y pH inicial del medio. Este último factor se incluye debido a que otros autores han confirmado el gran efecto que presenta sobre la fermentación extractiva (11-17, 22, 26, 27). Dado que el pH óptimo de crecimiento de Lactobacillus delbrueckii spp. bulgaricus es de 5.5, y que algunos autores encontraron que la etapa de extracción se favorece a pH bajo (27), se definió un intervalo de trabajo para el factor pH que va desde 3.9 hasta 6.1.
Por medio de la teoría del diseño experimental (25), se definieron los niveles de cada factor (véase Tabla 1). Para este ensayo se tiene que
a =1.6818, k = 3 y n0 = 6, lo cual implica un total de 20 experimentos. Se utilizaron como variables respuesta la concentración de AL en la fase acuosa (ALFA) y el coeficiente de partición de AL (Kd = ALFO/ALFA), donde ALFO es la concentración de AL en la fase orgánica. La influencia de los factores y sus interacciones sobre el modelo de regresión obtenido del tratamiento estadístico, fue evaluada por medio de un análisis de varianza y mostrada a través de diagramas de Pareto.
Tabla 1. Factores y niveles de la fermentación extractiva.
RESULTADOS Y DISCUSIÓN
Fermentación control
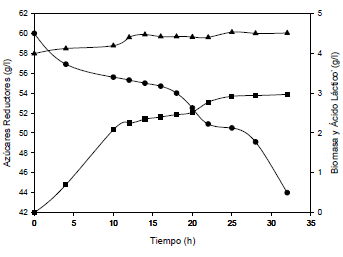
Los resultados obtenidos (véase Figura 1), muestran una producción de AL cercana a 3 g/L (yp/s = 0.218 C-mol ácido láctico/C-mol lactosa), la cual está por debajo de valores reportados en trabajos anteriores (2), (18). Esto se debe principalmente a la necesidad de una etapa de optimización del medio de cultivo, la cual se aleja del objetivo del presente trabajo. También se observa que la máxima concentración de biomasa lograda es tan sólo de 4.5 g/L, lo que implica que no hubo un crecimiento celular significativo, debido tanto al trabajo anaeróbico, como al efecto inhibitorio del AL sobre el crecimiento celular, ampliamente reportado en la literatura (19), (28).
Figura 1. Comportamiento cinético de la fermentación control. T 43 °C, pH 5.5, velocidad de agitación 125 rpm.  Ácido láctico,
Ácido láctico,  azúcares reductores,
azúcares reductores,  biomasa.
biomasa.
Prueba de toxicidad
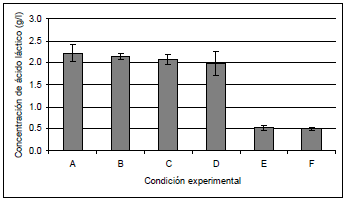
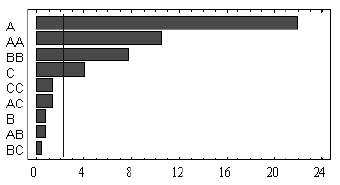
Los resultados muestran que la fase orgánica compuesta por iso-octano-TBP, presentó una mayor toxicidad sobre el microorganismo (véase Figura 2), generando una disminución en la producción de ácido láctico respecto a la fermentación control, cercana a 85%. Por el contrario, el hexano-TBP y heptano-TBP mostraron un menor efecto tóxico, evidenciado en una disminución en la producción de ácido láctico cercana a 30%. Un trabajo realizado por Demirci usando Lactobacillus lactis y glucosa como sustrato, mostró que el hexano-TBP y el heptano-TBP presentan bajos efectos tóxicos (17).
Figura 2. Prueba de toxicidad. (A) hexano, 15% de TBP, (B) hexano, 30% de TBP, (C) heptano, 15% de TBP, (D) heptano, 30% de TBP, (E) iso-octano, 15% de TBP, (F) iso-octano, 30% de TBP.
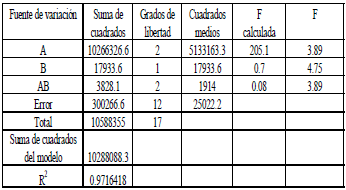
El análisis de varianza (véase Tabla 2) muestra que efectivamente el factor tipo de solvente es significativo sobre la concentración de ácido láctico obtenida durante la fermentación, mientras que el factor % de TBP y la interacción entre los dos factores no lo son. Una prueba Duncan mostró que no existe diferencia significativa entre el hexano y el heptano.
Tabla 2. Análisis de varianza para la prueba de toxicidad. (A) Tipo de solvente, (B) % de TBP.
Una explicación del mayor efecto tóxico mostrado por el iso-octano puede ser la presencia de interacciones dipolo-dipolo inducidas con el agua, superior a la que ejercen los otros compuestos, lo que implica que su solubilidad en el medio de cultivo es mayor, permitiendo así un mayor contacto entre el compuesto y el microorganismo (29).Prueba de capacidad extractiva
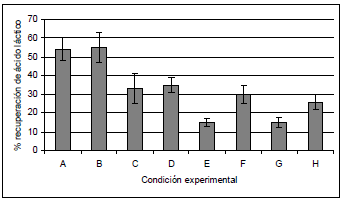
En esta prueba no se incluyó el iso-octano debido al gran efecto tóxico que presentó. Los resultados muestran que al usar hexano como solvente, no se observó un efecto importante por parte del factor % de TBP (véase Figura 3), mientras que con el % de fase acuosa el efecto fue mucho mayor. Por el contrario, al usar heptano como solvente, el efecto del % de TBP sí fue importante, mientras que el efecto de % de fase acuosa no lo fue. Se concluye que usando hexano-TBP y 50% de fase acuosa, se presenta la mayor eficiencia en la recuperación de AL, que llega a valores de 55% de recuperación. La máxima recuperación lograda con el heptano-TBP se presentó al usar un 30% de TBP, y correspondió a 30%. Demirci reporta que con hexano-TBP se logra una recuperación de ácido láctico de 52%, mientras que con heptano-TBP la recuperación es de 38% (17). Kahya, usando una fase orgánica compuesta por alcohol oleico-Alamina 336, reporta que con 50% de fase acuosa se logra la mayor recuperación de ácido láctico, (26). Kilic, trabajando también con una fase orgánica formada por alcohol oleico, encontró que con 45% de fase acuosa se favorece el proceso de recuperación de ácido cítrico (30).
Figura 3. Prueba de capacidad extractiva. (A) hexano, 15% de TBP, 50% de fase acuosa, (B) hexano, 30% de TBP, 50% de fase acuosa, (C) hexano, 15% de TBP, 67% de fase acuosa (D) hexano, 30% de TBP, 67% de fase acuosa, (E) heptano, 15% TBP, 50% de fase acuosa, (F) heptano, 30% de TBP, 50% de fase acuosa, (G) heptano, 15% de TBP, 67% de fase acuosa, (H) heptano, 30% de TBP, 67% de fase acuosa.
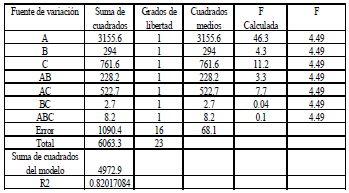
El análisis de varianza (véase Tabla 3), muestra que el tipo de solvente y el % de fase acuosa, con su respectiva interacción, son significativos. Los resultados indican que la capacidad extractiva de ácido láctico está directamente relacionada con la cantidad de fase orgánica utilizada.
Tabla 3. Análisis de varianza para la prueba de capacidad extractiva. (A) Tipo de solvente, (B) % de TBP, (C) % de fase acuosa.
Fermentación extractiva
Basados en los resultados de las pruebas anteriores, se seleccionó el hexano como solvente, por presentar un bajo efecto tóxico sobre el microorganismo y permitir una mejor extracción de ácido láctico. Los factores % de TBP y % de fase acuosa se siguieron usando, con lo cual se buscó evaluar si existe algún tipo de interacción de éstos con el pH inicial del medio.
Con ayuda del programa estadístico Statgraphics, se obtuvieron los modelos de regresión para ALFA y Kd, que se muestran a continuación:
22763.2 - 9351.22 * X1 - 19.8674X2 - 59.593 * X3 + 1063.53 * X12 - 5.76517 * X1 * X2 + 1.58125 * X1 * X3 + 1.31936 * X22 - 0.284597 * X2 * X3 + 0.540844 * X32 (R2 = 94.7520)
Kd = -4.38382 + 2.00094*X1 + 0.0684015*X2 + 0.000399212*X3 - 0.242869*X12 - 0.00141791*X1*X2 + 0.00230559*X1*X3 -0.00141818*X22 + 0.0000582631*X2*X3 - 0.000144769*X32 (R2 = 98.8611)
Donde:
X1: pH inicial del medio de cultivo
X2: % de TBP
X3: % de fase acuosa
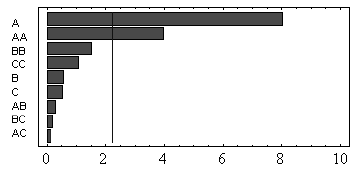
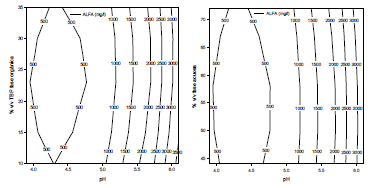
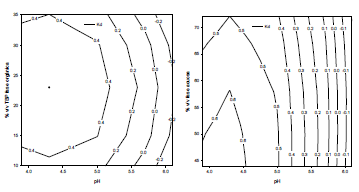
El diagrama de Pareto para la variable respuesta ALFA (véase Figura 4), muestra que únicamente el factor pH es significativo sobre el modelo (P = 0.0000 < 0.05), lo cual puede ser evidenciado también por medio de las superficie de respuesta, donde se observa, además, que a valores de pH altos se favorece la producción de AL (véase Figura 5).
Figura 4. Diagrama de Pareto para la variable respuesta ALFA. (A) % de TBP, (B) % de fase acuosa.
Figura 5. Superficies de respuesta para la variable respuesta ALFA.
El diagrama de Pareto para la variable respuesta Kd (véase Figura 6), muestra que tanto el pH (P = 0.0000 < 0.05), como el % fase acuosa (P=0.0038 < 0.05), son significativos sobre el modelo, aunque su interacción no lo es. Por otra parte el efecto lineal del factor % de TBP, no es significativo, pero su efecto cuadrático sí lo es (P = 0.0001 < 0.05), por lo que se deduce que este último factor también es significativo, lo cual se justifica con ayuda del principio estadístico denominado parsimonia. Observando las superficies de respuesta (véase Figura 7), se observa que a valores de pH menores de 4.5, concentración de TBP cercana a 25% y relación volumétrica de fase acuosa menor de 55%, se favorece la recuperación de AL, llegando a ser del orden de 40%. Figura 6. Diagrama de Pareto para la variable respuesta Kd. (A) % de TBP, (B) % de fase acuosa.
Figura 7. Superficies de respuesta para la variable Kd.
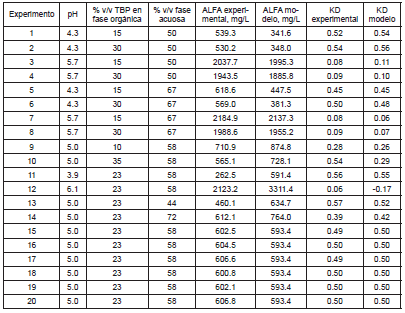
Comparando los resultados experimentales para ALFA y Kd con los obtenidos a través de los modelos matemáticos (véase Tabla 4), se concluye que dichos modelos son adecuados para explicar el comportamiento de las variables. Además, al analizar los resultados obtenidos con respecto al efecto del factor pH, se concluye que el proceso de fermentación extractiva para la producción de ácido láctico, debe ser realizado a valores de pH cercanos a 5, buscando de esta manera un equilibrio entre las mejores condiciones de producción de ácido láctico y de extracción del mismo.
Tabla 4. Descripción de experimentos y resultados de la fermentación extractiva.
AGRADECIMIENTOS
Para la realización del presente trabajo se contó con el apoyo del laboratorio de Bioconversiones de la Universidad Nacional de Colombia, Sede Medellín. De la misma forma se agradece a lso doctores Sebastián Cavalitto y Roque Hours, del Centro de Investigaciones y Desarrollo en fermentaciones Industriales (CINDEFI), La Plata, Buenos Aires, Argentina.
REFERENCIAS BIBLIOGRÁFICAS
1. Zhan YZ, Bon J, Joan MK. Production of lactic acid from renewable materials by Rhizopus fungi. Chem Eng Process. 2006; (46): 361.-374. [ Links ]
2. Hofuendahl K, Hahn-Hagerdal B. Factors affecting the fermentative lactic acid production from renewable resources. Enz Microb Tech. 2000, (26): 87-107. [ Links ]
3. González MI, Álvarez S, Riera F, Álvarez R. Economic evaluation of an integrated process for lactic acid production from ultrafiltred whey. J Food Eng. 2006; (80): 553-561. [ Links ]
4. Planas J, Varelas V, Tjerneld F, Hahn-Hägerdal B. Amine-based aqueous polymers for the simultaneous titration and extraction of lactic acid in aqueous two-phase systems. J Chrom B. 1998; (711): 265-275. [ Links ]
5. Joglekar HG, Imran R, Sureh B, Kulkarni BD, Ajit J. Comparative assesment of downstream procesing options for lactic acid. Separ Techn. 2006; (52): 1-17. [ Links ]
6. Frieling P, Schügerl K. Recovery of lactic acid from aqueous model solutions and fermentation broths. Process Biochem. 1999; (34): 685-696. [ Links ]
7. Pai R, Doherty M, Malon M. Design of reactive extraction systems for bioproduct recovery. AIChe Journal.2002; 48 (3): 514-526. [ Links ]
8. Ye K, Jin S, Shimizu K. Performance improvement of lactic acid fermentation by multistage extractive fermentation. J Ferm Bioeng. 1996; 81 (3): 240-246. [ Links ]
9. Cascaval D, Oniscu C, Dumitru I., Galaction A. New extraction techniques in biotechnology. Roum Biotechnol Lett. 2001; 6 (3): 207-232. [ Links ]
10. Jianping L, Maohong Z, Xiaowei Z, Shiyi L, Yinghua L. Extrative fermentation of L-lactic acid with immobilized Rhizopus oryzae in a three-phase fluidized bed. Chem Eng Proccess. 2007; (46): 369-374. [ Links ]
11. García A, Bonen M, Ramírez-Vick J, Sadaka M, Vuppu A. Bioseparation Process Science. Massachusetts: Blackwell Science; 1999. p. 233-236. [ Links ]
12. Yabannavar V, Wang D. Extractive fermentation for lactic acid production. Biotech Bioeng. 1991; 37: 1095-1100. [ Links ]
13. San Martín M, Pazos C, Coca J. Liquid-liquid extraction of lactic acid with alamine 336. J Chem Tech Biotechnol. 1996; (65): 281-285. [ Links ]
14. Choudhury B, Basha A, Swaminathan T. Study of lactic acid extraction with higher molecular weight aliphatic amines. J. Chem. Technol. Biotechnol. 1998; (72): 111-116. [ Links ]
15. Matsumoto M, Takahashi T, Fukushima K. Synergistic extraction of lactic acid with alkylamine and tri-n-butylphosphate: effects of amines, diluents and temperature. Separ Purif Technol. 2003; (33): 89-93. [ Links ]
16. Matsumoto M, Otono T, Kondo K. Synergistic extraction of organic acids with tri-n-octylamine and tri-n-butylphosphate. Separation and Purificatión Technology. 2001; (24): 337-342. [ Links ]
17. Demirci Pometto A, Harkins K. Rapid screening of solvents and carrier compounds for lactic acid recovery by emulsion liquid extraction and toxicity on Lactobacillus casei (ATCC 11443). Bioseparation. 1999; (7): 297-308. [ Links ]
18. Peñuela M, Vargas G, Torres AM, Ríos R. Evaluación de medios de cultivo preparados a partir de suero de leche enriquecido para la producción de ácido láctico, con Lactobacillus plantarum y Lactobacillus casei. Revista Facultad de Ingeniería. 2001; (24): 35-39. [ Links ]
19. Trujillo M, Suárez F, Gallego D. Fermentación láctica en continuo a partir de suero dulce de leche desproteinizado. Rev Col Biotecnol. 1998; 1 (1): 45-50. [ Links ]
20. Cen P, Tsao G. Recent advances in the simultaneous bioreaction and product separation processes. Sept. Technol. 1993; (3): 58-75. [ Links ]
21. Staniforth M, Hanlon M, Khong T. Comparative study of lactic acid and polylactides using static headspace, gas chromatography and high-performance liquid chromatography. J Chrom. 1999; (833): 195-208. [ Links ]
22. Tik N, Bayraktar E, Mehmetoglu Ü. In situ reactive extraction of lactic acid from fermentation media. J Chem Tech Biotech. 2001; (76): 764-768. [ Links ]
23. Miller GL. Use the dinitrosalicylic acid reagent for determination of reducing sugar. Ana Chem. 1959; 31 (3): 426-430. [ Links ]
24. Gallego Cuenca J. Análisis de tres alternativas para la separación de las proteínas del suero lácteo proveniente de queserías. Medellín: Universidad Nacional de Colombia; 1988. [ Links ]
25. Ghosh S, Swaminathan T. Optimization of process variables for the extractive fermentation of 2,3-butadineol by Klebsiella oxytoca in aqueous two phase system using response surface methodology. Chem Biochem Eng. 2003; 17 (49): 319-325. [ Links ]
26. Kahya E, Bayraktar E, Mehmetoglû. Optimization of process parameters for reactive lactic acid extraction. Turk J Chem. 2001; (25): 223-230. [ Links ]
27. Yankov D, Moliner J, Albert J, Malmary G, Kyuchoukov G. Lactic acid extraction from aqueous solutions with tri-n-octylamine dissolved in decanol and dodecano. Biochem Eng J. 2004; (21): 63-71. [ Links ]
28. Balannec B, Bouguettoucha A, Amrane A. Unstructured model for batch cultures without pH control of Lactobacillus helveticus - inhibitory effect of the undissociated lactic acid. Biochem Engin J. 2007; 35(3): 289-294. [ Links ]
29. Kotz J, Treichel P. Química y reactividad química. 5 Ed. México DF: Thomson Internacional; 2003. p. 514-515. [ Links ]
30. Kilic M, Bayraxtar E, Ates S, Mehmetoglu U. Investigation of extractive citric acid fermentation using response-surface methodology. Process Biochem. 2002; (37): 759-767. [ Links ]
Recibido: Junio 12 de 2007 Aceptado: Septiembre 20 de 2007
*Autor a quien se debe dirigir la correspondencia: adzapata@unal.edu.co