Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.2 Medellín July/Dec. 2007
EFECTOS FARMACOLÓGICOS SOBRE EL SISTEMA NERVIOSO CENTRAL INDUCIDOS POR CUMARINA, AISLADA DE Hygrophila tyttha LEONARD
PHARMACOLOGICAL EFFECTS ON THE CENTRAL NERVOUS SYSTEM INDUCED BY COUMARIN, ISOLATED FROM Hygrophila tyttha LEONARD
Sandra Y. ARIZA1, Diana C. RUEDA1, Javier RINCÓN V.1 Edgar L. LINARES2 y Mario F. GUERRERO1*
1Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia Sede Bogotá. A.A. 14490. Bogotá, Colombia.
2Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia Sede Bogotá. A.A. 14490. Bogotá, Colombia.
RESUMEN
En este estudio se describe el aislamiento, identificación y perfil farmacológico ejercido sobre el sistema nervioso central por cumarina (1,2-benzopirona), molécula obtenida de la especie Hygrophila tyttha Leonard (Acanthaceae. NV: amansamachos), planta medicinal utilizada popularmente en Colombia con fines tranquilizantes. En ratones albinos ICR se llevaron a cabo pruebas destinadas a detectar posible actividad de tipo ansiolítico (laberinto en cruz elevado, enterramiento de esferas), anticonvulsivante (electroshock, pentilentetrazol), sedante (potenciación de sueño inducido por pentobarbital y éter) y relajante muscular (prueba del alambre). Los resultados muestran que cumarina (200 mg/kg, vo) es un compuesto clave en la actividad farmacológica de esta especie, dados sus efectos positivos en las pruebas de laberinto en cruz, enterramiento de esferas, electroshock y potenciación de sueño. Esto abre la posibilidad de encontrar alternativas terapéuticas de tipo ansiolítico, anticonvulsivante y/o sedante a partir de este compuesto natural.
Palabras clave: Cumarina, Hygrophila tyttha, ansiolítico, anticonvulsivante, antidepresivo, sedante.
ABSTRACT
This study shows the isolation, identification and pharmacological profile on the central nervous system induced by coumarin (1-2 benzpyrone), molecule obtained from Hygrophila tyttha Leonard (Acanthaceae. Vulgar name:: amansamachos). This specie is a medicinal plant used in Colombian traditional medicine for the treatment of anxiety. Tests destined to detect possible activity of anxiolytic type (elevated plus maze, marble burying behavior), anticonvulsant (electroshock, pentylenetetrazole), sedative (pentobarbital and ether sleep time) and miorelaxant (wiring test) were used in albino ICR mice. According to the positive results in the plus maze, marble burying, electroshock and sleep tests, coumarin (200 mg/kg, po) seems to be a key compound in the pharmacological response induced by Hygrophila tyttha. These results may led to the finding of therapeutic alternatives of anxiolytic, anticonvulsant and/or sedative kind from this natural compound.
Keywords: Coumarin, Hygrophila tyttha, anxiolytic, anticonvulsant, antidepressant, sedative.
INTRODUCCIÓN
Es un hecho que la mayor parte de la población mundial acude en forma directa o indirecta a las plantas medicinales para su atención primaria en salud (1). Desde luego por razones económicas en buena medida, pero no hay duda de que constituyen fuente de principios farmacológicos, de lo que da cuenta el hecho de que más del 50% de los fármacos utilizados actualmente son de origen natural (2). Desde ese punto de vista, Colombia tiene una importancia estratégica por su biodiversidad. Si a esto se añade el conocimiento tradicional de las comunidades, es enteramente factible encontrar nuevas alternativas terapéuticas en los recursos propios del país.
Las enfermedades del sistema nervioso central afectan un alto porcentaje de la población y acarrean consigo un elevado costo económico, social y emocional. Además, son la causa frecuente de toxicomanías, alcoholismo, y en ocasiones de suicidios. Estudios realizados demuestran que el 40% de la población colombiana ha padecido alguna vez en su vida uno o más trastornos mentales (3), cifra que puede incrementarse fácilmente debido a los problemas de pobreza, desempleo y violencia que afronta nuestro país. Sin duda, para su manejo eficaz requieren un abordaje multidisciplinario, pero el uso de medicamentos es definitivamente necesario en cierto número importante de casos, en los que la sola psicoterapia no es suficiente, particularmente en los pacientes cuyo trastorno mental es de naturaleza predominantemente endógena.
Se dispone en el mercado de productos de origen natural que contribuyen en la farmacoterapia de trastornos diversos del sistema nervioso central. Ejemplos de ellos son galantamina, rivastigmina y extractos de especies como Ginkgo biloba, hierba de San Juan, kava-kava, valeriana, Bacopa monniera y Convolvulus pluricaulis (4). Los esfuerzos de la investigación encaminada a examinar el potencial farmacológico de especies nativas puede, por lo tanto, dar con nuevas alternativas terapéuticas para el manejo de los trastornos del sistema nervioso central.
La especie objeto de la presente investigación es conocida popularmente como: amansamachos o amansaguapos y se vende comúnmente en las plazas de mercado del país con fines tranquilizantes. Es una planta bien conocida en los mercados populares y se vende informalmente.
En un estudio previo (5) se describieron los efectos de tipo ansiolítico y anticonvulsivante sobre el sistema nervioso central por el extracto y algunas fracciones obtenidas de la especie Hygrophila tyttha Leonard, conocida popularmente con el nombre de amansamachos o amansaguapos. En el presente trabajo se describe el efecto farmacológico ejercido por cumarina, uno de los principales compuestos aislados de esta especie. Para ello se utilizaron procedimientos fitoquímicos bioguiados, y modelos de tamizado farmacológico en ratones, orientados a detectar actividad sobre el sistema nervioso central.
MATERIALES Y MÉTODOS
Preparación del extracto
La especie Hygrophila tyttha Leonard (nombre vulgar: amansamachos), se recolectó en Palmira (Valle del Cauca, Colombia) y se clasificó en el Herbario Nacional Colombiano de la Universidad Nacional (Código: 511937 COL).
Diez Kg de material fresco (partes aéreas) se sometieron a secado en estufa de aire circulante, a una temperatura inferior de 50°C durante 72 h y luego se trituraron en un molino de discos. El material vegetal seco obtenido se sometió a percolación con etanol al 96% durante dos días, luego de lo cual se filtró y se concentró en un rotavapor a temperatura cercana a 40°C. El extracto etanólico resultante se transfirió a una cápsula y se dejó secar a temperatura ambiente, al vacío y protegido de la luz, hasta adquirir una consistencia pastosa. Con una porción de este extracto se procedió a la realización de la marcha fitoquímica de rutina para determinar los grupos de metabolitos presentes, aplicando reacciones de coloración, precipitación y cromatografías en capa fina (6).
Fraccionamiento fitoquímico
Del extracto se destinaron 70 g al fraccionamiento fitoquímico, empleando el sistema de partición Kupchan modificado, en el cual se utilizan solventes de diferente polaridad como: hexano, cloroformo, metanol y agua. Para la primera partición se empleó una proporción de CHCl3 - H2O 1:1. La fracción clorofórmica obtenida se secó con sulfato de sodio y se concentró en rotavapor, posteriormente se trató sucesivamente con hexano y una mezcla MeOH-H2O 9:1. La fracción metanólica resultante se concentró en rotavapor y posteriormente se liofilizó para eliminar completamente el agua remanente.
Cuatro gramos de la fracción metanólica obtenida de la partición con solventes se fraccionaron mediante cromatografía en columna a vacío, empleando una columna de vidrio de 3 cm de diámetro, empacada con 109 g de sílica gel G254. La columna se eluyó con hexano, cloroformo y metanol en diferentes proporciones, para variar la polaridad. La mezcla de solventes con la cual eluyó la fracción 4 (cumarina) fue hexano - CHCl3 90:10. Las fracciones se concentraron, se analizaron por cromatografía en capa delgada y se reunieron. Aquellas en las cuales se obtuvieron precipitados, se analizaron utilizando métodos espectrocópicos, que incluyeron espectroscopia infrarroja y resonancia magnética nuclear.
Animales de experimentación
Se emplearon ratones machos ICR de 25 a 35 g de peso, criados y mantenidos en el bioterio de experimentación del Departamento de Farmacia, Universidad Nacional, con ciclos de 12 h luz-12 h oscuridad, temperatura 21±1º C, con agua y comida a libre disposición.
Pruebas farmacológicas
La determinación del perfil de actividad central de cumarina obtenida de la especie Hygrophila tyttha L., se realizó por medio de pruebas orientadas a detectar posibles actividades de tipo ansiolítico, antidepresivo, hipnótico y anticonvulsivante, descritas a continuación. El vehículo utilizado fue la mezcla de glicerina (10%), propilenglicol (3%), polisorbato 80 (2%) y agua destilada (85%).
Suelo agujereado: Se utilizó como prueba de clasificación de los animales, para detectar su nivel basal de ansiedad y así distribuirlos uniformemente en los diferentes grupos de tratamiento (cumarina, control y patrón). Para ello se coloca el animal en el centro de una plataforma de acrílico de 50 x 50 cm a 10 cm de altura, con 16 orificios de dos cm de diámetro, equidistantes. Se evalúa la actividad locomotora durante 5 min, registrando el número de veces que el ratón introduce la cabeza en los agujeros hasta por lo menos el nivel de las orejas. El aumento en el número de exploraciones sugiere un menor estado de ansiedad o una mayor actividad exploratoria (7).
Laberinto en cruz elevado: Consiste en una plataforma de 25 cm de altura, formada por dos brazos abiertos opuestos de 30 x 5 cm y dos brazos cerrados de 30 x 5 x 5 cm, con un área central denominada zona neutra de 5 x 5 cm. Se coloca el animal en la zona neutra, mirando hacia uno de los brazos cerrados y se observa durante 5 min, registrando el
número de veces que ingresa a las zonas abiertas y a las zonas cerradas, al igual que el tiempo de permanencia en ellas. Un aumento en la frecuencia y el tiempo de permanencia en las zonas abiertas sugiere efecto ansiolítico (8).
Enterramiento de esferas: Cada ratón se coloca en una caja de acrílico transparente, sobre una superficie de aserrín que contiene 25 esferas. Al cabo de 10 minutos se registra el número de bolitas enterradas en, al menos, dos terceras partes de la superficie (9). Los animales que esconden mayor número de esferas tienden a presentar un mayor nivel de ansiedad.
Electroshock: Se aplica a cada ratón una descarga eléctrica vía corneal de 50 mA, 20 ms y 60 Hz, tras lo cual se observa si presenta una convulsión tónico-clónica generalizada. La ausencia de la extensión tónica de las extremidades posteriores indica protección frente a la convulsión (10).
Pentilentetrazol: Se administra pentilentetrazol vía subcutánea (80 mg/kg) y se observa, durante 30 minutos, la aparición o no de convulsiones mioclónicas en cabeza, tronco y/o extremidades (10).
Sueño inducido por pentobarbital: Se administra pentobarbital (50 mg/kg, ip) y se observa el tiempo que el animal tarda en perder el equilibrio (período de latencia) y el tiempo que tarda en recuperarlo (período de sueño). Las sustancias hipnóticas tienden a acortar el período de latencia y/o prolongar el período de sueño (11).
Sueño inducido por éter etílico: Esta prueba es útil para descartar que los efectos positivos observados en la prueba de sueño barbitúrico se deban a interacciones sobre el metabolismo hepático (12). El animal se introduce en una cámara de vidrio herméticamente cerrada (30 x 20 cm de diámetro), a la que 10 min antes se le coloca una torunda de algodón (5 g) humedecida con éter (5 mL). El animal se retira de la cámara 60 seg después de haber perdido el reflejo postural. Se registra el período de latencia y el período de duración total de sueño (13).
Prueba del alambre: Esta prueba es útil para evidenciar efectos sobre la coordinación motora (14). Su utilidad es similar a la del eje rodante (15). Suspendiendo al animal por la cola, se le permite agarrarse con sus extremidades delanteras de un alambre (15 x 1 cm), ubicado a 20 cm de altura, se tracciona horizontalmente y se suelta. La alteración motriz se pone en evidencia cuando el animal (previamente entrenado) tarda o no logra agarrarse del alambre con sus patas traseras.
Criterios de experimentación
Para la evaluación de la actividad de cumarina se utilizó una dosis de 200 mg/Kg, vo (5). En cada una de las pruebas se utilizaron 10 ratones por tratamiento: cumarina, patrón y control (vehículo). El volumen de administración fue de 0.01 mL/g de peso. Se utilizaron diferentes patrones según la prueba utilizada, así: diazepam (0.5 mg/kg, ip) en las pruebas de laberinto en cruz, enterramiento de esferas y sueño inducido por pentobarbital; clonazepam (0.5 mg/kg, vo), en la prueba de convulsión por pentilentetrazol y fenitoína sódica (20 mg/kg, vo), en la prueba de convulsión por electroshock.
Aspectos éticos
En todas aquellas circunstancias en las que definitivamente se considere indispensable la prueba in vivo, y en las que no existan alternativas al uso del animal de laboratorio, la investigación debe regirse por una conducta en la que prime el principio de minimizar cualquier dolor o angustia que sea forzoso infligir al animal. Se considera que los modelos experimentales contemplados en este estudio son necesarios en el tamizado farmacológico de sustancias potencialmente útiles. Se siguieron los aspectos fijados en las Normas Científicas, Técnicas y Administrativas para la Investigación en Salud, establecidas en la Resolución No. 008430 de 1993, del Ministerio de Salud de Colombia.
Fármacos y reactivos
Como sustancias patrón se utilizaron: diazepam (VALIUM-ROCHE), fenitoína sódica (PARKE DAVIS), clonazepam (RIVOTRIL-ROCHE), pentilentetrazol (SIGMA), pentobarbital (INVET) e imipramina (SIGMA).
Equipos
Los equipos utilizados en el desarrollo del análisis fitoquímico fueron: bomba de vacío (BUCHI B-169); equipo de liofilización (LABCONCO), horno de convección (OVEN BROILER), evaporador rotatorio (BUCHLER), balanza de triple brazo (OHAUS) serie 700, balanza analítica (SARTORIUS BP221S), lámpara de luz ultravioleta (CHROMATO-VUEC-706), equipo de infrarrojo (PERKIN ELMER 1600 FT-IR), equipo de RMN (BRUKER-400), estufa de secado y equipo de cromatografía de presión media (BUCHI B-688 A).
Para el desarrollo de los ensayos biológicos se utilizó el estimulador fisiológico (Coulbourn Instruments E 13-51), el fisiógrafo computarizado (CI S13-28) y los instrumentos: laberinto en cruz elevado y trapecio, para la realización de cada test.
Diseño experimental y análisis estadístico
En los experimentos de cada una de las actividades a evaluar se aplicó un diseño completamente al azar (DCA). La asignación de los tratamientos: cumarina, control y patrón, se efectuó aleatoriamente. La unidad experimental y observacional en todos los experimentos correspondió al animal íntegro. Se aplicó un análisis de varianza simple (ANOVA), seguido de un análisis de comparaciones múltiples (Tukey), para discriminar los tratamientos responsables de las diferencias significativas en todas las pruebas, excepto en las de convulsiones, inducidas por electroshock y pentilentetrazol, en las que se aplicó la prueba de chi cuadrado, en vista de la naturaleza cuantal de los resultados (del todo o nada: protección o convulsión). Se utilizaron los programas Excel® y SPSS® para el procesamiento de los datos.
RESULTADOS
Identificación de cumarina
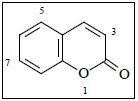
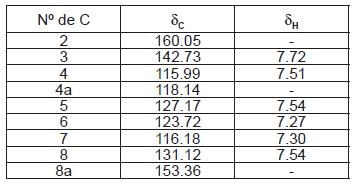
Cumarina (figura 1) se identificó por el análisis de los valores de 1H-NMR y 13C-NMR, descritos en la Tabla 1 (16).
Figura 1. Estructura química de cumarina (1,2-Benzopirona).
Tabla 1. Espectros de RMN de 1H y 13C de cumarina (CDCl3, 400/100 MHz)
Este resultado está de acuerdo con el de la marcha fotoquímica, que indicó la presencia de cumarina en la especie. Con el fin de verificar la identidad del compuesto, se ejecutó una cromatografía en capa delgada, empleando una fase móvil de tolueno- AcOEt 9:1, encontrándose una mancha fluorescente al UV y con el mismo valor de Rf que el patrón de cumarina. Este compuesto puede encontrarse como tal en la especie, o ser el resultado de la hidrólisis de una molécula mayor.
Estudio farmacológico
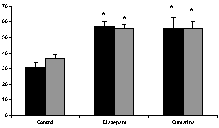
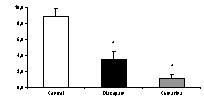
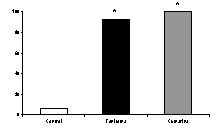
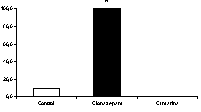
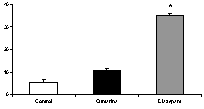
En la prueba de laberinto en cruz elevado, cumarina (200 mg/kg, vo) arrojó resultados significativos, tanto en la frecuencia como en el tiempo de acceso a las zonas abiertas, similares a los observados con diazepam (figura 2). En la la de enterramiento de esferas, en mayor medida que diazepam, ejerció efectos positivos con respecto al control (figura 3). En la de electroshock, arrojó resultados positivos comparables a los ejercidos por el patrón fenitoína sódica (figura 4). En la de pentilentetrazol, no ejerció efectos significativos, a diferencia del patrón, clonazepam
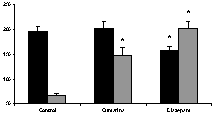
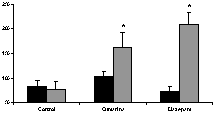
(0,5 mg/kg, vo), (Figura 5). En la de sueño, incrementó significativamente, aunque en menor medida que diazepam (0.5 mg/kg, ip), el tiempo de sueño inducido por pentobarbital (40 mg/kg, ip); diazepam acortó, además, el período de latencia (figura 6). En la de sueño inducido por éter etílico, tanto cumarina como diazepam incrementaron significativamente el período de sueño (figura 7). En la del alambre, a diferencia de diazepam, cumarina no afectó significativamente la función motriz (figura 8).
Figura 2. Efecto de cumarina (200 mg/Kg, vo) y diazepam (0.5 mg/kg, ip) en el porcentaje de tiempo (barras negras) y frecuencia (barras grises) de acceso a los brazos abiertos del laberinto en cruz. Los datos se expresan como el promedio ± ems * p<0,05 con respecto al control.
Figura 3. Efecto de cumarina y diazepam en el número de esferas enterradas. *p<0.05 con respecto al control.
Figura 4. Efecto de cumarina (200 mg/kg, vo) y fenitoína (20 mg/kg, vo) en el porcentaje de protección en la convulsión máxima inducida por electroshock. * p<0.05, con respecto al control (Chi2).
Figura 5. Efecto de cumarina (200 mg/Kg, vo) y clonazepam (0,5 mg/ Kg, ip) en el porcentaje de protección frente a la convulsión inducida por pentilentetrazol (80 mg/kg, sc). Los datos se expresan como el promedio ± ems * p<0,05.
Figura 6. Efecto de cumarina (200 mg/Kg, vo) y diazepam (0,5 mg/kg, ip) en el período de latencia (barras negras) y el período de sueño (barras grises) inducido por pentobarbital (40 mg/kg, ip) Los datos se expresan como el promedio ± ems * p<0,05, comparado con el grupo control.
Figura 7. Efecto de cumarina (200 mg/Kg, vo) y diazepam (0,5 mg/kg, ip) en el período de latencia (barras negras) y el período de sueño (barras grises) inducido por éter. Los datos se expresan como el promedio ± ems * p<0,05, comparado con el grupo control.
Figura 8. Efecto de cumarina (200 mg/Kg, vo) y diazepam (0,5 mg/kg, ip) en el tiempo de prensión con las patas posteriores en la prueba del alambre. Los datos se expresan como el promedio ± ems *p<0,05, comparado con el grupo control.
DISCUSIÓN
En este estudio se verificó la actividad que sobre el sistema nervioso central ejerce cumarina aislada de Hygrophila tyttha Leonard, lo que da cuenta de su posible potencial ansiolítico y anticonvulsivante, si bien no se descarta que metabolitos de tipo flavonoide, terpenoides
y/o esteroles, también tengan alguna participación en la respuesta central inducida por esta especie (5). En un estudio previo se mostró que el extracto de H. tyttha no ejerce efectos letales en ratones según la prueba de Irwin, incluso tras la administración de 2000 mg/kg, vo, si bien se observaron signos depresores del sistema nervioso central a partir de 120 mg/kg, vo (5).
Cumarina produjo resultados interesantes en la prueba de laberinto en cruz, prueba particularmente útil para detectar actividad de tipo gabaérgico, como ocurre con las benzodiacepinas (17). Además, el perfil de tipo ansiolítico de esta molécula se amplia al considerar la prueba de enterramiento de esferas, en donde cabe plantear mecanismos vinculados con la inhibición central de serotonina y/o noradrenalina (18).
Cumarina produjo también resultados favorables en la prueba de convulsión por electroshock; en contraste, los resultados fueron negativos en la prueba de convulsión por pentilentetrazol. Un buen número de fármacos anticonvulsivantes disponibles en el mercado, entre ellos fenitoína sódica y carbamazepina, son activos frente al modelo de convulsión por electroshock, modelo de las crisis tónico-clónicas, a la vez que inefectivos frente a pentilentetrazol, modelo de las crisis de ausencia (19). Esto es claro si se tiene en cuenta que se trata de trastornos convulsivos de bases fisiopatogénicas diferentes. Habría que considerar posibles interacciones directas o indirectas de cumarina con canales de sodio dependientes de voltaje, en vista de la protección conferida por el compuesto frente a la descarga por electroshock (20).
No se descartarían tampoco mecanismos de tipo gabaérgico, si se cotejan los resultados de cumarina en las pruebas de electroshock, laberinto en cruz y potenciación de sueño. En ellas, cumarina observa un comportamiento similar al producido por diazepam, pero difiere de esta benzodiacepina en la ausencia de protección frente a pentilentetrazol, así como en la ausencia de efectos miorrelajantes (a dosis terapéuticas), a juzgar por su comportamiento en la prueba del alambre. Adicionalmente, los efectos notorios de cumarina en la prueba de enterramiento de esferas son sugestivos de mecanismos vinculados con la interacción en la recaptación de serotonina (21).
Cumarina es un compuesto ampliamente conocido, está presente en una gran variedad de plantas, microorganismos y algunas especies animales. Se considera que es de baja toxicidad en el humano, a diferencia de lo que ocurre en otras especies como los roedores. Esto parece deberse a importantes diferencias de especie a especie en sus procesos metabólicos. La hidroxilación en la posición 7 es la ruta metabólica más importante en el humano, en tanto que en ratas y ratones la epoxidación en las posiciones 3-4, parece ser la responsable de sus efectos hepatotóxicos (22).
Las aplicaciones farmacológicas más importantes de derivados cumarínicos se encuentran en el campo de los anticoagulantes, por los compuestos de tipo 4-OH-cumarinas (v.gr. warfarina), que antagonizan la vitamina K. También tienen interés compuestos de tipo aflatoxinas y psoralenos (23). Además, hay que subrayar efectos farmacológicos vinculados con sus acciones de tipo antioxidante, antiinflamatorio e inmunomodulador (24-26), por ejemplo cloricromeno, un derivado sintético de cumarina, inhibe la liberación del ácido araquidónico, lo que explicaría sus efectos antiagregantes y vasodilatadores. Escoparona (6,7-dimetoxicumarina), obtenida de Artemisia scoparia, posee propiedades captadoras de radicales libres de oxígeno, inhibe tirosina quinasa y potencia la proliferación de prostaglandinas, todo lo cual podría explicar efectos inhibitorios en la proliferación de células mononucleares, relajación del músculo liso y disminución de colesterol total y triglicéridos. Fraxetina, 4-metildafnetina y 5,7dihidroxi-4-metilcumarina poseen propiedades captadoras de radicales e inhibidoras de la peroxidación lipídica y de 5-lipooxigenasa. Ostol (7-metoxi-8-[3-metilpent-2-enil] coumarin), aislado de Angelica pubescens, ejerce efectos vasodilatadores, hipotensores y antiagregantes plaquetarios, vinculados con la inhibición del calcio intracelular y fosfodiesteresas de nucleótidos cíclicos. Derivados tipo preniloxicumarinas ejercen efectos inhibitorios sobre la citocromo P450 (CYP 3A4) y podrían ser útiles en tumores de colon (27).
Es posible que los efectos antioxidantes sean responsables, cuando menos en parte, de los efectos farmacológicos sobre el sistema nervioso central observados en este estudio con cumarina; no obstante, a juzgar por algunos datos de la literatura, hay que considerar otro tipo de mecanismos. Derivados con efectos centrales incluyen: dihidropiranocumarinas, que ejercerían efectos neuroprotecores frente a glutamato (28), furocumarinas (aisladas de la raiz de Psoralea corylifolia), con posibles efectos de tipo antidepresivo, vinculados con la inhibición de la MAO-A, MAO-B e inhibición de la superóxido dismutasa y malondialdehído (29); escopoletina, uno de los principales metabolitos de especies de tila, utilizada tradicionalmente con fines tranquilizantes (30); psoralenos, que ejercen efectos hipnóticos (31), y un buen número de derivados cumarínicos con efectos analgésicos (32).
Se conoce más acerca de los efectos de cumarina en otros órganos y sistemas que sobre el sistema nervioso central. Se sabe, por ejemplo, que disminuye el linfedema, efecto vinculado con la modulación de la actividad de macrófagos. Parece ser el metabolito principal responsable de los efectos antiinflamatorios descritos en Melilotus officinalis, así como de los efectos hipnóticos y analgésicos de Leucas inflata L (33, 34). Como producto natural está sujeto a una extensa biotransformación y es posible que su efecto farmacológico resulte de su conversión a hidroxicumarina y/o de su conjugación con ácido glucurónico (27). También estaría implicada en los efectos hipnóticos y analgésicos de Leucas inflata L (34).
En conclusión, cumarina es responsable, cuando menos en parte, de los efectos de tipo ansiolítico, anticonvulsivante y sedante descritos en la especie Hygrophila tyttha Leonard, planta medicinal utilizada tradicionalmente en Colombia con fines tranquilizantes. Esto abre la posibilidad de obtener alternativas terapéuticas a partir de este compuesto. Estudios posteriores habrán de determinar su potencia, eficacia y efectividad farmacológica. Así mismo se requieren estudios adicionales para determinar si los responsables de sus efectos centrales, son mecanismos de tipo antioxidante o si éstos se deben a interacciones de otra naturaleza con receptores canales o mensajeros intracelulares.
AGRADECIMIENTOS
A la Vicerrectoría de Investigación de la Universidad Nacional, al Grupo Búsqueda de Principios Bioactivos en Plantas, y al Grupo de Investigaciones en Farmacología Molecular del Departamento de Farmacia de la Universidad Nacional de Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Akerele O. Nature's medicinal bounty: don't throw it away. World Health Forum. 1993; 14 (4): 390-5. [ Links ]
2. Gurib-Fakim A. Medicinal plants: traditions of yesterday and drugs of tomorrow. Mol Aspects Med. 2006; 27(1):1-93. [ Links ]
3. Posada-Villa J, Aguilar-Gaxiola S, Magaña C, Gómez L. Prevalencia de trastornos mentales y uso de servicios: resultados preliminares del Estudio Nacional de Salud Mental. Colombia 2003. Rev Col Psiqui. 2004. 23 (3): 241-262. [ Links ]
4. Kumar V. Potential medicinal plants for CNS disorders: an overview. Phytother Res. 2006; 20(12):1023-35. [ Links ]
5. Ariza SY, Rincón J, Guerrero MF. Efectos sobre el sistema nervioso central del extracto etanólico y fracciones de Hygrophila tyttha Leonard. RCCQF. 2006; 35 (1): 106-119. [ Links ]
6. Sanabria A. Análisis fitoquímico preliminar. Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. Bogotá: Universidad Nacional de Colombia; 1983. [ Links ]
7. File SE, Pellos S. The effects of triazolobenzodiazepines in two animal tests of anxiety and in the holeboard. Brit J Pharmacol. 1985; 86 (3):729-35. [ Links ]
8. Lister RG. Ethologically-based animal models of anxiety disorders. Pharmacol Ther. 1990; 46(3):321-40. [ Links ]
9. Broekkamp CL, Rijk HW, Joly-Gelouin D, Lloyd KL. Major tranquillizers can be distinguished from minor tranquillizers on the basis of effects on marble burying and swim-induced grooming in mice. Eur J Pharmacol. 1986; 126 (3):223-9. [ Links ]
10. Swinyard, EA, Brown WC, Goodman LS. Comparative assays of antiepileptic drugs in mice and rats. J Pharmacol Exp Ther. 1952; 106: 319-330,. [ Links ]
11. Carlini EA, Contar J de DP, Silva Filho AR, Da Silveira Filho NG, Frochtengarten ML, Bueno OF. Pharmacology of lemongrass (Cymbopogon citratus Stapf) I. Effects of teas prepared from th leaves on laboratory animals. J Ethnopharmacol. 1986; 17 (1): 37-64. [ Links ]
12. Lapa AJ, Souccar C, Lima-Landman MT, Castro MS, de Lima T. Métodos de avaliação da atividade farmacológica de plantas medicinais. Caracterização farmacológica da atividade farmacológica no sistema nervoso central. Sociedade brasilera de plantas medicinais. Setor de produtos naturais. Fortaleza, CE: Departamento de Farmacología. UNIFESP/ EPM. SBPC; 2005. [ Links ]
13. Chambers DM, Jefferson GC, Puddick CA. Halothane-induced sleeping time in the mouse: its modification by benzodiazepines. Eur J Pharmacol. 1978; 50 (2): 103-112, [ Links ]
14. Boissier JR, Dremont C, Robins R, Pagny J. Tentative de pharmacologie prévisionelle dans le domain des neuroleptiques: actions sedative centrale et adrenolytique de la N(dimethoxy-3,4phenetyl)N´(chloro-2 phenyl) piperazine. Arch Int Pharmacodyn Ther. 1961, 133: 29-32. [ Links ]
15. Dunham NW, Miya TS. A note on a simple apparatus for detecting neurological deficit in rats and mice. J American Pharm Assoc. 1957; 46: 208-210. [ Links ]
16. DeGarmo O, Raizman P. Coumarin. En: Kirk RE, Othmer DF, eds. Encyclopedia of Chemical Technology, 2 ed. New York: John Wiley & Sons; 1967. p. 425-33. [ Links ]
17. Rodgers RJ, Dalvi A. Anxiety, defence and the elevated plus-maze. Neurosci Biobehav Rev. 1997; 21(6):801-10. [ Links ]
18. Millan MJ, Dekeyne A, Papp M, La Rochelle CD, MacSweeny C, Peglion JL, et al. S33005, a novel ligand at both serotonin and norepinephrine transporters: II. Behavioral profile in comparison with venlafaxine, citalopram, and clomipramine. J Pharmacol Exp Ther. 2001; 298(2):581-91. [ Links ]
19. Swinyard EA, White HS, Wolf HH, Bondinell WE. Anticonvulsant profiles of the potent and orally active GABA uptake inhibitors SK&F 89976-A and SK&F 100330-A and four prototype antiepileptic drugs in mice and rats. Epilepsia. 1991; 32(4):569-77. [ Links ]
20. Tasso SM, Moon SCh, Bruno-Blanch LE, Estiu GL. Characterization of the anticonvulsant profile of valpromide derivatives. Bioorg Med Chem. 2004; 12(14):3857-69. [ Links ]
21. Borsini F, Podhorna J, Marazziti D. Do animal models of anxiety predict anxiolytic-like effects of antidepressants? Psychopharmacology. 2002; 163 (2):121-41. [ Links ]
22. Lake BG. Coumarin metabolism, toxicity, and carcinogenicity: relevance for human risk assessment. Food Chem Toxicol. 1999; 37 (4): 423-453. [ Links ]
23. Epifano F, Genovese S, Menghini L, Curini M. Chemistry and pharmacology of oxyprenylated secondary plant metabolites. Phytochemistry. 2007; 68 (7): 939-53. [ Links ]
24. Paya M, Halliwell B, Hoult JR. Interactions of a series of coumarins with reactive oxygen species. Scavenging of superoxide, hypochlorous acid and hydroxyl radicals. Biochem Pharmacol. 1992; 44 (2): 205-14. [ Links ]
25. Fylaktakidou KC, Hadjipavlou-Litina DJ, Litinas KE, Nicolaides DN. Natural and synthetic coumarin derivatives with anti-inflammatory/ antioxidant activities. Curr Pharm Des. 2004; 10 (30): 3813-33. [ Links ]
26. National Toxicology Program. NTP toxicology and carcinogenesis studies of coumarin (CAS No. 91-64-5) in F344/N rats and B6C3F1 mice (Gavage Studies). Natl Toxicol Program Tech Rep Ser. 1993; 422:1-340. [ Links ]
27. Hoult JRS, Paydt M. Pharmacological and biochemical actions of simple coumarins: natural products with therapeutic potential. Gen Pharmac. 1996; 27 (4): 713-722. [ Links ]
28. Kang SY, Lee KY, Sung SH, Kim YC. Four new neuroprotective dihydropyranocoumarins from Angelica gigas. J Nat Prod. 2005; 68 (1):56-9. [ Links ]
29. Chen Y, Kong LD, Xia X, Kung HF, Zhang L. Behavioral and biochemical studies of total furocoumarins from seeds of Psoralea corylifolia in the forced swimming test in mice. J Ethnopharmacol. 2005, 15; 96 (3):451-9. [ Links ]
30. Barreiro Arcos ML, Cremaschi G, Werner S, Coussio J, Ferraro G, Anesini C. Tilia cordata Mill extracts and scopoletin (isolated compound): differential cell growth effects on lymphocytes. Phytother Res. 2006; 20(1):34-40. [ Links ]
31. Apseloff G, Hilliard JB, Gerber N, Mays DC. Inhibition and induction of drug metabolism by psoralens: alterations in duration of sleep induced by hexobarbital and in clearance of caffeine and hexobarbital in mice. Xenobiotica. 1991; 21(11):1461-71. [ Links ]
32. Meotti FC, Ardenghi JV, Pretto JB, Souza MM, d' Avila Moura J, Junior AC, et al. Antinociceptive properties of coumarins, steroid and dihydrostyryl-2-pyrones from Polygala sabulosa (Polygalaceae) in mice. J Pharm Pharmacol. 2006; 58(1):107-12. [ Links ]
33. Foldi-Borcsok E, Bedall F, Rahlfs VW. The anti-inflammatory and anti-edematous effects of coumarins from Melilotus officinalis. Arzneimittelforschung. 1971; 21 (12): 2025-30. [ Links ]
34. Al-Yousuf MH, Ali BH, Bashir AK, Tanira MO, Blunden G. Central nervous system activity of Leucas inflata Benth in mice. Phytomedicine. 2002; 9(6):501-7. [ Links ]
Recibido: Junio 15 de 2007 Aceptado: Agosto 28 de 2007
*Autor a quien se debe dirigir la correspondencia: mfguerrerop@unal.edu.co