Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.2 Medellín July/Dec. 2007
EFECTO DEL SOLVENTE EN LA FOTOOXIDACIÓN DE LA AMODIAQUINA CON OXÍGENO MOLECULAR SINGULETE
SOLVENT EFFECT ON THE PHOTOOXIDATION OF AMODIAQUINE WITH SINGLET MOLECULAR OXYGEN
Adriana M. SOTO Z. 1*, Gloria C. VALENCIA U.1, Mariluz GIL.1
1Grupo de fisicoquímica Orgánica, Departamento de Química. Universidad Nacional de Colombia - Sede Medellín, Calle 59A No. 63-20.
RESUMEN
El uso de amodiaquina (AQ) en el tratamiento y prevención de la malaria causa efectos secundarios adversos en tejidos expuestos a la luz; investigaciones previas relacionan esto con la capacidad fotosensibilizadora de este medicamento para generar especies activas del oxígeno, tal como oxígeno molecular singulete (O2(1Δg)). Este estudio muestra constantes de velocidad química, kr, para la reacción entre amodiaquina y O2(1Δg), medidas en varios solventes, en el rango de 0,12±0,02 x 106 M-1s-1 en cloroformo hasta 1,71±0,16 x 106 M-1s-1 en metanol. Las kr son entre uno y dos órdenes de magnitud menores que kT (constante de velocidad total), indicando que la molécula es un eficiente desactivador del oxígeno excitado. El efecto del solvente sobre la constante de velocidad (LSER) muestra que kr aumenta en solventes con alta capacidad de estabilizar cargas y solventes aceptores de protones. Estos resultados indican que la amodiaquina reacciona con el oxígeno molecular singulete, muy probablemente vía un exciplejo de transferencia de carga, como ha sido propuesto para la trietilamina. Además, la poca influencia del carácter dador de protones por el solvente, es atribuida a la formación de un puente de hidrógeno intramolecular entre el protón del fenol y el nitrógeno de la amina terciaria.
Palabras clave: Amodiaquina, Oxígeno singulete, Fotooxidación, Efecto del solvente, LSER.
ABSTRACT
The use of Amodiaquine (AQ) in the treatment and prevention of the malaria, cause adverse effects in tissue exposed to the light; previous investigations relate these nocive effects to the capacity of this drug to generate active species of oxygen as singlet molecular oxygen (O2(1Δg)). This study shows chemical rate constants, kr, for interaction between AQ and (O2(1Δg)) measured in several solvents, in the range from 0,12±0,2 x 106 M-1s-1 in chloroform to 1,71±0,16 x 106 M-1s-1 in methanol, indicating that kr depends on solvent properties, increasing in solvent of greater polarity. Values for kr are one and two orders of magnitude smaller respect to kT (chemical and physical rate constant); these results show that AQ is a good singlet oxygen quencher. Analysis of solvent effects on kr using the LSER, indicates that kr increases in solvents with great capacity to stabilize charges and dipoles and hydrogen-bond acceptor (HBA) solvents. This solvent dependence is similar to that observed in aliphatic amines, such as triethylamine. Therefore, the little significance from parameter donor HBA is attributed to the formation of a intramolecular hydrogen bridge between of phenol and the nitrogen of tertiary amine.
Keywords: Amodiaquine, Singlet oxygen, Photooxidation, Solvent effect, LSER.
INTRODUCCIÓN
La Amodiaquina, un derivado estructural de la 4-aminoquinolina, ha sido ampliamente usada en el tratamiento de la malaria en los últimos 50 años, pero su uso clínico ha sido asociado a reacciones de hipersensibilidad, como hepatotoxicidad(1), agranulocitosis(2), retinopatía(3,4) entre otras, ya que esta droga absorbe luz en la región ultravioleta (UVA) del espectro, (λmáx 340 nm), radiación que es capaz de penetrar algunos tipos de piel y que puede ser transmitida a la retina por las lentes oculares; sin embargo, se encuentra que sensibiliza débilmente la formación de oxígeno molecular singulete; por lo tanto, es posible relacionar, al menos parcialmente, los efectos laterales adversos con la habilidad de este fármaco para generar oxígeno molecular singulete y/o con los productos generados tras la interacción química de AQ con O2(1Δg), pues las constantes de apagamiento medidas en una gama de solventes son del orden de (107M-1s-1) (5) .
340 nm), radiación que es capaz de penetrar algunos tipos de piel y que puede ser transmitida a la retina por las lentes oculares; sin embargo, se encuentra que sensibiliza débilmente la formación de oxígeno molecular singulete; por lo tanto, es posible relacionar, al menos parcialmente, los efectos laterales adversos con la habilidad de este fármaco para generar oxígeno molecular singulete y/o con los productos generados tras la interacción química de AQ con O2(1Δg), pues las constantes de apagamiento medidas en una gama de solventes son del orden de (107M-1s-1) (5) .
Se han realizado numerosos estudios sobre la fototoxicidad de los compuestos antimaláricos (6), en los que se ha propuesto la participación de especies activas de oxígeno, como anión radical superóxido, oxígeno molecular singulete y radical hidroxilo, además de radicales libres centrados en carbono y/o en nitrógeno(7,8). También se ha mostrado que el O2(1Δg) producido por fotosensibilización, puede reaccionar con residuos de aminoácidos fotooxidables de una proteína, para generar especies reactivas que puedan interaccionar con aminoácidos de otras proteínas, provocando el entracruzamiento del biopolímero (7).
Es importante precisar que, además del sistema quinolínico, todas las drogas antimaláricas presentan en su estructura grupos amino alifáticos, aromáticos, y en el caso particular de la AQ, está presente el grupo para-aminifenol, por lo que es interesante estudiar qué grupo o grupos funcionales promueven la interacción con el oxígeno molecular singulete. Sin embargo, cabe anotar que para el caso de los grupos amino esta interacción ha sido ampliamente estudiada (9,10).
Existen determinaciones previas de la kT entre AQ y O2(1Δg), pero se desconoce qué tipo de desactivación predomina (física o química) y cómo la naturaleza de los sustituyentes afecta tal interacción, aspecto importante al momento de establecer órdenes de reactividad. Por lo anterior, es conveniente realizar estudios cinéticos que permitan identificar las características de la interacción entre AQ, nuestro sustrato de estudio, y O2(1Δg).
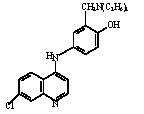
El presente trabajo se propone evaluar la constante de velocidad para la reacción química kr en comparación al efectuado sobre la kT, para determinar cuál es la interacción que predomina entre AQ y el O2(1Δg) (química ó física), mediante el análisis cinético, a través del estudio del efecto del solvente, permitiendo establecer qué grupo o grupos funcionales en la AQ promueven tal reacción. De manera preliminar es posible plantear que el carácter electrofílico del O2(1Δg) lo lleva a interactuar con especies ricas en electrones, que para la AQ en particular (Figura 1), incluyen el grupo amino terciario de alta reactividad, el sistema aromático para-aminofenol, el amino secundario y el sistema quinolínico. Así, tanto el estudio cinético como el análisis del efecto del solvente mediante el uso de relaciones lineales de energía libre de solvatación (LSER), que correlacionan la constante de velocidad del proceso con parámetros empíricos del solvente(11,12), permitirán identificar los centros reactivos, tanto por la magnitud de las constantes, como por la sensibilidad de la reacción frente a los distintos parámetros.
Figura 1. Amodiaquina
MATERIALES Y MÉTODOS
Todos los solventes utilizados fueron grado espectroscópico o HPLC: metanol, etanol, butanol, acetonitrilo, acetona, benceno, tolueno, cloroformo y éter fueron adquiridos de JT Baker, diclorometano, dioxano y acetonitrilo (Mallinckrodt), ácido fórmico (Merck), dietilamina (Aldrich), utilizados sin purificación previa.
El sensibilizador rubreno, y los actinómetros 1,3-difenilisobenzofurano (DPBF), y 9,10-dimetilantraceno (DMA), obtenidos de Aldrich, se utilizaron sin tratamientos previos. Rosa de bengala (R de B), (Fluka), fue recristalizado desde etanol. Acetato de amonio 98% fue adquirido de Sigma Aldrich. Sulfato de sodio anhidro con una pureza de 99% (Panreac). El clorhidrato de amodiaquina fue obtenido de Sigma.
Para determinar las constantes de velocidad en la reacción entre el oxígeno molecular singulete y la AQ, en algunos solventes, se empleó el método de irradiación en estado estacionario, pues el O2(1Δg) se genera por transferencia de energía de un sensibilizador, que es excitado por una fuente de luz constante.
Se procede inicialmente a irradiar la solución de AQ en presencia de rosa de bengala (sensibilizador) en una celda de 1 cm de paso óptico, provista de un sistema de doble pared, para mantener la temperatura constante, utilizando como fuente de irradiación una lámpara halógena de 90 W y un filtro óptico, que permite irradiar la muestra justo a la longitud de onda que absorbe el sensibilizador, sin afectar la AQ.
Utilizando las mismas condiciones experimentales, se determinó la concentración estacionaria de oxígeno molecular singulete por actinometría (14), empleando como sustratos aceptores de oxígeno singulete al 9,10-dimetilantraceno (DMA), 1,3-difenilisobenzofurano (DPBF) y al rubreno; este último tiene velocidad de autoconsumo. El seguimiento del consumo de los actinómetros se realiza por espectrofotometría UV-vis a la λ de máxima absorción del actinómetro, en el solvente utilizado. Tanto en la solución de AQ como en la del actinómetro, debe utilizarse la misma cantidad de sensibilizador, lo cual se verifica logrando la misma absorción a la λ máxima del sensibilizador.
Las constantes de velocidad para la reacción química entre el oxígeno molecular singulete y amodiaquina, se determinaron siguiendo el consumo del sustrato reactivo, AQ, por cromatografía líquida (HPLC). La fase móvil consistió en acetonitrilo y acetato de amonio 0,25 M (80:20, v/v) dopada con 1% (v/v) dietilamina, y ajustando el pH a 3,0 con ácido fórmico. Se trabajó a temperatura ambiente, con una rapidez de flujo de 1 ml/min. El seguimiento se realizó a 340 nm y 254 nm. Paralelamente se observó la señal a 555 nm, para verificar la salida del sensibilizador.
Los estudios del efecto del solvente sobre las constantes de velocidad kr, para la reacción química entre el oxígeno singulete y amodiaquina, se realizaron en términos de ecuaciones lineales de energía libre (LSER) (12), específicamente utilizando los parámetros incluidos en la ecuación de Taft.
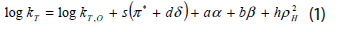
donde 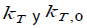 son las constantes de velocidad de la reacción en presencia de un solvente dado y en un solvente de referencia respectivamente. Los coeficientes s, d, a, b y h, dan cuenta de la sensibilidad de la reacción a cada parámetro
son las constantes de velocidad de la reacción en presencia de un solvente dado y en un solvente de referencia respectivamente. Los coeficientes s, d, a, b y h, dan cuenta de la sensibilidad de la reacción a cada parámetro 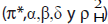 , y cada parámetro hace referencia a alguna propiedad específica del medio; por ejemplo, el parámetro π* hace referencia a la polaridad y polarizabilidad del solvente (11) . El valor δ es un factor de corrección de polarizabilidad y es función del índice de refracción. La escala de acidez α es una medida de la habilidad del solvente para donar puentes de hidrógeno y la escala ß de basicidad se relaciona con la capacidad del solvente para aceptar puentes de hidrógeno o donar pares de electrones libres. El término
, y cada parámetro hace referencia a alguna propiedad específica del medio; por ejemplo, el parámetro π* hace referencia a la polaridad y polarizabilidad del solvente (11) . El valor δ es un factor de corrección de polarizabilidad y es función del índice de refracción. La escala de acidez α es una medida de la habilidad del solvente para donar puentes de hidrógeno y la escala ß de basicidad se relaciona con la capacidad del solvente para aceptar puentes de hidrógeno o donar pares de electrones libres. El término 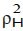 , parámetro de solubilidad de Hildebrand o densidad de energía cohesiva (13), se asocia a cambios en el volumen de las especies involucradas en la expresión cinética y es de trascendental importancia en reacciones concertadas.
, parámetro de solubilidad de Hildebrand o densidad de energía cohesiva (13), se asocia a cambios en el volumen de las especies involucradas en la expresión cinética y es de trascendental importancia en reacciones concertadas.
RESULTADOS Y DISCUSIÓN
Reacción química de O2(1Δg) con AQ
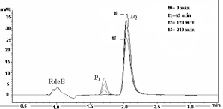
Con el fin de determinar la contribución de la reacción química a la desactivación total del oxígeno molecular singulete, se hizo el seguimiento por HPLC, observando la disminución del pico de la AQ, paralelamente a la aparición de un pico, producto mayoritario (P1), como se muestra en los perfiles de reacción para el sistema AQ-Rosa de bengala en metanol (Véase Figura 2) (16). Con respecto a la identidad de (P1), no fue posible obtenerla por la inestabilidad térmica y fotoquímica del compuesto, pero aun así se pudo observar que en la molécula de AQ se conserva el grupo amino terciario, permitiendo descartar este grupo como centro reactivo de la AQ frente al ataque del O2(1Δg).
Figura 2. Superposición de los perfiles de reacción para el sistema AQ- Rosa de Bengala en metanol en un tiempo (0, 45, 120, y 210) min de irradiación.
La irradiación de la solución AQ en presencia de R de B (sensibilizador), causa un decrecimiento en el pico de la AQ. En este caso, el consumo de AQ sigue una cinética de pseudo-primer-orden (Véase Figura 3), donde la velocidad de consumo de AQ se puede representar de acuerdo con la siguiente ecuación:
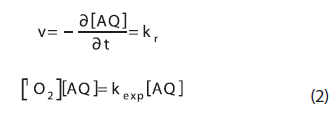
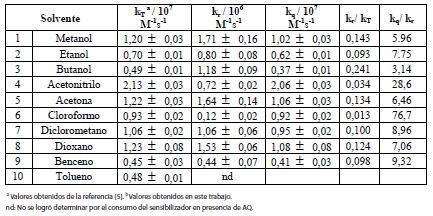
(Véase Tabla 1) las constantes de velocidad (kr) en varios solventes, obtenidas de las pendientes de los gráficos de pseudo-primer-orden, empleando 1,3-difenilisobenzofurano y 9,10-dimetilantraceno como actinómetros.
Figura 3. Fotooxidación de amodiaquina en metanol empleando rosa de Bengala como sensibilizador.
Tabla 1. Constantes de velocidad para la reacción química de amodiaquina con O2(1Δg).
De la tabla se puede observar que las constantes de velocidad química (kr) son entre uno y dos órdenes de magnitud menores que las constantes de velocidad para la reacción total (kT), siendo la contribución de la constante química menor de un 15% en la mayoría de los casos, por lo que se puede deducir que el mecanismo principal de desactivación del O2(1Δg) por AQ, corresponde a un mecanismo de tipo físico (kq). En solventes apróticos, como acetonitrilo, dioxano y acetona, los valores de kr aumentan a medida que aumenta el carácter básico del solvente, de acuerdo a los valores reportados por Reichard(11), siendo 0,26 0,63 y 0,92 respectivamente. En solventes polares como metanol, los valores de la kr son del orden de 106 M-1 s-1, mientras que en solventes apolares como benceno, son del orden de 105 M-1 s-1, lo que muestra que la reacción se ve favorecida en solventes de mayor polaridad. Estos resultados indican que las constantes de desactivación total son dependientes del medio, pues varían dependiendo del tipo de solventes empleados para la reacción.
Analizando la contribución de la reactividad química sobre la constante de velocidad total para cloroformo y butanol, siendo situaciones extremas, con valores de 1,3% y 24,1% respectivamente sobre la kT, esto puede explicarse teniendo en cuenta la diferencia del valor del parámetro α de dichos solventes, ya que el cloroformo presenta el menor valor (0,1) y el butanol el mayor valor (0,84) de acuerdo a los parámetros incluidos en la ecuación solvatocrómica, comprobándose así que solventes básicos atraen protones, desprotegen a la amodiaquina, aumentando la densidad de carga en algunos sectores, e incrementando las posibilidades del ataque electrofílico; por lo tanto el O2(1Δg) reacciona más eficientemente con la AQ generando productos.
Análisis del efecto solvente sobre la constante de reactividad (kr)
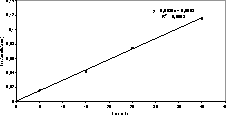
La aplicación de la Ecuación de Taft a los datos de kr obtenidos para la reacción de AQ con O2(1Δg), da como resultado la ecuación presentada a continuación, en la cual se elimina Δ y el parámetro de 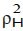 , debido a su bajo peso estadístico (Véase Figura 4).
, debido a su bajo peso estadístico (Véase Figura 4).
Log kr=2,666+3,225π*+0,836+2,234ß (3)
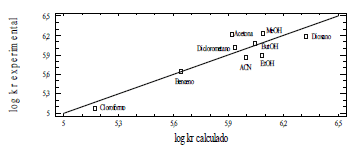
Figura 4. Correlación de los valores de log kr experimental para AQ vs log kr calculado.
En la gráfica se observa una correlación de R2=82 entre los valores calculados experimentalmente y los predichos por el modelo.
La aplicación de la Ecuación de Taft a los datos obtenidos para la amodiaquina muestra como resultado que es más importante el parámetr π con un coeficiente igual a + 3,225, lo que significa que solventes con capacidad de estabilizar cargas y/o dipolos favorecen la kr. Esto implica que el estado de transición de la etapa determinante de la velocidad de reacción, presenta mayor separación de cargas que los reactivos. El parámetro que sigue en importancia es el ß, con un coeficiente de + 2,234, observándose que en solventes aceptores de hidrógenos la constante de velocidad química aumenta, lo que puede interpretarse como que solventes con capacidad de aceptar puentes de hidrógeno, aumentan la densidad de carga en las posiciones susceptibles al ataque electrofílico, favoreciendo la interacción entre AQ y O2(1Δg). Respecto al a, éste no fue incluido en la ecuación definitiva, por la poca influencia que tiene sobre la velocidad de reacción, reflejado en el valor tan pequeño de su coeficiente asociado. Esto indica que el sitio de interacción AQ-O2(1Δg) no es el grupo amino terciario, pues la capacidad de donar puentes de hidrógeno por el solvente altera significativamente la velocidad de reacción, impidiendo el acercamiento del oxígeno excitado al nitrógeno amínico. Lo anterior se refleja en el análisis LSER para la reacción entre la trietilamina y O2(1Δg).
Log k = 8,06 - 1,54a + 0,23 (π* - 0,91d) (4)
En conjunto, estos resultados indican que la amodiaquina reacciona con el oxígeno molecular singulete, muy probablemente vía un exciplejo de transferencia de carga (9), donde el aumento en el valor de kr en solventes polares no próticos, se explica por una mayor estabilización del complejo, por interacciones dipolares.
La AQ presenta varios sitios que eventualmente pueden reaccionar con el oxígeno molecular singulete: el grupo amino terciario de la cadena lateral, el anillo quinolínico y el anillo fenólico. Además, la importancia relativa del parámetro es menor que la observada típicamente en reacciones de transferencia de carga del oxígeno molecular singulete con aminas (9). Teniendo en cuenta dichas consideraciones, se propone que en esta molécula el grupo amino terciario está bloqueado por una interacción de enlace de hidrógeno intramolecular, reportado por Clennan y col (17), que impide el ataque del oxígeno singulete (Véase Figura 5).
Esta interacción, que bloquea el acceso del oxígeno excitado al grupo amino terciario, debería ser más importante en solventes no-próticos, mientras que en solventes próticos, las interacciones del solvente con el par de electrones no enlazantes del nitrógeno amínico también impiden estéricamente la interacción de este grupo con el O2(1Δg).
Considerando los resultados obtenidos en este trabajo y los datos de la literatura, es muy probable que la reacción de la amodiaquina con O2(1Δg), involucre el ataque del oxígeno excitado al grupo para-aminofenólico de la AQ (18). La dependencia de kr con el parámetro π* apoya un mecanismo en el que se presenta una apreciable separación de cargas en el estado de transición de la etapa determinante de la velocidad, mecanismo que ocurre vía un intermediario de transferencia parcial de carga (Véase Figura 6).
Los resultados expuestos anteriormente muestran que la contribución de la constante química sobre la total es entre 10 y 15% en la mayoría de los casos, de lo que puede inferirse que la AQ es un buen apagador del oxígeno excitado por una ruta física, lo que implica que los efectos secundarios podrían ser causados por los productos o por otro tipo de interacciones, en las que no necesariamente intervenga el O2(1Δg) de manera directa, como lo es el entrecruzamiento de proteínas (7). Para evaluar esto, se pueden estudiar técnicas que permitan detectar el entrecruzamiento de proteínas, lo cual puede determinarse inicialmente utilizando tejidos biológicos. También sería interesante observar los cambios que presenta la AQ bajo irradiación directa en el rango de luz al que estamos sometidos por la radiación solar, identificar los productos y evaluar su comportamiento frente al oxígeno molecular singulete o en la generación de otras especies activas del oxígeno.
CONCLUSIONES
Los valores de las constantes de velocidad para la reacción química entre la amodiaquina y el oxígeno molecular singulete, fueron de uno a dos órdenes de magnitud menores que la kT, con una contribución de kr menor de un 15% en la mayoría de los casos, lo que muestra que la molécula es un eficiente desactivador del oxígeno excitado a través de la ruta física en la que se regenera la AQ.
La velocidad de esta reacción es dependiente del solvente, observándose que en solventes polares como metanol, los valores de la kr son del orden de 106 M-1 s-1, mientras que en solventes apolares como benceno, son del orden de 105 M-1 s-1, lo que muestra que la reacción se ve favorecida en solventes de mayor polaridad, favoreciendo la formación de un complejo de transferencia de carga.
La aplicación de la ecuación de Taft a los datos obtenidos para la amodiaquina muestra como resultado que es más importante el parámetro π*, lo que significa que solventes con capacidad de estabilizar cargas y/o dipolos favorecen la kr.
La reacción química de la amodiaquina con el O2(1Δg) es mucho más lenta que la desactivación física, alrededor de uno a dos órdenes de magnitud menor, por lo que la acumulación de productos necesita largos tiempos de irradiación. Este es un factor importante, si se considera que este sustrato es utilizado contra la malaria, ya que podría inhibir la acción dañina del oxígeno molecular singulete y sus efectos secundarios nocivos podrían ser ocasionados por otros mecanismos.
AGRADECIMIENTOS
Expresamos nuestra gratitud por el apoyo de la Universidad Nacional en el proyecto DIME Código 03082741 (QUIPU 20201004540) Reactividad de la amodiaquina frente al oxígeno molecular singulete. También hacemos un reconocimiento al laboratorio de análisis instrumental de la Universidad Nacional, por la disponibilidad de los equipos para llevar a cabo este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Yokoyama A, Mori S, Takahashi HK, Kanke T, Wake H, Nishibori M. Effect of amodiaquine, a histamine N-methyltransferase inhibitor, on, Propionibacterium acnes and lipopolysaccharide-induced hepatitis in mice. European J Pharmacolog. 2007; 558(1-3): p. 179-184. [ Links ]
2. Fontagne J, Roch-Arveiller M, Giroud JP, Lechat P. Effects of some antimalarial drugs on rat inflammatory polymorphonuclear leukocyte function. Biomed Pharmacother. 1989; 43(1): p. 43-51. [ Links ]
3. Zhang H, Solomon VR, Hu C, Ulibarri G, Lee H. Synthesis and in vitro cytotoxicity evaluation of 4-aminoquinoline derivatives. Biomed Pharm. In Press. Corrected Proof. [ Links ]
4. Kristensen S, Grinberg L, Tonnesen HH. Photoreactivity of biologically active compounds: XI. Primaquine and metabolites as radical inducers. European J Pharm Sci. 1997; 5(3): p. 139-146. [ Links ]
5. Lemp E,Valencia C, Zanocco AL, Solvent effects on reactions of singlet molecular oxygen, O2(1[Delta]g), with antimalarial drugs. J Photochem Photobiol A: Chem. 2004; 168(1-2): p. 91-96. [ Links ]
6. Spikes JD, Photosensitizing properties of quinine and synthetic antimalarials. J Photochem Photobiol B: Biol. 1998; 42(1): p. 1-11. [ Links ]
7. Kristensen S, Wang RH, Tønnesen, H.H., Dillon, J., Roberts, J.E. Photoreactivity of biologically active compounds. VIII. Photosensitized polymerization of lens proteins by antimalarial drugs in vitro. Photochemistry and Photobiology 1995. 61(2): p. 124-130 [ Links ]
8. Kristensen S, Wang RH, Tønnesen, H.H., Dillon, J., Roberts, J.E. Photoreactivity of biologically active compounds VII. Interaction of antimalarial drugs with melanin in vitro as part of phototoxicity screening. Journal of Photochemistry and Photobiology B: Biology, 1994. 26(1): p. 87-95. [ Links ]
9. Zanocco AL, Lemp E, Pizarro N, Julio RF, Günther G. Solvent effects on the sensitized photoxygenation of lidocaine. J Photochem Photobiol A: Chem, 2001. 140(2): p. 109-115. [ Links ]
10. Edward L Clennan, L.J.N., T. Wen, and E. Szneler, Solvent effects on the ability of amines to physically quench singlet oxygen as determined by time-resolved infrared emission studies. J Organic chem. 1989; 54(15): p. 3581-3584. [ Links ]
11. Reichardt C, Solvent Effects in Organic Chemistry. 1994. 3: p. 44-60. [ Links ]
12. Kamlet MJ, Abboud JLM, Abraham MH, Taft RW. Linear solvation energy relationships. 23. A comprehensive collection of the solvatochromic parameters, .pi.*, .alpha., and .beta., and some methods for simplifying the generalized solvatochromic equation. J. Org Chem, 1983. 48(17): p. 2877-2887. [ Links ]
13. Schmidt R, Schweitzer S. Physical Mechanisms of Generation and Deactivation of Singlet Oxigen. Chem. Rev. 2003; 103: p. 1685-1757. [ Links ]
14. Nonell S. Photosensitized Production and Physico-Chemical Properties of Singlet of Singlet Molecular Oxigen in Systems of Biological Importance. Steady-State and Time-Resolved Near-IR Phosphorescence Studies. Mülheim: Ed. Max-Planck Institut. 1988. [ Links ]
15. Marcus Y. The propierties of organic liquids that are revelant to their Use as Solvating Solvents. Chem. Soc. Rev, 1993. 22: p. 409-416. [ Links ]
16. Soto AM Valencia GC, Gil M. Estudio cinético de la reacción entre Amodiaquina y Oxígeno molecular singulete. XIV Congreso Colombiano de Química 2006. 27(80): p. 59-60. [ Links ]
15. Clennan EL, Noe LJ, Wen T, Szneler E. Solvent effects on the ability of amines to physically quench singlet oxygen as determined by time-resolved infrared emission studies. Org. Chem, 1989 54(15): p. 3581-3584. [ Links ]
18. Briviba KDA, Devasagayam TP, Siez H, Steenken S. Selective Para Hydroxylation of Phenol and Aniline by Singlet Molecular Oxygen. Chem. Res. Toxicol, 1993. 6: p. 548-553 [ Links ]
Recibido: Agosto 9 de 2007 Aceptado: Octubre 30 de 2007
* Autor a quien se debe dirigir la correspondencia: amsoto@unalmed.edu.co