Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.14 no.2 Medellín July/Dec. 2007
EFECTO DE LA TÉCNICA DE EXTRACCIÓN DE RUTA GRAVEOLENS SOBRE LA ACTIVIDAD ANTITIROSINASA Y CORRELACIÓN ENTRE LA INHIBICIÓN ENZIMÁTICA, EL CONTENIDO DE COMPUESTOS FENÓLICOS Y LA CITOTOXICIDAD
EFFECT OF EXTRACTION TECHNIQUE OF RUTA GRAVEOLENS ON ANTITYROSINASE ACTIVITY AND CORRELATION AMONGST INHIBITORY ACTIVITY, PHENOLIC COMPOUNDS CONTENT AND CYTOTOXICITY
Katalina MUÑOZ D.1*, Julián A. LONDOÑO L.1, Gabriel J. ARANGO A.1, Jelver A. SIERRA R.2, Karent E. BRAVO M.1
1Grupo de Investigación en Sustancias Bioactivas (GISB). Facultad de Química Farmacéutica. Corporación de Patologías Tropicales. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
2Grupo de Inmunodeficiencia Primarias. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
RESUMEN
La pigmentación de la piel es el resultado de la producción y distribución de melanina, un pigmento que es formado por la oxidación sucesiva de la L-Tirosina a L-Dihidroxifenilalanina (L-DOPA) y dopaquinona por el enzima tirosinasa. Las irregularidades en la pigmentación de la piel son un problema estético para muchos individuos. Es por ello que actualmente existe un gran interés en investigar productos con propiedades aclaradoras de la piel. Con el propósito de buscar inhibidores del enzima tirosinasa a partir de productos naturales, se estudian extractos de Ruta graveolens (R. graveolens) empleando diferentes métodos de extracción. Se determina la inhibición de la oxidación de la L-Tirosina catalizada por tirosinasa de hongo y se correlaciona esta actividad con la citotoxicidad y el contenido de compuestos fenólicos, pues se ha reportado que existe actividad inhibidora de este enzima por algunos de estos compuestos. Se encuentra que el método de extracción influye sustancialmente en el contenido de compuestos fenólicos y en la citotoxicidad, mientras ejerce un efecto modesto sobre la actividad inhibidora de tirosinasa.
Palabras clave: Citotoxicidad, inhibición de tirosinasa, Ruta graveolens, despigmentadores
ABSTRACT
Skin pigmentation is the consequence of melanin production and dispersion, this pigment is formed by a successive oxidation of L-Tyrosine into L-Dihydroxyphenylalanine (L-DOPA) and dopaquinone by Tyrosinase enzyme. Skin pigmentation irregularities become an aesthetic problem for many people. Therefore there is a big interest in research on products with skin lightening properties. In order to find inhibitors of Tyrosinase enzyme from natural product, extracts of Ruta graveolens (R. graveolens) were studied by using different extraction methods. The inhibition of the oxidation of L-Tyrosine catalyzed by mushroom tyrosinase is determined and correlated with cytotoxicity and the content of phenolic compounds, because inhibitory activity on the enzyme has been reported of these kind of compounds. It found that the extraction method affects strongly the content of phenolic compounds of the extract and the cytotoxicity as well, in contrast with the inhibition of tyrosinase activity which remains almost unaffected.
Keywords: Cytotoxicity, tyrosinase inhibition, Ruta graveolens, skin lightening agents
INTRODUCCIÓN
Para muchas personas, las irregularidades en la pigmentación de la piel llegan a ser un problema estético y psicológico, principalmente cuando se presentan en el rostro. Por tal razón, hay un gran interés en la búsqueda de productos con propiedades aclaradoras de la piel para el tratamiento de la pigmentación irregular causada por factores internos o externos, tales como hormonas, envejecimiento, exposición a productos químicos y a radiaciones solares (1).
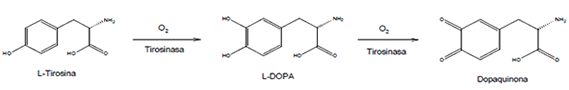
La pigmentación cutánea es, desde el punto de vista bioquímico, el resultado de la producción y distribución de melanina, un pigmento sintetizado en los melanosomas de los melanocitos epidérmicos (2). En este nivel, el aminoácido precursor L-Tirosina es oxidado sucesivamente a L-DOPA y dopaquinona por el enzima tirosinasa cuyo cofactor es el cobre (EC 1.14.18.1). La hiperpigmentación resulta de un incremento en el número de melanocitos o en la actividad de enzimas melanogénicas como tirosinasa (3,4). Este enzima limita la velocidad de biosíntesis de la melanina (5) y es clave en la coloración de la piel, los ojos y el cabello (6). Se encuentra distribuido en mamíferos, plantas y hongos, y tiene como sustratos fenoles y catecoles (7,8).
Varios compuestos, tanto de origen sintético como natural, se han estudiando y reportado como inhibidores de la actividad de tirosinasa. Algunos han sido incluidos en fórmulas cosméticas con propiedades desmanchadoras de la piel, entre ellos la hidroquinona, la arbutina y el ácido kójico. Sin embargo, la hidroquinona es un compuesto altamente reactivo, que presenta actividad mutagénica, y su uso prolongado se ha relacionado con eventos de despigmentación permanente y hepatotoxicidad, por lo cual ha sido prohibido o estrictamente regulado (9). La popularidad y uso de fórmulas que contienen ácido kójico se ha limitado, puesto que también se han reportado serios efectos adversos en humanos, principalmente genotoxicidad , hepatocarcinogenicidad y dermatitis alérgicas (12-15). De igual manera, varios extractos vegetales han sido incluidos en fórmulas cosméticas como inhibidores de
tirosinasa, solos, como es el caso de Lilium candidum, Arctostaphylos uva-ursi (L.) Sprengel, Polygonum bistorta, Coix lacryma-jobi y Sophora angustifolia (16), o en combinación, como Rumex occidentalis S. Wats, R. maritimus L., R. Pseudonatronatus, R. Stenophyllus (Tysrostat®) (17).
Además se ha reportado que los compuestos fenólicos encontrados en vino, como el ácido caféico, el ácido ferúlico y el ácido p-cumárico actúan como inhibidores de tirosinasa (18). Otros fenoles como el canferol, la quercetina, la rutina, la apigenina, el ácido azelaíco, el catecol, la morina, la crisina y otros flavonoides (19) han mostrado ser buenos inhibidores del enzima y en algunos casos se han usado en fórmulas cosméticas.
En este trabajo se presenta el estudio del efecto inhibitorio de R. graveolens sobre el enzima tirosinasa. Ésta es una planta nativa de Europa pero actualmente distribuida por todo el mundo (20). Entre sus componentes activos están el flavonoide rutina (del cual se ha reportado una importante actividad antitirosinasa), aceites esenciales, alcaloides, taninos y cumarinas entre otros (21). Es ampliamente utilizada en la medicina tradicional como antiséptico, estimulante, abortivo, analgésico contra dolores reumáticos, cólicos, amenorrea, menorragia y antiparasitario (22,23), aunque actualmente su uso es controversial debido a sus efectos tóxicos (20).
Para determinar la influencia del método de extracción sobre la inhibición del enzima tirosinasa y correlacionar esta actividad con el contenido de compuestos fenólicos y la citotoxicidad, se evaluaron extractos de R. graveolens obtenidos por percolación, soxhlet y ultrasonido. Estas técnicas de extracción difieren en variables como temperatura y tiempo de extracción, hecho que interfiere en el proceso extractivo (24).
MATERIALES Y MÉTODOS
Reactivos
En los ensayos de inhibición de tirosinasa, citotoxicidad y contenido de compuestos fenólicos se usaron reactivos de alta pureza (Sigma). Para el cultivo celular, RPMI, tripsina, antibióticos y el suero fetal bovino (FBS) se utilizaron reactivos marca Gibco BRL.
Material vegetal
El material vegetal se adquirió de fuentes comerciales. A partir de 170 g secos y molidos de R. graveolens se hizo la extracción con una mezcla agua-etanol en una proporción 1:1. Las metodologías empleadas para la extracción se describen a continuación; extracción por soxhlet (2 h a 60º C), extracción por percolación (24 h a temperatura ambiente) y extracción con ultrasonido (2 h a temperatura ambiente). El solvente se evaporó a presión reducida.
Ensayo de tirosinasa
El ensayo espectrofotométrico para determinar la inhibición de tirosinasa se realizó con base en un método ya descrito previamente por Chen y Kubo (25). Se preparó una solución stock de cada extracto a una concentración de 7.3 mg/ml, usando como solvente una mezcla de DMSO/Buffer fosfato de potasio pH 6.5 (1:27). A partir de estas soluciones se obtuvo una dilución a una concentración final de 2.5 mg/ml. Se preparó una mezcla de reacción con solución de L-Tirosina 1 mM y buffer fosfato pH 6.5 y se oxigenó. Posteriormente se adicionó solución de tirosinasa de hongo a una concentración de 750 U/ml y se realizó un barrido espectrofotométrico minuto a minuto durante 180 minutos en un espectrofotómetro Cary Bio 50 (Varian®). Cada ensayo se realizó por triplicado. Los resultados expresados representan las medias y las desviaciones estándar de las medias. Se tomaron como control preparaciones que no contenían extracto, para evaluar el efecto del solvente sobre el enzima, se realizó por triplicado y se usó cianuro de sodio como inhibidor estándar.
El porcentaje de inhibición se definió como la concentración de producto indicada para causar un cambio en la absorbancia a 481 nm y se determinó mediante la siguiente ecuación:
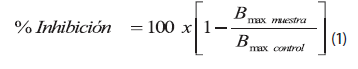
donde,
B max = Parámetro que expresa la máxima unión del ligando con su receptor (Ecuación 2). Este parámetro se discute en la sección Resultados y Discusión.
Ensayo de ciotoxicidad
La actividad citotóxica de los extractos se evaluó en la línea celular L-929 (ATCC CCl-1®), aislada inicialmente de tejido conectivo subcutáneo de ratón. Las células se cultivaron en botellas de 75 cm3 bajo condiciones estándar en medio RPMI 1640 suplementado con 10 % de suero fetal bovino (FBS), 2mM de L-glutamina, 25 mM de HEPES y antibióticos. Los cultivos se mantuvieron en fase de crecimiento exponencial cosechando cada dos días y ajustando la densidad celular a ~2 x105 células/ml. Para el ensayo se prepararon soluciones stock de cada extracto a una concentración de 200 mg/ml, empleando como solvente dimetil sulfóxido (DMSO) y se almacenaron a 4 °C hasta su uso. A partir de éstas se prepararon las diluciones del extracto en las concentraciones requeridas usando como diluente medio de cultivo.
Para estimar la concentración citotóxica 50 (CC50), se utilizó el micrométodo enzimático 3-(4,5-dimethyithiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT), descrito por Mosmann (26). Las células se cosecharon y se sembraron en microplatos de 96 pozos a una densidad de 1 x 104 células por pozo. Los platos se incubaron durante 12 horas hasta la adherencia de las células, y luego se adicionaron las diferentes diluciones del extracto preparadas en medio fresco. Los platos que contenían los extractos a evaluar se incubaron nuevamente durante 72 horas. Pasado este tiempo se retiró el estímulo y se adicionó medio fresco que contenía MTT y se incubó de nuevo a 37° C durante 4 horas. El azul de formazán que se formó se disolvió en DMSO y se leyeron las densidades ópticas a 550 nm con referencia a 630 nm en un espectrofotómetro Power Wave X. Éste ensayo se realizó por triplicado. Los resultados se obtienen a partir del análisis de regresión y se expresan como Concentración citotóxica CC50 (concentración que reduce la población celular en un 50% con respecto al control de células no tratadas), y representan la media de los triplicados y su desviación estándar.
Contenido de compuestos fenólicos
Los compuestos fenólicos se midieron por el método de Folin-Ciocalteau, descrito por Singleton (27). Se preparó una mezcla de reacción que contenía agua destilada, extracto disuelto en una mezcla de DMSO/Metanol 1:1, solución de carbonato de sodio al 10 % y reactivo Folin-Ciocalteau. Esta mezcla se incubó en la oscuridad durante 1 hora y luego se leyó la absorbancia a 760 nm. Los resultados se expresan como µg/ml equivalentes de ácido gálico (GAE) por cada mg de extracto.
RESULTADOS Y DISCUSIÓN
Basados en el análisis cualitativo de la composición de R. graveolens, donde se encuentran flavonoides reportados como inhibidores de la actividad tirosinasa como rutina, quercetina y otros, se pensó inicialmente que la cantidad de compuestos fenólicos extraídos afectaría directamente la actividad tirosinasa (12-15,19). Sin embargo, los datos obtenidos muestran que no existe una relación directa entre el contenido de compuestos fenólicos y la inhibición de este enzima. Esto podría explicarse dado que los resultados del ensayo de actividad se presentan para una concentración de extracto fija. Para clarificar este aspecto, es necesario estimar la Concentración Inhibitoria 50 (IC50) de cada extracto y comparar estos datos normalizados con el contenido de compuestos fenólicos. Este parámetro está siendo determinado en el laboratorio.
Figura 1. Reacción de oxidación de la L-tirosina a dopaquinona catalizada por el enzima tirosinasa.
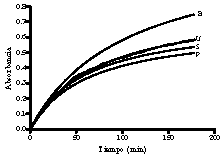
Para determinar la inhibición del enzima tirosinasa por los diferentes extractos se realizó una cinética de la reacción oxidación de L-tirosina a L-dopaquinona y se midió la absorbancia a 480 nm (Figura 2). Al analizar los resultados obtenidos en el paquete estadístico GraphPad Prism® demo, Versión 4,00 para Windows (GraphPad software, Inc, San Diego CA 2003) se encontró que esta cinética sigue un modelo de hipérbola (Figura 2), que describe la unión de un ligando a un receptor. La ecuación matemática que representa este modelo es:
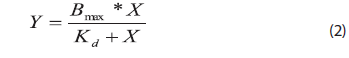
donde,
Bmax = Unión máxima de ligando al receptor
Kd = Concentración de ligando requerida para alcanzar la mitad de la unión máxima
Bmax fue el parámetro utilizado para calcular el porcentaje de inhibición empleando la ecuación (1).
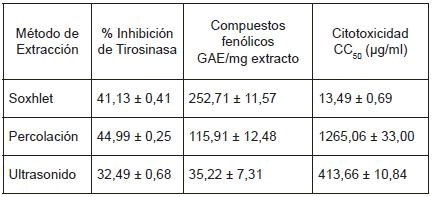
Tabla 1. Resultados de la inhibición de tirosinasa, contenido de compuestos fenólicos y citotoxicidad de extractos de R. graveolens, obtenidos por diferentes métodos de extracción
Al evaluar la actividad de los extractos de R. graveolens sobre la inhibición del enzima tirosinasa se pueden observar diferencias entre ellos. Se encuentra que los extractos hidroalcohólicos de R. graveolens presentan una inhibición del enzima tirosinasa entre 32 y 45% (Tabla 1). El ensayo de inhibición se siguió por un método espectrofotométrico en el cual se midió la absorbancia del producto final de la reacción de oxidación que es, en este caso, L-dopaquinona (Figura 1).
El extracto que produjo una mayor inhibición del enzima tirosinasa fue el obtenido por percolación, y el que causó menor inhibición fue el obtenido por ultrasonido (Tabla 1), (Figura 2).
Para evaluar el efecto tóxico de los extractos, se realizaron ensayos de citotoxicidad basal (MTT). Estos ensayos son un buen punto de partida para evaluar el potencial tóxico in vivo y predecir los efectos agudos de los compuestos in vivo y se utilizan como indicadores de toxicidad sistémica aguda, puesto que si un compuesto es tóxico durante una exposición aguda in vitro, se anticipa, en la mayoría de los casos, que esto refleja una agresión a las funciones intrínsecas de las células (28). En estudios previos para un amplio número de sustancias se demostró una correlación razonable entre la citotoxicidad basal y toxicidad aguda en animales y humanos (9).
Figura 2. Efecto de extractos de R. graveolens sobre la formación de L-dopaquinona medida a 480 nm. Blanco (B), extracto obtenido con ultrasonido (U), extracto obtenido por soxhlet (S), extracto obtenido por percolación (P).
En este trabajo se encontró que el método de extracción afecta de modo importante los valores de citotoxicidad (Tabla 1). Por lo tanto, se sospecha que la citotoxicidad puede estar determinada tanto por el tipo como por la cantidad de compuestos y que los métodos de extracción más astringentes, como soxhlet y ultrasonido, ejercen una mayor acción mecánica y, por lo tanto, extraen compuestos que no pueden ser obtenidos mediante percolación.
El extracto de R. graveolens obtenido por percolación presentó la menor citotoxicidad y el más alto valor de CC50 correspondiente a 1265,06 µg/ml (>1000) y por lo tanto, de acuerdo a la clasificación de toxicidad de Gad Shayne para productos naturales (29), se puede clasificar como un extracto potencialmente no tóxico.
En los ensayos realizados no fue posible establecer una correlación entre la inhibición del enzima tirosinasa y el contenido de compuestos fenólicos (Figura 3), puesto que el extracto obtenido por percolación que presentó la mayor inhibición del enzima no tuvo el mayor contenido de compuestos fenólicos; sin embargo fue el menos citotóxico. El extracto obtenido por soxhlet fue el más citotóxico y tuvo un mayor contenido de compuestos fenólicos. Por lo tanto se sospecha que este método de extracción arroja algún tipo de compuesto fenólico que ejerce poca o nula acción inhibidora sobre el enzima tirosinasa pero que tiene un efecto tóxico sobre las células.
Figura 3. Efecto de extractos de R. graveolens obtenidos por diferentes métodos de extracción sobre la inhibición de tirosinasa, contenido de compuestos fenólicos y citotoxicidad.
CONCLUSIONES
El uso de la especie R. graveolens se encuentra restringido actualmente. Teniendo en cuenta su alta toxicidad, en este estudio se encontró que la citotoxicidad inducida por los extractos de esta planta puede variar de acuerdo con el proceso de extracción empleado, donde una técnica menos astringente, como la percolación, por un periodo de tiempo corto, mantiene los niveles de inhibición de la actividad tirosinasa y reduce en buena medida la citotoxicidad, cuando se compara con la extracción asistida por ultrasonido o soxhlet.
Para muchos compuestos fenólicos, se ha encontrado una capacidad para inhibir la actividad del enzima tirosinasa; sin embargo, en las condiciones empleadas aquí, no se encontró relación entre el contenido de compuestos fenólicos y la inhibición de la actividad enzimática.
Si bien antes de establecer un uso práctico del extracto hidroalcohólico de R. graveolens como agente para uso tópico, es necesaria una caracterización profunda de los efectos tóxicos del extracto, como por ejemplo fototoxicidad, genotoxicidad y mutagenicidad, los resultados de este estudio muestran que el extracto hidroalcohólico obtenido por percolación durante 24 h, presenta un buen perfil de toxicidad, que permite estudiar más a fondo sus propiedades como agente potencialmente aclarador cutáneo. Bajo las condiciones del método, el cianuro de sodio a una concentración de 5mM es un inhibidor de la actividad del enzima tirosinasa.
REFERENCIAS BIBLIOGRÁFICAS
1. Ok-Sub L, Eun-Joung K. Skinn lightening. Cosmet & Toilet. 1995;110:51-6. [ Links ]
2. Robb D. A copper proteins and copper enzymes. Boca Ratón: CRC; 1984;fl:207-41. [ Links ]
3. Griffiths CE, Finkel LJ, Ditre CM, Hamilton TA, Ellis CN, Voorhees J. Topical tretinoin (retinoic acid) improves melasma. A vehicle-controlled, clinical trial. Br J Dermatol. 1993;129(4):415-21. [ Links ]
4. Kanwar AJ, Dhar S, Kaur S. Treatment of melasma with potent topical corticosteroids. Dermatology. 1994; 188(2):170. [ Links ]
5. Del Mármol V, Beermann F. Tyrosinase and related proteins in mammalian pigmentation. FEBS Lett. 1996 Mar 4; 381(3):165-8. [ Links ]
6. Pérez M, García F. Dimethyl sulfide, a volatile flavor constituent, is a slow-binding inhibitor of tyrosinase. Biochem Biophys Res Commun. 2001; 285(2):257-61. [ Links ]
7. Schoot-Uiterkamp AJM, Mason HS. Magnetic dipole-dipole coupled copper (II) pairs in nitric oxide-treated tyrosinase. Structural relation between the active sites of tyrosinase and hemocyanin. Proc Natl Acad Sci 1973; 70:993-6. [ Links ]
8. Van Gelder CWG, Flurkey WH, Wichers HJ. Sequence and structural features of plant and fungal tyrosinases. Phytochem. 1997; 45(7):1309-23. [ Links ]
9. Steinberg DC. Regulatory review the new Japanese cosmetic regulation. Cosmet & Toilet. 2001; 116(1):30-8. [ Links ]
10. Suzuki H, Ikeda N, Kobayashi K, Terashima Y, Shimada Y, Suzuki T, et al. Evaluation of liver and peripheral blood micronucleus assays with 9 chemical using young rats: A study by the Collaborative Study Group for the Micronucleus Test (CSGMT)/Japanese Environmental Mutagen Society (JEMS) - Mammalian Mutagenicity Study Group (MMS). Mutat Res. 2005; 583:133-45. [ Links ]
11. Takizawa T, Imai T, Onose J, Ueda M, Tamura T, Mitsumori K, et al. Enhancement of hepatocarcinogenesis by kojic acid in rat two-stage models alter inition with N-bis(2-hydroxypropyl)nitrosamine or N-diethylnitrosamine. Toxicol Sci. 2004; 81(1):43-9. [ Links ]
12. Maeda K, Fukuda M. Arbutin: mechanism of its depigmentation action in human melanocyte culture. J Pharmacol Exp Ther. 1996; 276:765-69. [ Links ]
13. Nihei K-I, Kubo I. Identification of oxidation product of arbutin in mushroom tyrosinase assay system. Bioorg Med Chem Lett. 2003;13(14):2409-12. [ Links ]
14. Saruno R, Kato F, Ikeno T. Kojic acid: a tyrosinase inhibitor from Aspergillus albus. Agric Biol Chem. 1979; 43:1337-8. [ Links ]
15. Seo SY, Sharma VK, Sharma N. Mushroom tyrosinase: recent prospects. J Agric Food Chem. 2003; 51(10):2837-53. [ Links ]
16. Curto EV, Kwong C, Hermersdörfer H, Glatt H, Santis C, Virador V, et al. Inhibitors of mammalian melanocyte tyrosinase: in vitro comparisons of alkyl esters of gentisic acid whit other putative inhibitors. Biochem Pharmacol. 1999; 57:663-72. [ Links ]
17. Fox C, Kosey K. Technically Speaking: patents skin lightening formula. Cosmet & Toilet. 1998; 23. [ Links ]
18. Gómez-Cordovés C, Bartolomé B, Vieira W, Virador VM. Effect of wine phenolics and sorghum tannins on tyrosinase activity and growth of melanoma cells. J Agric Food Chem. 2001; 49:1620-24. [ Links ]
19. Kubo I, Kinst-Hori I, Swapan KC, Kubo Y, Sánchez Y, Ogurab T. Flavonols from Heterotheca inuloides: tyrosinase inhibitory activity and structural criteria. Bioorg Med Chem. 2000; 8(7):1749-55. [ Links ]
20. Raghau S, Gupta B, Agrawal C, Goswami K, Das H. Anti-inflammatory effect of Ruta graveolens L. in murina macrophage cell. J Ethnopharmacol. 2006; 104:234-239. [ Links ]
21. Wagner H, Bladt S. Plant drug análisis: a thin layer chromatography. 2ª ed. Alemania: Springer-Verlag; 2001. p.129. [ Links ]
22. Srivastava SD, Srivastava SK, Halwe K. New coumarins and limonoids of Ruta graveolens. Fitoterapia. 1998;69(11):80-81. [ Links ]
23. Kong YC, Lau CP, Wat KH, Ng KH, But PP, Cheng KF, et al. Antifertility principle of Ruta graveolens. Planta Med. 1989;55(2):176-8. [ Links ]
24. Sharapin N, Pinzón R. Fundamentos de tecnología de productos fitoterapéuticos. Convenio Andrés Bello. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. Santafé de Bogotá: Quebecor-Impreandes; 2000. p. 38-9. [ Links ]
25. Chen QX, Kubo I. Kinetics of mushroom tyrosinase inhibition by quercetin. J Agric Food Chem. 2002; 50:4108-12. [ Links ]
26. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983; 65(1-2):55-63. [ Links ]
27. Singleton VL, Orthofer R, Lamuela-Raventos RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol. 1991; 299:152-78. [ Links ]
28. Eisenbrand G, Pool-Zobel B, Baker V, Balls M, Blaauboer B J, Boobis A, et al. Methods of in vitro toxicology. Food Chem Toxicol. 2002; 40(2):193-236. [ Links ]
29. Gad Shayne C. Alternatives to in vivo studies in toxicology. En: Balantyne B, Marrs T, Syversen T. General and applied toxicology. Vol (1). USA: Grove's dictionaries Inc.; 1999. p. 178. [ Links ]
Recibido: Febrero 19 de 2007 Aceptado: Septiembre 18 de 2007
* Autor a quien se debe dirigir la correspondencia: kmunos@farmacia.udea.edu.co