Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae v.14 n.2 Medellín jul./dez. 2007
ACCIÓN INSECTICIDA DE EXTRACTOS ETANÓLICOS DE ESPONJAS DEL GOLFO DE URABÁ SOBRE LARVAS DE Aedes aegypti y Culex quinquefasciatus
INSECTICIDE ACTION OF ETHANOL EXTRACTS OF SPONGES FROM URABÁ GULF ON Aedes aegypti AND Culex quinquefasciatus larvae
Alejandro MARTÍNEZ M.1*, Elkin GALEANO J.1, Jorge CADAVID2, Yuly MIRANDA R.1, Juliana LLANO L.3 y Karla MONTALVO M.3
1Grupo de Investigación de Productos Naturales Marinos, Facultad de Química Farmacéutica, Universidad de Antioquia. Calle 67 No 53-108, Bloque 2. Medellín, Colombia.
2Grupo de Investigación de Entomología Médica, Facultad de Medicina, Universidad de Antioquia. Calle 67 No 53-108. Medellín, Colombia.
3Estudiantes de Química Farmacéutica, Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Dado el incremento de la resistencia a los insecticidas químicos, de los mosquitos vectores de enfermedades de importancia en salud pública, se realiza la búsqueda de métodos alternativos de control, como el uso de extractos de esponjas marinas con potencial actividad insecticida, debido a su capacidad de biodegradación, generando menor daño ambiental. En este trabajo se evalúa la actividad insecticida de extractos de las esponjas Amphimedon compressa, Topsentia ophiraphidites, Svenzea zeai, Ircinia campana y Agelas sventres sobre larvas de IV estadio de Aedes aegypti y Culex quinquefasciatus, en condiciones de laboratorio (25oC y 75% de humedad relativa). El seguimiento del análisis se realiza evaluando y comparando el porcentaje de mortalidad de cada especie frente a cada concentración de extracto. El parámetro evaluado es la respuesta de las larvas a los efectos de los extractos etanólicos de las esponjas en tres concentraciones, 500, 200 y 100 ppm; demostrándose que los extractos de Ircinia campana son los más activos contra ambos insectos, y el extracto de Amphimedon compressa tiene mayor efecto tóxico sobre las larvas de Aedes aegypti que sobre las larvas de Culex quinquefasciatus.
Palabras clave: Esponjas marinas, insecticida, Golfo de Urabá, Aedes aegypti, Culex quinquefasciatus.
ABSTRACT
Due to increasing resistance of the vectors mosquitoes causing diseases of importance in public health, to chemical insecticides, is necessary the searching for alternative control methods, as the use of marine sponges extracts with insecticide activity, owing to its capacity of biodegradation and generation of minor environmental damage. In this work the insecticide activity is evaluated for the ethanol extracts of the marine sponges Amphimedon compressa, Topsentia ophiraphidites, Svenzea zeai, Ircinia campana and Agelas sventres, on stadium IV larvae of Aedes aegypti and Culex quinquefasciatus, in conditions of laboratory (25oC and 75 % Relative Humidity). The follow-up of the analysis is realized for evaluation and comparison of the percentage of mortality of each species at each extract concentration. The evaluated parameter is the response of the larvae to the effects of the ethanolic extracts of the sponges at three concentrations, 500, 200 and 100 ppm. Results demonstrates that Ircinia campana extract is most active against two insects, as long as the extract of Amphimedon compressa has a higher toxic effect on Aedes aegypti than on Culex quinquefasciatus.
Keywords: Marine sponges, Urabá's Gulf, insecticide, Aedes aegypti, Culex quinquefasciatus.
INTRODUCCIÓN
Las especies Aedes aegypti y Culex quinquefasciatus, son reconocidas vectoras de enfermedades de gran importancia en salud pública como la filariasis (1), la encefalitis equina venezolana (2), el dengue y la fiebre amarilla (3). El Aedes aegypti es una especie ampliamente distribuida en el mundo entre los 45º de latitud norte y los 35º de latitud sur, sus hábitos son esencialmente urbanos y periurbanos; es una especie holometábola cuyas larvas se crían en todo tipo de recipientes artificiales que contengan agua limpia como llantas, tanques, canecas, botellas, envases plásticos, y canaletas de techo, (4); El Culex quinquefascitus (Say 1823) es una importante especie vectora de la filarisis linfática en Asia y África. En América es importante en la transmisión del virus de la Encefalitis Equina Venezolana (EEVV), tanto en su fase enzoótica como en la epizoótica (5). Para el control de estas especies vectoras se utilizan especialmente insecticidas químicos tales como Malathion®, Lambdacihalotrina®, y Fenitrotión®, los cuales presentan problemas ambientales y generación de problemas resistentes (6), es por ello que se buscan otras alternativas frente a este tipo de insecticidas químicos utilizados actualmente para controlar las fuentes de tales enfermedades.
Una de estas alternativas la constituyen los productos naturales marinos, ya que diversas investigaciones han demostrado que los organismos marinos son una fuente natural rica en compuestos con actividad biológica (7), entre las cuales se reportan compuestos anticancerígenos (8), antimicrobianos, antimicóticos (9-10), antiinflamatorios (11), y antimaláricos (12), algunos de ellos ya en estudios preclínicos y clínicos avanzados (13). Pero estos compuestos no sólo son de interés biomédico, también hay metabolitos bioactivos que están comenzando a ser investigados, con el fin de encontrarles beneficios de importancia ambiental y agrícola. En el caso particular de estudios de productos naturales marinos con actividad insecticida, hasta 1997 se habían reportado unos 40 compuestos insecticidas de origen marino, los cuales incluyen fundamentalmente diez clases de núcleos: monoterpenos, compuestos de 15 átomos de carbono polihalogenados, diterpenos como un grupo de diterpénlactonas denominadas briaranos, diterpenos tipo asbestitina, diterpenos alicíclicos, péptidos, aminoácidos, derivados fosforilados y derivados azufrados (14). En 2003, estos mismos autores evaluaron la actividad insecticida de 11 compuestos marinos, de los cuales solo 3 que corresponden a alcaloides tipo manzamina, mostraron actividad. Según dichos autores el potencial de encontrar sustancias insecticidas en los organismos marinos es muy amplio, dado lo poco que se han investigado y a la hipótesis de que los insectos presentan cada vez una mayor resistencia contra sustancias insecticidas de origen terrestre, mientras que las de origen marino no tendrían este inconveniente (15). Para algunos de estos compuestos se han realizado estudios de relación estructura-actividad, como los diterpenoides tipo neo-clerodano (16).
Es interesante anotar como materiales marinos como la tierra de diatomeas tiene actividad insecticida, no debida a sustancias químicas orgánicas sino al daño físico de los materiales inorgánicos que las constituyen (17).
Con este estudio se evalúa la actividad insecticida de extractos etanólicos de algunas esponjas marinas del Golfo de Urabá en concentraciones de 500, 200 y 100 ppm sobre larvas de Aedes aegypti y Culex quinquefasciatus mediante bioensayos, para desarrollar una forma eficaz de control sobre los focos de propagación de enfermedades que pongan en riesgo la salud pública, como la fiebre amarilla y el dengue.
METODOLOGÍA
Recolección y tratamiento preliminar de las esponjas
Las muestras fueron colectadas y clasificadas por el Biólogo Marino Diego Valderrama, utilizando un equipo de buceo autónomo a profundidades entre 9 y 21 m, abarcando 12 kilómetros de costa desde los 8° 35´ de latitud norte cerca a la localidad de Acandí (Chocó) hasta la frontera entre Colombia y Panamá en Cabo Tiburón (8° 41´ N) en febrero de 2001. El material extraño fue removido con un cuchillo de las muestras, las cuales se lavaron varias veces con agua destilada para limpiarlas de la epibiosis. Posteriormente se congelaron a -10°C para su envío al Laboratorio de Productos Naturales Marinos de la Universidad de Antioquia. Una muestra del material animal fue depositada en el Museo de Historia Natural del INVEMAR (MHNMC), Santa Marta.
Extracción
Las esponjas se secaron a 40°C por 12 horas en una estufa convencional, y posteriormente se molieron. La esponja molida fue sometida a extracción exhaustiva con etanol destilado. Cada extracto fue filtrado y concentrado a presión reducida y baja temperatura por medio de un rota evaporador. Los extractos obtenidos, se envasaron en recipientes de vidrio adecuados y protegidos de la luz.
Mantenimiento de las colonias en el laboratorio
Para los bioensayos se utilizaron individuos en estado larval de Aedes aegypti y Culex quinquefasciatus. Las colonias fueron mantenidas en el Insectario del Laboratorio de Entomología Médica (GEM) de la Universidad de Antioquia bajo condiciones de temperatura promedio 25oC, humedad relativa de 75% y alimentación para las larvas con 0.5 g de alimento para roedores (Conejina®) /1.5 Lt de agua libre de cloro; los adultos fueron mantenidos en jaulas entomológicas donde se ingresaba tres veces por semana un ratón como fuente de sangre para la ovipostura, también se alimentaban con agua azucarada. La colonia de Culex quinquefasciatus se alimentó en la noche. Diariamente el medio que contiene las larvas (agua libre de cloro) fue aseado, igualmente se retiraron las pupas de dicho medio y estas fueron transferidas a recipientes tapados a las cajas enmalladas, de estos recipientes se liberaron los adultos cada 24 horas.
Preparación de las concentraciones requeridas de los extractos
Para preparar la solución de extracto etanólico de esponja a 500 ppm, se pesó en un vial 250 mg de extracto, el cual fue disuelto con 0.5 mL de dimetilsulfóxido (DMSO) y agitado en un agitador Vortex® para la completa disolución. Posteriormente se lleva a un volumen de 500.0 mL con agua destilada. La concentración final de DMSO en esta solución es de 0.01%.
De la solución de 500 ppm se preparan las soluciones con concentración de 200 ppm y 100 ppm, con una concentración final de DMSO de 0.004% y 0.002%, respectivamente.
Ensayo biológico
Para cada una de las especies de mosquitos (Aedes aegypti y Culex quinquefasciatus) se realizaron tres repeticiones con cada una de las concentraciones (500, 200 y 100 ppm) de cada extracto (Topsentia ophiraphidites, Amphimedon compressa, Svenzea zeai, Ircinia campana y Agelas sventres). Cada repetición estuvo conformada por dos réplicas problema, una réplica control negativo y una réplica control positivo. La réplica problema se realizó en un vaso de precipitados con 100 mL de solución muestra a la concentración determinada, para evaluar 20 larvas de la especie establecida; la réplica control negativo se realizó con 100 mL de agua destilada, evaluándose 20 larvas del mosquito designado; la réplica control positivo se realizó con 100 mL de una solución al 0.05% de ABATE® (insecticida comercial) al cual se le adicionan 20 larvas.
De igual manera se realizó un bioensayo con DMSO en agua destilada a concentraciones de 0.8%, 0.5% y 0.2%, para determinar si este solvente es letal con las larvas de Aedes aegypti y Culex quinquefasciatus.
A cada réplica se le adicionó una pizca de alimento. La actividad insecticida se determinó haciendo lecturas de mortalidad a las 24 horas tiempo durante el cual fueron mantenidas en la oscuridad, para evitar degradación de los compuestos en cada solución muestra. Para evaluar la mortalidad se toma como criterio la no respuesta de las larvas a un estimulo punzante.
Análisis estadístico
El análisis de los resultados se realizó bajo un paquete estadístico de SPSS Versión 11.0 para Windows®, tomando como unidad de cálculo o referencia la réplica, los datos se concluyeron con un intervalo de confianza del 95% para la extrapolación a las poblaciones. Las repeticiones con las que se trabajó presentaron un porcentaje de mortalidad en el blanco menor al 5% y un porcentaje de mortalidad en el control positivo del 100%.
En los ensayos realizados con DMSO, se observa que este solvente a las concentraciones de 0.8%, 0.5% y 0.2% no es letal para las larvas, presentándose una mortalidad del 0% en las concentraciones mencionadas.
Las gráficas 1 y 2, muestran los resultados de los ensayos de mortalidad contra Aedes aegypti y Culex quinquefasciatus, para las 5 especies de esponjas estudiadas.
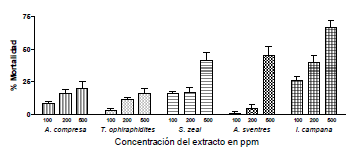
Gráfica 1. Porcentaje de mortalidad de las 5 especies de esponjas estudiadas contra larvas de C. quinquefasciatus.

Gráfica 2. Porcentaje de mortalidad de las 5 especies de esponjas estudiadas contra larvas de A. aegypti.
De acuerdo con estos resultados, el extracto más activo contra C. quinquefasciatus, es el de 500 ppm de I. campana, el cual produce una mortalidad promedio del 70%. Mientras tanto, los extractos de las otras esponjas estudiadas no sobrepasan el promedio del 45% de mortalidad a esta misma concentración.
En el caso de las larvas de A. aegypti, los extractos más activos fueron a 500 ppm de las esponjas I. campana y A. compressa, con un promedio de mortalidad del 72,5% de mortalidad; mientras los extractos de las otras tres especies de esponjas analizadas no superan el 49% de mortalidad.
El extracto de la esponja A. sventres tuvo resultados muy similares contra las larvas de A. aegypti como para C. quinquefasciatus a 500 ppm, con mortalidades del 43.3% y del 45%, respectivamente. Igual sucede con el extracto de S. zeai a 500 ppm, pues los resultados entre las especies de insectos muestran ser parecidos.
La esponja que menos porcentaje de mortalidad mostró para A. aegypti como para C. quinquefasciatus, fue T. ophiraphidites. Los resultados muestran una mortalidad del 10.8% y el 16.6% para estas dos especies a una concentración de 500 ppm. De acuerdo a los resultados presentados, se puede observar una tendencia a que los extractos aumentan su actividad insecticida a medida que aumenta su concentración. Sin embargo, la única esponja que a las concentraciones de 100 ppm y 200 ppm tiene la misma mortalidad es T. ophiraphidites, tanto en Aedes aegypti como en Culex quinquefasciatus.
Para A. compressa, se puede observar la poca diferencia que hay entre los resultados obtenidos en las concentraciones de 200 ppm y 500 ppm, lo que indica una diferencia muy pequeña o nula de la actividad insecticida con el aumento de la concentración del extracto. I. campana, resultó ser la esponja que tiene mayor actividad insecticida de las esponjas en estudio, pues aunque tiene la misma mortalidad que A. compressa contra A. aegyti, es la que mayor actividad presenta contra C. quinquefasciatus.
Dada la relevancia de los porcentajes de mortalidad en el extracto de I. campana sobre larvas de A. aegypti y C. quinquefasciatus en IV estadío en concentraciones de 500 ppm y 200 ppm, es recomendable continuar con el análisis, reconocimiento, aislamiento y caracterización de la(s) sustancia(s) presentes en dicha esponja responsables de tal efecto con el fin de desarrollar un método alternativo a los insecticidas químicos utilizados actualmente. Además existen trabajos reportados que demuestran que esta esponja contiene sustancias biológicamente activas (18). Lo mismo sucede con la esponja A. compressa que mostró una alta acción insecticida, es importante seguir desarrollando métodos que permitan determinar cuáles son las sustancias encargadas de ejercer esta acción insecticida, pues se conoce que esta esponja contiene una serie de metabolitos altamente citotóxicos los cuales han sido estudiados para fines terapéuticos (19-21), y que quizás sean alguno de estos compuestos los responsables de la muerte de los mosquitos en estudio.
CONCLUSIONES
La especie Culex quinquefasciatus en comparación a Aedes aegypti mostró menos sensibilidad a los extractos evaluados de las cinco esponjas del Golfo de Urabá. Los mayores porcentajes de inhibición contra esta esponja se presentaron con el extracto de I. campana a una concentración de 500 ppm (70%), siendo importante recordar, que el control positivó mostró 100% de inhibición en todas las réplicas contra estas larvas a una concentración de 0,5 ppm.
Los mayores porcentajes de mortalidad de larvas de Aedes aegypti se obtuvieron con los extractos de A. compressa e I. campana a 500 ppm, con un valor de 72.5%. Mientras que la esponja T. ophiraphidites mostró los menores valores promedios de inhibición contra ambas cepas de larvas, sin superar el 16% de mortalidad contra ninguna de las dos especies evaluadas. Esto hace poco atractiva a esta especie para ser utilizado su extracto crudo etanólico como insecticida, aunque esta especie ya haya demostrado tener otras actividades biológicas como: inhibidora del VIH y antimicrobiana (10).
Es importante resaltar, que la esponja con los resultados más representativos fue I. campana, pues la actividad insecticida que tuvo para las dos especies de insectos fue mayor a los demás resultados a 500 ppm, 70% de mortalidad contra las larvas de Culex quinquefasciatus y un 72,5% de mortalidad contra las larvas de Aedes aegypti. En próximas investigaciones, se realizará una caracterización química biodirigida de los metabolitos secundarios presentes en el extracto etanólico de I. campana y A. compressa con el fin de determinar los compuestos implicados en la acción insecticida para evaluarlos individualmente y poder tener un valor objetivo de la dosis letal de cada uno de los componentes del extracto.
AGRADECIMIENTOS
Agradecemos al Biólogo marino Diego Valderrama por la recolección y clasificación taxonómica de las muestras de esponjas. Al Comité para el Desarrollo de la Investigación CODI, por la financiación del proyecto de menor cuantía Evaluación de la actividad insecticida de extractos polares de las esponjas marinas del Golfo de Urabá sobre larvas de Aedes aegypti y Culex quinquefasciatus (Díptera : Culicidae), código CIQF-079.
REFERENCIAS BIBLIOGRÁFICAS
1. Rawlins S, Lammie P. Lymphatic filariasis in the Caribbean region: the apportunity for its elimination and certification. Rev Panam Sal Pub. 2000; 07 (5), 319-324. [ Links ]
2. Gómez G. La encefalitis equina venezolana. Rev Acovez. 1995; 20 (4), 38-39. [ Links ]
3. Fundação Nacional de Saúde (FUNASA). Programa Nacional de Controle da Dengue - PNCD. 2002; p 51. [ Links ]
4. Martínez E. (1998). Dengue y dengue hemorrágico. (Ed.), Centro de Impresiones, Universidad Nacional de Quilmes. 1ª ed, pp 48-54. Buenos Aires (Argentina). [ Links ]
5. Campos RE, Garcia JJ. Variación estacional de tres especies de Culex (Diptera:Culicidae) y sus parásitos patógenos en Punta Lara, provincia de Buenos Aires, Argentina. Rev Biol Tropical (San José). 1997; 45 (1), 267-275. [ Links ]
6. Fonseca I, Quiñones M. Resistencia a insecticidas en mosquitos (Diptera: Culicidae): mecanismos, detección y vigilancia en salud pública. Rev Col Entomol. 2005; 31 (2), 107-115. [ Links ]
7. Haefner B. Drugs from the deep: Marine natural products as drug candidates. Drug Discovery Today. 2003; 8 (12), 536-544. [ Links ]
8. Amador ML, Jimeno J, Paz-Ares L, Cortes-Funes H, Hidalgo M. Progress in the development and acquisition of anticancer agents from marine sources. Ann Oncol. 2003; 14, 1607-1615. [ Links ]
9. Márquez D, Martínez A, Galeano E. Productos naturales marinos con actividad biológica Parte I. Vitae. 2003; 10 (2), 61-71. [ Links ]
10. Galeano E, Martínez A. Antimicrobial activity of marine sponges from Urabá Gulf, Colombian Caribbean region. J Mycol. Méd. 2007; 17, 21-24. [ Links ]
11. Alcaraz MJ, Paya M. Marine sponge metabolites for the control of inflammatory diseases. Curr Opin Investig Drugs. 2006; 7 (11), 974-979. [ Links ]
12. Mayer AM, Hammann MT. Marine pharmacology in 1999: Compounds with antibacterial, anticoagulant, antifungal, anthelmintic, anti-inflammatory, antiplatelet, antiprotozoal and antiviral activities affecting the cardiovascular, endocrine, immune and nervous systems, and other miscellaneous mechanisms of action. Comp Biochem Physiol. C. 2002; 132, 315-339. [ Links ]
13. Newman DJ, Cragg GM. Marine natural products and related compounds in clinical and advanced preclinical trials. J Nat Prod. 2004; 67,1216-1238. [ Links ]
14. El Sayed, K, Dunbar D, Perry T, Wilkins S, Hamann M. Marine Natural Products as Prototype Insecticidal Agents J Agric Food Chem. 1997; 45, 2735-2739. [ Links ]
15. Peng J, Shen X, El Sayed K, Dunbar D, Perry T, Wilkins S, Hamann M. Marine Natural Products as Prototype Agrochemical Agents J Agric Food Chem. 2003; 51, 2246-2252. [ Links ]
16. Gonzalez-Coloma A, Gutiérrez C, Miguel del Corral J, Gordaliza M, De La Puente M, San Feliciano A, Structure -and Species-Dependent Insecticidal Effects of neo-Clerodane Diterpenes, J Agric Food Chem. 2000; 48, 3677-3681. [ Links ]
17. Korunic Z. Diatomaceous Earths, a Group of Natural Insecticides. J Stor Prod Res. 1998; 34, 87-97. [ Links ]
18. Martínez A, Robledo S, Muñoz D, Blair S, Vélez I, Higuita E, Echeverri E, Bedoya J, Zea S. Antiparasitic Activity of Methanol Extracts and Isolated Fractions from Caribbean Sponges. Vitae 2001; 1/2 71-77. [ Links ]
19. Albrizi S, Ciminiello P, Fattorusso E, Magno S. Amphitoxin, a new high molecular weight antifeedant pyridinium salt from the Caribbean sponge Amphimedon compressa. J Nat Prod. 1995; 58 (5), 647-652. [ Links ]
20. Rangel M, de Sanctus B, de Freitas JC, Polatto JM, Granato AC, Berlinck R, Hajdu E. Cytotoxic and neurotoxic activities in extracts of marine sponges Porifera from southeastern Brazilian coast. J Exper Marine Biol Ecol. 2001; 262, 31-40. [ Links ]
21. Matsunaga S, Miyata Y, van Soest RWM, Fusetani N. Tetradehydrohalicyclamine A and 22-Hydroxyhalicyclamine A, New Cytotoxic Bis-piperidine Alkaloids from a Marine Sponge Amphimedon sp. J Nat Prod. 2004, 67, 1758-1760. [ Links ]
Recibido: Junio 4 de 2007 Aceptado: Noviembre 6 de 2007
*Autor a quien se debe dirigir la correspondencia: amart@farmacia.udea.edu.co














