Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
INGENIERÍA Y TECNOLOGÍA DE ALIMENTOS
CINÉTICA DE LOS CAMBIOS DE COLOR EN MANZANA DESHIDRATADA POR AIRE FORTIFICADA CON VITAMIN E.
KINETIC OF COLOUR CHANGE OF AIR DRIED FORTIFIED APPLES WITH VITAMIN E.
Misael CORTÉS R.1*, Amparo CHIRALT B.2
1 Facultad de Ciencias Agropecuarias, Departamento de Ingeniería Agrícola y de Alimentos, Universidad Nacional de Colombia, Sede Medellín, A.A. 568
2 Departamento de Tecnología de Alimentos, Universidad Politécnica de Valencia España
RESUMEN
La cinética de los cambios de color en manzanas deshidratadas fortificadas con vitamina E, se evalúa a partir de las coordenadas CIE-L*a*b*, tono (hab*) y croma (Cab*), durante 180 días y temperaturas de almacenamiento de 4, 20 y 30ºC. Debido a translucidez de las muestras, es aplicada la teoría de Kubelka-Munk de dispersión de luz múltiple a los espectros de reflexión, identificando un incremento en la adsorción frente a la dispersión, cuanto mayor es la temperatura y el tiempo de almacenamiento. A 4ºC el color no es un parámetro crítico para el producto, ya que no hay cambios apreciables durante los 180 días, al igual que con el tipo de envasado (atmosférico y al vacío). A 20 y 30ºC ocurren los mayores cambios del color, principalmente en las muestras envasadas al vacío, su evolución define trayectorias diferentes según el envasado y la temperatura con una tendencia hacia los rojos (> a*), de color pálido a oscuro (< L*) y menos puro (< Cab*) debido al pardeamiento. Se aplican modelos cinéticos de órdenes 0, 1 y 2 para describir los cambios de color, siendo el de 2º orden el que mejor coeficiente de regresión presenta en la mayoría de los parámetros.
Palabras clave: manzana, color, pardeamiento, vitamina E
ABSTRACT
The kinetics of color changes in dehydrated apples fortified with vitamin E is evaluated starting from the CIE-L*a*b * coordinates, tone (hab*) and chromes (Cab*), during 180 days and storage temperatures of 4, 20 and 30ºC. Due to translucency of samples, the Kubelka-Munk's theory of multiple light dispersion is applied to reflection spectrum, showing an increment in the adsorption compared with dispersion as much as higher is the temperature and storage time. At 4ºC the color is not a critical parameter for the product, since there are not appreciable changes during the 180 days, as well as with packing type (atmospheric and vacuum). At 20 and 30ºC higher changes in color appear, mainly in vacuum packed samples, its evolution defines different trajectories according to packing type and temperature with a tendency to red ones (> a *), from pale to dark color (< L *) and less pure (< Cab*) due to browning. Kinetic models of orders 0. 1 and 2 are applied to describe color changes, being the 2nd order model the one that better coefficient of regression presents in most of parameters.
Keywords: apples, color, browning, vitamin E.
INTRODUCCIÓN
El éxito actual de la industria alimentaria depende de la capacidad de adaptación e innovación de productos de calidad que satisfagan las expectativas y además respondan a las necesidades de los consumidores. Las evidencias científicas en que se apoyan los efectos fisiológicos descritos o los beneficios para la salud y la seguridad de los alimentos funcionales, aumentan de la mano con el interés de los consumidores, la industria y los legisladores por este tipo de alimentos (1, 2, 3, 4, 5, 6).
Los tocoferoles son los principales compuestos que exhiben actividad de vitamina E y son los antioxidantes naturales más importantes por su alta actividad (7, 8). Los antioxidantes interrumpen las reacciones en cadena que producen los radicales libres, que pueden reaccionar con cualquier otra molécula como ácidos grasos de las membranas de las células, grasas que circulan por la sangre, proteínas, vitaminas, ácidos nucleicos de los genes, etc. (9, 10, 11, 12).
El color es un atributo de calidad muy importante para la determinación del tiempo de vida útil de un producto y muy apreciado por los consumidores. Algunos autores han evaluado los cambios de color causados por efectos del pardeamiento en frutas y vegetales, utilizando la disminución de la luminosidad (ΔL*) (13), cambios en L* y a* (cromaticidad verde (-) rojo (+)) (14) o cambios en L* y b* (cromaticidad azul (-) amarillo (+) (15). El oscurecimiento en frutas y vegetales durante el secado y almacenamiento es el resultado de reacciones de pardeamiento enzimático (16, 17) y no enzimático (18, 19, 20, 21, 22, 23). Hay básicamente dos tipos de reacciones no enzimáticas asociadas con la pérdida de color en los alimentos durante el almacenamiento, una debida a las reacciones de azúcares reductores y aminoácidos (reacciones de Maillard), y la otra a reacciones de oxidación, tal como la conversión de polifenoles en policarbonilos (19) o la degradación oxidativa del ácido ascórbico (24, 25). Por otro lado, reacciones de formación de complejos con iones metálicos como el cobre y el hierro, redundan también en pardeamiento con una disminución de L* y un aumento de a* (26); además, otras reacciones de degradación de pigmentos, especialmente carotenides y clorofila, afectan el color durante el secado (27).
La influencia del pretratamiento de deshidratación osmótica con solución de sacarosa al 45%, es tal que las manzanas mantienen el color durante el secado por aire caliente (SAC) (28). Manzanas con pretratamientos de escaldado y antipardeantes, deshidratadas hasta valores de aw entre 0.5 y 0.7, han presentado una disminución en L* durante el almacenamiento a 30ºC. La aw, en este sentido, tiene una influencia importante en las reacciones de Maillard (29), además de la actividad enzimática todavía presente después del escaldado.
Se han aplicado modelos cinéticos de los cambios de color como criterios de calidad en diferentes procesos y estructuras alimentarias con coeficientes de regresión aceptables, tales como: pardeamiento no enzimático en jugo de manzana (30, 31), pardeamiento enzimático en jugo de manzana en presencia de ciclodextrinas (32), fritura de papas (33), procesado térmico en espárragos (34), degradación térmica del color en puré de melocotón (35) y en concentrado de tomate (36).
La técnica de impregnación a vacío (IV) de disoluciones, emulsiones o dispersiones en estructuras porosas, a través del mecanismo hidrodinámico (HDM) (37, 38), es un método donde los cambios en la composición se deben principalmente a la transferencia de masa causada por el gradiente de presión aplicado al sistema, además de la incorporación por efectos capilares. El desarrollo de productos de manzana fortificados es interesante, por la gran porosidad de esta fruta que permite una alta eficacia del proceso de impregnación, ya que en éste los poros del tejido quedan llenos de la solución con el o los compuestos fortificantes.
El objetivo de este trabajo fue analizar la evolución del color en productos de manzana fortificados con vitamina E, deshidratados por aire caliente, bajo diferentes condiciones de envasado, temperatura y tiempo de almacenamiento para determinar la cinética de los cambios en los parámetros observados.
MATERIALES Y MÉTODOS
Materia prima
Manzanas de la variedad Granny Smith, de origen chileno, adquiridas en un supermercado de la ciudad de Valencia (España) y almacenadas a 4ºC. Se utilizaron muestras en forma de rodajas de 10 mm de grosor, φext = 66.7 mm, φint = 22.4 mm, con un peso aproximado de 25g. Se utilizó dl-α-tocoferol acetato con una pureza del 96.43% (Roche), que es una forma sintética de vitamina E, y se almacenó a 4ºC, en recipiente bien cerrado protegido de la luz y en atmósfera de N2. El dl-α-tocoferol acetato (0.065%) fue emulsificado en un medio acuoso isotónico con la manzana fresca (disolución de glucosa de 9º Brix, 99.685%) con una actividad agua (aw) similar a la de la manzana fresca. Se emplearon dos tensoactivos no iónicos: Tween 80 (polioxietilen sorbitan monooleato, BHL = 15) (0.051%), Span 60 (monoesterato de sorbitano, BHL 4.7) (0.049%) y además se utilizó goma arábiga (0.100%). La emulsión fue preparada en un homogenizador a vacío de velocidad variable (Ultraturrax T 25-Janke & Kunkel IKA - Labortechnik) durante 20 minutos a 24.000 RPM y se le adaptó un recipiente (250 mL) con recirculación y camisa de enfriamiento. La concentración teórica del dl-α-tocoferol acetato añadido en la emulsión se determinó con el criterio de fortificar el 100% del consumo diario recomendado (CDR) de vitamina E en 200 g de manzana fresca (33 mg dl-α-tocoferol acetato) (39).
Las muestras para el estudio fueron deshidratadas en un equipo de secado por aire caliente de bandejas de flujo transversal marca LIZ a una temperatura de 40ºC, el nivel de humedad alcanzado fue 14.3 ± 2.0 y los valores de aw entre 0.5 y 0.55.
Impregnación a vacío
Los experimentos de impregnación a vacío se realizaron en el equipo descrito en Fito et al, 1996 y según la metodología descrita en Cortés, (39).
Color y translucidez
Se utilizó el espectrocolorímetro MINOLTA SpectraMagic, modelo CM-3600D, iluminante D65 y observador de 10º como referencia. A partir del espectro de reflexión de las muestras, se obtuvieron las coordenadas de color CIE-L*a*b*, donde L* es un indicador de la luminosidad, a* indica la cromaticidad en el eje verde (-) a rojo (+), y b* la cromaticidad en el eje azul (-) a amarillo (+), y las coordenadas psicométricas tono (hab* = arctg [b*/a*]) y croma (Cab* = [a*2 + b*2]1/2). Las medidas se realizaron con componente especular incluida y con diámetro de ventana (11 mm). El carácter translúcido de las muestras se evaluó utilizando la teoría de Kubelka-Munk de dispersión de luz múltiple (40, 41, 42) a partir de los espectros de reflexión sobre fondo negro y blanco. Se evaluó la relación K/S (coeficiente de absorción / coeficiente de dispersión) a partir de la medida de reflectancia intrínseca o de un espesor infinito de muestra para cada longitud de onda, según las ecuaciones 1 a 4,
donde Rfn: reflectancia fondo negro, Rfb: reflectancia fondo blanco y Rref: reflectancia del blanco de referencia.
Para cada condición de almacenamiento (envasado-temperatura-tiempo) se realizaron determinaciones de color en 6 muestras (4 medidas/ muestra, 90º c/u), esto corresponde a un total de 24 lecturas/condición de almacenamiento y a 36 muestras al inicio de almacenamiento.
Almacenamiento
Las muestras fueron envasadas en bolsas plásticas de Poliamida / Polietileno (referencia RCA 20-70 de Eurobag) con permeabilidad al oxígeno (O2), 40-50 cm3/m2; permeabilidad al vapor de agua, 2.6 g/m2; permeabilidad al nitrógeno (N2), 10 cm3/m2 y permeabilidad al dióxido de carbono (CO2), 150 cm3/m2. El envasado se realizó en condiciones atmosféricas (SV) y con aplicación de vacío (CV). Los productos envasados fueron almacenados a temperatura controlada de 4, 20 y 30ºC y se hicieron controles a 0, 15, 30, 60, 90 y 180 días.
Análisis de datos
Los resultados fueron analizados a partir de ANOVAS, utilizando el LSD (mínimas diferencias significativas) como método de comparaciones múltiples, con un nivel de confianza del 95%. El análisis de varianza fue realizado con el paquete estadístico Statgraphics plus versión 5.1.
RESULTADOS Y DISCUSIÓN
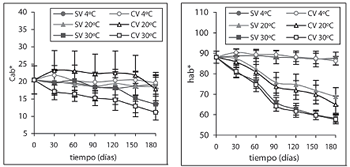
La figura 1 ilustra la evolución de los parámetros L*, a*, b*, Cab* y hab* durante los 180 días de almacenamiento. El ANOVA a 4ºC, para las muestras SV durante los 180 días no mostró diferencias significativas en L*, igual que las muestras CV durante los primeros 150 días, luego hay una tendencia muy significativa a disminuir. Esta disminución podría deberse en parte a la extracción del aire de las muestras y a la compactación progresiva de las mismas, lo que aumenta la homogeneidad en el índice de refracción del tejido, potenciando la absorción de luz en la zona superficial, con la consiguiente caída de la claridad. El parámetro a* no presentó diferencias significativas asociadas con el tipo de envasado, pero sí con el tiempo, mostrando un ligero incremento, causado principalmente por la degradación de pigmentos de clorofila, responsables de la componente verdosa del color del producto (43). En los parámetros b* y Cab*, el tipo de envasado y el tiempo fueron significativos en los cambios observados: descenso en sus valores con el tiempo y mayores en las muestras CV. Estos cambios podrían atribuirse también a la degradación de clorofilas y al efecto de compactación del tejido del envasado a vacío, más que a un pardeamiento del tejido. Para el caso del tono hab*, el efecto del envasado no fue significativo y se dio una ligera tendencia a disminuir su valor con el tiempo sin llegar a ser crítico (valor mínimo 87º). En general, el almacenamiento con refrigeración a 4ºC, permite obtener un producto con características de color muy aceptables a los 180 días de almacenamiento.
Figura 1. Parámetros de color L*, a*, b*, Cab* y hab*, en función del tiempo de almacenamiento.
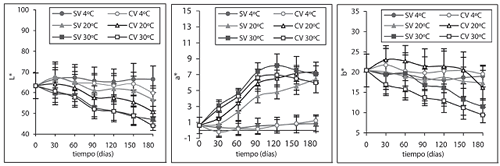
Las muestras almacenadas a 20 y 30ºC presentaron, en la mayoría de los parámetros de color, diferencias significativas debidas al tipo de envasado y al tiempo de almacenamiento, excepto en Cab* a 20ºC, que durante los 180 días presentó una ligera tendencia a disminuir que no llegó a ser muy apreciable, y en L* a 30ºC el tipo de envasado no tuvo influencia significativa. Se observa que a 30ºC, a* tiende a ser asintótico a partir de los 90 días, alcanzando su máxima saturación en el rojo, mientras que para 20ºC ésta sigue todavía creciente por el mismo pardeamiento no enzimático presente.
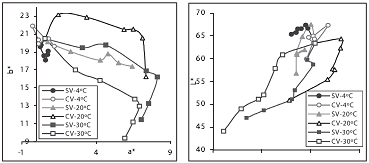
La figura 2 presenta la evolución de las muestras con el tiempo en los planos cromáticos a*b* y L*Cab*. El primero refleja claramente cómo las muestras presentan una tendencia hacia los rojos, definiendo trayectorias diferentes según el tipo de envasado y la temperatura, por efecto de la intensidad del pardeamiento no enzimático. Al inicio del almacenamiento las variaciones observadas son del orden de la variabilidad propia de las 36 muestras de manzana (desviaciones estándar en L* de 6, en a* de 1, en b* de 4, en Cab* de 4 y en hab* de 3). En el plano L*Cab* se observa que la evolución se da desde un color pálido hacia un color oscuro y menos puro, debido al pardeamiento. La mayor evolución del color, al igual que el plano cromático, se presenta a las temperaturas superiores en las muestras CV.
Contrariamente a lo esperado, el efecto del vacío en el envasado fue negativo, lo que refleja que la presión de oxígeno no es un factor determinante en la estabilidad del color. Este oscurecimiento (< L*) se debe principalmente al efecto mecánico del cambio de presión que genera la compactación progresiva de las muestras, explicado anteriormente; además, este fenómeno podría hacer emigrar hacia la superficie de la muestra compuestos intracelulares: enzimas y sustratos, interactuando mínimamente con el O2 que se encuentra con una baja presión parcial.
En los resultados obtenidos por Contreras et al., (44) en manzanas de la misma variedad no impregnadas recién deshidratadas por aire a 30 y 50ºC, se presentan > valores de L* (muestras más claras) que los alcanzados en la actual investigación, probablemente debido a que el contenido de glucosa en la emulsión de fortificación incorporada durante el proceso IV favorece las reacciones de pardeamiento enzimático (45). Otros ensayos realizados por los mismos autores en manzanas impregnadas con jugo de manzana (igual aw) y deshidratadas a las mismas temperaturas, se presentan < valores de L* (muestras más oscuras), debido a que las características propias del jugo incorporado contribuyen a intensificar el pardeamiento enzimático y no enzimático en toda la estructura. En ambos casos los valores de a* y b* fueron similares debido a la misma variabilidad propia de las muestras.
Figura 2. Evolución de los puntos experimentales en los planos de color a*b* y L*Cab*
durante el almacenamiento.
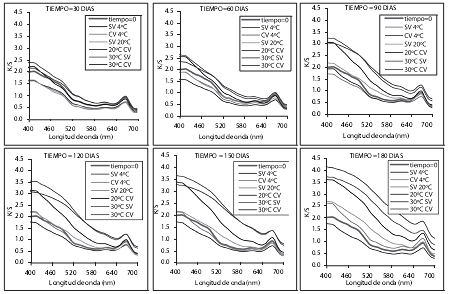
La figura 3 muestra la distribución espectral de la relación K/S, donde puede observarse el incremento en la absorción frente a la dispersión, tanto más cuanto mayor es la temperatura y el tiempo de almacenamiento. Esto se potencia también por el efecto del envasado a vacío.
Figura 3. Relación K/S en función del tiempo y la temperatura de almacenamiento y el tipo de envasado.
Dado que las mayores diferencias se dan a bajas longitudes de onda, se seleccionó el valor a 400 nm para la comparación de los cambios. La figura 4 presenta la variación de la relación K/S a 400 nm con respecto al tiempo. Todas las muestras almacenadas a cada temperatura presentaron diferencias significativas debidas al tiempo y a la condición de envasado, excepto las muestras SV a 4ºC. Las muestras a 30ºC (CV y SV) y las muestras CV a 20ºC presentaron un mayor incremento en la relación K/S que las muestras SV a 20ºC y mucho más que las almacenadas a 4ºC. Los resultados son coherentes con los cambios observados en las coordenadas de color ya comentados. El incremento en la relación K/S está asociado a la potenciación de la absorción por la formación de pigmentos pardos, producto de las reacciones de pardeamiento.
Figura 4. Evolución de la relación K/S a 400 nm con el tiempo de almacenamiento para las diferentes temperaturas y tipos de envasado.
Cinética del color
Los datos experimentales de los parámetros de color se analizaron inicialmente con ecuaciones cinéticas de orden 0 y 1. La tabla 1 presenta los resultados obtenidos, donde se identifica que ambos modelos cinéticos pueden ser usados adecuadamente (R2 > 0.95) para L* (SV, CV, 30°C), b* (CV, 30°C), Cab* (CV, 30°C), hab* (SV, CV, 20ºC) y hab* (SV, 30°C), además las constantes cinéticas (Kº y K1) fueron mayores con el incremento de la temperatura y con el envasado al vacío. El parámetro a* (SV, 20°C) ajustó mejor a una cinética de orden cero, mientras que el resto de parámetros, L* (SV, 20ºC), a* (SV, CV, 30ºC), b*(SV, CV, 20ºC), Cab* (SV, CV, 20ºC) no tuvieron un ajuste aceptable.
Cinéticas de orden cero con coeficientes de regresión entre 0.89 y 0.99 han sido obtenidos por Acevedo et al. (46), en procesos de pardeamiento no enzimático, evaluado como una respuesta del cambio de L* en manzanas deshidratadas al vacío y liofilizadas, con y sin pretratamiento de escaldado, durante el almacenamiento a 70ºC y en diferentes humedades relativas (33, 52, 64 y 76%). Igual cinética se presenta en kiwi deshidratado por aire caliente y por microondas (R2 >= 0.95) (27).
Tabla 1. Ajustes cinéticos de primer y orden cero de L*, a*, b*, Cab* y hab*.
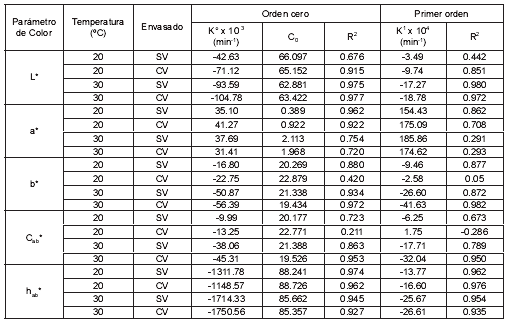
K0, K1: constantes cinéticas de los modelos de orden cero y primer orden.
C0: constantes de la ecuación de orden cero.
Cinéticas de primer orden han sido obtenidas por Koca et al., (47) en los parámetros a* y b*, para zanahorias deshidratadas con aire caliente a 60 ± 5ºC, durante el almacenamiento a 27 y 37ºC (R2 > 0.90) y en zanahorias escaldadas y deshidratadas en las mismas condiciones, y almacenadas a temperaturas de 27, 37, 47 y 57ºC (R2 > 0.95). Igual cinética se presenta en los parámetros L* y a* para ajo deshidratado durante el almacenamiento a diferentes humedades relativas (48), en los parámetros L*, a*, b* y a*/b* para procesos de concentración de pulpa de tomate a 70, 80, 90 y 100ºC (36), y en el parámetro de luminosidad Hunter durante la concentración de pulpas de manzana, melocotón y ciruela a temperaturas de 66, 80 y 94°C (49).
Debido a la falta de homogeneidad en las tendencias respecto al tipo de cinética, se ensayó un ajuste polinómico de grado dos, que permitió una modelización global más aceptable, excepto en L* (SV, 20ºC), b*(SV, CV, 20ºC) y Cab* (SV, CV, 20ºC), los cuales presentaron un pobre ajuste de regresión en todos los modelos ensayados. La tabla 2 presenta los datos obtenidos para el ajuste polinómico de segundo grado. Algunos autores han aplicado otros modelos diferentes a orden cero y primer orden tales como modelos combinados o modelos fraccionales (20, 34, 50).
Tabla 2. Ajuste polinómico de segundo grado de L*, a*, b*, Cab* y hab*.
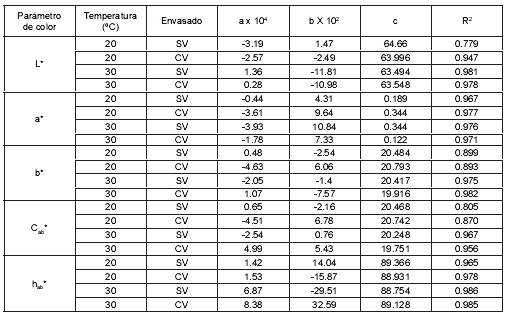
a, b y c: constantes de la ecuación de segundo grado.
CONCLUSIONES
El almacenamiento de manzanas deshidratadas fortificadas con vitamina E bajo refrigeración a 4ºC, permitió obtener unas características de color aceptables durante los 180 días de almacenamiento, mientras que a temperaturas de 20 y 30ºC se produce pardeamiento notable a los 30 días. El envasado al vacío no fue un factor positivo para la estabilidad del color de las muestras, debido principalmente a los efectos mecánicos causados por los cambios de presión que hacen compactar las muestras con la correspondiente extracción del aire desde el interior, lo que aumenta la homogeneidad en el índice de refracción del tejido, potenciando la absorción de luz en la zona superficial, con el consiguiente oscurecimiento de estas. Modelos cinéticos de orden 0 y 1 presentaron un ajuste de regresión aceptable (R2 > 0.95) para L* (SV, CV, 30°C), Cab* (CV, 30°C) y b* (CV, 30°C), hab* (SV, CV, 20ºC) y hab* (SV, 30°C); sin embargo, en general, para la mayoría de los parámetros de color, el modelo cinético de 2º orden presentó los mejores coeficientes de regresión, excepto para L* (SV, 20ºC), b*(SV, CV, 20ºC) y Cab* (SV, CV, 20ºC).
REFERENCIAS BIBLIOGRÁFICAS
1. Thomas PR, Earl R. Enhancing the food supply. En: Thomas PR, Earl R. Opportunities in the nutrition and food sciences. Washington: National Academy Press; 1994. p 98-142. [ Links ]
2. Schneider M. Phospholipids for functional food. Eur J Lipid Sci Technol 2001; 103 (2): 98-101. [ Links ]
3. Robertfroid M. Defining functional food. En: Gibson G, Williams CM, editors. Functional foods: concepts to product. Cambridge: Woodhead; 2000. p. 9-29. [ Links ]
4. Robertfroid MB. What is the benefical for health? The concept of functional food. Food Chem Toxicol 1999; 37 (9-10): 1039 – 1041. [ Links ]
5. Bello J. Los alimentos funcionales nutracéuticos: Funciones saludables de algunos componentes de los alimentos. Alimentaria 1995; 267: 49-58. [ Links ]
6. Kruger CL, Mann SW. Safety evaluation of functional ingredients. Food Chem Toxicol 2003; 41 (6): 793-805. [ Links ]
7. Yoshida Y, Niki E, Noguchi N. Comparative study on the action of tocopherols and tocotrienols as antioxidant: chemical y physical effects. Chem Phys Lipids 2003; 123 (1): 63-75. [ Links ]
8. Ohkatsu Y, Kajiyama T, Arrai Y. Antioxidants activities of tocopherols. Polymer Degradation and Stability 2001; 72 (2): 303-311. [ Links ]
9. Wang X, Quinn PJ. Vitamin E and function in membranes. Prog Lipid Res 1999; 38 (4): 309-326. [ Links ]
10. Curtay JP, Lyon J. La enciclopedia práctica de las vitaminas, las sales minerales y los oligoelementos. España: Salvat; 2000: 127-136. [ Links ]
11. Kritharides L, Stocker R. The use of antioxidant supplements in coronary hearth disease. Atherosclerosis 2002; 164 (2): 211-219. [ Links ]
12. Bast A, Haenen GRMM. The toxicity of antioxidants and their metabolites. Environ Toxicol Pharmacol 2002; 11 (3-4): 251-258. [ Links ]
13. Burda S, Oleszek W, Lee CY. Phenolic compounds and their changes in apple during maturation and cold storage. J Agricult Food Chem 1990; 38: 945-948. [ Links ]
14. Sapers GM, Garzarella L, Pilizota V. Applications of browning inhibitors to cup apples and potato by vacuum and pressure infiltration. J Food Sci 1990; 55: 1049-1053. [ Links ]
15. Mastrocola D, Severini C, Lerici C. Colorimetric control of enzymatic browning in fruit and vegetables. En: Spiess WEL, Schubert H, editores. Engineering and food. Londres: Elsevier Applied Science; 1989. p 662 [ Links ]
16. Goupy P, Amot MJ, Richard-Forget F, Duprat F, Aubert S, Nicolas J. Enzymatic browning of model solutions and apple phenolic extracts by apple polyphenoloxidase. J Food Sci 1995; 60 (3): 497-505. [ Links ]
17. Lozano de González PG, Barret DM, Wrolstad RE, Durst RW. Enzymatic browning inhibited in fresh and dried apple ring by pineapple juice. J Food Sci 1993; 58 (2): 399-404. [ Links ]
18. Babsky NE, Toribio JL, Lozano JE. Influence of storage on the composition of clarified apple juice concentrate. J Food Sci 1986; 51 (3): 564-567. [ Links ]
19. Bolin HR, Steele RJ. Nonenzymatic browning in dried apples during storage. J Food Sci 1987; 52 (6): 1654-1657. [ Links ]
20. Ibarz A, Pagan J, Garza S. Kinetic models for colour changes in pear puree during heating at relatively high temperatures. J Food Eng 1999; 39 (4): 415-422. [ Links ]
21. Sapers GM. Browning of food: control by sulfites, antioxidants, and other means. Food Technol 1993. [ Links ]
22. Ibarz A, Pagan J, Garza S. Kinetic models of non-enzymatic browning in apple pure. JSFA 2000; 80 (8): 1162-1168. [ Links ]
23. Krokida MK; Maroulis ZB, Saravacos GD. The effect of the method of drying on the colour of dehydrated products. Int J Food Sci Technol 2001; 36 (1): 53-59. [ Links ]
24. Lozano JE, Ibarz A. Colour changes in concentrated fruit pulp during heating at high temperatures. J Food Eng 1997; 31 (3): 365-373. [ Links ]
25. Barreiro JÁ, Milano M, Sandoval AJ. Kinetic of colour change of double concentrated tomato paste during thermal treatment. J Food Eng 1997, 33 (3-4), 359-371. [ Links ]
26. Mastrocola D, Lerici C. Colorimetric measurements of enzymatic and non-enzymatic browning in apples purees. Int J Food Sci 1991; 3: 219-229. [ Links ]
27. Mascan M. Kinetic of colour of kiwifruits during hot air and microwave drying. J Food Eng 2001; 48 (2): 169-175. [ Links ]
28. Mandala IG, Anagnostaras EF, Oikonomou CK. Influence of osmotic dehydration conditions on apple air-drying kinetics and their quality characteristics. J Food Eng 2005; 69 (3): 307–316. [ Links ]
29. Salmarch M, Labuza T. Nonenzimatic browning via Maillard reaction in food. Diabetes 1982; 31 (3): 29. [ Links ]
30. Vaikousi H, Koutsoumanis K, Biliaderis CG. Kinetic modelling of non-enzymatic browning of apple juice concentrates differing in water activity under isothermal and dynamic heating conditions. Food Chem 2008; 107 (2): 785–796. [ Links ]
31. Burdurlu HS, Karadeniz F. Effect of storage on nonenzymatic browning of apple juice concentrates. Food Chem 2003; 80 (1): 91–97. [ Links ]
32. López-Nicolás JM, Núñez-Delicado E, Sánchez-Ferrer A, García-Carmona F. Kinetic model of apple juice enzymatic browning in the presence of cyclodextrins: The use of maltosyl-b-cyclodextrin as secondary antioxidant. Food Chem 2007; 101 (3): 1164–1171. [ Links ]
33. Krokida MK, Oreopoulou V, Maroulis ZB, Marinos-Kouris D. Colour changes during deep fat frying. J Food Eng 2001; 48 (3): 219-225. [ Links ]
34. Lau MH, Tang J, Swanson BG. Kinetics of textural and color changes in green asparagus during thermal treatments. J Food Eng 2000; 45 (4): 231- 236. [ Links ]
35. Ávila IMLB, Silva CLM. Modelling kinetics of thermal degradation of colour in peach puree. J Food Eng 1999; 39 (2): 161-166 [ Links ]
36. Barreiro JA, Milano M, Sandoval AJ. Kinetics of colour change of double concentrated tomato paste during thermal treatment. J Food Eng 1997; 33 (3-4): 359 -371. [ Links ]
37. Fito P. Modelling of vacuum osmotic dehydration of foods. J Food Eng 1994; 22 (1-4): 313-328. [ Links ]
38. Fito P, Pastor R. On some diffusional mechanism occurring vacuum osmotic dehydration (VOD). J Food Eng 1994; 21 (4): 513-519. [ Links ]
39. Cortés M. Desarrollo de productos de manzana deshidratados enriquecidos con vitamina E [Tesis doctoral]. Valencia, España: Universidad Politécnica de Valencia: 2004. [ Links ]
40. Judd DB, Wyszecki G. Color in business, science and industry. New York: John Wiley and Sons; 1975. [ Links ]
41. Hutchings JB. Food and colour appearance, 2 ed. Gaithersburg, Maryland: Aspen; 1999. [ Links ]
42. Gilabert EJ. Medida del color. Valencia, España: Universidad Politécnica de Valencia; 2002. [ Links ]
43. García-Martínez E, Ruiz-Díaz G, Martínez-Monzo J, Camacho MM, Martínez-Navarrete N, Chiralt A. Jam manufacture with osmodehydrated fruit. Food Res Int 2002; 35 (2-3): 301-306. [ Links ]
44. Contreras C, Martín-Esparza ME, Chiralt A, Martínez-Navarrete N. Influence of microwave application on convective drying: Effects on drying kinetics, and optical and mechanical properties of apple and strawberry. J Food Eng 2008; 88 (1): 55-64. [ Links ]
45. Martins SIFS, van Boekel MAJS. A kinetic model for the glucose/glycine Maillard reaction pathways. Food Chem 2005; 90 (1-2): 257–269. [ Links ]
46. Acevedo NC, Vilbett PB, Aguilera JM. Microstructure
affects the rate of chemical, physical and color changes during storage of dried apple discs. J Food Eng 2008; 85 (2): 222–231. [ Links ]
47. Koca N, Burdurlu HS, Karadeniz F. Kinetics of colour changes in dehydrated carrots. J Food Eng 2007; 78 (2): 449–455. [ Links ]
48. Prachayawarakorn S, Sawangduanpen S, Saynampheung S, Poolpatarachewin T, Soponronnarit S, Nathakarakule A. Kinetics of colour change during storage of dried garlic slices as affected by relative humidity and temperature. J Food Eng 2004; 62 (1): 1–7. [ Links ]
49. Lozano JE, Ibarz A. Colour changes in concentrated fruit pulp during heating at high temperatures. J Food Eng 1997; 31 (3): 365 – 373. [ Links ]
50. Ibanoglu E. Kinetic study on colour change in wheat germ due to heat. J Food Eng 2002; 51 (3): 209 – 213. [ Links ]
Recibido: Enero 21 de 2008; Aceptado: Abril 22 de 2008
* Autor a quien se debe dirigir la correspondencia: mcortesro@unalmed.edu.co