Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
BIOTECNOLOGÍA
CRECIMIENTO DE Scenedesmus sp EN DIFERENTES MEDIOS DE CULTIVO PARA LA PRODUCCION DE PROTEINA MICROALGAL
Scenedesmus sp GROWTH IN DIFFERENT CULTURE mediums FOR MICROALGAL PROTEIN PRODUCTION
Catalina QUEVEDO O.1, Sonia P. MORALES V.1*, Alejandro ACOSTA C.1
1 Grupo Bioprocesos, Facultad de Ingeniería, Departamento de Ingeniería Química, Universidad de Antioquia, ciudad universitaria,
Calle 67 53-108, Laboratorio 18-438, A.A. 1226. Medellín, Colombia
RESUMEN
Las microalgas son consideradas alimentos funcionales, capaces no sólo de elevar el contenido nutricional de los alimentos tradicionales, sino también de afectar positivamente la salud de animales y humanos, debido a que contienen cantidades apreciables de proteínas, vitaminas y ácidos grasos poliinsaturados. Algunas microalgas incluso tienen un contenido aminoacídico superior al presentado por alimentos convencionales; tal es el caso de Scenedesmus sp que posee niveles de lisina superiores al patrón de la Food and Agriculture Organization of the United Nations (FAO), y niveles de proteína entre 25 y 35 % lo que la hace una atractiva fuente de proteína. Por lo tanto, en este trabajo se busca el medio de cultivo donde se pueda alcanzar la mayor producción de biomasa y proteína de la microalga verde Scenedesmus sp, evaluando los medios de cultivo Estándar 1, Estándar 2 y Algal, empleando, NaHCO3 como fuente de carbono. El medio Estándar 2 presenta la mayor producción de biomasa (0.41 g/ L) y el medio Algal, el más alto porcentaje de proteína por materia seca (35.18%). Adicionalmente se estudia el polimorfismo que presenta la microalga en cada medio de cultivo, y se hacen evidentes cambios morfológicos, incluso entre colonias con el mismo número de células. Esta microalga tiene aplicación potencial en la industria de alimentos balanceados para animales.
Palabras clave: microalgas, Scenedesmus sp., medio de cultivo, biomasa, proteína.
ABSTRACT
Microalgae are considered as functional food capable not only of raise nutritional content but also of affect positively the animal's health and human's containing important amounts of proteins, vitamins, and polyunsatured fatty acids. Some Microalgae have even higher amino acid content than conventional food; Scenedesmus sp has a lysine level higher than the required for the Food and Agriculture Organization of the United Nations (FAO) and proteins levels between 25 and 35%, becoming a rich protein source. In this study, biomass and protein production of Green microalgae Scenedesmus sp, in different growth mediums, Standard 1, Standard 2 and Algal with NaHCO3 as carbon source, , were evaluated, . Among mediums:. Standard 2 medium had presented the higher biomass production (0.41 g/L) and the Algal medium the higher protein percentage measured by dry weight (35.18%). also, polymorphism presented by the microalgae in each medium was studied; which show morphological changes even among colonies with same cells number. This microalgae has a potential application in animal food industry.
Key words: microalgae, Scenedesmus sp., culture medium, biomass, protein.
INTRODUCCIÓN
Las microalgas se consideran como alimentos funcionales, capaces no sólo de elevar el contenido nutricional de los alimentos tradicionales, sino también de afectar positivamente la salud de animales y humanos. Poseen cantidades apreciables de carbohidratos, lípidos, vitaminas, minerales, ácidos grasos poliinsaturados (omega – 3 y omega – 6) y antioxidantes (carotenos). Algunas tienen, incluso, un contenido aminoacídico superior al presentado por alimentos convencionales; tal es el caso de Scenedesmus, que posee niveles de aminoácidos esenciales superiores al patrón de la FAO; además, niveles de proteína entre 25 y 65 % lo que la convierte en una atractiva fuente de proteína (1, 2, 3).
Comercialmente el aminoácido más importante de la familia del Aspartato es la Lisina. Ésta se encuentra en pequeñas cantidades en la mayoría de los cereales que se emplean en alimentación animal, como maíz, arroz y trigo, a los cuales, cuando se emplean para este fin, es necesario suplementarlos con lisina. Inicialmente la lisina es aislada de hidrolizados de proteínas que se producen a gran escala por fermentación microbiana (4, 1).
En Colombia, las investigaciones concernientes al cultivo de microalgas no han tenido gran alcance; por eso se hace necesaria la realización de estudios más elaborados sobre estos microorganismos para obtener de ellos sus mayores beneficios, demostrados por diferentes investigaciones en países como China, Estados Unidos, Alemania, Japón y México, entre otros (5, 6). Este trabajo tiene por objetivo evaluar diferentes medios de cultivo a nivel de laboratorio para la producción de proteína a partir de la microalga Scenedesmus sp, los parámetros cinéticos y su perfil aminoácidico, además de las características polimórficas de esta especie.
MATERIALES Y MÉTODOS
Microorganismo y condiciones de cultivo
Se utilizó una cepa de la microalga verde de agua dulce Scenedesmus sp, donada por la Universidad del Zulia, Venezuela. Para su crecimiento y mantenimiento se transfirieron células en suspensión cada 10 días a medio de cultivo Estándar 2 fresco (Tabla 1), asegurando así la conservación de células jóvenes. Los inóculos para cada cultivo fueron de 0.2 g/L y la experimentación se realizó a temperatura ambiente (25 ± 3 °C), fotoperíodo día: noche de 12:12 horas, intensidad lumínica de 12 µmol/m2 s y agitación de 200 rpm. Tanto la experimentación como los análisis se realizaron por triplicado.
Medios de cultivo
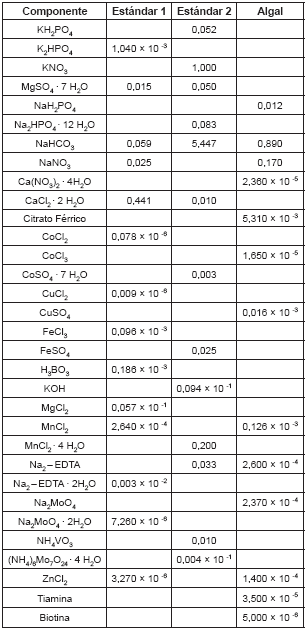
Se evaluaron los medios de cultivo Estándar 1 (7), Estándar 2 (6) y Algal (8) (véase tabla 1).
Tabla 1. Concentración salina de los medios de cultivo Estándar 1, Estándar 2 y Algal (g/L).
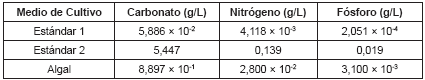
Con el fin de evaluar el efecto de los micronutrientes en los medios de cultivo se ajustó la fuente de carbono, nitrógeno y fósforo, según lo reportado por Ramírez (1998) (9), conservando una relación de C: N: P de 41: 7: 1, y empleando el bicarbonato de sodio como fuente de carbono para los medios de cultivo (Véase tabla 2).
Tabla 2. Concentración de macronutrientes en los medios de cultivo ajustada para garantizar la relación 41:7:1 de C: N: P (9).
Determinación del crecimiento celular y proteína
La cuantificación de la biomasa se efectuó por el método de peso seco (10) por triplicado y analizadas cada 48 horas, al igual que la concentración de proteína, la cual se determinó empleando el método de Lowry (11). La velocidad específica de crecimiento celular (µmax) se calculó tomando la pendiente de la recta que resulta al graficar Ln (X/X0) vs el tiempo, donde X es la concentración de biomasa y X0 es la concentración del inóculo en g/L. El tiempo de duplicación (td) se determinó con la ecuación td=(Ln2/µ) días-1.
Determinación cualitativa del polimorfismo
Para la determinación cualitativa del polimorfismo, se realizaron conteos celulares a cada uno de los medios de cultivo, empleando un hemocitómetro, teniendo en cuenta el número de células que había por colonia en proporción a las células totales. Los análisis morfológicos se efectuaron al comienzo y al final de la cinética de crecimiento.
Determinación del perfil aminoácidico
Se utilizó una muestra de 2 gramos de biomasa seca cultivada por treinta días sobre medio Algal, deshidratada por 24 horas a 65oC para evitar la desnaturalización de las proteínas. Para la determinación del perfil aminoácidico de las proteínas de Scenedesmus sp, se empleó un cromatógrafo Agilent Technologies 1100 con detección de fluorescencia, columna de cromatografía C18 por el método de fase reversa.
RESULTADOS Y DISCUSIÓN
Producción de biomasa celular
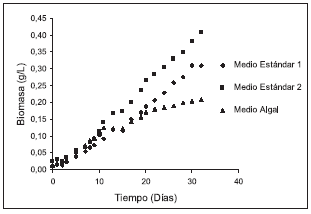
El crecimiento de la microalga presentó una tendencia similar en todos los medios evaluados, con una fase de latencia que culminó el día 4 en los tres medios de cultivo, seguida de una fase exponencial que duró 19 días para el medio Algal, 28 días para el medio Estándar 1 y más de 32 días para el medio Estándar 2. La microalga presentó una fase estacionaria después de los días 20 y 30 en los medios Algal y Estándar 1 respectivamente (Figura 1).
Figura 1. Cinética de crecimiento de Scenedesmus sp. en los medios de cultivo Estándar 1, Estándar 2 y Algal.
La mayor producción de biomasa y los más altos valores de productividad se presentaron en el medio Estándar 2, con 0,4 g/L y 0,01 g/L d respectivamente, seguidos del medio Estándar 1 y por último el Algal (véase tabla 3). La más alta velocidad de crecimiento se registró en el medio Estándar 1, seguido de los medios Estándar 2 y Algal; esto se ve reflejado en el tiempo de duplicación de la microalga, el cual es menor en el medio Estándar 1 y mayor en el medio Algal.
Tabla 3. Concentración de biomasa, productividad, velocidad específica de crecimiento (µ) y tiempo de duplicación celular (td) de Scenedesmus sp. en los medios de cultivo Estándar 1, Estándar 2 y Algal.
La concentración de biomasa alcanzada en este trabajo es mayor a la reportada por Kim et al, 2007 (12), donde se cultiva la microalga Scenedesmus sp en el medio KEP I y se airea constantemente para proveer un crecimiento de 0,197 g/L, pero menor a las concentraciones reportadas por Greque y Vieira 2007 (13), donde se obtienen 1,800 g/L de Scenedesmus obliquus cultivada en tres fotobioreactores en serie de 2 L de capacidad, a los cuales se les provee constantemente CO2.
Algunos autores presentan rangos amplios de velocidades específicas de crecimiento; tal es el caso de Martínez et al, en el año 2000 (14), quienes presentan velocidades específicas de crecimiento entre 0,045 h-1 y 0,190 h-1 con medios de cultivo preparados con efluentes de tratamiento secundario y un suministro continuo de CO2. Otros autores muestran valores menores al reportado en este trabajo para la velocidad especifica de crecimiento en los medios Estándar 2 y Algal; tal es el caso de Martínez et al, 1997 (15), al emplear Scenedesmus obliquus cultivada en erlenmeyer a una temperatura de 30 °C, donde se obtiene µmax igual 0,047 h-1, y Hodaifa et al, 2007 (16), obtuvieron valores de de 0,044 h-1, con adición de CO2 por aireación. Greque y Vieira, en el año 2007 (13), presentan una mayor velocidad de crecimiento a las obtenidas en el presente trabajo, puesto que reportan un valor de 0,220 h-1 para Scenedesmus obliquus.
En términos generales, los resultados de este trabajo muestran cinéticas de cultivo prolongadas y bajas concentraciones de biomasa, en contraste con las cinéticas reportadas que emplean como fuente de carbono el CO2, las cuales presentan una duración relativamente corta (entre 10 y 15 días) (2). Este comportamiento puede deberse a la baja solubilidad del NaHCO3 en el medio de cultivo y a la baja permeabilidad de éste a través de la membrana celular (5,000 × 10-7 cm s-1), en comparación con el CO2 (4,500 × 10-1 cm s-1) utilizado convencionalmente (19).
Las productividades obtenidas en esta investigación son bajas comparadas con valores reportados por otros investigadores, lo cual es lógico, ya que estos últimos realizan cultivos en continuo y semicontinuo, donde las productividades son mayores que para un cultivo por lotes. La productividad obtenida por Voltolina et al, 2005 (17) fue de 39,300 mg L-1 d-1 para biomasa en medios de cultivo preparados con diluciones del 30% de aguas residuales en cultivo semicontinuo, y Nuñez et al en el 2001 (18) reportan productividades de 153,700 mg L-1 d-1 en quince días de cultivo.
Producción de proteína
La más alta concentración de proteína y los mayores valores de productividad se obtuvieron en el medio Estándar 2, seguido del medio Estándar 1 y por último el Algal (Véase Tabla 4). Sin embargo, los porcentajes de proteína por materia seca de microalga presentaron un comportamiento diferente, obteniéndose un mayor valor en el medio Algal, seguido del Estándar 2 y finalmente el Estándar 1. Estos resultados muestran que el medio Algal produce mayor cantidad de proteína por célula en relación con el volumen total de la misma. Otros autores han reportado que Scenedesmus, a una concentración de nitrógeno menor en el medio, da como resultado mayor porcentaje de proteína total; tal es el caso de Scenedesmus obliquus, que al cultivarse con un porcentaje de nitrógeno de 0.01% y 0.1% produce 34.0% y 32.9% de proteína espectivamente (2). En este trabajo, el medio Estándar 2 (Véase tabla 1) fue preparado con una concentración de 1 g/L KNO3, y el medio Algal con 0.170 g/L de NaNO3, correspondientes a porcentajes de fuente de nitrógeno del 0.1% y 0.01%, produciendo porcentajes de proteína similares a los reportados en la literatura (Véase tabla 4).
Las productividades de proteína obtenidas en esta investigación, son bajas comparadas con valores reportados por Voltolina et al, 2005 (17), donde se presentan valores de 24,900 mg L-1 d-1 en medios de cultivo preparados con diluciones del 30% de agua residuales en cultivo semicontinuo; de manera similar Nuñez et al. (18) obtuvieron, en el año 2001, una productividad de 52,360 mg L-1 d-1 de Scenedesmus obliquus cultivada en reactores de 2 litros de capacidad, en aguas residuales.
Tabla 4. Contenido de proteína (µg/mL) y porcentaje de proteína total producida por materia seca para cada medio de cultivo.
Análisis estadístico
Los resultados se analizaron en el programa Stat Graphics, utilizando el método ANOVA factorial, donde puede observarse la estrecha relación que existe entre los medios de cultivo y la cantidad de biomasa en g/L producida por la microalga para cada uno de ellos. El medio de cultivo donde se obtuvo la mayor cantidad de biomasa es el Estándar 2, seguido de los medios Estándar 1 y Algal. Igualmente, la producción de proteína en función de los medios de cultivo utilizados muestra que el medio de cultivo Estándar 2 es el que presenta la mayor concentración de esta variable. Estos resultados implican que la variación del medio de cultivo afecta tanto la producción de biomasa como la de proteína.
De acuerdo con los resultados anteriormente expuestos se concluye que el medio de cultivo que favorece la producción tanto de biomasa como de proteína es el Estándar 2.
Evaluación del polimorfismo
Bajo condiciones ambientales fluctuantes tanto al interior como al exterior de las células, las especies de Scenedesmus sp cambian su forma buscando una manera de adaptarse a gradientes en las condiciones de cultivo como la temperatura o la intensidad lumínica e, incluso, llegan a cambiar totalmente su identidad (20). Los cambios respecto a las condiciones externas de los diferentes medios de cultivo evaluados en esta investigación, radican principalmente en la composición de los medios y las concentraciones de los macro y micronutrientes.
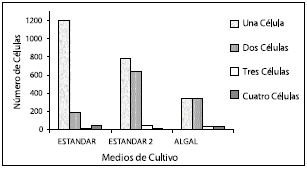
En las observaciones al microscopio se identificaron cenobios de 1, 2, 3 y 4 células en todos los medios evaluados; sin embargo, el conteo celular para colonias de tres y cuatro células, en ninguno de los medios de cultivo es lo suficientemente representativo en contraste con el número de colonias de una y dos células (Véase figura 2). Comparando las morfologías de los diferentes medios de cultivo se evidencian cambios, incluso entre cenobios con el mismo número de células.
Los cenobios de cuatro células del medio Estándar 1 son delgados y alargados, las uniones entre ellos comienzan desde los extremos, la terminación de las células no tiene ninguna prolongación o apéndice, no obstante se puede observar que son de forma puntiaguda. Algunos cenobios de dos células son redondeados en un extremo y alargados en el opuesto, otros son redondos en ambos extremos, e incluso se observa la presencia de células casi por completo redondas. En este medio se notan cambios morfológicos más variados que en los medios Estándar 2 y Algal.
Figura 2. Determinación del polimorfismo en los medios de cultivo Estándar 1, Estándar 2 y Algal.
En el medio Estándar 2 los cenobios son, en su mayoría, de una y dos células; éstas son completamente redondas, aunque sus extremos terminan en forma de punta sin la presencia de apéndices; las uniones entre las células se dan en el centro de las mismas, no desde los extremos, y se observa un espacio entre células mucho más amplio que en los otros dos medios. Las células individuales presentan, en general, la misma forma que las halladas en cenobios de dos células, aunque algunas son completamente redondas.
El medio Algal evidencia cenobios de dos células que se unen desde puntos extremos de las mismas, son semiredondeadas, los extremos de las células son completamente redondos y sin apéndices, la separación entre células es menos evidente que en el medio Estándar 2. (Véase figura 3). La constante en los tres medios son las colonias de cuatro células, que suelen ser más delgadas que las demás, largas y, en algunas ocasiones, presentan apéndices, aunque en todos los casos los extremos son en forma de punta; la diferencia entre ellas radica en el diámetro de las células y los cenobios que, para el caso de el medio Estándar 2, son ensanchados.
Figura 3. Morfologías encontradas en los medios de cultivo
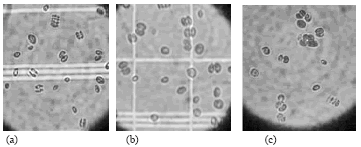
(a) Medio Estándar 1, (b) Medio Estándar 2 y (c) Medio Algal.
Las altas concentraciones de nutrientes en el medio Estándar 2 hacen que las células tiendan a aumentar su esfericidad más de lo normal, produciéndose un aumento en la relación superficie/volumen, que favorece la incorporación de nutrientes y un incremento en la concentración de cloroplastos, con lo que se les permite a las células una mayor captación de la luz (20). De igual manera en el medio Algal, la esfericidad es observable, mientras que en el medio Estándar 1, que presenta la menor concentración de nutrientes, las células son de forma alargada.
Perfil aminoácidico de la microalga Scenedesmus sp.
En la Tabla 5 se presenta el análisis del perfil aminoácidico de la microalga Scenedesmus sp. Los resultados obtenidos en porcentaje (g aminoácido/g de peso seco*100) se comparan con los de la soya, y con los requerimientos mínimos de ácidos esenciales exigidos por la FAO (21).
Según los análisis realizados se aprecia que las relaciones obtenidas entre aminoácidos esenciales como lisina y cistina se encuentran presentes en la microalga Scenedesmus sp en niveles superiores a los requerimientos básicos reportados por la FAO, e incluso los presentados por la soya. Esto es un indicativo de que la microalga podría emplearse para reemplazar parte del alimento que se suministra a algunos animales de corral (22). Incluso debido a los altos valores de lisina que presenta la especie Scenedesmus sp empleada en esta investigación, en relación con los otros aminoácidos, puede ser promisorio cultivar la microalga con el fin de aislar este aminoácido.
Tabla 5. Aminoácidos esenciales en la dieta para niños en crecimiento, según la FAO, presentados en mg aminoácido/g de aminoácidos esenciales, comparados con los que poseen la soya y la microalga Scenedesmus sp.
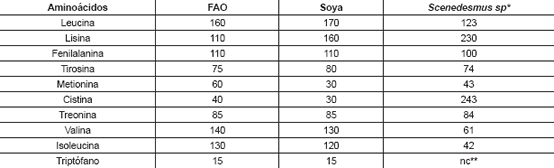
* Microalgas cultivadas a nivel de laboratorio, Grupo de Bioprocesos.
**nc: no se cuantificó.
CONCLUSIÓN
Según el perfil aminoácidico obtenido para la microalga Scenedesmus sp, se encuentra que ésta tiene aplicación potencial en la industria de alimentos balanceados para animales. La microalga puede ser cultivada en el medio Estándar 2, debido a que es allí donde presenta la mayor concentración de biomasa y proteína, pero se recomienda emplear CO2 como fuente de carbono.
REFERENCIAS BIBLIOGRÁFICAS
1. Méndez M. Evaluación de la remoción de fósforo y nitrógeno de aguas residuales por el alga Chlorella sp. Revista Clon 2003; 2: 42-46. [ Links ]
2. Abalde J, Cid A, Fidalgo J, Torres E, Herrero C. Microalgas: cultivo y aplicaciones. La Coruña: Servicio de Publicaciones; 1996. [ Links ]
3. Visentainer J, De Souza N, Makoto M, Hayashi C, Franco M. Influence of diets enriched with flaxseed oil on the a-linolenico, eicosapentanoic and docosahexaenoico fatty acid in Nile tilapia (Oreochromis niloticus). Food Chem 2005; 90: 557-560. [ Links ]
4. Seibold G, Auchter M, Berens S, Kalinowski J, Eikmanns BJ. Utilization of soluble starch by a recombinant Corynebacterium glutamicum strain: Growth and lysine production. J Biotechnol 2006; 124 (2): 381-391. [ Links ]
5. Spolaore P, Joannis C, Duran E, Isambert A. Review commercial applications of microalgae. J Biosci Bioeng 2006; 101 (2): 87-96. [ Links ]
6. Borowitzka M. Commercial production of microalgae: ponds, tanks, tubes and fermenters. J Biotechnol 1999; 70 (1-3): 313-321. [ Links ]
7. Clesceri L, Greenberg A, Trussell R. Standard methods for the examination of water and wastewater. 17 edición. Washington: American Public Health Association 1989; 8: 17-19. [ Links ]
8. Fábregas J, Herrero C, Cabezas B, Abalde J. Growth of the marine microalga Tetraselmis suecica in batch cultures with different salinities. Aquaculture 1984; 42: 207-215. [ Links ]
9. Ramírez A, Vina G. Limnología colombiana: aportes a su conocimiento y estadísticas de análisis. Bogotá: Panamericana; 1998. p. 12 – 14. [ Links ]
10. Bajguz A, Godlewska-Zylkiewicz B. Protective role of 20-hydroxyecdsone against lead stress in Chlorella vulgaris cultures. Phytochemistry 2004; 65: 711-720. [ Links ]
11. Piorreck M, Baasch K, Pohl P. Biomass production, total protein, chlorophylls, lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes. Phytochemistry 1984; 23(2): 207-216. [ Links ]
12. Kim MK, Park JW, Park CS, Kim SJ, Jeune KH, Chang MU, et al. Enhanced production of Scenedesmus spp. (green microalgae) using a new medium containing fermented swine wastewater. Bioresource Technol 2007; 98: 2220 – 2228. [ Links ]
13. Greque M, Vieira JÁ. Biofixation of carbon dioxide by Spirulina sp. and Scenedesmus obliquus cultivated in a three-stage serial tubular photobioreactor. J Biotechnol 2007; 129: 439–445. [ Links ]
14. Martínez ME, Sánchez S, Jiménez JM, El Yousfi F, Muñoz L. Nitrogen and phosphorus removal from urban wastewater by the microalga Scenedesmus obliquus. Bioresource Technol 2000; 73: 263 – 272. [ Links ]
15. Martínez ME, Jiménez JM, Farida EY. Influence of phosphorus concentration on the growth kinetics and stoichiometry of the microalga Scenedesmus obliquus. Proccess Biochem 1997; 32 (8): 657-664. [ Links ]
16. Hodaifa G, Martínez M, Sánchez S. Use of industrial wastewater from olive-oil extraction for biomass production of Scenedesmus obliquus. Bioresource Technol 2007; 99(5): 1111 – 1117. [ Links ]
17. Voltolina D, Gómez Villa H. Nitrogen removal and recycling by Scenedesmus obliquus in semicontinuous cultures using artificial wastewater and simulated light and temperature cycle. Bioresource Technol 2005; 96: 359 – 362. [ Links ]
18. Nuñez V, Voltolina D, Nieves M, Piña P, Medina A, Guerrero M. Nitrogen budget in Scenedesmus obliquus cultures with artificial wastewater. Bioresource Technol 2001; 78: 161-164. [ Links ]
19. Nielsen J, Villadsen J. Bioreaction engineering principles. 2ª ed. New York: Plenum; 2002. [ Links ]
20. Acevedo A, Ramírez J. Influencia de un gradiente cruzado de luz y temperatura en la morfología de Scenedesmus acutus meyen var. globosus hortobágyi y sus implicaciones taxonómicas. Actual Biol 2003; 25 (79): 141 – 146. [ Links ]
21. González P. Desarrollo de productos para las panaderías y productos materno infantiles. Disponible en: http://www.wishh.org. Organizacion wishh (World initiative for soy in human health). Consultado: septiembre de 2006 [ Links ]
22. Martin O, Madrazo G, Rodríguez A. Evaluación de dietas de preinicio en el comportamiento productivo de pollos de engorde. Revista Cubana de Ciencia Avícola 2002; 26: 151-158. [ Links ]
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI) y a la Universidad de Antioquia por la financiación del proyecto MC04-1-06.
Recibido: Septiembre 20 de 2007; Aceptado: Marzo 4 de 2008
* Autor a quien debe dirigir la correspondencia: smora@udea.edu.co