Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
BIOTECNOLOGÍA
ESTABLECIMIENTO DE SUSPENSIONES CELULARES DE Bixa orellana L. PRODUCTORAS DE COMPUESTOS FENÓLICOS POTENCIALMENTE ANTIOFÍDICOS.
CELLULAR SUSPENSIONS ESTABLISHMENT OF Bixa orellana L., PHENOLIC COMPOUNDS PRODUCERS WITH POTENTIAL ANTIOPHIDIC ACTIVITY.
Silvia L. JIMÉNEZ R.1*; Hader I. CASTAÑO P. 1; Juan Carlos QUINTANA.1; Gelmy L. CIRO G.1; Lida QUINCHÍA.1; Sebastián ESTRADA.1
1 Grupo de Ofidismo y Escorpionismo. Facultad de Química Farmacéutica. Universidad de Antioquia. A.A 1226. Medellín-Colombia
RESUMEN
Se ha desarrollado un protocolo para la producción y masificación de células de achiote en suspensión, a partir de callos friables obtenidos de tejidos de hojas, como estrategia para la obtención de metabolitos antiofídícos, especialmente compuestos fenólicos, y para ello se ha evaluado el efecto de las concentraciones de inóculo, glucosa, fósforo y nitrógeno sobre la cinética de crecimiento celular, en el medio ½MS+2,4-D (5 ppm)+BAP (1 ppm), almacenados a 25º C, en oscuridad y a 140 rpm, utilizando un diseño factorial completamente aleatorizado de cuatro factores y dos niveles, con evaluación a los 20 y 40 días de establecimiento. El tratamiento que presenta la mayor producción de biomasa de células de achiote en suspensión tiene una concentración inicial de biomasa de 4 g/l, 20 g/l de glucosa, 0.13 g/l de fósforo y 2.52 g/l de nitrógeno. La cinética de crecimiento de las células de achiote en suspensión, en las condiciones de cultivo de este tratamiento, presenta una fase exponencial bien definida de 25 días; a partir de allí se establece una fase estacionaria hasta el tiempo final de la evaluación (40 días). Se comparan los contenidos de fenoles totales entre el material obtenido in vitro y el material vegetal proveniente de plantas crecidas ex-vitro, como criterio válido para justificar posteriores trabajos de producción metabólica in-vitro en esta especie vegetal.
Palabras clave: suspensiones celulares, Bixa orellana L, compuestos fenólicos.
ABSTRACT
A protocol for production and massification of achiote cells in suspension from friable calli of leaf tissues, has been developed as a strategy to obtain antiophidics metabolites, especially phenolics compounds. Concentration effects of, inoculum, glucose, phosphorus and nitrogen, on cellular growth kinetics were evaluated in ½ MS+2,4-D (5 ppm)+BAP (1 ppm) medium, stored at 25º C, darkness and 140 rpm, using a randomized factorial design with 4 factors, two levels and evaluation at 20 and 40 days of establishment. Treatment with highest biomass production of achiote cells in suspension, had an initial biomass concentration of 4g/l, glucose 20g/l, phosphorus 0,13g/l and nitrogen 2,52 g/l. Kinetics growth of achiote cells in suspension in culture conditions, presented a well defined exponential phase of 25 days, since then a stationary phase until the end of the evaluation (40 days). Total phenols contents among material obtained in-vitro and vegetable material obtained ex vitro were compared as a valid criteria to justify later works of in-vitro metabolic production in this vegetable specie.
Key Words: cells suspensions, Bixa orellana L, phenolics compound
INTRODUCCIÓN
En algunas regiones de los departamentos de Antioquia y Chocó, ubicados al noroccidente de Colombia, se reportan anualmente cerca de 700 casos (1) de mordedura de serpiente, el 95% por Bothrops asper (mapaná), una especie muy agresiva y con alta capacidad reproductiva. Su veneno induce alteraciones patológicas locales y sistémicas como edema, necrosis, hipotensión, alteraciones en la coagulación, hemorragia sistémica, trombocitopenia y nefrotoxicidad (2,3).
El tratamiento de los accidentes ofídicos ha presentado diversas dificultades debido a que las personas directamente implicadas en este tipo de sucesos son, generalmente, individuos de escasos recursos que no tienen la capacidad ni los medios necesarios para acceder al tratamiento, lo que a su vez, conduce a que la mayoría de los casos (60%) sean tratados inicialmente por curanderos tradicionales de la región (3), que poseen conocimientos empíricos de extractos acuosos o alcohólicos de plantas medicinales. Debido a la gran biodiversidad colombiana y al problema que representa la incidencia de este tipo de accidentes, se hace necesario buscar en nuestro territorio, especies vegetales promisorias que puedan servir como posible alternativa terapéutica para el tratamiento de las mordeduras de serpientes, especialmente para los accidentes ocasionados por B. asper (mapaná equis), la serpiente responsable del 50 al 70% de los accidentes ofídicos de nuestro país. Los metabolitos secundarios presentes en los extractos polares obtenidos a partir de las hojas de Bixa orellana L. se han convertido en una alternativa importante para nuestro medio, por el amplio espectro de actividades demostradas, tales como antiedematizante, antihemorrágica y neutralizante del veneno de B. asper. (1)
A la planta completa, o a algunas de sus partes, se les atribuyen efectos en la medicina tradicional; de hecho, su utilización se remonta a las antiguas tribus aborígenes americanas.
Todas las propiedades mencionadas están directamente relacionadas con la composición química de las hojas, pues se han aislado flavonoides (apigenina, luteolina, hipoaletina e isoscutelareína), algunos de sus heterósidos (cosmosiína), derivados bisulfatados (apigenina, luteolina-7-bisulfato e hipoaletina-8-bisulfato), diterpenos (farnesilacetona, geranil-geraniol, geranilforniato), ácido gálico, pirogalol y aceite esencial, caracterizado por la presencia de un hidrocarburo sesquiterpénico inusual, el bixaganeno o iswarano (4).
Es hipoglicemiante, por su capacidad de reducir la aldosa reductasa con una CI50 de 0.0000033 g/ml, acción atribuida a la presencia de la isoescutelareína (5); antibacteriana y antifúngica frente a Neisseria gonorrhoea, Trichomona vaginalis, Cladosporium cladosporoides, Bacillus subtilis, Staphylococcus aureus, Streptococcus faecalis, Macrosporum gypseum y Tricophyton mentagrophytes (6); antimalárica in vitro en un 95% en el test HPIA a dosis de 2.5 mg/ml e in vivo frente a cepas sensibles y resistentes a cloroquina de Plasmodium falciparum con una CI50 de 28 a 33 µg/ml (7); e inhibidora de la enzima prostaglandina-sintetasa a 750 µg/ml (8) y de las fosfolipasas A2 (PLA2), que son responsables de algunos eventos relacionados con actividades neurotóxicas, miotóxicas, cardiotóxicas y agregantes plaquetarias de los venenos de serpientes (9).
Hasta el momento, se ha considerado que la producción óptima de metabolitos secundarios con importancia terapéutica generados a partir de B. orellana L., sólo se logra en plantas con cierto grado de desarrollo y por esto no se alcanza a cubrir su demanda. A ello se agregan diversos factores, como la variación en el número cromosómico de la especie (2n = 14, 16), la disminución del porcentaje de viabilidad (10), la necesidad de escarificación mecánica para incrementar la germinación (11) y la alta exigencia de suelos ricos en manganeso (12).
Por lo anterior, se justifica el uso de técnicas de manipulación in-vitro en B. orellana L., que permitan establecer las condiciones óptimas para la obtención y masificación de suspensiones celulares, como etapa preliminar a la producción de los contenidos metabólicos responsables de las actividades biológicas ya descritas, y evaluar su potencial como una alternativa diferente al suero antiofídico, poco accesible y con serias reacciones adversas reportadas frente al tratamiento de los accidentes ofídicos.
MATERIALES Y MÉTODOS
Recolección del material vegetal y preparación de extractos.
La colección de hojas provenientes de material crecido ex-vitro, se realiza en la finca Villa Adela ubicada a 1.494 m.s.n.m, corregimiento El Hatillo, Municipio de Barbosa (Antioquia) y es clasificada por el Herbario de la Universidad de Antioquia, mientras que células desdiferenciadas obtenidas y subcultivadas de manera rutinaria en el laboratorio (13) sirven como material vegetal inicial para todos los ensayos realizados. Las hojas colectadas son secadas en estufa a 35ºC durante 48 horas. Una vez seco, el material vegetal (hojas y rizomas) es sometido a percolación en etanol al 96% durante 48 horas y posteriormente, el extracto etanólico es concentrado usando un rotavapor Büchi R-124. Por último, los extractos obtenidos se almacenan a 4°C hasta el momento de los ensayos.
Curva de crecimiento preliminar
La variable de respuesta del diseño para el establecimiento de las suspensiones es la concentración celular (biomasa) (Tablas 1 y 2).
El seguimiento de los factores y de las variables de respuesta, determina el desarrollo cinético del proceso, permitiendo, con estos criterios, seleccionar el mejor tratamiento para la producción de biomasa y la estrategia adecuada para el mantenimiento de la suspensión stock.
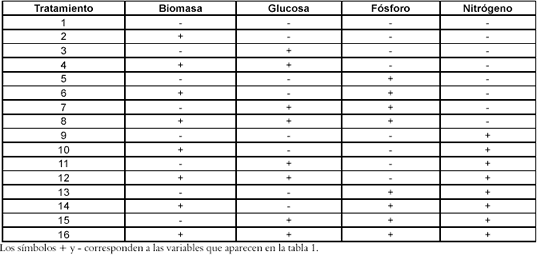
Como etapa previa a la evaluación de los tratamientos, se realiza una curva de cinética de crecimiento celular con el objetivo de identificar sus fases, definir los tiempos de cosecha de las suspensiones y evaluar el efecto de la concentración de las sales del medio MS (Murashige-Skoog) (14). Para tal fin, se realizan tres montajes de suspensiones celulares con las siguientes condiciones (MS, ½ MS y 1 ½ MS) y tratamiento hormonal compuesto de 2,4 D 5 ppm y BAP de 1 ppm- coincidiendo con lo establecido por Duangjai S. et al. para Vitex glabrata (15), enriquecido con vitaminas y hierro EDTA, pH de 5.7, inóculo 4g/l de peso fresco, glucosa 30 g/l, agitación de 140 rpm en agitador orbital, a temperatura ambiente y en completa oscuridad. La cinética de crecimiento es monitoreada por espacio de 40 días, tomando muestras para determinación de peso seco a intervalos de 5 días.
Evaluación del efecto de las concentraciones de biomasa, glucosa, fósforo y nitrógeno
Para masificar las suspensiones celulares, se transfieren las células a medios nutritivos líquidos con composiciones determinadas bajo un diseño factorial completamente aleatorio utilizando cuatro factores: concentración inicial de biomasa, glucosa, nitrógeno y fósforo, cada uno de ellos evaluado en dos niveles, 16 tratamientos con cuatro réplicas por tratamiento, para un total de 64 ensayos, donde la variable respuesta es la biomasa expresada en peso seco (mg). Los callos friables de achiote son utilizados como inóculo en erlenmeyers de 500 ml con un volumen de medio de 100 ml. Los medios de cultivo se formulan tomando como base el medio MS, modificando la concentración de las sales fuentes de fósforo y nitrógeno, como se muestra en la Tabla 1.
Tabla 1. Diseño experimental para la suspensión celular.
Tabla 2. Diseño factorial 24 completamente aleatorio
Los experimentos se realizan por duplicado, evaluando la biomasa a los 20 y 40 días respectivamente. Las unidades experimentales después de la esterilización (121ºCx15 min.) e inoculación son mantenidas a temperatura ambiente en completa oscuridad y a 140 rpm, en un agitador orbital. Las biomasas de las unidades experimentales se cosechan por filtración a vacío utilizando papel Whatman (0,25μm), y son secadas hasta peso constante a una temperatura de 38º C, para evitar degradaciones térmicas de las muestras.
Curva de crecimiento de suspensiones celulares en medio mejorado
Se establece el montaje de las suspensiones para determinar la curva de crecimiento de biomasa en las condiciones del tratamiento que presenta la mejor respuesta. La cinética de crecimiento celular es evaluada por espacio de 40 días, realizando determinaciones de biomasa en los días 5, 10, 20, 25, 35 y 40. El montaje del diseño experimental se fundamenta en la determinación de biomasa en peso seco de cuatro repeticiones para cada intervalo de tiempo. El método utilizado para la determinación de biomasa es idéntico al utilizado en la fase anterior de la experimentación.
Cuantificación de fenoles totales
Los fenoles presentes en los materiales vegetales se extraen a una fase líquida utilizando solventes polares y ultrasonido. En un tubo de ensayo se maceran 80 mg de material seco (células de los callos, hojas, células de las suspensiones) con 5 ml de acetona al 70 % como solvente de extracción, luego es sometido a ultrasonido por 20 minutos a temperatura ambiente, y por último centrifugado a 3.000 rpm y 4º C. El sobrenadante colectado se coloca en un baño de hielo. El precipitado es nuevamente macerado con acetona al 70 % (2.5 ml), se somete a ultrasonido por 20 minutos y se centrifuga por 10 minutos a 3.000 rpm y 4º C. El sobrenadante se reúne con el anterior, que reposa en el baño de hielo. Este último proceso se repite una vez más. Del extracto total se toman alícuotas de 0,02 - 0,05 y 0,1 ml, se llevan a volumen (0,5 ml) con agua destilada, se les adicionan 1,25 ml de carbonato de sodio al 20 % y 0,25 ml del reactivo Folin Ciocalteu (1:1). Se agitan e incuban por 40 minutos en la oscuridad para leer la absorbancia de cada muestra a 725 nm, contra una curva de ácido tánico y se cuantifican los fenoles totales utilizando el método del Folin-Ciocalteu, expresando los resultados como equivalente de ácido tánico (16). Todos los ensayos se realizan por triplicado.
Tratamiento estadístico
Para evaluar el efecto de los factores se utiliza análisis de varianza que establezca relaciones entre tratamientos. Este análisis, las medidas descriptivas necesarias y las comparaciones de medias se realizan con ayuda del paquete estadístico Statgraphics plus 4.0, bajo entorno Windows, con un grado de significancia de p<0.05.
RESULTADOS Y DISCUSIÓN
Se observa una mejor respuesta de crecimiento celular en suspensión de los callos de achiote en medio ½MS, en concordancia con los resultados obtenidos por Cuartas et al., 2002. (17). En la curva de crecimiento de la suspensión de células de achiote en el medio ½MS + 2,4-D (5ppm) + BAP (1ppm) se presenta una diferenciación clara de las fases de crecimiento celular en discontinuo, como se observa en la Figura 1: en el día 10 inicia la fase exponencial y culmina el día 25, donde inicia la fase estacionaria.
Figura 1. Curva de crecimiento preliminar
A partir de esta información se definen los días 20 y 40 para realizar el seguimiento a la biomasa y determinar el efecto de los diferentes tratamientos sobre el establecimiento de la suspensión celular.
Evaluación del efecto de las concentraciones de biomasa, glucosa, fósforo y nitrógeno
Únicamente la concentración de nitrógeno (suministrado como KNO3) en las suspensiones cosechadas a los 20 días presenta un efecto significativo, con un p≤0.001, sobre el crecimiento celular; obteniéndose una mejor respuesta con el nivel de mayor concentración. Resultados similares fueron encontrados en el establecimiento de suspensiones celulares de Dendrobium huoshanense en la producción de polisacáridos (18), y de Panax quinquefolium en la producción de saponinas de ginseng (19).
Para las suspensiones cosechadas a los 40 días, el análisis estadístico mediante la prueba de Manova, muestra que sólo existe efecto de la interacción de las variables: concentración inicial de glucosa y biomasa sobre el crecimiento celular, con un p≤ 0,000704; resultado que concuerda con el estudio del establecimiento de suspensiones de Panax ginseng en la producción de saponinas y el efecto combinado de la concentración inicial de sustrato y tamaño de inóculo (20).
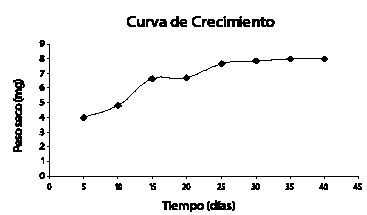
La evaluación realizada a la biomasa cosechada el día 40, presenta el mismo comportamiento de los factores estudiados en las suspensiones cosechadas en el día 20. El Análisis de Varianza (ANOVA) aplicado para evaluar el efecto de los diferentes factores (concentración de biomasa, glucosa, fósforo y nitrógeno) sobre el crecimiento celular, muestra que no existe diferencia significativa entre los tratamientos; por tanto, se selecciona el tratamiento que presenta la formulación del medio de cultivo más económica para el establecimiento de la suspensión, así como la mínima concentración inicial de biomasa requerida para la determinación de compuestos fenólicos. Por estas razones se selecciona el tratamiento 2 (ver tabla 2), cuya formulación contempla concentraciones iniciales de biomasa 4 g/l de callo friable, 20 g/l de glucosa, 0,13 g/l de fósforo suplementado como NaH2P04.2H20 y 2,52 g/l nitrógeno suplementado como KNO3, con tratamientos hormonales idénticos al utilizado para el montaje de la suspensión pre-experimental, 2,4-D (5 ppm) y BAP (1 ppm).
El efecto individual del inóculo para los niveles evaluados (2 y 4 g/l) sobre el crecimiento celular a los 40 días, permite observar una mayor respuesta de la concentración de 4 g/l sobre el crecimiento celular en suspensión (Véanse figuras 2 y 3).
Figura 2. Producción de biomasa para un inóculo de 4 g/l
Figura 3. Producción de biomasa para un inóculo de 2 g/l
Cinética de crecimiento de la suspensión de células de achiote
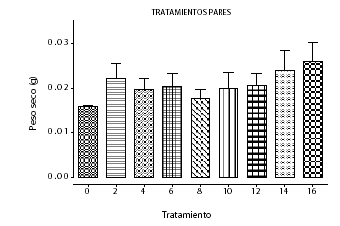
La curva de crecimiento en la suspensión celular de achiote en el medio de cultivo seleccionado, presenta un incremento sostenido de biomasa entre los días 5 y 25, correspondiente a la fase de crecimiento exponencial. La fase estacionaria se extiende hasta el día 40, donde se alcanza el máximo contenido de biomasa en peso seco (25 mg), que corresponde a un incremento de 20 mg (400%) (Véase figura 4). Zha et al., (18), lograron incrementar la biomasa en 245 % con respecto al medio original mediante optimización del medio de cultivo de la suspensión de Dendrobium huoshanense evaluando el efecto de las concentraciones iniciales de biomasa, fuente de nitrógeno e iones metálicos.
Figura 4. Curva de crecimiento en el medio seleccionado (Tratamiento 2)
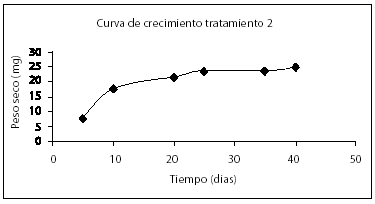
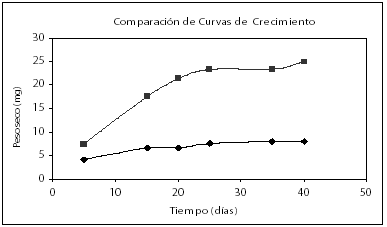
Se presenta una mejor respuesta del crecimiento en el tratamiento seleccionado comparado con la curva de crecimiento pre-experimental (Véase figura 5).
Figura 5. Comparación de curvas de crecimiento.
( ½ MS modificado con concentraciones iniciales de biomasa en forma de callo 4 g/l, glucosa 20 g/l, 0.13 g/l de fósforo suplementados como NaH2P04.2H20 y 2.52 g/l de nitrógeno suplementado como KNO3.
½ MS modificado con concentraciones iniciales de biomasa en forma de callo 4 g/l, glucosa 20 g/l, 0.13 g/l de fósforo suplementados como NaH2P04.2H20 y 2.52 g/l de nitrógeno suplementado como KNO3.  ½ MS con concentración inicial de biomasa 4 g/l peso fresco).
½ MS con concentración inicial de biomasa 4 g/l peso fresco).
Cuantificación de fenoles totales
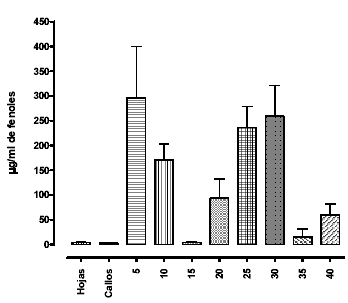
La concentración de fenoles totales en hojas crecidas ex-vitro es de 4.405 ± 0.391 µg/ml, mientras que la concentración de fenoles en callos es de 2.622 ± 0.2426 µg/ml. En las suspensiones celulares crecidas en el Tratamiento 2, se observa una producción irregular de fenoles totales (medio+callos) durante el periodo de cultivo hasta los 40 días (ver gráfica 6). La concentración de fenoles en hojas y callo es menor, en ambos casos, que la producida por las células del cultivo, demostrando así que la producción en medios líquidos es una buena alternativa de producción.
Figura 6. Comparación de fenoles totales entre las diferentes muestras. Los datos están expresados en µg/ml de fenoles totales. Los datos representan la media ± S.E.M.
Los resultados muestran que los compuestos fenólicos producidos por estas células parecen ser excretados al medio y se determinan los días 5, 25 y 30 como los mas apropiados para obtenerlos. Otros autores demuestran que la producción de compuestos de interés farmacológico se incrementa con los días de cultivo (día 40) (21). Se observa un comportamiento oscilante en la producción de los metabolitos en estudio, que podría explicarse por una posible reutilización de las células para suplir deficiencias nutricionales o como productos del estrés a la que están sometidas las células en estas condiciones artificiales de crecimiento, cuando se agotan los nutrientes. De todas formas, las vías de la biogénesis de los compuestos fenólicos, en general, y de los flavonoides, en particular, se encuentran bajo el control de múltiples condiciones relacionadas; entre ellas la luz y las hormonas de crecimiento, afectando la expresión de los genes biosintetizadores (22). El papel de los compuestos fenólicos, intra e intercelular, no ha sido bien estudiado y como marcadores en las plantas, involucran actividades enzimáticas o comunicación célula-celúla difíciles de caracterizar (23). Por estas razones, se hace necesario llevar a cabo posteriores experimentos que conduzcan a la aclaración de este comportamiento en la producción de los metabolitos en referencia y utilizar elicitores que promuevan dicha producción, tal y como se logró con Corylus avellana, para producir taxol y taxanos que pudiesen ser utilizados como medicamentos anticancerígenos. (24)
CONCLUSIONES
El medio de crecimiento basal ½ MS presenta la mejor respuesta de crecimiento bajo el modelo de suspensión celular. Sólo la concentración inicial de nitrógeno, suplementado como KNO3, presenta efecto sobre el crecimiento celular de la biomasa de achiote para el día 20; para el día 40, sólo la interacción entre los factores de glucosa y biomasa. La identificación del efecto de la concentración de sales del medio basal y la evaluación de los factores: glucosa, nitrógeno, fósforo y biomasa, resultan ser una buena estrategia para la selección y determinación de las mejores condiciones de establecimiento de suspensiones celulares, permitiendo incrementar la biomasa en peso seco en un 400%. Se selecciona el Tratamiento 2 como medio de formulación para el establecimiento de la suspensión de células de achiote, dadas sus ventajas frente a los costos de producción del medio y por la respuesta en biomasa que otorga la cantidad mínima necesaria para la determinación de compuestos fenólicos, dada la sensibilidad del método. Los días 5, 25 y 30 resultan ser los más apropiados para obtener los compuestos fenólicos en la suspensión. Además, se encuentra que las suspensiones son una mejor fuente de compuestos fenólicos que las hojas y los callos. Todo esto hace necesario, en posteriores estudios, determinar el potencial antiofídico de los compuestos obtenidos en el cultivo y el uso de elicitores que incrementen la producción de estos compuestos.
AGRADECIMIENTOS
Los autores agradecen al Comité para el Desarrollo de la Investigación (CODI) y a la Universidad de Antioquia por la financiación del proyecto "Estudio químico comparativo de extractos polares obtenidos a partir de suspensiones celulares y hojas de Bixa orellana L."
REFERENCIAS BIBLIOGRÁFICAS
1. Otero R, Fonnegra R, Jiménez S. Plantas utilizadas contra mordedura de serpientes en Antioquia y Chocó, Colombia. Medellín: Otero R, Fonnegra R, Jiménez S (editores); 2000. [ Links ]
2. Otero R, Núñez V, Jiménez S, Fonnegra R, Osorio R, García M, et al., Snakebites and ethnobotany in the northwest region of Colombia, Part II: Neutralization of letal and enzymatic effects of Bothrops atrox venom, J Ethnopharmacology 2000; 71: 505-511 [ Links ]
3. Otero R, Núñez V, Barona J, Saldarriaga M, Fonnegra R, Osorio R, et al., Neutralization of edema-forming and defibrinating effects of Bothrops atrox asper venom by extracts of plants used by healers in Antioquia and Chocó, Colombia, En: Cordovez JM. Abstracts XV International Congress for Tropical Medicine and Malaria. Bogotá: Corcas; 2000, pp. 186 [ Links ]
4. Lawrence BM, Hogg JW. Ishwarane in Bixa orellana leaf oil. Phytochemistry 1973; 12(12): 2995 [ Links ]
5. Terashima S, Shimitzu M, Horie S, Morita N. Studies on aldose reductasa inhibitors from natural products. IV. Constituents and aldose reductase inhibitory efect of Chrysanthemum morifolium, Bixa orellana and Ipomoea batatas. Chem Pharm Bull 1991; 39: 3346-3347. [ Links ]
6. Cáceres A, Menéndez H, Méndez E, Cohobon E, Samayoa BE, Jáuregui E, et al. Antigonorrhoeal activity of plants used in Guatemala for the tratament of sexually transmitted diseases. J Ethnopharmacology 1995; 48: 85-88. [ Links ]
7. Baelmans R, Deharo E, Bourdy G, Muñoz V, Quenevo C, Sauvain M. A search for natural bioactive compounds in Bolivia through a multidisciplinary approach; Part IV. Is a new haem polymerization inhibition test pertinent for the detection of antimalarial natural products? J Ethnopharmacology 2000; 73; 271-275 [ Links ]
8. Tseng C, Iwakami S, Mikajiri A, Shibuya M, Hanaoka F, Ebizuka Y, et al. Inhibition of in vitro prostaglandin and leucotriene biosynteses by cinnamoyl-b-phenethylamine and n-acyldopamine derivates. Chem Pharm Bul 1992; 40:396-400. [ Links ]
9. Gowda TV. Interaction of snake venom phospholipases A2 with plant isolates, En: Kini RM (editor.). Venom phospholipase A2 enzymes. Chichester: John Wiley & Sons. 1997; 124-127 [ Links ]
10. Belfort AJL, Kato OR, Kato M do SA. Practical method of drying annatto seeds for seedling production, Circular Técnica 67. Belem, Brazil: Centro de Pesquisa Agropecuaria do Trópico Umido, EMBRAPA-CPATU. 1992; 14. [ Links ]
11. Amaral LIV, de Pereira FA, Cortelazzo AL. Dormancy breaking in seeds of Bixa orellana. Revista Brasileira de Fisiología Vegetal 1995; 7(2): 151-157 [ Links ]
12. Eira MTS, Mello CMC. Bixa orellana L., seed germination and conservation. Seed Sci Tech 1997; 25: 373-380. [ Links ]
13. Alarcón JC, Castaño H, Corrales L, Jiménez S, Díaz A. Evaluación de algunas combinaciones de reguladores de crecimiento inductoras de callos en achiote (Bixa orellana L.), planta activa contra la mordedura de serpientes. Vitae 2006; 13(1):17-23. [ Links ]
14. Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 1962; 15: 473-497. [ Links ]
15. Duangjai S, Preeyada D, Sanha P. Optimization of cell growth and 20 hydroxyecdysone production in cell suspension culture of Vitex glabrata R.Br. Chin J Biotechnol 2007; 23 (6):1033-1036. [ Links ]
16. FAO/IAEA. Quantification of tannins in tree foliage, a laboratory manual. Working document. Viena: IAEA; 2000, p 3-6 [ Links ]
17. Cuartas S, Perea M, Montoya D. Production of the Bixa orellana L. (achiote) pigment from cell suspension culture. Plant Biotechnology 2002 and beyond: proceedings of the 10th Iaptc&B Congress, 2002, Orlando: Kluwer Academic Pub; 2002, 145:78 - 78. [ Links ]
18. Zha X, Luo J, Jiang S, Wang J. Enhancement of polysaccharide production in suspension cultures of protocorm-like bodies from Dendrobium huoshanense by optimization of medium compositions and feeding of sucrose. Process Biochem 2007; 42: 344-351. [ Links ]
19. Zhong J, Wang S. Effects of nitrogen source on the production ginseng saponin and polysaccharide by cell cultures of Panax quinquefolium of Panax quinquefolium. Process Biochem 1998; 33 (6):671-675. [ Links ]
20. Akalezi CO, Liu S, Li QS, Yu JT, Zhong JJ. Combined effects of initial sucrose concentration and inoculum size on cell growth and ginseng saponin production by suspension cultures of Panax ginseng. Process Biochem 1999; 34:639-642. [ Links ]
21. Inyushkina YV, Bulgakov VP, Veselova MV, Bryukhanov VM, Zverev YF, Lampatov VV, et al. High rabdosiin and rosmarinic acid production in Eritrichium sericeum callus cultures and the effect of the calli on masugi-nephritis in rats. Biosci Biotechnol Biochem 2007; 71(5):1286-93. [ Links ]
22. Irani NG, Hernández JM, Grotewold E. Regulation of anthocyanin pigmentation. Rec Adv Phytochem 2003; 38:59-78 [ Links ]
23. Grotewold E. The science of flavonoids. New York: Springer Science; 2006. [ Links ]
24. Bestoso F, Ottaggio L, Armirotti A, Balbi A, Damonte G, Degan P, et al. in vitro cell cultures obtained from different explants of Corylus avellana produce Taxol and taxanes. BMC Biotechnol 2006; 6:45. [ Links ]
Recibido: Marzo 12 de 2008; Aceptado: Mayo 13 de 2008
* Autor a quien se debe dirigir la correspondencia : sjimenez@udea.edu.co