Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
ATENCIÓN FARMACÉUTICA
MEDICAMENTOS VITALES NO DISPONIBLES:ANALISIS DE REGLAMENTACIÓN NACIONAL E INTERNACIONAL, PROPUESTA DE ACTUALIZACIÓN DEL LISTADO NACIONAL
VITAL MEDICINES NOT AVAILABLE: NATIONAL AND INTERNATIONAL REGULATION ANALYSIS, UPDATE PROPOSAL OF NATIONAL LIST
Gloria A. SANDOVAL.1, Claudia P. VACCA G.1*, Jorge OLARTE.1
1 Departamento de Farmacia. Facultad de Ciencias. Universidad Nacional de Colombia. A.A. 14490. Bogotá - Colombia
RESUMEN
Se realiza una revisión comparativa de las políticas y normas existentes a nivel nacional e internacional en relación con la disponibilidad y acceso a medicamentos huérfanos y/o vitales. Adicionalmente se elabora una propuesta de actualización del listado de medicamentos vitales no disponibles a partir de la comparación con las listas de medicamentos huérfanos de Estados Unidos y la Unión Europea, la lista de solicitudes de importación realizadas al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) hasta mayo de 2006, una consulta a prestadores de servicios de salud, aseguradores e importadores y comercializadores de medicamentos vitales, el listado propuesto por la Sala Especializada de Medicamentos de la Comisión Revisora del instituto, así como una revisión de la lista de medicamentos protegidos por el decreto 2085 de 2002 y de las importaciones de medicamentos realizadas por el Ministerio de la Protección Social en el marco de los programas de salud pública. De un total de 107 medicamentos propuestos, 26 coinciden con las listas de medicamentos huérfanos de los países de referencia y 12 se encuentran en condiciones de exclusividad en virtud del Decreto 2085 de 2002.
Palabras clave: medicamentos huérfanos, medicamentos excepcionales, enfermedades raras, enfermedades descuidadas, legislación
ABSTRACT
A comparative revision was carried out on the national and international policies and regulations about access of orphan and/or vital drugs. An analysis of: orphan drugs' list from USA, European Union and all applications for importation of not available drugs submitted by the Drug Regulatory Authority (INVIMA) until 2006; an informal consultation with health care providers, insurance companies and distributors of vital medicines, were included, in order to improve the actual vital drugs list within the frame of public health programs. The analysis included all drugs that have been protected by Decree 2085 from 2002, as well as the imported drugs by the Ministry of Social Welfare under the public health program. 26 of 107 proposed drugs match the lists of orphan drugs from the countries analyzed and 12 are protected with exclusivity by decree 2085 from 2002.
Key words: orphan drugs, exceptional drugs, rare disease, neglected disease, legislatio
INTRODUCCIÓN
La situación de disponibilidad de medicamentos para el tratamiento de enfermedades raras o de baja prevalencia es crítica. Así mismo, existen enfermedades de mayor prevalencia no incluidas dentro de las prioridades de investigación de la industria farmacéutica. Este problema puede ser explicado por las deficiencias del esquema actual de incentivos a la propiedad intelectual, orientado fundamentalmente al atractivo del mercado potencial.
Las patologías con estas características son conocidas en inglés con el término neglected diseases. Su traducción varía entre autores, muchos de los cuales las denominan enfermedades olvidadas, descuidadas, desatendidas, o incluso despreciadas.
La dificultad en el acceso a medicamentos para el tratamiento de las enfermedades mencionadas es una preocupación creciente de los gobiernos y se ha incorporado en las agendas de las políticas farmacéuticas nacionales, de forma que se asegure el acceso equitativo a los tratamientos y se establezcan iniciativas de disponibilidad de los mismos (1).
En Colombia, el documento de política farmacéutica adoptado en el año 2003, establece la necesidad de desarrollar incentivos para mejorar la disponibilidad de medicamentos huérfanos en el país. Aunque no se han diseñado tales incentivos, el Ministerio de la Protección Social y el Instituto Nacional de Vigilancia de Medicamentos y alimentos (INVIMA) han desarrollado el concepto de Medicamentos Vitales No Disponibles (MVND), entendidos como aquellos indispensables e irremplazables para salvaguardar la vida o aliviar el sufrimiento de un paciente o un grupo de pacientes y que, por condiciones de baja rentabilidad en su comercialización, no se encuentran disponibles en el país, o las cantidades no son suficientes, y han establecido el marco regulatorio que facilite los trámites de importación (2) con el fin de enfrentar el problema de los medicamentos huérfanos en el país.
Esta definición es un avance en el reconocimiento de los problemas de disponibilidad de medicamentos, no solamente para enfermedades de baja prevalencia, sino descuidadas o de escaso interés en la investigación de alternativas terapéuticas necesarias. En este sentido, se ha reconocido la necesidad de actualizar la lista MVND para que sea adoptada por el INVIMA y sirva de referencia nacional.
METODOLOGÍA
Parte 1.
1. Revisión de las normas nacionales e internacionales relacionadas con el tema en sitios Web de las agencias regulatorias documentos de referencia relacionados con el tema.
Parte 2.
1. Consulta de las solicitudes de importación de MVND presentadas al INVIMA.
2. Consulta de listado de MVND adoptados por el INVIMA hasta Mayo de 2006.
3. Consulta de los medicamentos importados por el Ministerio de Protección Social en el marco de los programas de salud pública.
4. Consulta a entidades prestadoras de servicios de salud y a empresas importadores de MVND sobre posibles inclusiones en listado.
5. Consulta de los medicamentos considerados huérfanos por Estados Unidos y la Unión Europea
6. Debido a que el decreto 481 de 2004 determina que también se consideran MVND aquellos que aún encontrándose en el país no cubren la demanda del mismo, se realizó un listado de medicamentos monopólicos protegidos mediante el decreto 2085 de 2003 y que eran considerados huérfanos por la Food and Drug Administration (FDA) y la Unión Europea (UE).
7. Análisis comparativo de las consultas realizadas, propuesta de listado actualizado de MVND y sugerencias de estrategias para facilitar el acceso a estos medicamentos.
RESULTADOS
Legislación internacional
Estados Unidos
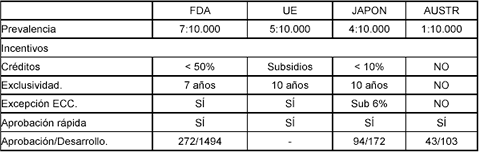
Estados Unidos fue el primer país que reglamentó los aspectos relacionados con medicamentos huérfanos, incluyendo los incentivos de investigación y desarrollo en 1983, mediante la Ley de medicamentos huérfanos (3) para garantizar el acceso a medicamentos y tratamientos a las personas que sufren de enfermedades raras o descuidadas.
La definición de medicamentos huérfanos en la legislación estadounidense se relaciona con la prevalencia de la enfermedad y contempla dos casos: aquellos destinados a tratar enfermedades que afectan a menos de 200.000 personas en Estados Unidos (7 en 10.000) y aquellos utilizados en patologías que aún afectando a más de 200.000 personas, no son desarrollados debido al costo ocasionado por la baja demanda.
La regulación norteamericana contempla estrategias que generen atractivos comerciales para la investigación y desarrollo de medicamentos huérfanos a través de tres tipos de incentivos:
1. La disminución en tasas de créditos para los estudios clínicos en un 50%
2. La exclusividad de producción por 7 años.
3. La excepción en estudios clínicos, justificados en el bajo número de personas que son afectadas por este tipo de enfermedades (4).
Adicionalmente, alguna evidencia empírica establece que existe un menor tiempo para la aprobación de medicamentos huérfanos que para aquellos que no lo son, (el tiempo de aprobación de un medicamento huérfano es en promedio 12,8 meses, para aquellos no huérfanos es aproximadamente 33,1 meses) (5).
Durante la década anterior a la existencia de la ley de medicamentos huérfanos de 1983, el número de medicamentos huérfanos desarrollados sin ayuda del gobierno fue de 10 (6), y el número registrado actualmente, de 1544 (7) (última revisión marzo 21 de 2006). La proporción de medicamentos aprobados con respecto a los desarrollados fue de 272/1.494 (5) hasta octubre de 2000 (Tabla 1).
Los incentivos para medicamentos huérfanos en los Estados Unidos se aplican a un medicamento por enfermedad, la aparición o desarrollo de uno nuevo debe demostrar superioridad terapéutica sobre el existente.
Unión Europea
De otro lado, la Unión Europea (8), entendiendo la necesidad de generar una acción comunitaria que permitiera desarrollar y sostener una política de medicamentos huérfanos, por medio del Consejo del 16 de diciembre de 1999 y el reglamento (CE) 141/2000 del Parlamento Europeo, definió medicamento huérfano de acuerdo a la prevalencia de la enfermedad en la población. Dicha prevalencia no debe superar cinco casos por diez mil habitantes y, considerando la experiencia norteamericana y de Japón, estableció una política de incentivos al desarrollo de estos medicamentos, la cual contempla:
- Exclusividad de comercialización por 10 años (con un periodo de transición que inició con 6 años).
- Subsidios por parte de los gobiernos, a pequeñas y medianas empresas o entidades académicas.
- Prioridad a proyectos que promuevan la información sobre enfermedades raras, entrenamiento, capacitación, colaboración transnacional, monitorización, vigilancia y descubrimiento de nuevos grupos de enfermedades raras.
Algunos países como Francia y el Reino Unido se han interesado más por proveer un acceso rápido a tratamientos e información a pacientes que por tener una legislación relevante al respecto.
Australia
La política australiana referente a medicamentos huérfanos se estableció en 1997 (9). Para otorgarle el estatus de medicamento huérfano, la prevalencia de la enfermedad debe ser de 1 en 10.000; sin embargo, no cuenta con mayor exclusividad de comercialización, como sucede en Estados Unidos y la Unión Europa. La proporción de medicamentos huérfanos aprobados y desarrollados hasta octubre de 2000 fue de 43/103 (5) la más baja de los países revisados (véase tabla 1).
Japón
Fue el segundo país en promulgar una política encaminada a reglamentar los medicamentos para tratar enfermedades raras en 1985. El número de afectados por enfermedad para ser considerada rara es de 4 en 10.000. Los incentivos manejados por Japón incluyen:
- La exclusividad de comercialización por 10 años.
- Disminución en las tasas de crédito en un 10%.
- Subsidios a investigación y desarrollo del 6% para ensayos clínicos y no clínicos.
- Rápida revisión y aprobación de los medicamentos.
Con este tipo de incentivos, la proporción de fármacos aprobados y desarrollados era de 94/172 hasta octubre de 2000 (5)
Tabla 1. Incentivos a investigación y desarrollo de medicamentos huérfanos a nivel internacional y su incidencia.
Colombia
Colombia expidió el decreto 481 de 2004 (2), buscando incentivar la oferta de medicamentos vitales no disponibles en el país, considerando estrictamente la disponibilidad y la baja demanda de los mismos. El decreto establece algunos parámetros para facilitar el acceso, como:
- No requerir registro sanitario para su producción, importación y comercialización.
- Autorización de importación a pacientes específicos o, en caso de urgencia clínica, con sólo la autorización médica.
Sin embargo, no existen incentivos en el sentido estricto de la palabra para la investigación y desarrollo de medicamentos, ni un ambiente legislativo propicio para que la industria desarrolle medicamentos para el tratamiento de enfermedades cuya demanda no se encuentra totalmente cubierta.
La exclusividad de comercialización por períodos de tiempo más prolongados es una de las estrategias para incentivar la investigación y desarrollo de medicamentos huérfanos. No obstante, si bien esta exclusividad existe en Colombia desde 2002 (Decreto 2085), no se emplea como estrategia para incentivar la investigación de medicamentos huérfanos.
Situación de enfermedades raras
Aunque existen más de 5.000 enfermedades consideradas raras, de las cuales el 80% son de origen genético (10), el desarrollo de medicamentos se ha concentrado en tratar dos grupos de patologías predominantemente: los diferentes tipos de cáncer (31%), como el ovárico y la leucemia, y las enfermedades producidas por desórdenes metabólicos (11%) (6).
La focalización de la investigación y desarrollo de medicamentos destinados al tratamiento de enfermedades raras en grupos específicos, se da, en gran medida, por las dificultades de patentabilidad, ya que en muchos casos las bases investigativas se desarrollan alrededor de la identificación de genes y desarrollo de productos biológicos donde la reglamentación es bastante ambigua o inexistente.
Prevalencia de enfermedades raras
Establecer cuál es la prevalencia de una enfermedad es de gran importancia para determinar si es rara. Cada país establece la prevalencia de las enfermedades, según su capacidad de cubrir su atención.
El 52,2% de enfermedades raras están ubicadas en el rango de 1/10.000 a 1/100.000, de acuerdo a un muestreo de 230 enfermedades raras en la Unión Europea. En el Reino Unido este porcentaje es del 31,82%, mientras que el 33,3% se refiere a enfermedades con una prevalencia de 1/1.000 hasta 1/10.000, según datos obtenidos de grupos de soporte o asociaciones de pacientes con enfermedades raras (11).
Otro factor importante es el efecto sobre la calidad de vida de un paciente que padece una enfermedad rara, dado que éste varía dependiendo del tipo de enfermedad. Algunas enfermedades generan una alta mortalidad infantil o en edad adulta. Por ejemplo, en el Reino Unido, el porcentaje de mortalidad por causa de enfermedades raras es del 41,9% y en la Unión Europea los casos de muerte infantil alcanzan el 25,7% antes de los 5 años. Otras enfermedades que afectan la calidad de vida de los pacientes ocasionan diferentes grados de incapacidad sin llegar a producir la muerte. En el Reino Unido las incapacidades ocasionadas por enfermedades raras alcanzan 43,6% (5, 11)
Situación de las enfermedades descuidadas
Las enfermedades descuidadas son aquellas para las cuales las perspectivas económicas no son favorables y que no generan en la industria farmacéutica interés en su desarrollo a pesar de su alta prevalencia, en especial en países en vías de desarrollo. Los casos más relevantes de estas enfermedades son la malaria y la leishmaniasis.
Los tratamientos para estas enfermedades no son los apropiados para establecer su estatus como medicamentos huérfanos; sin embargo, es claro el bajo interés en su desarrollo y producción. En el periodo comprendido entre 1972 y 1992, el desarrollo de medicamentos para enfermedades tropicales fue de 13, menos del 1%, de los cuales 3 fueron resultado de la investigación y desarrollo de la industria farmacéutica, mientras los 10 restantes fueron desarrollados por las fuerzas armadas o por la industria veterinaria (12).
Adicionalmente, las innovaciones en medicinas para este tipo de enfermedades salen al mercado con elevados precios, ocasionando problemas de acceso.
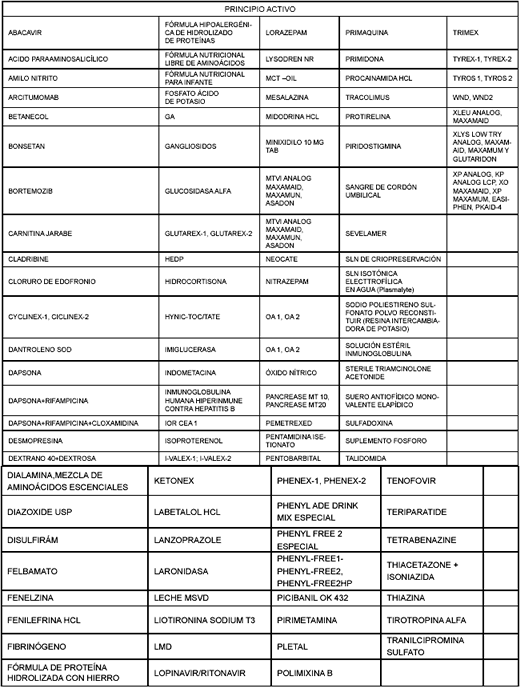
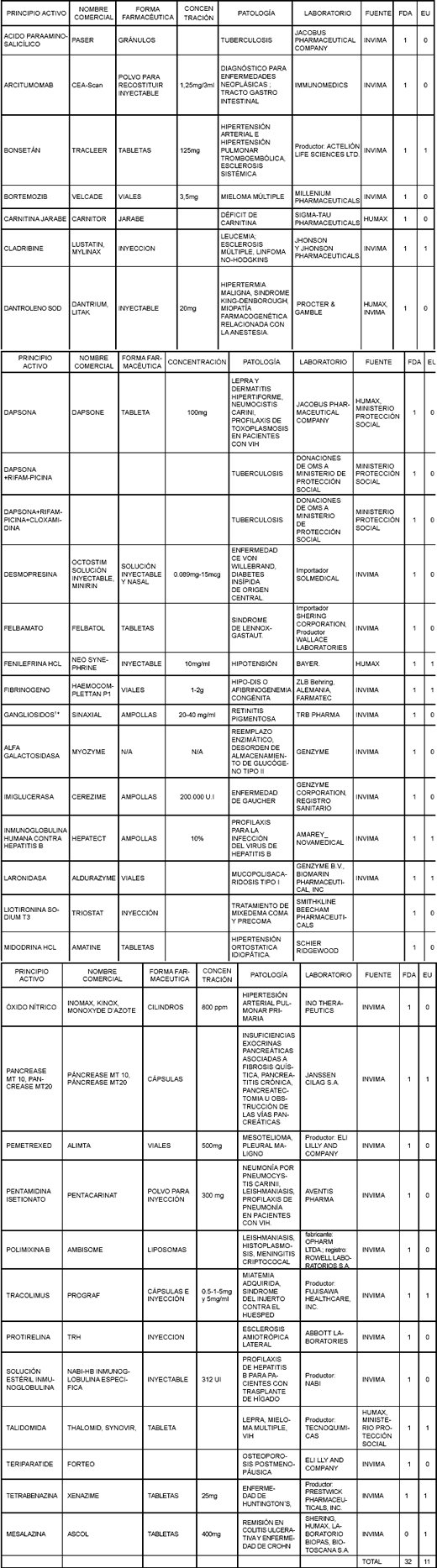
Revisión de listados de medicamentos huérfanos y otras fuentes para la propuesta de actualización
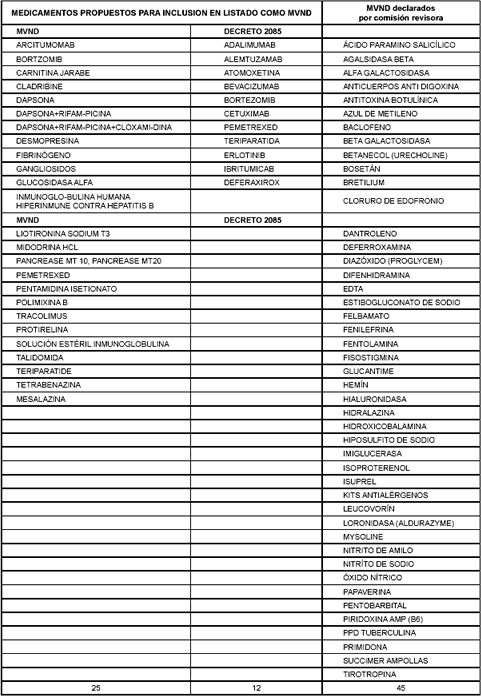
La información sobre la oferta y la demanda de medicamentos, así como el listado de MVND propuesto por la Sala Especializada de Medicamentos de la Comisión (véase tabla 2), se compara con el listado de medicamentos considerados huérfanos por Estados Unidos y la Unión Europea (véase tabla 3). La comparación permite establecer que existe un total de 32 medicamentos coincidentes con el listado de medicamentos huérfanos de la FDA (31%) y 11 (11%) con el listado de la Unión Europea.
Tabla 2. Total de posibles MVND recomendados por diferentes instituciones consultadas a nivel nacional
Tabla 3. Medicamentos que también son considerados huérfanos por FDA y UE
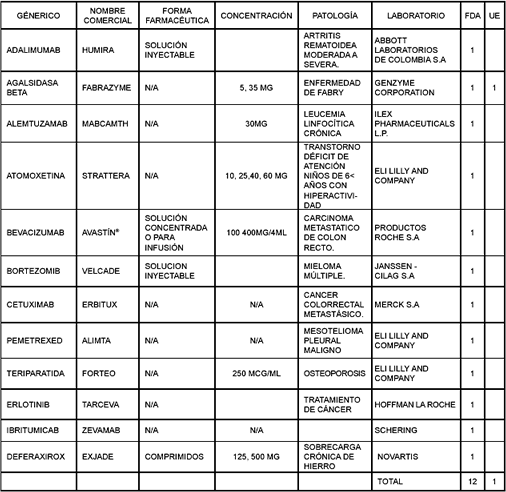
Adicionalmente, la lista de medicamentos con exclusividad, establecida por el decreto 2085 hasta diciembre de 2005, se comparó con el listado oficial de huérfanos de Estados Unidos y la Unión Europea. De los 36 fármacos protegidos (13), 9 son comunes a la lista norteamericana (25%) y 1 a la de la Unión Europea (3%) (Tabla 4).
La propuesta de actualización (Tabla 5), incluye:
1. Los medicamentos considerados vitales no disponibles por la Comisión Revisora, mediante acta, hasta mayo de 2006
2. La propuesta de inclusión, considerando las solicitudes de importación realizadas ante el INVIMA y las listas sugeridas por las instituciones y que, a su vez, coincidían con los listados de la FDA y la Unión Europea.
Tabla 4. medicamentos cubiertos por el decreto 2085** considerados huérfanos por FDA o UE
Tabla 5. Propuesta de listado actualizado de MVND y medicamentos aprobados por la Comisión revisora de medicamentos hasta mayo de 2006
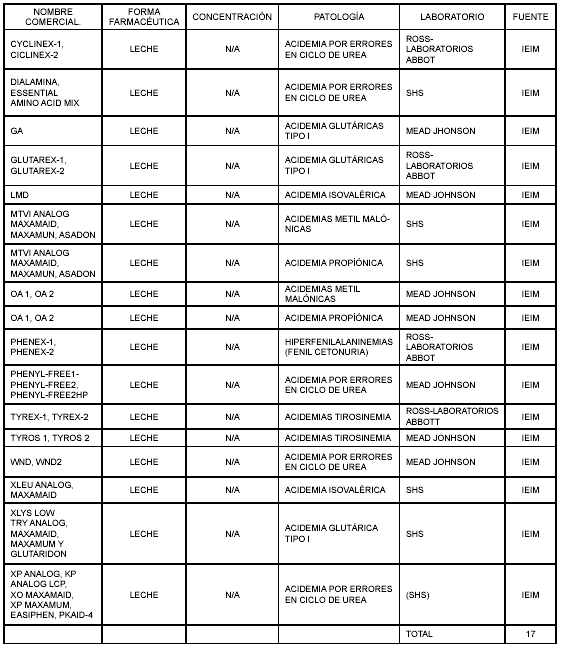
En la Tabla 6 se encuentran algunos suplementos nutricionales, destinados al tratamiento de enfermedades metabólicas, no considerados medicamentos en sus países de origen, pero necesarios para salvaguardar la vida de un paciente.
Tabla 6. Soportes nutricionales para tratamiento de enfermedades generadas por errores innatos del metabolismo.
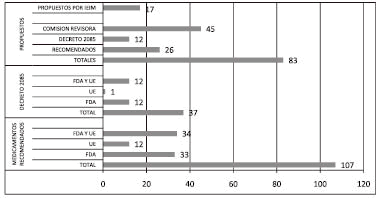
La lista propuesta es eminentemente cuantitativa e incluye 26 medicamentos adicionales a los ya considerados como MVND por la sala especializada de medicamentos de la Comisión Revisora del INVIMA, hasta mayo de 2006, y 12 que se encuentran protegidos por el decreto 2085, hasta agosto de 2006 (Figura 1).
Figura 1. Cuadro resumen
ANÁLISIS Y DISCUSIÓN
Aunque en la regulación de los países consultada se establece claramente que un medicamento se considera huérfano en razón de la prevalencia de la enfermedad y el bajo interés comercial en su desarrollo, el acercamiento realizado por Colombia resulta interesante por la perspectiva asumida: la disponibilidad. Esto permitió la adopción regulatoria del término MVND.
En efecto, considerando la definición de MVND, existe coincidencia con algunos medicamentos considerados huérfanos en otros países (31% y 11%, Estados Unidos y Unión Europea respectivamente), pero también resultan incluidos otros medicamentos desabastecidos por razones de monopolio, especulación y/u otras necesidades detectadas a través de las solicitudes de importación y de la consulta a interesados.
Sin embargo, resulta importante una revisión desde la perspectiva de las patologías, debido a que la prevalencia de enfermedades raras cambia, dependiendo de la ubicación geográfica.
Establecida la prevalencia, sería aconsejable comparar la lista propuesta e identificar cuántas de las enfermedades de baja prevalencia pueden ser tratadas con dichos medicamentos.
Esta inclusión es importante, pues generalmente las patologías raras se asocian a un medicamento. Sin embargo, debido a que el concepto de MVND es mucho más amplio y no se limita a medicamentos destinados al tratamiento de enfermedades de baja prevalencia, algunos pueden usarse en el tratamiento de una patología, como el ácido amino-para-salicílico y la Dapsona, empleados en el tratamiento de la tuberculosis (Tabla 3). En este caso habría que analizar si el concepto de MVND podría aplicarse de la misma manera.
La creación de incentivos a la investigación y desarrollo de medicamentos por parte de los gobiernos ha demostrado tener impacto en el desarrollo de fármacos para el tratamiento de patologías raras. Sin embargo, en Colombia no se han establecido este tipo de incentivos, los cuales podrían tener impacto en el desarrollo de nuevos fármacos de interés en salud pública, al margen de la baja prevalencia, por ejemplo, el caso del tratamiento de la malaria producida por Plasmodium vivax, que afecta a un alto número de personas en países en vía de desarrollo (14).
Se incluyeron también los suplementos nutricionales para el tratamiento de enfermedades metabólicas, dado que su falta de administración puede causar daños irreversibles en el paciente. Estos productos podrían ser cubiertos por las disposiciones del Decreto 481 porque en muchos casos no se comercializan en el país. Un ejemplo específico de esta situación son las acidemias metabólicas, relacionadas con errores en el ciclo de la urea y que generan concentraciones de amonio lesivas para el sistema nervioso central y, en general, fallas a nivel renal, hepático y cardíaco, las cuales pueden ser tratadas con fórmulas especiales que eliminen las fuentes de proteína y suplan los requerimientos vitamínicos y de minerales (15).
El desarrollo de medicamentos necesarios para el tratamiento de enfermedades olvidadas requiere algunas estrategias que incluyan la movilización de experiencia y conocimientos para la elaboración de una lista de prioridades y factores de riesgo para enfermedades específicas, incluyendo una evaluación del balance riesgo/costo/beneficio (16).
CONCLUSIONES Y RECOMENDACIONES
Se han hecho avances en Colombia en la conceptualización y reglamentación de los problemas relacionados con el acceso a medicamentos específicos y para el tratamiento de condiciones clínicas especiales. Particularmente el Decreto 481 de 2004 incorpora una definición amplia de lo que se considera Medicamento Vital No Disponible y los procesos para su importación. Sin embargo, no se han desarrollado mecanismos de incentivos y subsidios para su investigación, producción y comercialización. Estos mecanismos han mostrado ser efectivos en otros países como Estados Unidos y la Unión Europea.
La propuesta de una lista actualizada de MVND en Colombia hasta 2006 incorpora un total de 34 medicamentos, producto de una consulta de la oferta y la demanda nacionales y un análisis comparativo de la misma frente a las listas de la FDA y de la Unión Europea. Adicionalmente se incorporan 12 medicamentos que se encuentran protegidos bajo la modalidad del decreto 2085, en condición de exclusividad, destinados al tratamiento de enfermedades de baja prevalencia. Sin embargo, considerando la definición del MVND, la lista podría ampliarse, incorporando un análisis de los medicamentos en condición de monopolio.
La actualización permanente del listado propuesto requeriría codificar los medicamentos siguiendo el sistema ATC, y las patologías en las que se utilizan empleando CIE910, al igual que una revisión de la prevalencia de enfermedades consideradas como raras y de enfermedades descuidadas en Colombia.
Aunque no se realizó un análisis de los precios de los MVND, es común que sean elevados, por lo que se sugiere establecer mecanismos de seguimiento a los mismos y explorar mecanismos para reducir los costos de importación e intermediación y formas de compensación de los costos de tratamiento.
REFERENCIAS BIBLIOGRÁFICAS
(1) Unión Europea, Comisión de regulación. Communication from the Commission on Regulation (EC) n° 141/2000 on orphan medicinal products. La comisión. Disponible en: http://ec.europa.eu/enterprise/pharmaceuticals/orphanmp/doc/com_0703/com_orphan_en.pdf Consultado: 15 de Enero de 2008 [ Links ]
(2) Colombia, Presidencia, Decreto 481 de 2004, febrero 18, Por el cual se dictan normas tendientes a incentivar la oferta de medicamentos vitales no disponibles en el país. Bogotá, Presidencia. Disponible en:http://www.invima.gov.co/Invima///normatividad/docs_medicamentos/decreto_481_2004.htm. Consultado: 15 de Enero de 2008 [ Links ]
(3) The Orphan Drug Act (as amended). Food and Drug Administration (FDA) Disponible en: http://www.fda.gov/orphan/oda.htm. Consultado: 17 de Enero de 2008 [ Links ]
(4) Benzi G, Ceci A. Drugs trying to get the parents: there will be incentives for the european scientific community to develop research in the field of the orphan drugs. Pharmacol Res 1997; 35 (2): 89-93 [ Links ]
(5) Kanavos P, Saka O. Providing access to modern treatments and influencing policy in orphan diseases: the international experience and evidence from the UK. Londres: LSE Health and Social Care - The London School of Economics and Political Science; 2005 [ Links ]
(6) Haffner ME. The current environment in orphan drug development. Drug Inf J 2003; 37, (4): 373-379 [ Links ]
(7) Cumulative list of all orphan designated products. Disponible en: http://www.fda.gov/orphan/designat/alldes.rtf. Consultado: 17 de Enero de 2008 [ Links ]
(8) Reglamento (CE) No 141/2000 del Parlamento Europeo y del Consejo, de 16 Diciembre de 1999. Sobre Medicamentos Huérfanos. Disponible en: http://www.ub.es/legmh/disposici/reg141.htm. Consultado: 17 de Enero de 2008 [ Links ]
(9) The Orphan Drug Program and Improving Communitiy Access To Effective Drugs For Rare Diseases. Camberra: Department of Health and Aged Care; 2001. [ Links ]
(10) Aidan Hollis. Drugs for rare diseases: paying for innovation (2005). Disponible en: http://jdi.econ.queensu.ca/Files/Conferences/HealthServicesconferencepapers/Hollis_paper.pdf. Consultado: 15 de enero de 2008 [ Links ]
(11) Rare diseases in numbers. Eurordis - Orphaned. Disponible en: http://www.orpha.net/actor/Orphanews/2005/doc/Rare_Diseases_in_Numbers.pdf. Consultado: 18 de Enero de 2008 [ Links ]
(12) Trouiller P, Battistella C, Pinel J, Pecoul B. Is orphan drug status beneficial to tropical disease control? Comparison of the American and future European orphan drug acts. Trop Med Int Health 1999; 4 (6): 412-420 [ Links ]
(13) Colombia, Ministerio de Salud. Decreto 2085 de 2002, septiembre 19. por el cual se reglamentan aspectos relacionados con la información suministrada para obtener registro. Bogotá: El Ministerio; 2002. [ Links ]
(14) (PAHO) Malaria Still a Public Health Problem in the Americas Washington, D.C., September 30, 2005. Disponible en: http://www.paho.org/English/DD/PIN/pr050930.htm. Consultado: 18 de Enero de 2008. [ Links ]
(15) Barrera LA, Sáenz H, Cuellar YM, Ospina SY, Garzón K, Cabrera M, et al. Manual de enfermedades Metabólicas. Bogotá: Instituto de Errores Innatos del Metabolismo; 2004. [ Links ]
(16) Trouiller P, Torreele E, Olliario P, White N, Foster S, Wirth D, et al. Drugs for neglected diseases: a failure of the market and a public heath failure? Trop Med Int Health 2001; 6 (11): 945-951. [ Links ]
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, INVIMA, Ministerio de Protección Social, Organización No gubernamental Misión Salud y al programa Banco de Medicamentos, al Laboratorio Humax, y a Claudia Vargas por la colaboración en la edición del documento.
Recibido: Octubre 10 de 2007; Aceptado: Abril 8 de 2008
* Autor a quien se debe dirigir la correspondencia: cpvacag@unal.edu.co
** Para consultar el listado actualizado a 2007 puede consultar la página: http://www.invima.gov.co/Invima//consultas/medicamentos%20vitalesnodisp/medicamentos%20vitales%20no%20disponiblesag.htm