Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
PRODUCCIÓN FARMACÉUTICA
DETERMINACIÓN DE LAS CONDICIONES DE MICROENCAPSULACIÓN DE UN BACULOVIRUS ENTOMOPATÓGENO MEDIANTE COACERVACIÓN CON EUDRAGIT S100®
DETERMINATION OF THE BASIC CONDITIONS FOR MICROENCAPSULATION OF AN ENTHOMOPATHOGENIC BACULOVIRUS BY MEANS OF COACERVATION USING EUDRAGIT S100®
Laura F. VILLAMIZAR R. 1; Fleming MARTÍNEZ R.2*
1 Laboratorio de Control Biológico, Centro de Biotecnología y Bioindustria, Corpoica, Tibaitatá, Cundinamarca
2 Grupo de Investigaciones Farmacéutico-Fisicoquímicas, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C., A.A. 14490.
RESUMEN
La microencapsulación por coacervación consiste en el recubrimiento de micropartículas con una película polimérica, la cual es obtenida por la precipitación del material polimérico disuelto en el medio dispersante. El presente trabajo pretende estudiar la coacervación con el copolímero del ácido metacrílico Eudragit S100® y su uso potencial para el desarrollo de microcápsulas de un baculovirus entomopatógeno del gusano cogollero del maíz, Spodoptera frugiperda. Se estudia la solubilidad del polímero en 16 solventes orgánicos y la compatibilidad de éstos con el principio activo (baculovirus). Teniendo en cuenta los solventes compatibles se seleccionan parejas de solventes-no-solventes con las que se evalúan cuatro relaciones de volumen, tres concentraciones de polímero y cuatro velocidades de adición de los no-solventes. Se seleccionan las parejas: etanol-heptano, etanol-hexano, acetona-heptano y acetona-hexano, como concentración de polímero 0,50 % p/v y como relación de volúmenes 1:3, por presentarse la aparente formación de una fase de coacervado. El sistema consistente en acetona-hexano a una velocidad de 1,0 mL/min, es seleccionado como el más promisorio por producir una separación lenta del polímero y el depósito uniforme de éste sobre el balón, comportamiento que podría permitir la microencapsulación del núcleo requerido.
Palabras clave: Eudragit S100®, coacervación, microencapsulación, baculovirus, Spodoptera frugiperda
ABSTRACT
Microencapsulation by coacervation consists in the coating of microparticles by depositing a polymeric film on them. This process is carried out by the precipitation of the polymer dissolved in the dispersing medium. The present work pretends to study the coacervation of a methacrylic acid copolymer (Eudragit S100®) and their potential use in the development of microcapsules containing an entomopathogen baculovirus of corn armyworm Spodoptera frugiperda. The polymer solubility in 16 solvents, as well as the compatibility of them with the baculovirus is studied. By considering the compatible solvents, several couples of Solvent-Non-Solvent are selected, with which four volume ratios, three polymer concentrations, and four Non-Solvent addition velocities are evaluate. The couples Ethanol-Heptane, Ethanol-Hexane, Acetone-Heptane, and Acetone-Hexane are chosen. The values 0.50 % w/v and 1:3 are chosen as polymer concentration and volumes ratio respectively, because they show the apparent formation of a coacervate phase. Finally, the system Acetone-Hexane with velocity 1.0 mL/min is chosen as the most promissory because this system produces a slow polymer separation and therefore, the formation of a uniform film inside the balloon. These behaviors could allow the nucleus microencapsulation.
Keywords: Eudragit S100®, Coacervation, Microencapsulation, Baculovirus, Spodoptera frugiperda
INTRODUCCION
La microencapsulación es un proceso de recubrimiento de sustancias sólidas, líquidas o gaseosas con diferentes materiales, con miras a obtener partículas sólidas de tamaño micrométrico. Los productos resultantes de este proceso tecnológico reciben el nombre de "micropartículas", "microcápsulas" o "microesferas", las cuales se diferencian en su forma y estructura interna; sin embargo, todas presentan como característica común el poseer un tamaño de partícula inferior a 1,0 mm (1).
La microencapsulación es ampliamente utilizada en el área farmacéutica y también en otros campos industriales, tales como el cosmético y el alimentario (2). De forma similar, esta tecnología ha incursionado en los últimos años en campos tan diversos como la agroquímica, para reducir la contaminación ambiental generada por los plaguicidas, ya que al encapsular los ingredientes activos de estos productos se puede controlar su liberación, aumentando así su eficacia y persistencia, y además, reduciendo las cantidades liberadas al ambiente (3). Para fines prácticos, los métodos de microencapsulación se clasifican en tres grupos, esto es, físicos, químicos y fisicoquímicos (4). Dentro de los métodos fisicoquímicos se destaca la coacervación, definida como la separación de un coloide muy solvatado en dos fases líquidas, una de las cuales contiene una alta proporción de coloide (capa de coacervado) y la otra, una baja proporción (1). De otro lado, si hay partículas sólidas insolubles, o gotas de líquido inmiscibles suspendidas en el medio, las gotas de coacervado formadas pueden ser adsorbidas en la superficie de las partículas dispersadas. Cuando el coacervado se deposita en la superficie, envuelve el núcleo con una película fluida y viscosa del polímero (microencapsulación). La película fluida es posteriormente endurecida y solidificada para formar una cápsula dura alrededor del núcleo (5).
Las estrategias para inducir la coacervación dependen principalmente de las características fisicoquímicas del polímero y del núcleo a recubrir. La coacervación puede ser inducida por la adición de un no-solvente; método en el cual, la separación de fases es inducida por la adición lenta de un "no-solvente" sobre una solución del polímero formador de cubierta, la cual contiene suspendido el material que va a encapsularse. Se entiende por "no-solvente" aquel disolvente que es miscible con el disolvente del polímero y en el cual el polímero es insoluble. A medida que se adiciona el no-solvente se provoca la insolubilización del polímero, el cual, a su vez, se va depositando alrededor de las partículas presentes en suspensión. Al final del proceso, se añade un volumen elevado del no-solvente con la finalidad de endurecer las microcápsulas (6).
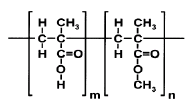
Los Eudragit® son un grupo de polímeros derivados del ácido metacrílico, que están disponibles en diferentes formas iónicas (6). La solubilidad del Eudragit S100® es pH-dependiente, siendo altamente soluble a valores de pH alcalino, debido a la neutralización de los grupos carboxilo (Figura 1) con la respectiva formación de la sal (7), y por lo tanto, exhibiendo el carácter de polielectrolito aniónico en solución.
Figura 1. Estructura molecular de las unidades de repetición del Eudragit S100® con m = 1 y n = 2.
Diferentes tipos de Eudragit® han sido ampliamente utilizados en la elaboración de micropartículas que permiten la liberación de principios activos a nivel intestinal, evitando la inactivación de fármacos en el estómago, por ejemplo, en la preparación de micropartículas que permiten la administración oral de péptidos y proteínas (5); éstas, en particular, han generado un gran interés para el desarrollo de sistemas de administración oral de insulina (8).
El presente trabajo pretendió determinar algunas condiciones útiles para el desarrollo de una técnica de microencapsulación de un baculovirus entomopatógeno del gusano cogollero del maíz Spodoptera frugiperda, mediante la coacervación con el copolímero del ácido metacrílico Eudragit S100®.
MATERIALES Y MÉTODOS
Materiales
En esta investigación se utilizaron Eudragit S100® de Röhm GmbH; dimetilsulfóxido R.A., butanol R.A. y tolueno R.A. (Sigma); etanol R.A., heptano R.A., etilenglicol R.A. (Merck); acetona R.A., xileno R.A., n-hexano R.A., cloruro de metileno R.A. y alcohol i-amílico R.A. (J.T. Baker); metanol R.A. (Mallinckrodt); cloroformo R.A. (Chemicol); benceno R.A. (RPE); n-propanol R.A. (Fisher); dietiléter R.A. (Proanalysis).
Determinación de la compatibilidad del virus con solventes orgánicos
Con miras a seleccionar solventes orgánicos que no afectaran la actividad del virus y que pudieran ser utilizados en el proceso de microencapsulación, se realizó un estudio de compatibilidad. Para tal fin, muestras de 0,010 g del virus purificado liofilizado fueron dispensadas en 16 tubos Eppendorf de 500 µL. En cada tubo se adicionaron 20 µL de cada solvente y se agitaron mediante inversión manual durante 30 minutos a una temperatura de a 20,0 ± 1,0 °C. Posteriormente, los tubos fueron centrifugados en una microcentrífuga Eppendorf Centrífuga 5415 a 14000 rpm durante 30 minutos. El sobrenadante se eliminó y el sedimento correspondiente a las partículas virales fue lavado dos veces con 500 µL de agua destilada estéril. El sedimento fue resuspendido en 50 µL de agua y a partir de dicha suspensión viral se preparó una suspensión ajustada a una concentración de 1 x 1010 cuerpos de inclusión por mL. Se colocaron 10 μL de cada suspensión viral en uno de los pozos de una microplaca de 96 pozos de fondo plano, adicionando a cada pozo 10 μL de una solución de sacarosa al 4,0 % y colorante azul de alimentos al 1,0 %.
El contenido de cada pozo se utilizó para evaluar la actividad viral mediante un bioensayo siguiendo la metodología descrita por Támez et al. (9). El tratamiento testigo positivo consistió en virus purificado no expuesto a ningún solvente y se contó con un testigo absoluto en el que las larvas no recibieron ningún tratamiento.
El diseño experimental se hizo completamente al azar. Los resultados de mortalidad al día 7 fueron corregidos con respecto al testigo, utilizando la fórmula de Schneider-Orelli (10), sometidos a un análisis de varianza (ANAVA) y a una prueba de comparación de medias de Tukey con una confiabilidad del 95 % (11).
Comportamiento del Eudragit S100® frente a diferentes solventes orgánicos
Se pesaron 0,050 g de polímero y se adicionaron en tres tubos de ensayo con 6,0 mL de cada uno de los 16 solventes. Los tubos de ensayo tapa-rosca con los diferentes tratamientos se taparon y se ubicaron en una gradilla sumergida en un baño termostatado Linderberg/blue SWB1122A (22,0 ± 1,0 °C). Pasados 10 minutos los tubos se agitaron mediante inversiones manuales y se observó el comportamiento de la dispersión, además se leyó la absorbancia de cada muestra en un espectrofotómetro Milton Roy Spectronic 601, a una longitud de onda de 650 nm (12). Los solventes que sólo produjeron el hinchamiento del polímero fueron clasificados como "no-solventes". Así mismo, se consideraron "no-solventes", aquellos con los que se obtuvo una absorbancia superior a 0,010, así como todos aquellos con los que se obtuvo una absorbancia inferior a 0,010, pero en los cuales se observaron sólidos en suspensión.
Determinación de la concentración del polímero y de la relación solvente-no-solvente
Se evaluaron las diferentes parejas de solvente-no-solvente determinadas previamente utilizando diferentes concentraciones del polímero y relaciones de solventes (13). Las concentraciones de polímero evaluadas fueron 0,25, 0,50 y 0,75 %, combinadas con las relaciones de solvente-no-solvente: 1:1, 1:2, 1:3 y 1:4 respectivamente, obteniéndose así un total de 12 tratamientos para cada pareja de solventes.
La dispersión del polímero en el solvente correspondiente a cada tratamiento se adicionó en un balón de fondo redondo con un agitador magnético de 1 cm de longitud. El balón se ubicó sobre una plancha magnética Velp Scientifica F20540162 con una velocidad de agitación de 200 rpm. El no-solvente fue adicionado por goteo a una velocidad de 3,0 mL/min utilizando una bomba peristáltica Watson Murlow 5058. Durante todo el tiempo de adición del no-solvente se registraron cualitativamente los cambios en el aspecto de la dispersión coloidal.
Determinación de la velocidad de adición del no-solvente
Se evaluaron cuatro velocidades de adición del no-solvente, esto es, 1,0 mL/min, 3,0 mL/min, 5,0 mL/min y 8,0 mL/min. Para tal fin se prepararon 10 mL de solución del polímero a la concentración escogida, en el solvente seleccionado, en un balón de fondo redondo con agitación magnética a 200 rpm. Se adicionó por goteo el no-solvente seleccionado, utilizando diferentes velocidades de adición según el tratamiento, hasta obtener la relación de solvente-no-solvente determinada previamente. Durante todo el tiempo de adición del no-solvente se registraron cualitativamente los cambios en el aspecto de la dispersión coloidal.
RESULTADOS Y DISCUSIÓN
Determinación de la compatibilidad del virus con solventes orgánicos
La exposición de las partículas virales a los 16 solventes orgánicos evaluados no afectó su actividad biocontroladora sobre larvas neonatas de
S. frugiperda. Con el virus expuesto a los solventes, así como con el virus no expuesto, se alcanzó el 100 % de mortalidad de las larvas a los 8 días post-inoculación, y la prueba de comparación de medias de Tukey (P > 0,05) no detectó diferencias significativas entre los porcentajes de eficacia presentados por dichos tratamientos.
Este resultado sugiere que el virus es compatible con los solventes evaluados y, por lo tanto, todos podrían ser utilizados en el desarrollo de una técnica de microencapsulación por coacervación. Dicha compatibilidad podría deberse a que los baculovirus son virus ocluidos que presentan viriones embebidos en una matriz cristalina proteica, del tipo "poliedro", que constituye el conocido cuerpo de inclusión (CI). Esta cubierta proteica no fue en ningún caso solubilizada por los compuestos orgánicos. Esto se evidenció porque las muestras no presentaron cambio en su coloración parda y turbia original (la cual se debe a las partículas virales en suspensión), lo que fue confirmado mediante observación en el microscopio de luz (400X). Para todos los tratamientos se observó que los cuerpos de inclusión se mantuvieron en suspensión después de los 30 minutos de exposición a cada solvente, sin evidenciarse cambios significativos en su tamaño y morfología. Dicha cubierta, posiblemente evitó el contacto directo de los viriones constituidos por la nucleocápside y el ADN con los solventes, protegiéndolos de cualquier efecto detrimental de éstos sobre las unidades infectivas. Así como lo reportaron Moraes et al (14) y Caballero et al (15), los CIs brindan protección a los viriones, debido a que son insolubles en agua, excepto bajo condiciones extremadamente alcalinas, y resistentes a la putrefacción y desintegración por agentes químicos, y también a tratamientos físicos como la congelación, la desecación o la liofilización, características que les confieren persistencia en el medio.
Los baculovirus son muy estables desde el punto de vista fisicoquímico debido a la presencia y composición del CI. Otros virus también han demostrado ser estables frente a compuestos orgánicos; éste es el caso de los rotavirus, los cuales son funcionales en un rango de pH entre 3 y 9 y las partículas virales son estables por meses a temperaturas cercanas a los 40 °C y aún a 200 °C en condiciones particulares. La partícula completa mantiene su integridad y su infectividad cuando es tratada con diferentes solventes orgánicos tales como éter, cloroformo o freón, lo que refleja la ausencia de lípidos en su estructura. Pero pierde su infectividad al ser tratada con desinfectantes tales como formalina, cloro, betapropiolactona y etanol al 95 %, quizás por la pérdida de la capa externa (16, 17). Por el contrario, virus como el de la rabia, que pertenece a la familia Rhabdoviridae, son rápidamente inactivados por el calor, los rayos ultravioleta, la desecación, los solventes orgánicos y la tripsina (18).
Comportamiento del Eudragit S100® frente a diferentes solventes orgánicos
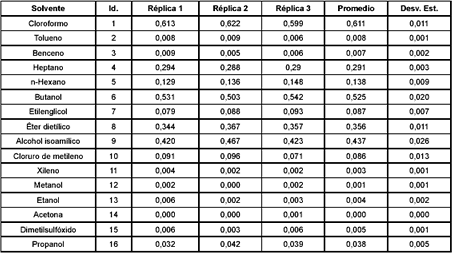
Cuando el polímero fue adicionado sobre los solventes etanol, metanol, n-propanol, acetona y dimetilsulfóxido, las partículas sólidas se depositaron en el fondo del tubo. Sin embargo, al realizarse la agitación del sistema, las partículas se redispersaron y desaparecieron rápidamente formando una solución blanca conocida como "lechada", que se tornó totalmente transparente (absorbancia < 0,01), por lo que se consideró que el polímero fue soluble en dichos solventes (Tabla 1).
Tabla 1. Valores de absorbancia del Eudragit S100® en diferentes disolventes orgánicos
La disolución de un polímero es un proceso lento que puede tener lugar si las fuerzas intermoleculares polímero-polímero son superadas por las fuerzas de interacción polímero-solvente (19). Se considera que la disolucion de un polímero puede llevarse a cabo por dos mecanismos, dependiendo de factores como el peso molecular del mismo, el solvente empleado y la temperatura, entre otros (20). El comportamiento observado con los solventes etanol, metanol, n-propanol, acetona y dimetilsulfóxido podría deberse a un mecanismo de disolución denominado de "rajado" o "agrietado" ("cracking mechanism", en inglés), en el cual no se produce el hinchamiento del polímero. Éste se agrieta rápidamente cuando las partículas entran en contacto con solventes molecularmente pequeños y muy buenos solventes para el polímero. Su alta velocidad de difusión y poder de hinchamiento causan un rápido aumento en la presión interna del polímero, de manera que éste se fractura antes de que la matriz pueda relajarse mediante el hinchamiento gradual (21). Dicho agrietamiento y rompimiento caótico de las partículas podría estar relacionado con el cambio en el color del sistema antes de alcanzarse el equilibrio o completa disolución.
Con benceno, tolueno y xileno, las partículas de polímero desaparecieron al entrar en contacto con los solventes y la absorbancia obtenida fue menor a 0,010. Sin embargo, sobre las paredes de los tubos se observó una capa de partículas sólidas transparentes, correspondientes al polímero con cierto grado de hinchamiento y no se produjo lechada, lo que indica que dichos solventes iniciaron la solvatación, pero posiblemente requieren más tiempo para disolver al Eudragit S100® y, por lo tanto, para alcanzar el equilibrio; por esta razón, éstos últimos se podrían considerar como "solventes pobres". El comportamiento observado con estos solventes se puede atribuir a un segundo mecanismo de disolución, en el cual el solvente posiblemente tiene que difundir dentro del polímero, produciendo el hinchamiento del mismo en la interfase, lo que se detectó como una capa con aspecto de gel, mecanismo que se desarrolla principalmente con solventes pobres (20). Con el transcurso del tiempo, posiblemente una cantidad mayor de solvente podría haber penetrado en el polímero aumentando la fase de hinchamiento hasta alcanzar la completa disolución, pero este efecto no fue detectado ya que la evaluación cualitativa y la medida de la absorbancia se realizaron únicamente a los 10 minutos después de montado el sistema.
Estas diferencias en los mecanismos de disolución de los polímeros están relacionadas con el tamaño de las moléculas de solvente, como lo sugirieron Papanau et al (22), quienes encontraron que la velocidad de disolución de un polímero del ácido metacrílico, disminuyó a medida que aumentó el tamaño molecular del solvente, posiblemente porque a mayor tamaño se tiene una menor velocidad de difusión del solvente dentro del polímero.
Con los solventes restantes (heptano, butanol, cloroformo, éter dietílico, alcohol i-amílico cloruro de metileno y hexano) el polímero se sedimentó en el fondo del tubo en forma de partículas redispersables mediante agitación pero sin presentar disolución y se obtuvieron absorbancias de 0,290; 0,520; 0,610; 0,350; 0,430; 0,090 y 0,140 respectivamente (Tabla 1), que indican que el polímero no fue soluble en estos compuestos.
Con base en los resultados, y teniendo en cuenta que para la inducción de la coacervación por el método de adición de un no-solvente se requiere que la pareja de solventes sean totalmente miscibles entre sí, se seleccionaron como parejas solvente-no-solvente: etanol-heptano, etanol-hexano, etanol-butanol, etanol-cloruro de metileno, acetona-heptano, acetona-hexano, acetona-butanol, acetona-cloruro de metileno, metanol-butanol y metanol-cloruro de metileno.
Determinación de la concentración del polímero y de la relación solvente-no-solvente
Con el propósito de seleccionar un sistema que permitiera la formación de una fase de coacervado con potencial para el recubrimiento de las partículas virales, se evaluó cualitativamente el comportamiento de la solución polimérica variando las parejas solvente-no-solvente, la relación de volumen entre los solventes, y el porcentaje de polímero.
Considerando que el resultado obtenido es de carácter cualitativo, se definieron las siguientes categorías para los posibles cambios en el sistema, algunos de los cuales presentaron respuestas combinadas: [SC] -Sin cambio: el sistema se mantuvo homogéneo y traslúcido, sin cambio de color ni aparición de sólidos; [L] -Lechoso: el sistema se tornó blanco lechoso y no se observan sólidos en suspensión; [P] -Precipitado: aparición de polímero precipitado, que se ubicó en una zona específica formando agregados, masas o hebras blancas de tamaño variable, y finalmente, [D] -Depósito: el polímero se depositó sobre las paredes del balón formando una película viscosa y traslúcida.
Independientemente del solvente evaluado, de la concentración de polímero o de la relación de solventes, no se observó ningún cambio en la apariencia del sistema cuando el no-solvente adicionado fue el cloruro de metileno (Tabla 2). La no inducción de la separación del polímero por la adición de este solvente podría sugerir que la acetona, el metanol y el etanol son tan buenos solventes para el Eudragit S100® que requerirían una mayor adición de cloruro de metileno para que el polímero se desolvate. Lo anterior también sugiere que el polímero podría presentar una mejor solubilidad en este solvente, la cual posiblemente no se evidenció en el ensayo de solubilidad en solventes orgánicos realizado en el presente trabajo, debido al corto tiempo de evaluación, o porque la solubilidad del polímero en este solvente es inferior a las concentraciones aparentes evaluadas en dicho ensayo. También se ha demostrado que la adición de una cantidad de no-solvente a un buen solvente, da como resultado un aumento significativo de la solubilidad de algunos polímeros y, por lo tanto, no conduce a su precipitación, debido a un efecto de plastificación, como lo reportaron Cooper et al (23) para el polimetil-metacrilato.
Tabla 2. Comportamiento del polímero utilizando diferentes parejas solvente-no-solvente y relaciones de volumen entre estos. [SC] Sin cambio, [L] Lechoso, [P] Precipitado, [D] Depósito.
El butanol sólo produjo, como respuesta, la formación de una capa translúcida y pegajosa en el fondo del balón, cuando se alcanzó la relación de solventes 1:4 con los solventes metanol y etanol, sin observarse previamente un cambio en la coloración del medio.
Respecto a las parejas etanol-heptano, etanol-hexano, acetona-heptano y acetona-hexano se encontró que antes de alcanzarse la relación de solvente-no-solvente 1:1, los sistemas presentaron un cambio en su coloración, observándose éstos totalmente homogéneos y de color blanco lechoso, lo que indicó el inicio de la desolvatación del Eudragit S100®.
Con la pareja etanol-hexano se observó la formación de agregados (precipitado) cuando el polímero se utilizó a la mayor concentración (0,75 %) y se alcanzó la relación de solventes 1:4. Este mismo comportamiento se presentó con la pareja de solventes etanol-heptano cuando la concentración de polímero fue 0,50 % y la relación de solventes 1:3, y cuando la concentración de polímero fue 0,75 % para las relaciones de solventes 1:2, 1:3 y 1:4.
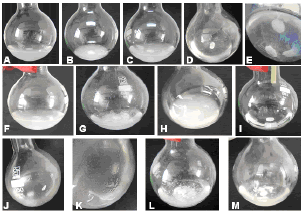
Se seleccionaron las parejas solvente-no-solvente: etanol-heptano, etanol-hexano, acetona-heptano y acetona-hexano, como concentración de polímero 0,50 % y como relación de volúmenes 1:3, por presentarse con estos tratamientos la aparente formación de una fase rica en polímero (que se distinguió por el color blanco), sin producirse precipitación, como se observó con el polímero al 0,75 % o con la relación de solventes 1:4 (Figura 2). Con estos tratamientos se procedió a evaluar diferentes velocidades de adición del no-solvente.
Figura 2. Comportamiento de los sistemas solvente-no-solvente. Polímero al 0,25 %: A. acetona-hexano, B. etanol-hexano, C. etanol-heptano, D. etanol-butanol, E. tolueno-heptano. Con polímero al 0,50 %: F. acetona-hexano, G. etanol-heptano, H. etanol-hexano, I. metanol-cloruro de metileno. Polímero al 0,75 %: J. acetona-heptano, K. acetona-hexano, L. etanol-hexano, M. etanol-heptano.
Determinación de la velocidad de adición del no-solvente
Para todos los tratamientos evaluados, a medida que la velocidad de adición del no-solvente aumentó, la separación del polímero fue más rápida, produciéndose una precipitación que dio origen a la formación de agregados densos de un tamaño cercano a 3 mm.
Cuando se utilizó la menor velocidad (1,0 mL/min) el sistema inicialmente se tornó lechoso para todos los tratamientos, lo que indica la formación de una fase rica en polímero, que se mantuvo en equilibrio hasta llegar a una relación solvente-no-solvente 1:2, momento en el que se observó para el sistema etanol-heptano, la aparición de hilos delgados de polímero, los cuales se precipitaron al fondo del balón y aumentaron a medida que se siguió adicionando el no-solvente, hasta alcanzar la relación 1:3 (Tabla 3).
Tabla 3. Respuesta observada al evaluar diferentes velocidades de adición del no-solvente. [SC] Sin cambio, [L] Lechoso, [P] Precipitado, [D] Depósito.
En el caso de los tratamientos con acetona, los sistemas se mantuvieron lechosos sin observarse precipitación hasta alcanzar la relación de volúmenes 1:3. Sin embargo, al desechar el contenido del balón para los dos no-solventes evaluados se observó que una cierta proporción del polímero se depositó sobre la superficie del balón formando una fina película translúcida. A partir de estos resultados se seleccionó el sistema acetona-hexano con la velocidad 1,0 mL/min como el más adecuado, por producir una separación lenta del polímero y, además, el depósito uniforme de éste sobre el balón, sin inducir la precipitación del mismo en forma de agregados.
Paralelamente al presente trabajo, en el Laboratorio de Control Biológico del Centro de Biotecnología y Bioindustrias de CORPOICA se está desarrollando un sistema de producción viral eficiente, que permita disponer del virus (principio activo) requerido para el desarrollo de los ensayos de microencapsulación con Eudragit S100®, utilizando los diferentes parámetros determinados en este estudio.
CONCLUSIONES
El presente trabajo permitió establecer algunas condiciones con potencial para desarrollar un sistema de microencapsulación de un nucleopoliedrovirus de S. frugiperda con el polímero pH dependiente Eudragit S100® mediante el método de coacervación. El sistema seleccionado fue el siguiente: concentración de polímero 0,50 %, la pareja de solventes acetona-hexano, la relación de solvente-no-solvente 1:3 y la velocidad de adición 1,0 mL/min.
REFERENCIAS BIBLIOGRÁFICAS
1. Florence A, Attwood D. Physicochemical principles of pharmacy. 3a ed. Bristol: MacMillan Press; 1998. pp. 357-358. [ Links ]
2. Chen K, Chen M, Lin C. Optimal combination of the encapsulating materials for probiotic microcapsules and its experimental verification. J Food Eng 2006; 76(3): 313-320. [ Links ]
3. Hirech K, Payan S, Carnelle G, Brujes L, Legrand J. Microencapsulation of an insecticide by interfacial polymerization. Powder Technol 2003; 130(1-3), 324-330. [ Links ]
4. Yáñez J, Salazar J, Chaires L, Jiménez J, Márquez M, Ramos E. Aplicaciones biotecnológicas de la microencapsulación. México: Alfa Editores Técnicos; 2006. pp. 10-16. [ Links ]
5. Dobetti L, Pantaleo V. Application of a hydrodynamic model to microencapsulation by coacervation. J Microencapsulation 2002; 19(2): 139-151. [ Links ]
6. Chiappetta D. 2006., Microencapsulación de medicamentos, Cátedra de Farmacotecnia I, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Argentina. Disponible en: http://www.ffyb.uba.ar/farmacotecnia%20I/Microencapsulacion.htm., acceso: noviembre 2006. [ Links ]
7. Horaczek A, Viernstein H. Beauveria brongniartii subjected to spray-drying in a composite carrier matrix system. J Microencapsulation 2004; 21(3): 317-330. [ Links ]
8. Thomasin C, Merkle H, Gender B. Drug microencapsulation by PLA/PLGA coacervation in the light of thermodynamics. 2. Parameters determining microspheres formation. J Pharm Sci 1998; 87(3): 269-275. [ Links ]
9. Tamez P, Zamudio V, Martínez J, Rodríguez C, Tamez R, Gómez R. Formulaciones granulares de baculovirus en combinación con abrillantadores ópticos para su empleo como bioinsecticidas. Ciencia UANL 2006; 9(2): 149-156. [ Links ]
10. Ciba-Geigy S.A. Manual de Ensayos de Campo. Basilea; 1973. [ Links ]
11. Zar J. Biostatistical Analysis. 4a ed. New Jersey: Prentice Hall; 1999. [ Links ]
12. Schmitt C, Sánchez C, Thomas F, Hardy J. Complex coacervation between β-lactoglobulin and acacia gum in aqueous medium. Food Hydrocolloids 1999; 13(6): 483-496. [ Links ]
13. Martín L, Vargas A, Barbosa H, Martínez F. Estudio de las variables más relevantes de un proceso de microencapsulación por coacervación utilizando un polímero derivado del ácido metacrílico. Rev Colomb Cienc Quím Farm 2002; 31(1): 19-28. [ Links ]
14. Moraes R, Maruniak J, Funderburk J. Methods for detection of Anticarsia gemmatalis nucleopolihedrovirus DNA in soil. Appl Environ Microbiol 1999, 65(6): 2307-2311. [ Links ]
15. Caballero P, López-Ferber M, Williams T. Los baculovirus y sus aplicaciones como bioinsecticidas en el control biológico de plagas. Universidad Pública de Navarra. Navarra: Phytoma; 2001. [ Links ]
16. Kurtz J, Lee T, Parsons A. The action of alcohols on rotavirus, astrovirus and enterovirus. J Hosp Infect 1980; 1(4): 321-325. [ Links ]
17. Vaughn JM, Chen Y, Thomas M. Inactivation of human and simian rotaviruses by chlorine. Appl Environ Microbiol 1986; 51(2): 391-394. [ Links ]
18. Montano J, Mata A. Estructura antigénica y mecanismos de infección del virus de la rabia. Ciencia Veterinaria 1996; 7: 67-106. [ Links ]
19. Raula J, Hannele E, Kauppienen E. Influence of the solvent composition on the aerosol synthesis of pharmaceutical polymer nanoparticles. Int J Pharm 2004; 284: 13-21. [ Links ]
20. Miller-Chou B, Koeing J. A review of polymer dissolution. Progr Polym Sci 2003; 28(8): 1223-1270. [ Links ]
21. Ouhano A, Carothers F. Dissolution dynamics of some polymers: solvent-polymer boundaries. Polym Eng Sci 1980; 20(2): 160-166. [ Links ]
22. Papanu J, Hess D, Bell A, Soane D. Dissolution of thin poly(methyl-methacrylate) in ketones, binary ketone/alcohol mixtures and hydroxyketones. J Electrochem Soc 1989; 136(10): 30077-30083. [ Links ]
23. Cooper W, Krasicky P, Rodríguez F. Dissolution rates of poly(methyl-methacrylate) films in mixed solvents. Appl Polym Sci 1986; 31(1): 65-73. [ Links ]
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la DIB de la Universidad Nacional de Colombia por el apoyo financiero, a Röhm GmbH y Almapal Colombia por la donación del polímero, y al Laboratorio de Control Biológico de Corpoica (Tibaitatá) por facilitar las instalaciones requeridas para el desarrollo de esta investigación.
Recibido: Noviembre 19 de 2007; Aceptado: Marzo 18 de 2008
* Autor a quien se debe dirigir la correspondencia: fmartinezr@unal.edu.co