Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
PRODUCTOS NATURALES
INHIBICIÓN DE LAS ACTIVIDADES PROTEOLÍTICA, COAGULANTE Y HEMOLÍTICA INDIRECTA INDUCIDAS POR EL VENENO DE Bothrops asper POR EXTRACTOS ETANÓLICOS DE TRES ESPECIES DE HELICONIAS.
INHIBITION OF PROTEOLITIC, COAGULANT AND INDIRECT HEMOLYTIC ACTIVITIES INDUCED BY Bothrops asper VENOM, BY ETHANOLIC EXTRACTS FROM THREE HELICONIAS SPECIES
Jaime A. PEREAÑEZ J. 1,2*; Silvia L. JIMÉNEZ.1,2; Juan C. QUINTANA.1,2; Vitelbina NUÑEZ.1,3; Maritza FERNANDEZ.2; Yessica RESTREPO.2
1. Programa Ofidismo/Escorpionismo. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
2. Facultad Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
3. Escuela de Microbiología. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
RESUMEN
En Colombia, Bothrops asper (mapaná) es la especie causante del 70 al 90% de los cerca de 3.000 accidentes ofídicos informados cada año. Durante varios siglos, la medicina tradicional ha utilizado plantas para el tratamiento de la mordedura de serpiente. En nuestro país, el 60% de las mordeduras son atendidas inicialmente por curanderos o chamanes, que usan al menos 100 especies de plantas medicinales en diferentes formas, de acuerdo al estado clínico del paciente. En este estudio se evaluó la capacidad inhibitoria de tres especies de la familia Heliconiaceae, H. latispatha Benth, Hemidesmus indicus Petersen y H. curtispatha Petersen, sobre los efectos proteolítico, coagulante y hemolítico indirecto inducido por el veneno de Bothrops asper. La primera indujo un mayor porcentaje de inhibición del efecto hemolítico indirecto del veneno de B. asper que la Heliconia wagneriana, así como una reducción en la intensidad en las proteínas del veneno con masa molecular de 14 KDa, mientras que el extracto de la segunda planta mostró una mayor inhibición del efecto proteolítico inducido por el veneno de B. asper, así como mayores cambios en las bandas de proteína del veneno con masas moleculares entre 95 y 110 KDa. El extracto de Heliconia curtispatha, mostró la mayor capacidad inhibitoria de los efectos hemolítico, proteolítico y coagulante; además indujo una degradación de todas las proteínas del veneno completo de B. asper, como había sido reportado previamente.
Palabras clave: veneno de serpiente, actividad proteolítica, actividad hemolítica, actividad coagulante, Bothrops asper, extractos de plantas, Heliconias.
ABSTRACT
In Colombia, Bothrops asper (mapaná) inflicts at least 70 to 90% of an approximated 3.000 snakebites reported each year. For many centuries, traditional medicine has used plants for treatment of snakebites. In Colombia, 60% of snakebite victims are initially attended by traditional healers or "chamanes", who use at least 100 medicinal plants species in different forms according to clinical conditions of patients. In this work, the ethanol extracts of three species of Heliconiaceae family, H. latispatha Benth, Hemidesmus indicus Petersen and H. curtispatha Petersen, were examined for their possible inhibitory ability against proteolytic, coagulant and indirect hemolytic effects induced by B. asper. The first of three induced more inhibition percentage of Indirect Hemolytic Activity than the Heliconia wagneriana, as well as induced reduction of venom proteins intensity with 14 KDa of molecular weight, belonging to phospholipases A2. The extract of H. latispatha showed major inhibition on the proteolytic effect induced by Bothrops asper venom, as well as greater change on the protein bands with molecular weights between 95 and 110 KDa, possibly belonging to proteases (metalloproteases). Heliconia curtispatha showed the greatest inhibitory ability against mentioned effects, including coagulant induced by Bothrops asper venom, and it did present degradation of all venom proteins , as well as it had been reported previously.
Keywords: snake venom, indirect hemolytic activity, proteolitic activity, coagulant activity, Bothrops asper, plant extracts, Heliconias
INTRODUCCIÓN
En América Latina, cerca del 90% de las mordeduras de serpientes son ocasionadas por el género Bothrops (Fan HW et al, 1995; Gutiérrez JM et al, 1995). Sus venenos inducen efectos locales y sistémicos tales como edema, hemorragia, dermonecrosis, mionecrosis, alteraciones de la coagulación, hipotensión, insuficiencia renal aguda, entre otros (Gutiérrez JM et al, 1995; Otero R et al, 2002; Otero R et al, 1992). En Colombia la especie Bothrops asper es la causante del 70 al 90% de los 3.000 accidentes reportados cada año (Otero R et al, 1992; Quintana JC, 2005; Silva, 1989).
Desde hace más de un siglo, el tratamiento específico para el accidente ofídico ha sido el suministro de antivenenos (Bon C. 1996); sin embargo, se ha demostrado que estos no resuelven todos los efectos inducidos por los venenos de víboras, ya que tienen limitada capacidad de neutralización de los efectos locales tales como hemorragia, edema y mionecrosis (Bon C. 1996; Gowda T 1997; Lomonte B et al., 1994), debido a su rápida instalación.
Durante varios siglos, la medicina tradicional ha utilizado plantas para el tratamiento de la mordedura de serpiente. Aunque se han reportado cerca de 700 plantas usadas a nivel mundial como antiofídicas, pocas han sido evaluadas en su efectividad en ensayos controlados (Houghton P et al, 1993; Otero R et al, 2000b; Otero R et al, 2000c; Núñez V et al, 2004a; Núñez V et al, 2005; Alam M et al, 1994; Alam M et al, 1995; Ode OJ et al, 2006). En Colombia, el 60% de las mordeduras son atendidas inicialmente por curanderos o chamanes, que usan al menos 100 especies de plantas medicinales en diferentes formas, de acuerdo al estado clínico del paciente (Otero R et al, 2000c; Otero R et al, 1992; Otero-Patino R et al, 1998). En trabajos recientes, el extracto de Heliconia curtispatha Petersen demostró actividad inhibitoria de los efectos letal, edematizante, desfibrinante, coagulante, mionecrosante, proteolítico y hemolítico indirecto frente a los venenos de Bothrops asper, Lachesis muta, Crotalus durissus cumanensis y Micrurus mipartitus (Otero R et al, 2000a; Otero R et al, 2000b; Núñez V et al, 2004a; Núñez V et al, 2004b). Este estudio pretendía demostrar si otras especies de Heliconias, como H. latispatha Benth y Hemidesmus indicus Petersen también poseen actividad frente al veneno de B. asper.
MATERIALES Y MÉTODOS
Venenos y Extractos
El veneno fue una mezcla homogénea, obtenida por ordeño manual de 40 especímenes adultos de B. asper procedentes de los departamentos de Antioquia y Chocó, mantenidos en cautiverio en el Serpentario de la Universidad de Antioquia. El veneno fue centrifugado, el sobrenadante liofilizado y congelado a -70º C hasta su uso.
H. curtispatha fue colectada en las comunidades rurales de la costa pácífica (Nuquí, Bahía Solano), su número de archivo en el Herbario de la Universidad de Antioquia es RF 6486 (Otero R et al, 2000c); H. latispatha y Hemidesmus indicus fueron colectadas en Barbosa (Antioquia, Colombia). El material vegetal (rizomas) se secó a 38ºC por dos días, una vez seco fue molido y percolado con etanol al 96% durante 48 horas. Los extractos se concentraron al vacío hasta sequedad, finalmente el residuo se liofilizó y congeló hasta su uso.
Inhibición de la actividad hemolítica indirecta
Se utilizó el método de agarosa - yema de huevo - eritrocitos, descrito por Gutiérrez et al. (Gutiérrez JM 1988). Se definió como dosis hemolítica indirecta mínima (DHmI) del veneno de B. asper, aquella que genera un halo de hemólisis de 20 mm de diámetro, después de 20 horas de incubación. Los ensayos de inhibición se llevaron a cabo incubando mezclas de cantidades variables de cada extracto con una DHIm del veneno a 37ºC por 30 minutos. La hemólisis se evaluó como se describió previamente. Los experimentos fueron realizados por triplicado.
Inhibición de la actividad proteolítica sobre la caseína
Se siguió la técnica descrita por Lomonte y Gutiérrez (Lomonte B et al, 1983). En resumen, a dos mililitros de caseína al 1 % en PBS, pH 7.2 se les adicionó un mililitro de solución que contenía cantidades variables de veneno de 0.02 a 2.0 mg/ml; la reacción fue detenida con la adición de ácido tricloroacético al 5 %, se dejó en reposo 30 minutos, finalmente los tubos fueron centrifugados a 3500 RPM por 10 minutos. La absorbancia del sobrenadante fue determinada a 280 nm en un espectrofotómetro contra un blanco de reactivos. La dosis proteolítica mínima (DPm) es aquella que causa un cambio de 0.5 en la absorbancia con respecto al control negativo, (DPm 1.5 mg para el veneno de B. asper). Las pruebas de inhibición se realizaron preincubando a 37 ºC mezclas de cantidades variables de cada extracto con una DPm durante 30 minutos. Finalmente, a estas mezclas se les determinó la actividad proteolítica de acuerdo al método descrito previamente. Los experimentos fueron realizados por triplicado.
Inhibición de la actividad coagulante
La actividad coagulante se determinó por el método descrito por Theakston y Reid (Theakston, RDG. et al, 1983). Las pruebas de inhibición se efectuaron preincubando a 37°C un microgramo de veneno de B. asper disuelto en 50 µl de PBS pH 7.2, con diferentes cantidades (0.25 -20µg) de cada uno de los extractos, durante 30 minutos. La mezcla fue adicionada a 300 µl de plasma y el tiempo para su coagulación fue registrado. Los experimentos fueron realizados por triplicado.
Electroforesis SDS-PAGE
La electroforesis se realizó sobre geles de poliacrilamida al 15% en condiciones no reducidas, como lo describe Laemmli (Laemmli, U K. 1970). Cuarenta µg de veneno se incubaron con 400 µg de cada extracto durante 30, 60 y 120 minutos a 37°C y se corrieron en una cámara Mini Protean-II® de BioRad durante 60 minutos a 150 voltios. Veneno solo fue incubado en los mismos tiempos y corrido en las mismas condiciones. Las proteínas fueron coloreadas empleando azul de Coomasie R 250.
Westernblotting
Las proteínas separadas en la electroforesis fueron transferidas a una membrana de nitrocelulosa a 200 mA. Las membranas fueron bloqueadas utilizando una solución de caseína al 1% y albúmina al 1% en PBS pH 7.2. Posteriormente, fueron incubadas durante 2 horas con el antiveneno polivalente (antilachésico, anticrotálico y antibothrópico), producido en el instituto Clodomiro Picado, San José de Costa Rica, lote: 3450403LQ, en una dilución 1/250. Después de lavar, se incubó durante una hora con una solución de IgG de conejo anti-IgG de caballo conjugada con peroxidasa en una dilución 1:2000. Las membranas se revelaron utilizando 2-cloronaftol como sustrato.
Análisis estadístico
Se realizó un ANOVA de una vía seguido por un test de Dunnet para comparar los controles positivos (veneno solo) realizados en cada prueba con los resultados obtenidos de la mezcla de cada extracto con el veneno. Todos los ensayos fueron realizados por triplicado y los resultados se expresaron como la media ± S.E.M (error estándar de la media). Se consideraron diferencias significativas cuando p<0.05.
RESULTADOS
Inhibición de la actividad coagulante
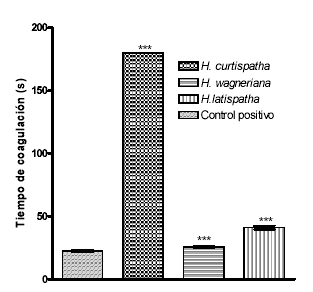
Un microgramo de veneno indujo coagulación del plasma en 20.9 ± 0.53 segundos. Cuando el veneno se preincubó con cada uno de los extractos en una relación veneno: extracto de 1:10, se observó un aumento en el tiempo de coagulación; siendo más activo el extracto de H. curtispatha (Véase figura 1). Así mismo, este extracto presentó una concentración inhibitoria 50 (IC50) muy baja, seguido por el de H. latispatha. El extracto de Hemidesmus indicus presento una IC50 superior a 20 µg (Véase tabla 1).
Figura 1. Inhibición del efecto coagulante inducido por el veneno de B. asper por extractos de H. latispatha, Hemidesmus indicus y H. curtispatha.
Tabla 1. Inhibición de los efectos coagulante, hemolítico indirecto y proteolítico inducidos por el veneno de B. asper por extractos de H. latispatha, Hemidesmus indicus y H. curtispatha.
Inhibición de la actividad hemolítica indirecta
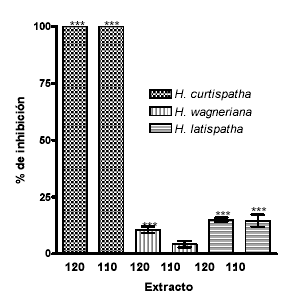
La dosis hemolítica mínima indirecta (DHIm) del veneno de B. asper fue de 2.2 μg. Cuando el veneno se preincubó con los extractos de H. latispatha y Hemidesmus indicus en una relación veneno: extracto de 1:10, mostraron una inhibición de este efecto del 14.6 ± 2.7% y 4.2 ± 1.4% respectivamente. Cuando la relación veneno:extracto fue de 1:20 los porcentajes de inhibición se incrementaron a 15 ± 0.9% y 10.6 ± 1.5% respectivamente. El extracto de H. curtispatha inhibió en un 100% el efecto hemolítico indirecto en las relaciones ya mencionadas. Estas diferencias fueron estadísticamente significativas en todos los casos, excepto cuando se comparó el control positivo con el extracto de Hemidesmus indicus en una relación 1:10 (Véanse figura 2 y tabla 1).
Figura 2. Inhibición del efecto hemolítico indirecto inducido por el veneno de B. asper por extractos de H. latispatha, Hemidesmus indicus y H. curtispatha.
La dosis hemolítica mínima indirecta (DHmI) fue de 2.2 µg, la cual es la dosis que induce un halo de hemólisis de 20 mm. Mezclas de cada extracto fueron incubadas con una DHmI en una relación 1:10 y 1:20. Los resultados se muestran como la media ± SEM de tres ensayos. *** p<0.05.
Inhibición de la actividad proteolítica
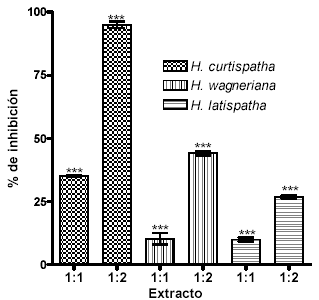
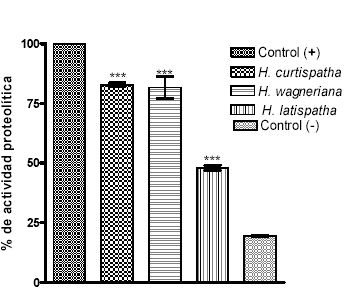
Los extractos de H. curtispatha, H. latispatha y Hemidesmus indicus inhibieron el efecto proteolítico inducido por el veneno en un 35.2 ± 0.4, 10.2 ± 2.2 y 9.9 ± 0.8% respectivamente, cuando se empleó una relación veneno: extracto de 1:1. Sin embargo, cuando la relación veneno: extracto se modificó a 1:2 se obtuvo una inhibición del 95 ± 1.3%, 44 ± 0.9 y 26.1 ± 0.65% respectivamente (Véase figura 3). El ANOVA indicó diferencia significativa en todos los casos (Véase tabla 1). Adicionalmente, se observó que H. curtispatha y Hemidesmus indicus por si solas (controles negativos), mostraron una actividad proteolítica alta cuando se compararon con el control positivo; para los tres extractos se determinó diferencia significativa con respecto a dicho control (Véase figura 4).
Figura 3. Inhibición del efecto proteolítico inducido por el veneno de B. asper por extractos de H. latispatha, Hemidesmus indicus y H. curtispatha
La dosis proteolítica mínima (DPm) del veneno fue de 1.5 mg. Mezclas de cada extracto con una DPm fueron incubadas en una relación 1:1 y 1:2. Los resultados se muestran como la media ± SEM de tres ensayos. *** p<0.05.
Figura 4. Actividad proteolítica del veneno de B. asper y H. latispatha, Hemidesmus indicus y H. curtispatha.
El control positivo fue una dosis proteolítica mínima (DPm) de veneno que equivale a 1.5 mg. Cada uno de los extractos fue utilizado en una cantidad de 3.0 mg. Los resultados se muestran como la media ± SEM de tres ensayos. *** p<0.05 con respecto a los controles positivo y negativo, respectivamente.
Electroforesis y western blotting
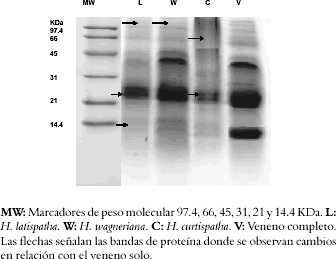
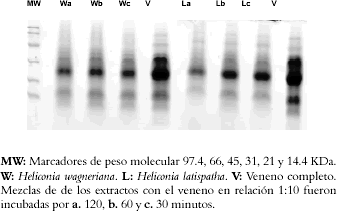
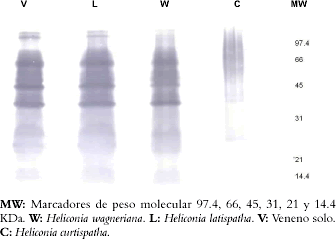
La electroforesis de proteínas en geles de poliacrilamida, mostró que el extracto de H. curtispatha induce una degradación de todas las bandas de proteína del veneno (Véase figura 5), mientras que el extracto de H. latispatha produjo solamente una disminución en la intensidad de algunas bandas de proteínas del veneno, especialmente las que tienen una masa molecular entre 95 y 110 KDa y las de 14 KDa. El extracto de Hemidesmus indicus solamente redujo la intensidad de las bandas con pesos moleculares de 95 y 110 KDa (Véase figura 5). Estos efectos fueron dependientes del tiempo de incubación, es decir a mayor tiempo, mayor disminución en la intensidad de las bandas (Véase figura 6). En el westerblott se observó que la mezcla del veneno con los extractos de H. latispatha y Hemidesmus indicus no disminuía el reconocimiento de las bandas de proteína por el antiveneno (Véase figura 6). Así mismo, aunque el extracto de H. curtispatha indujo una degradación de las proteínas del veneno, se evidenció que el antiveneno lograba reconocer algunos productos de esa degradación (Véase figura 7).
Figura 5. SDS-PAGE del veneno de B. asper después de 30 minutos de incubación con los extractos en una relación de 1:10.
Figura 6. SDS-PAGE del veneno de B. asper preincubado a diferentes tiempos con cada extracto.
Figura 7. Western Blotting del veneno de B. asper después de 30 minutos de incubación con los extractos en una relación de 1:10.
DISCUSIÓN
Varias investigaciones han reportado la presencia de actividad antiofídica en diversas plantas. El extracto de Eclipta prostrata y su componente wedelolactona, inhibió in vitro el efecto hemorrágico del veneno de Bothrops jararaca, Bothrops jararacussu y Lachesis muta (Melo P et al, 1999), así como el efecto letal y miotóxico de Crotalus durissus terrificus (Mors WB et al. 1989). Así mismo, los extractos de las raíces de Hemidesmus indicus, Pluchea indica, Vitex negundo, Emblica officinalis y Aristolochia indica, neutralizaron in vitro e in vivo el efecto hemorrágico inducido por el veneno de Vipera russellii, Echis carinatus, Naja naja, Ophiophagus hannah (Alam M et al, 1995). Un compuesto aislado de la raíz de Hemidesmus indicus, denominado HI-RVIF, al ser administrado vía intravenosa a ratones, demostró inhibición significativa de los efectos letal, hemorrágico y desfibrinante del veneno de Vipera russellii (Alam, M. et al, 1994). El mecanismo de inhibición de los efectos tóxicos de los venenos por extractos completos aún no es conocido, pero se sugiere que esta acción puede ser la suma de uno o varios efectos, mediados ya sea por uno o un grupo de compuestos del extracto (Gowda, T. 1997). Los extractos de Piper peltatum y P. umbellatum inhibieron la actividad enzimática de la miotoxina I del veneno de Bothrops atrox; uno de sus compuestos, el 4-nerodilcatecol, demostró una reducción en la actividad enzimática y de los efectos miotóxico y edematizante inducidos por esta toxina; de este compuesto se demostró que inducía modificaciones de tipo covalente en la molécula de miotoxina (Núñez et al, 2005).
El mecanismo de acción de los extractos de heliconias no es claro aún, pero los cambios observados en el patrón electroforético y en el westernblotting del veneno inducidos por el extracto de H. curtispatha sugieren una acción proteolítica inespecífica, la cual se hizo evidente en los ensayos de actividad sobre la caseína, en los cuales el extracto mostró alta capacidad de degradación de la proteína mencionada; no obstante esta proteólisis deja algunos fragmentos que contienen algunos epítopes que pueden ser reconocidos por el antiveneno. Es interesante anotar que el mecanismo de acción para los extractos de H latispatha y H wagneriana no parece ser el mismo, ya que sólo indujeron una leve disminución en la intensidad de algunas bandas de proteína.
El extracto de Hemidesmus indicus presentó un mayor porcentaje de inhibición sobre la actividad proteolítica inducida por el veneno de B. asper, que el de H. latispatha. Este efecto podría estar relacionado con los cambios inducidos por este extracto sobre las proteínas de alto peso molecular (95 y 110 KDa) del veneno, evidenciado en el patrón electroforético. Entre los componentes del veneno que tienen este rango de masa molecular están algunas proteasas, como las hemorraginas, que son metaloproteasas, cuyo peso molecular varía ente 20 y 100 KDa (Kamiguti A et al, 1996; Bjarnason J et al, 1994; Bjarnason J et al, 1988/89); algunas de estas enzimas ya han sido aisladas de la especie B. asper (Borkow G et al, 1993; Franceschi A et al, 2000; Gutiérrez JM et al, 1995b), y son las responsables de efectos tóxicos como hemorragia, edema, dermonecrosis, inhibición de la agregación plaquetaria, mionecrosis, entre otros (Gutiérrez JM et al, 2000) y gran parte de su mecanismo de acción está mediado por la proteólisis, la cual es dependiente de zinc; por ello sería importante evidenciar, en trabajos futuros, la presencia de sustancias quelantes en este extracto.
Otras enzimas presentes en el veneno de B. asper son las fosfolipasas A2, que hidrolizan fosfolípidos en la posición sn2 liberando ácidos grasos y lisofosfolípidos. Estas enzimas son responsables de efectos como neurotoxicidad, cardiotoxicidad, anticoagulación y mionecrosis, entre otros (Chang, C. 1985. Gowda, T. 1997). La actividad enzimática de estas proteínas puede ser evaluada por varios métodos, entre ellos el de hemólisis indirecta. El extracto de Heliconia latispatha mostró un mayor porcentaje de inhibición de la actividad hemolítica indirecta del veneno de B. asper, que el de Hemidesmus indicus; así mismo, este extracto indujo cambios, principalmente en las proteínas de 14 KDa, el cual corresponde a la masa molecular de las fosfolipasas A2.
El estudio demostró que aunque las tres plantas pertenecen a la familia Heliconeaceae, no presentan la misma capacidad inhibitoria de los efectos tóxicos inducidos por el veneno de B. asper; esto podría estar relacionado con diferentes mecanismos de inhibición. En conclusión, los extractos de H. latispatha y H. wageneriana presentan diferencias en su capacidad inhibitoria dependiendo del efecto sobre el cual se evalúe; esto quizás esté relacionado con su efecto sobre una u otra clase de toxina. En un trabajo realizado por Da Silva (Da Silva J et al, 2007) se evidenció un fenómeno similar, donde los compuestos denominados macrolobina A (Saponina triperpenoide) y macrolobina B (Triterpeno), obtenidas del extracto de Pentaclethra macroloba, inhibieron en mayor proporción el efecto hemorrágico que el efecto miotóxico. Trabajos futuros son necesarios para el aislamiento de las moléculas responsables de los efectos inhibitorios sobre el veneno, ya que el hallazgo de estas sustancias permite profundizar en los mecanismos de acción de las toxinas y posibilita el desarrollo de productos farmacéuticos que mejoren el pronóstico del accidente ofídico.
REFERENCIAS BIBLIOGRÁFICAS
1. Alam MI, Audi B, Gómez A. Isolation, purification and partial characterization of viper venom inhibiting factor from the root extract of the indian medicinal plant sarsaparilla (Hemidesmus indicus R. Br.). Toxicon 1994; 32: 1551-1557. [ Links ]
2. Alam MI, Gómez A. Indian medicinal plants active against Elapidae and Viperidae snake venoms. En: Abstracts First International Congress on Envenomations and their Treatments. París: Institut Pasteur; 1995. [ Links ]
3. Bjarnason JB, Fox JW. Hemorrhagic toxins from snake venoms. Journal of Toxicology-Toxins Reviews 1988/89 7; 121-209. [ Links ]
4. Bjarnason JB, Fox JW. Hemorrhagic metalloproteinases from snake venoms. Pharmac Ther 1994; 62: 325-372. [ Links ]
5. Bon C. The serum - therapie was discovered 100 years ago. Toxicon 1996; 34: 142-143. [ Links ]
6. Borkow G, Gutiérrez JM, Ovadía M. Isolation and characterization of synergistic hemorrhagins from the venom of the snake Bothrops asper. Toxicon 1993; 31: 1137-1150. [ Links ]
7. Chang CC. Neurotoxins with phospholipase A2 activity in snake venoms. Proc Natl Sci Counc Repub China B 198; 9: 126-42. [ Links ]
8. Da Silva JO, Fernándes RS, Ticlia FK, Oliveira CZ, Mazzia MV, Rancoa JJ, et al. Triterpenoid saponins, new metalloprotease snake venom inhibitors isolated from Pentaclethra macroloba. Toxicon 2007: 50: 283-291. [ Links ]
9. Fan HW, Cardoso JLC. Clinical toxicology of snakebite in South America. In: Meier J & White J (Editors), Handbook of Clinical Toxicology of Animal, Venoms and Poisons.Boca Ratón: CRC Press; 1995: 667-688. [ Links ]
10. Franceschi A, Rucavado A, Mora M, Gutiérrez JM. Purification characterization of BaH4, a hemorrhagic metalloproteinase from the venom of the snake Bothrops asper. Toxicon 2000; 38: 63-67. [ Links ]
11. Gowda TV. Interaction of snake venom phospholipases A2 with plant isolates. En: Kini RM, editor. Venom Phospholipase A2 Enzymes. Chichester: Willey; 1997: 205-221. [ Links ]
12. Gutiérrez JM, Ávila C, Rojas C, Cerdas L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon 1988; 26: 411-413. [ Links ]
13. Gutiérrez JM, Romero M, Díaz C, Borkow G, Ovadía M. Isolation and the characterization of metalloproteinase with weak hemorrhage activity from the venom of snake Bothrops asper (Terciopelo). Toxicon 1995; 33: 19-29. [ Links ]
14. Gutiérrez JM. Clinical toxicology of snakebite in Central America. In: Meier J & White J (Editors), Handbook of Clinical Toxicology of Animal, Venoms and Poisons. Boca Ratón, Fl: CRC Press; 1995: 645-665. [ Links ]
15. Gutiérrez JM, Rucavado A. Snake venom metalloproteinases: Their role in the patogénesis of local tissue damage. Biochemie 2000; 82: 841-850. [ Links ]
16. Houghton PJ, Osibogun LM. Flowering plants used against snakebite. J Ethnopharmacol 1993; 39: 1-29. [ Links ]
17. Kamiguti A, Hay C, Theakston RDG, Zuzel M. Insights into the mechanism of haemorrhage caused by snake venom metalloproteinases. Toxicon 1996; 34: 627-647. [ Links ]
18. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227: 680-685. [ Links ]
19. Lomonte B, Gutiérrez JM. La actividad proteolítica de los venenos de serpientes de Costa Rica sobre la caseína. Rev Biol Trop 1983; 31: 37-40. [ Links ]
20. Lomonte B, Lungren J, Johansson B, Bagge U. The dynamics of local tissue damage induced by Bothrops asper snake venom and myotoxin II on the mouse cremaster muscle: an intravital and electron microscopic study. Toxicon 1994; 32: 41-55. [ Links ]
21. Melo PA, Ownby CL. Ability of wedelolactone, heparin, and p-bromophenacyl bromide to antagonize the myotoxic effects of two crotaline venoms and their PLA2 myotoxins. Toxicon 1999; 37: 199-215. [ Links ]
22. Mors WB, Nascimento MC, Parente JP, DaSilva MH, Melo Pa, Suárez-Kurtz G. Neutralization of letal and myotoxic activities of South American rattlesnake venom by extracts and constituents of the plant Eclipta prostata (Asteraceae). Toxicon 1989; 27: 1003-1009. [ Links ]
23. Nuñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R. Neutralization of the edema-forming, defibrinating and coagulant effects of Bothrops asper venom by extracts of plants used by healers in Colombia. Braz J Med Biol Res 2004; 37: 969-977 [ Links ]
24. Núñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R. Inhibition of the Toxic effects of Lachesis muta, Crotalus durissus cumanensis and Micrurus mipartitus Snake Venoms by Plant Extracts. Pharma Biol 2004; 42: 49-54. [ Links ]
25. Núñez V, Castro V, Murillo R, Ponce-Soto LA, Merforf I. Inhibitory effects of Piper umbellatum and Piper peltatum extracts towards myotoxic phospholipases A2 from Bothrops snake venoms: isolation of 4-nerolidylcatechol as active principle. Phytochemistry 2005; 66: 1017-1025. [ Links ]
26. Ode OJ, Asuzu IU. The anti-snake venom activities of the methanolic extract of the bulb of Crinum jagus (Amaryllidaceae). Toxicon 2006; 48: 331-342. [ Links ]
27. Otero R, Tobón GS, Gómez LF, Osorio RG, Valderrama R, Hoyos D, et al. Accidente ofídico en Antioquia y Chocó. Aspectos clínicos y epidemiológicos (marzo de 1989-febrero de 1990). Acta Médica Colombiana 1992; 17: 229-249. [ Links ]
28. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: neutralization of the haemorrhagic effect of Bothrops atrox venom. J. Ethnopharmacol 2000; 73: 233-241. [ Links ]
29. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia: Part II: neutralization of lethal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacol 2000; 71, 505-511. [ Links ]
30. Otero R, Núñez V, Jiménez SL, Fonnegra R, Osorio RG, García ME, et al. Snakebites and ethnobotany in the northwest region of Colombia: Part I: traditional use of plants. J. Ethnopharmacol 2000; 71: 493-504. [ Links ]
31. Otero-PatiñoR, Cardoso JL, Higashi HG, Núñez V, Díaz A, Toro MF, et al. A randomized, blinded, comparative trial of one pepsin-digested and two whole IgG antivenoms for Bothrops snake bites in Urabá, Colombia. The Regional Group on Antivenom Therapy Research (REGATHER). Am J Trop Med Hyg 1998; 58: 183-189. [ Links ]
32. Otero R, Gutiérrez JM, Mesa MB, Duque E, Rodríguez O, Arango L, et al. Complications of Bothrops, Porthidium, and Bothriechis snakebites in Colombia. A clinical and epidemiological study of 39 cases attended in a university hospital. Toxicon 2002; 40: 1107-1114. [ Links ]
33. Quintana JC. Accidente ofídico. En: I.D. Vélez, E. Rodríguez, R. Duarte, editores. Enfermedades Tropicales. Guía de Manejo de ETV y Accidente Ofídico. Medellín: Litografía Solingraf; 2005: 131-147. [ Links ]
34. Silva J. Las serpientes del género Bothrops en la Amazonia Colombiana. Aspectos biomédicos (Epidemiología, clínica y biología del ofidismo). Acta Médica Colombiana 1989; 14: 148 - 165. [ Links ]
35. Theakston RDG, Reid HA. Development of simple standard assay procedures for the characterization of snake venoms. Bulletin of the World Health Organization 1983; 61: 949-956. [ Links ]
AGRADECIMIENTOS
Agradecemos a la doctora y experta en heliconias Aura Urrea por colectar e identificar H. latispatha y Hemidesmus indicus, y a la Universidad de Antioquia por el soporte financiero que nos brindó.
Recibido: Enero 19 de 2008;Aceptado: Marzo 25 de 2008