Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.1 Medellín Jan./June 2008
PRODUCTOS NATURALES
ACTIVIDAD ANTIOXIDANTE DEL ISOESPINTANOL EN DIFERENTES MEDIOS
ANTIOXIDANT ACTIVITY OF THE ISOESPINTANOL IN DIFFERENT MEDIA
Benjamín A. ROJANO.1*; Carlos A. GAVIRIA.1; Maritza A. GIL.1; Jairo A. SAEZ.2; Guillermo SCHINELLA.3; Horacio TOURNIER.3
1 Laboratorio de Ciencia de Alimentos. Facultad de Ciencias. Universidad Nacional de Colombia, Sede Medellín. A.A 3840, Medellín, Colombia.
2 Grupo de química de Plantas Colombianas. Instituto de Química, Universidad de Antioquia, A.A 1226, Medellín, Colombia.
3 Universidad Nacional de La Plata, Cátedra de Farmacología, Facultad de Ciencias Médicas, La Plata, Argentina.
RESUMEN
Se midió la actividad antioxidante del isoespintanol (2-Isopropil-3,6-dimetoxi-5-metilfenol), aislado de las hojas de Oxandra cf xylopioides, en diferentes modelos. Los resultados indican que el isoespintanol es un mejor reductor que el BHT en el ensayo FRAP. En los sistemas emulsificados decoloración de β-caroteno y peroxidación lipídica inducida por Fe/ascorbato y en el ensayo cinético de DPPH, el isoespintanol y el BHT tienen comportamientos antioxidantes similares. El BHT es un mejor atrapador de los radicales libres DPPH y ABTS. Isoespintanol y BHT no atrapan el radical superóxido y no inhiben significativamente la xantina oxidasa.
Palabras clave: Oxandra cf xylopioides, isoespintanol, actividad antioxidante, radicales libres, peroxidación, BHT.
ABSTRACT
Isoespintanol (2-Isopropil-3,6-dimetoxi-5-metilfenol) was isolated from Oxandra cf xylopioides and studied using different experimental models designed to assess antioxidant properties. The results indicated that isoespintanol is better reducing than BHT in the FRAP assay. In emulsified system, discoloration of β-carotene and lipid peroxidation induced by Fe / ascorbate in the kinetic assay DPPH has similar antioxidant behaviors. BHT is better free radicals DPPH and ABTS scavenger than isoespintanol, but both of then did not scavenge superoxide anion and inhibit significantly xanthine oxidase.
Keywords: Oxandra cf xylopioides, isoespintanol, free radical, antioxidant activity, peroxidation, BHT.
INTRODUCCIÓN
En los seres vivos aerobios se generan continuamente radicales libres y especies reactivas de oxígeno tales como anión superóxido, radical hidroxilo y oxígeno singlete, derivados de procesos fisiológicos normales, como la fosforilación oxidativa y como resultado de la exposición diaria a la radiación ionizante, la contaminación atmosférica, el humo del cigarrillo, entre otros [1].
Los radicales libres son especies muy reactivas que pueden dañar biomoléculas como carbohidratos, proteínas, lípidos, y ADN y, por consiguiente, afectar la membrana plasmática y organelas como la mitocondria y el núcleo celular [2]. La célula se protege de los radicales libres mediante la acción de sistemas enzimáticos antioxidantes como la superóxido dismutasa (SOD), la lactoferrina, la catalasa y la glutatión peroxidasa, y de sistemas no enzimáticos donde se incluyen antioxidantes como las vitaminas E y C, flavonoides y carotenoides provenientes de la dieta [3,4]. Sin embargo, cuando los radicales libres producidos en el organismo sobrepasan la capacidad de la célula para protegerse o repararse por sí misma, conducen al estrés oxidativo, el cual está asociado a enfermedades degenerativas o crónicas como el cáncer, la arterioesclerosis, la artritis reumatoidea, el mal de Parkinson, diabetes mellitus, envejecimiento y la infertilidad masculina [5,6].
La acción oxidativa causada por los radicales libres puede ser neutralizada mediante el uso de antioxidantes naturales o sintetizados químicamente. Algunos antioxidantes como la quercetina, el α-tocoferol, el β-caroteno y el ácido ascórbico han demostrado efecto protector contra una variedad de enfermedades como cáncer de esófago, úlcera estomacal y duodenal, infertilidad masculina y daño oxidativo inducido por endotoxinas. [7, 8, 9].
El butilhidroxianisol (BHA), y el butil hidroxitolueno (BHT) son los antioxidantes sintéticos de mayor uso en la industria de alimentos y farmacéutica; sin embargo, se han encontrado efectos secundarios en humanos, como el aumento del colesterol, hepatomegalia e inducción de cáncer hepático, entre otras. Debido a estos efectos y a la creciente importancia de los antioxidantes en la industria farmacéutica y alimenticia es necesaria la búsqueda de moléculas alternativas de origen natural con gran actividad y que no tengan efectos citotóxicos ni genotóxicos [10, 11,12].
En el año 2004, en Orlando FL, USA, se realizó el primer congreso internacional sobre Metodologías Antioxidantes, para asegurar la calidad de alimentos, extractos de plantas, nutraceuticos y otros suplementos dietarios. En esta reunión se propuso la necesidad de realizar varias técnicas para asegurar la capacidad antioxidante (AOC), debido a que un buen antioxidante, para su correcta evaluación, debe cumplir con muchos requisitos como: una alta solubilidad en el medio, una correcta orientación para interactuar con los radicales libres, orientarse adecuadamente en un sistema emulsificado (alimento), proteger los lípidos oxidables, ser un buen reductor y funcionar con alta reactividad, efectividad a diferentes pH y, en general, debido a los diversos mecanismos del antioxidante en el sitio de acción [13].
El isoespintanol (2-Isopropil-3,6-dimetoxi-5-metilfenol) es un monofenol extraído del extracto etéreo de las hojas de Oxandra cf xylopioides (Annonaceae). Se encontró que este compuesto, a las 3 horas, redujo en un 43 % la inflamación inducida por carragenina, en las patas de ratones. Además, redujo la producción de 1L-1β (interleuquinas) en un 72 % e inhibió significativamente la síntesis de mRNA de IL-1 β [14]. De otro lado, el isoespintanol, teórica y experimentalmente, se comportó como mejor captador de radicales y mejor reductor que el timol (análogo biosintético) [15].
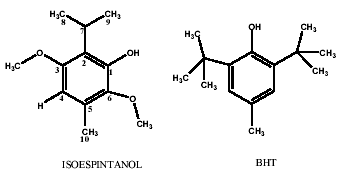
Debido al porcentaje tan alto encontrado para un producto natural como el isoespintanol (1.5%) y sus características estructurales adecuadas como un antioxidante promisorio para usar en diferentes medios, en este trabajo se estudiaron comparativamente el isoespintanol y el BHT por diferentes técnicas (Véase figura 1). Además, se reporta la elucidación estructural del isoespintanol para eliminar ambigüedades con algunos reportes previos [16].
Figura 1. Compuestos antioxidantes estudiados
MÉTODOS Y MATERIALES
Reactivos. El radical libre DPPH (1,1-difenil-2-picrilhidracil), catequina y BHT fueron obtenidos de Aldrich Chem. Co (Millw WI); metanol, dimetil sulfoxido (DMSO), Tween 20, fosfato ácido de sodio, piridina, MeOH, ácido acético, ácido sulfúrico, tricloruro de hierro, tetra metil silano (TMS) y placas cromatográficas fueron obtenidos de Merck (Darmstadt Germany); NADH (nicotin amida adenina dinucleotido reducido), metasulfato de fenacina, xantina oxidasa, xantina, azul de nitro tetrazolio (NBT), 2,4,6-tri (2-piridil) triazina fueron comprados a Aldrich Chem. Co (Millw WI), butilhidroxitolueno (BH T). 2,2-Azinobis-(3-etilbenzotiazolin-6-sulfonico) (ABTS), ácido tiobarbiturico (TBA) y cloroformo deuterado (CDCl3) fueron obtenidos de Sigma Chemical Co. (St.Louis, MO). El agua usada en los experimentos es grado HPLC. Los compuestos estudiados son: El isoespintanol (2-isopropil-3,6-dimetoxi-5-metilfenol) y BHT (2-tert-butil-5-metilfenol) (figura 1).
Equipos. Los puntos de fusión fueron medidos sin corrección en un aparato Büchi. Para el análisis por cromatografía en capa delgada (TLC) se usaron placas (Merck 60 F254 0.2 mm); en cromatografía de columna se usó sílica gel 60 (Merck 0.063-0.200 mesh). Las gotas en TLC fueron reveladas con una mezcla de ácido sulfúrico en ácido acético (10:90) y calentada a 100-105 °C. Los espectros IR fueron medidos en un espectrofotómetro PERKIN ELMER con un sistema RX I FT-IR, usando discos de KBr. Los espectros ultra violeta visible (UV-Vis) fueron obtenidos disolviendo la muestra en metanol (MeOH) y leyendo en un espectrofotómetro JENWAY 6405. Los espectros de 1H NMR (400 MHz) y 13C NMR (100 MHz) se realizaron todos en CDCl3, y fueron grabados en un equipo Bruker AMX 400, usando tetra metil silano (TMS) como estándar interno. Los espectros de masas (EI-MS) fueron obtenidos en un espectrómetro de masas Nermag-Sidar R10-10C.
Isoespintanol: Del extracto etéreo de Oxandra cf xylopioides se separó el isoespintanol como un sólido cristalino con punto de fusión 69-70 °C; UV (MeOH): λmax 227, 273 nm; IR: νmax cm-1 3372, 1228. 1H NMR (CDCl3, 400 MHz): δ (ppm): 1.31 (d, 6H, J=7.0 Hz, (CH3)2-CH-C2); 2.27 (s, 3H, CH3-Ar); 3.49 (sept, J=7.0 Hz, 1H, (CH3) 2-CH-C2); 3.75 s, 3H, (OCH3) -C3); 3.76 s, 3H, (OCH3) -C6); 5.85 (s, 1H, OH-C4); 6.44 (s, 1H, H-C4). 13C NMR (CDCl3, 100 MHz) y HMQC: δ (ppm) 16.2 (C10); 21.1 (C8 y C9); 25.1 (C7); 56.2 (C3-O−CH3); 61.2 (C6-O−CH3); 104.9 (C4), 120.9 (C2), 127.3 (C5), 140.0 (C6), 147.4 (C1) y 154.8 (C3). Correlaciones HMBC: CH3-C5, C5, C6, C4; (CH3)2-CH-C2, C1, C2, C3, C8, C9; (CH3)2-CH-C2, C8, C9, C7, C2; 3.75 (s, 3H, (OCH3)-C3, C2: 3.76 (s, 3H, (OCH3)-C6, OH-C2, C6, H-C7, C6, C3. Correlaciones NOESY: O-CH3-C6, OH-C1; H-C4, O-CH3-C3, CH3-C5. EI-MS: m/z 210, 195 (M+), 180, 163.
Acetilación del isoespintanol: El isoespintanol (100 mg), fue tratado con 2.0 mL de anhídrido acético-piridina (1:1) a temperatura durante 24 horas [17]. La mezcla fue diluida con H2O destilada y extraída tres veces con CH2Cl2. El extracto de CH2Cl2 fue concentrado bajo presión reducida y el compuesto acetilado purificado sobre sílica gel eluyendo con éter de petróleo-CH2Cl2 (8:2) y obtener (95 mg), de un sólido cristalino blanco con pf 49-50 °C; UV (c 1.0 MeOH): λmax 230, 285 nm; IR: νmax cm-1 1250, 1670 (C=O). 1H NMR (CDCl3, 400 MHz): δ (ppm) 1.30 (d, J=7.0 Hz, 6H, (CH3) 2-CH-C2); 2.30 (s, 3H, CH3-C5); 2.37 (s, 3H, CH3-C=O); 3.26 (sept, J=7.0 Hz, 1H, (CH3) 2-CH-C2); 3.80 (s, 3H, (OCH3) -C3); 3.72 (s, 3H, (OCH3) -C6); 6.59 (s, 1H, H−C4. 13C NMR (CDCl3, 100 MHz) y HMQC: δ (ppm) 15.7 (C10); 20.4 (CH3C=O); 20.6 (C8, C9); 25.5 (C7); 55.5 (C3-O−CH3); 60.3 (C6-O−CH3); 110.7 (C4); 142.5 (C1); 126.8 (C2); 128.8 (C5); 143.6 (C6) y 153.9 (C3) y 168.9 (C=O). Correlaciones HMBC: CH3-C5, C4, C5, C6, C10; (CH3) 2-CH-C2, C1, C2, C3, C8, C9; (CH3)2-CH-C2, C8, C9; 3.72 (OCH3)-C6, C6; 3.80 (OCH3)-C3, C3, CH3-C=O; H-C4, C2, C6 y C10. Correlaciones NOESY: CH3-C=O con H-C4 y 3.80 (OCH3) -C3); CH3-C5 con 3.80 ((OCH3)-C3); (CH3)2-CH-C2 con 3.80 ((OCH3) -C3) y 3.72 ((OCH3) -C6). EI-MS: m/z 252, 210 M+, 195, 180.
Análisis estadísticos. Las regresiones fueron calculadas con un nivel de significancia del 95% (p<0.05), usando el programa Statgraphics Plus versión 5.0 (Statistical Graphics Corp., Rockville, MD). Todos los experimentos antioxidantes se realizaron por triplicado en un espectrofotómetro UV-Vis Beckman DU-640 (Beckman Instruments Inc).
Medición de la actividad antioxidante
Ensayo de decoloración con el radical catiónico ABTS +. Este ensayo se fundamenta en la cuantificación de la decoloración del radical
+. Este ensayo se fundamenta en la cuantificación de la decoloración del radical
ABTS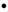 +, debido a la interacción con especies donantes de hidrógeno o de electrones. El radical catiónico ABTS
+, debido a la interacción con especies donantes de hidrógeno o de electrones. El radical catiónico ABTS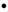 + es un cromóforo que absorbe a una longitud de onda de 415 ó 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis-(3-etil benzotiazolin -6- sulfonato de amonio) con persulfato de potasio. Las mediciones se realizan a una longitud de onda de 734 nm [18].
+ es un cromóforo que absorbe a una longitud de onda de 415 ó 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis-(3-etil benzotiazolin -6- sulfonato de amonio) con persulfato de potasio. Las mediciones se realizan a una longitud de onda de 734 nm [18].
En la evaluación se utilizaron 100 μL de extracto y 900 μL de la solución del radical ABTS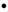 +. A los 60 minutos de reacción a temperatura ambiente y en la oscuridad, se leyó el cambio en la absorbancia respecto a la referencia del reactivo, a una longitud de onda de 734 nm. La referencia del reactivo consistió en una solución del radical ABTS
+. A los 60 minutos de reacción a temperatura ambiente y en la oscuridad, se leyó el cambio en la absorbancia respecto a la referencia del reactivo, a una longitud de onda de 734 nm. La referencia del reactivo consistió en una solución del radical ABTS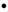 +con el solvente de la muestra. Para los dos compuestos se determinó la concentración inhibitoria del 50% (IC50) [18].
+con el solvente de la muestra. Para los dos compuestos se determinó la concentración inhibitoria del 50% (IC50) [18].
Peroxidación lipídica inducida por Fe/ascorbato. Los homogenatos de hígado de rata fueron preparados a partir de machos wistars que pesaron entre 200-250 g. Los animales fueron mantenidos a temperatura ambiente, con luz y alimento controlado. El homogenato de hígado se preparó por técnicas de centrifugación estándar, como lo describen Slater y Sawyer [19]. Las ratas fueron sacrificadas con éter etílico como anestésico y el hígado extraído lavado con hielo salino, removido y pesado. El hígado porcionado fue diluido con 4 volúmenes de buffer 0.1M en fosfato potásico (pH = 7.4), que contiene KCl al 1.15 w/v. El homogenato fue centrifugado a 2500 rpm por 10 min. La suspensión fue almacenada y mantenida a 70 °C durante dos meses. El contenido de proteínas fue cuantificado por el método de Lowry, usando albúmina de suero de bovino (BSA) como patrón [19].
La peroxidación lipídica fue medida según el protocolo de Halliwell [20]. Se mezclaron homogenato con Tris-HCl 0.1M. La peroxidación fue inducida con FeSO4 y ascorbato de sodio. Las muestras por triplicado fueron incubadas a 37 °C por 20 min. Los productos de peroxidación lipídica fueron detectados con ácido tiobarbitúrico (TBA) y la absorbancia medida a 532 nm [21]. La incubación se hizo con las respectivas concentraciones de las muestras disueltas en DMSO y sus controles.
Actividad para atrapar el radical superóxido. La medida de la actividad atrapadora del radical superóxido, fue realizada según el método descrito por Yamagushi et al [22], con algunas modificaciones. Se mezclaron 0.25 mL de una solución de azul de nitro tetrazolio (NBT) con 0.25 mL de una solución de NADH (468 μM) y 0.25 mL de muestra disuelta en metanol a diferentes concentraciones. A la mezcla anterior, se adiciona 0.25 mL de metasulfato de fenazina (60 μM), para iniciar la reacción. La catequina se usó como referencia. La reacción fue incubada a 25 ºC y fue medida a 560 nm, con un control cinético a los 5 minutos. La cinética de esta reacción es una doble recíproca, donde la pendiente de la curva/pendiente del control es el efecto total de cada concentración. El porcentaje de inhibición es calculado por la siguiente expresión:

Donde ms es la pendiente de cada concentración y mc es la pendiente del control. El IC50 fue calculado a partir de una regresión exponencial, donde la abcisa representa la concentración y la ordenada el porcentaje de inhibición.
Ensayo de la inhibición de xantina oxidasa. La xantina oxidasa (XO), es una enzima clave que cataliza la oxidación de hipoxantina o xantina hasta ácido úrico. Durante la reoxidación de la XO, el oxígeno molecular actúa como un aceptor de electrones produciendo radical superoxido y peróxido de hidrógeno. La XO es de alta importancia biológica como generador de radicales peróxidos; luego la inhibición de XO es un medio terapéutico para prevenir la artritis y la gota. La actividad para inhibir el sistema xantina oxidasa/xantina fue medida de acuerdo al método de Noro et al [23]. La mezcla de reacción fue 0.1 mL de isoespintanol a diferentes concentraciones, 0.3 mL de buffer fosfato de pH = 7.5 y 0.1 mL de xantina oxidasa en buffer fosfato de pH = 7.5. La mezcla se incuba a 25°C por 15 min, y la reacción se inicia con la adición de 0.3 mL HCl 1N; se mide la absorbancia a 290 nm. Una unidad de enzima se define como la cantidad de enzima que produce 1μM de ácido úrico por minuto a 25 °C. La actividad de la enzima se define como:
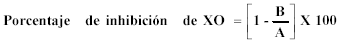
Donde A es la actividad de la enzima sin muestra y B es la actividad de la enzima con muestra.
Ensayo de decoloración de β-caroteno. Se utilizó la técnica empleada por Rosas y Rojano et al [24]; que está basada en la decoloración de β-caroteno en la presencia de metil-linoleato o ácido linoleíco como sustratos oxidables en una emulsión acuosa que usa tween 20 como agente emulsificante. La técnica es sencilla, rápida y se usa una mínima cantidad de reactivos y equipos de fácil acceso. La técnica se fundamenta en la decoloración del β-caroteno debido a su reacción con los radicales libres formados del proceso de oxidación del ácido linoleico o metil linoleato, usados como sustratos oxidables. En esta reacción los radicales destruyen la conjugación del beta caroteno, disminuyendo su capacidad de absorción a 455 nm [25]. En el ensayo se mezclan 1 mL de una solución de β-caroteno (0.2mg/mL de cloroformo), los cuales se adicionan a un balón volumétrico de 100 mL que contiene 15 μL de metil linoleato y 0.2 mL de Tween 20; la mezcla se lleva a sequedad. Al residuo resultante se le adicionan 100 mL de agua ultrapura previamente saturada con oxígeno.
Referencia control Rc: Contiene 1.9 mL de la emulsión de β-caroteno y 100 μL
Muestra referencia Rs: Contiene 1.9 mL de la emulsión de β-caroteno y 100 μL
Los tubos de reacción se incuban 1 hora a 50 ºC; y se miden los cambios de absorbancia de las soluciones a 465 nm. Todos los ensayos se efectuaron por triplicado. La actividad antioxidante se expresa como:

Rs es el cambio de absorbancia de la muestra. ∆Rc es el cambio de absorbancia de la referencia. Los valores de IC50 se calculan a partir de regresiones simples (dobles recíprocas); donde la abcisa es la concentración de las muestras (mg/L) y la ordenada es el porcentaje de inhibición (AA %).
Actividad atrapadora del radical libre 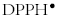 . El DPPH es un radical estable de color violeta, cuya absorbancia disminuye al ser reducido por un antioxidante (AH):
. El DPPH es un radical estable de color violeta, cuya absorbancia disminuye al ser reducido por un antioxidante (AH):
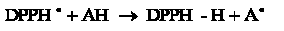
La capacidad antioxidante del BHT se cuantifica midiendo el grado de decoloración de una disolución metanólica de DPPH•(20 mg/L), a una longitud de onda de 515-517 nm [26]. El ensayo se llevó a cabo utilizando 100 µL de extracto y 900 µL de la solución de DPPH. Como referencia del reactivo se usó la misma cantidad de DPPH y 100 µL del solvente de la muestra. Luego de 30 minutos de reacción a temperatura ambiente y en la oscuridad, se leyó la absorbancia a una longitud de onda de 517 nm. El porcentaje de inhibición se calculó de la siguiente manera:
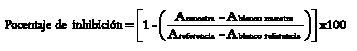
Con los porcentajes de inhibición y la concentración se calculó la concentración inhibitoria del 50% (IC50), expresada como μM del compuesto.
Ensayo Cinético del DPPH. La actividad atrapadora del radical 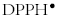 fue medida mezclando 5 mL de una solución metanólica de DPPH (20mg/L) con 1 mL de soluciones en DMSO de los compuestos y la referencia (BHT). Después de monitorear cada minuto durante 10 minutos de reacción, se midió concentración de
fue medida mezclando 5 mL de una solución metanólica de DPPH (20mg/L) con 1 mL de soluciones en DMSO de los compuestos y la referencia (BHT). Después de monitorear cada minuto durante 10 minutos de reacción, se midió concentración de 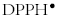 remanente para cada concentración de muestra, usando una curva de calibración Abs517nm versus concentración de
remanente para cada concentración de muestra, usando una curva de calibración Abs517nm versus concentración de 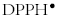 remanente (mol/L). El comportamiento cinético es una regresión exponencial donde la abcisa es la concentración remanente de
remanente (mol/L). El comportamiento cinético es una regresión exponencial donde la abcisa es la concentración remanente de 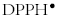 y la ordenada el tiempo en (s); la pendiente de la curva para cada concentración es la constante observada kobs. Los diferentes valores de kobs para cada concentración se correlacionan con la concentración del antioxidante para obtener una regresión lineal con la nueva pendiente kRSC, cuyo valor determina el comportamiento cinético para cada compuesto [22, 28, 29].
y la ordenada el tiempo en (s); la pendiente de la curva para cada concentración es la constante observada kobs. Los diferentes valores de kobs para cada concentración se correlacionan con la concentración del antioxidante para obtener una regresión lineal con la nueva pendiente kRSC, cuyo valor determina el comportamiento cinético para cada compuesto [22, 28, 29].
Ensayo FRAP (Ferric Reducing/Antioxidant Power). Este método evalúa la capacidad antioxidante de una muestra de acuerdo a su capacidad para reducir el Fe+3 presente en un complejo con la 2,4,6-tri(2-piridil)-s-triazina (TPTZ) hasta la forma ferrosa (Fe+2), que presenta un máximo de absorbancia a una longitud de onda entre 590-595 nm [30]. Este ensayo se llevó a cabo en un buffer ácido acético-acetato de sodio (pH 3.4), que contiene TPTZ y FeCl3. Se utilizan 900 μL de ésta solución, 50 μL de muestra y 50 μL de agua destilada. Luego de 60 minutos de reacción se determina la absorbancia a una longitud de onda de 593 nm. Para cada muestra se tuvo en cuenta la lectura de la absorbancia del blanco sin cromóforo, de la misma manera que en las pruebas anteriores. La curva de referencia se construyó usando ácido ascórbico como patrón primario. Las actividades de las muestras en estudio se expresaron como valor FRAP (g de ácido ascórbico por cada 100 g de antioxidante).
RESULTADOS Y DISCUSIÓN
Elucidación estructural del isoespintanol. El fraccionamiento cromatográfico del extracto de éter de petróleo permitió el aislamiento y purificación del isoespintanol. La fórmula molecular, C12H18O3, fue determinada por EI-MS y 13C NMR. El fragmento m/z 195, se formó a partir de la pérdida de un metil de la cadena lateral isopropílica. El fragmento m/z 180, es debido a la pérdida de un segundo grupo metilo de la cadena isopropílica El espectro IR (KBr) presentó absorciones a 3372, 1612, 1586 y 1492 cm-1, características para grupos metilos, hidroxilos, y aromáticos. Las absorciones máximas en el UV a 227 y 273 nm, es característica de compuestos aromáticos sustituidos [16]. La presencia de una función fenólica fue confirmada por el desplazamiento batocrómico en medio básico. El espectro 1H-NMR en CDCl3 presentó hidroxilos aromáticos a δ 5.85 ppm (1H, s), desplazamientos de protones aromáticos a δ 6.44 (1H, s); desplazamiento para dos grupos metoxi a δ 3.75 (3H, s), δ 3.76 (3H, s); señal para grupo metilo de un aromático δ 2.27 (3H, s) y señales alifáticas características para un grupo isopropílico a δ 3.49 (1H, hep), y δ 1.30-132 (3H, d). El espectro 1H-1H COSY mostró que solamente el singlete a δ 1.30-1.32 se acopló con el hepteto a δ 3.49, esto es característico para un grupo isopropílico. En el espectro HMBC la señal protónica a δ 2.27 mostró interrelaciones con las señales del carbón a δ 127.3 (C-5), y las señales a δ 140.0 (C-6) y δ 104.9 (C-4); el hepteto que aparece a δ 3.49, se acopló con el carbono a δ 147.4 (C-1) y las señales a δ 120.96 (C-2), δ 154.89 (C-3) y la señal a δ 21.16; la señal a δ 1.30-1.32 correlacionó con el carbono a δ 21.1 (C-8 C-9) y con las señales) a δ 25.1 (C-7) y δ 120.9 (C2); la señal a δ 3.76 mostró interrelaciones con el carbono a δ 154.89 (C-6); la señal a δ 3.75 se acopló con la señal a δ 140.0 (C-3); el singlete a δ 5.85 correlacionó con los carbonos a δ 120.9 (C-2), δ 140.0 (C-6) y δ 147.4 (C-1). Finalmente la señal a δ 6.44 acopló con los carbonos a δ 120.9 (C-2), δ 140.0 (C-6) y δ 154.8 (C-3).
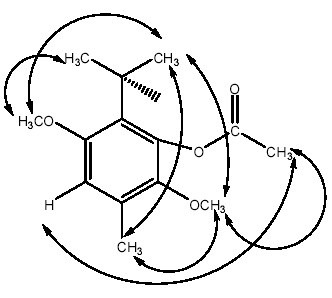
Los desplazamientos químicos de los grupos metoxilos en el espectro 1HRMN, están tan cercanos que la señal que aparece como un singlete entre δ 3.75-3.76 ppm no se puede discriminar fácilmente. Para confirmar la posición de los grupos metoxilos, el isoespintanol fue acetilado con piridina y anhídrido acético para producir el isoespintanol acetilado (2-isopropil-3,6-dimetoxi-5-metilfenil acetato [16]. En el espectro 1HNMR del isoespintanol las señales que aparecían a δ 3.76 [(OCH3) -C6] y δ 3.75 [(OCH3) -C3] cambiaron a δ 3.80 y δ 3.72 respectivamente. Las señales en 13CNMR, que estaban a δ 56.2 y δ 61.2, cambiaron respectivamente a 60.3 C-6 y 55.5 C-3. El espectro NOESY del compuesto acetilado mostró las siguientes correlaciones: El protón a δ 3.80 (O−CH3 C-6) correlacionó con el protón metílico a δ 6.59 (H C-4), con los protones metílicos a δ 2.30 (H C-10), δ 2.37 (-CO- CH3) y con el protón a δ 1.29 (H3C-C8); el protón a δ 2.30 (H3C-10) correlacionó con los protones metílicos a δ 1.29 (H3C-C8 y H3C-C7); el protón a δ 2.37 (CH3-CO) correlacionó con los protones a δ 6.59 (H C-4) y, finalmente, el protón a δ 3.72 (O−CH3 C-3), correlacionó con los protones a δ 1.29 (H3C-C7) y δ 1.31 (H3C-C9) (Véase figura 2). Con los espectros de 1HRMN, 13CNMR, junto al HMBC, HMQC y NOESY, del compuesto y su acetilado se elucidó inequívocamente el compuesto 2-isopropil-3,6-dimetoxi-5-metilfenol, denominado isoespintanol.
Figura 2. NOESY del isoespintanol acetilado.
Capacidad antioxidante del isoespintanol y BHT
Un antioxidante primario es un compuesto fenólico, fenilamina o cualquier sustancia que contiene al menos un grupo hidroxilo, tiol o amino unido a un anillo bencénico [31]. El papel de un antioxidante fenólico (ArOH) es interrumpir la segunda etapa de la cadena de propagación de oxidación de lípidos.
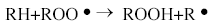
El antioxidante ArOH es capaz de reaccionar con ROO , cualquier radical R
, cualquier radical R o especie oxidante, de dos maneras: Por transferencia de un átomo de hidrógeno (HAT) o por transferencia de un electrón (SET) [32, 33, 34]. En el mecanismo (HAT) el antioxidante primario, atrapa un radical por una donación rápida de átomos de hidrógeno así:
o especie oxidante, de dos maneras: Por transferencia de un átomo de hidrógeno (HAT) o por transferencia de un electrón (SET) [32, 33, 34]. En el mecanismo (HAT) el antioxidante primario, atrapa un radical por una donación rápida de átomos de hidrógeno así:
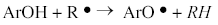
Una alta estabilidad de ArO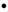 corresponde a una mejor eficiencia del antioxidante ArOH. Generalmente, la naturaleza de los enlaces de hidrógeno está determinada por la naturaleza de los sustituyentes, la conjugación y la resonancia que determinan a la vez la reactividad del radical fenoxilo
corresponde a una mejor eficiencia del antioxidante ArOH. Generalmente, la naturaleza de los enlaces de hidrógeno está determinada por la naturaleza de los sustituyentes, la conjugación y la resonancia que determinan a la vez la reactividad del radical fenoxilo 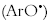 . En el segundo mecanismo, el antioxidante puede donar un electrón al radical peroxilo o a cualquier otra especie oxidante Fe+3, formando entre los productos un catión radical del antioxidante
. En el segundo mecanismo, el antioxidante puede donar un electrón al radical peroxilo o a cualquier otra especie oxidante Fe+3, formando entre los productos un catión radical del antioxidante 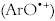 .
.
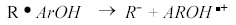
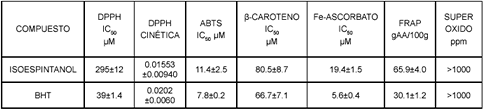
Los ensayos ABTS y DPPH reflejan la habilidad que posee un antioxidante para donar protones en un medio fisiológico pH 7.4 o en un medio metanólico. El BHT en ambos ensayos es más activo que el isoespintanol (Véase tabla 1). Su mayor actividad puede estar asociada a un fenómeno de hiperconjugación en el radical fenoxilo formado en el proceso de transferencia del protón, debido a la naturaleza de los ter-butilos en posición orto al grupo OH, dándole una alta estabilidad al radical. Las dos metodologías pueden diferenciar la capacidad para atrapar radicales libres que posee un antioxidante; sin embargo el ensayo con 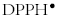 es mucho más selectivo que el método con ABTS debido a su conformación espacial, siendo difícil llegar al sitio activo, debido al alto impedimento estérico en el sitio activo; esta propiedad le ha dado vigencia a la técnica y permite diferenciar muy bien los antioxidantes atrapadores de radicales libres [35]. El isoespintanol es mejor reductor que el BHT a través de un fenómeno de transferencia de electrones, fenómeno evidenciado por el método FRAP (Véase tabla 1).
es mucho más selectivo que el método con ABTS debido a su conformación espacial, siendo difícil llegar al sitio activo, debido al alto impedimento estérico en el sitio activo; esta propiedad le ha dado vigencia a la técnica y permite diferenciar muy bien los antioxidantes atrapadores de radicales libres [35]. El isoespintanol es mejor reductor que el BHT a través de un fenómeno de transferencia de electrones, fenómeno evidenciado por el método FRAP (Véase tabla 1).
Tabla 1. Resultados actividad antioxidante in vitro
El ensayo de 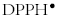 es un modelo ampliamente usado para evaluar la rapidez que tiene un antioxidante para atrapar radicales [25-26]. Evaluamos para el isoespintanol y el BHT los valores de la krsc. Inicialmente obtuvimos los valores de la concentración de DPPH remanente a partir de la ecuación: Abs517 = 10232.1 [DPPH]-3.96x10-3; r2>98%.Posteriormente, para cada concentración del antioxidante calculamos los valores de kobs según la regresión: [
es un modelo ampliamente usado para evaluar la rapidez que tiene un antioxidante para atrapar radicales [25-26]. Evaluamos para el isoespintanol y el BHT los valores de la krsc. Inicialmente obtuvimos los valores de la concentración de DPPH remanente a partir de la ecuación: Abs517 = 10232.1 [DPPH]-3.96x10-3; r2>98%.Posteriormente, para cada concentración del antioxidante calculamos los valores de kobs según la regresión: [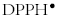 ] = [
] = [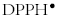 ]oe-Kobs, con valores de r2>97%. Finalmente, los valores de krsc se determinan a partir de la regresión entre kobs contra cada concentración (mg/mL) del isoespintanol o BHT. Para el Isoespintanol kRSC = 0.01553 ± 0.0094 (mg/L)-1s-1, para el BHT el valor de kRSC = 0.0202 ± 0.0060 (mg/L)-1s-1 (tabla 1). Esta metodología de trabajo permite realizar cálculos reproducibles y significativos para medir la velocidad de interacción de los antioxidantes con el radical
]oe-Kobs, con valores de r2>97%. Finalmente, los valores de krsc se determinan a partir de la regresión entre kobs contra cada concentración (mg/mL) del isoespintanol o BHT. Para el Isoespintanol kRSC = 0.01553 ± 0.0094 (mg/L)-1s-1, para el BHT el valor de kRSC = 0.0202 ± 0.0060 (mg/L)-1s-1 (tabla 1). Esta metodología de trabajo permite realizar cálculos reproducibles y significativos para medir la velocidad de interacción de los antioxidantes con el radical 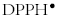 . Frente al radical
. Frente al radical 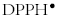 , el isoespintanol, un antioxidante natural, reacciona con una velocidad similar a la del BHT.
, el isoespintanol, un antioxidante natural, reacciona con una velocidad similar a la del BHT.
El ensayo de peroxidación lipídica en el sistema micelar metil linoleato/β-caroteno es más complejo, porque mide tres propiedades antioxidantes de la muestra [24]. Dos de las propiedades se pueden explicar basados en el mecanismo general de la oxidación de ácidos grasos. En el mecanismo, el antioxidante puede atrapar radicales peroxilos en la etapa de propagación inhibiendo la continuación de la reacción en cadena.
El antioxidante también puede tener la propiedad de inhibir la etapa de iniciación extinguiendo el oxígeno singlete (1O2), retardando así la oxidación del metil linoleato. La tercera propiedad antioxidante que mide el método en el sistema micelar metil linoleato/β-caroteno, está dirigida al carácter lipofílico-hidrofílico de la molécula a evaluar, de manera que la ubicación del compuesto en la micela podría permitir la interacción más frecuente con posibles especies radicalarias que se formen durante la oxidación del ácido graso. Un posible mecanismo para la decoloración del β-caroteno en el sistema emulsionado, se presume que es debido al ataque del radical peroxilo proveniente del metil linoleato oxidado [36].
El isoespintanol mostró un IC50 = 80.5 ± 5.5 μM y el BHT 66.7 ± 3.1 μM. Los grupos terbutilos del BHT le dan mayor carácter lipofílico, orientándose más cercano a la micela, interactuando fácilmente con los radicales peroxilos protegiendo el sistema micelar metil linoleato/ β-caroteno y por esto su ligera mayor actividad.
En la peroxidación lipídica (POL), los resultados son los siguientes: IC50 Isoespintanol 19.4 ± 1.5 μM e IC50 BHT 5.6 ± 0.3 μM. Es importante destacar que las sales de hierro pueden estimular la POL reaccionando directamente con el oxígeno molecular para producir el radical hidroxilo (OH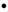 ) iniciador, y por descomposición de los hidroperóxidos lipídicos propagadores radicálicos orgánicos [21]. Los resultados obtenidos sugieren que los efectos antioxidantes de la POL microsomal pueden estar asociados a la capacidad de los componentes de los compuestos de afectar las interacciones hierro/ascorbato, quelatando al Fe2+ e impidiendo la formación de radicales OH
) iniciador, y por descomposición de los hidroperóxidos lipídicos propagadores radicálicos orgánicos [21]. Los resultados obtenidos sugieren que los efectos antioxidantes de la POL microsomal pueden estar asociados a la capacidad de los componentes de los compuestos de afectar las interacciones hierro/ascorbato, quelatando al Fe2+ e impidiendo la formación de radicales OH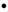 y/o la descomposición de los hidroperóxidos lipídicos para dar lugar a la formación de radicales alcoxil y peroxil, los cuales, pueden propagar adicionalmente la POL [37,38].
y/o la descomposición de los hidroperóxidos lipídicos para dar lugar a la formación de radicales alcoxil y peroxil, los cuales, pueden propagar adicionalmente la POL [37,38].
De igual manera, en sistemas emulsificados como la POL inducida por Fe/ascorbato, los compuestos con mayor carácter lipofílico se concentran mucho más cerca a la micela, protegiendo mejor los sustratos oxidables generadores de especies reactivas de oxígeno; por esto el BHT tiene una mejor actividad que el isoespintanol [36].
El radical superóxido fue formado en el sistema PMS/NADH-NBT, la disminución de la absorbancia 560 nm provocada por el antioxidante, implica consumo del radical superóxido [22]. En este ensayo, el isoespintanol y el BHT capturaron muy poco el radical superóxido y sus IC50 fueron superiores a 1000 mg/L, comparado con el IC50 de la catequina 389.3 ± 10 μM. A 1000 ppm ni el isoespintanol ni el BHT inhibieron la xantina oxidasa.
CONCLUSIONES
El isoespintanol es mejor reductor que el BHT. Este comportamiento se evidencia en la capacidad que tiene para reducir el Fe3+ hasta Fe2+ en el ensayo FRAP. El BHT es un mejor atrapador de los radicales libres ABTS y DPPH y en sistemas emulsificados como decoloración de β-caroteno y en la peroxidación lipídica en el sistema Fe-ascorbato la capacidad protectora de ambos compuestos es muy similar. El isoespintanol reacciona lentamente cuando atrapa radicales libres, por lo tanto su efecto protector es tardío permitiendo un posible uso en la conservación de alimentos con alto contenido de grasas o sistemas alimenticios emulsificados. Es recomendable hemisintetizar análogos del isoespintanol con sustituyentes que disminuyan la energía de disociación del enlace (BDE), estabilicen el radical fenoxilo y se orienten cercano al sitio donde ocurre el proceso oxidativo. Definitivamente, para comprender la capacidad antioxidante de una estructura química, es necesario evaluarla en diferentes medios para tener una idea de su posible uso.
REFERENCIAS BIBLIOGRÁFICAS
1. Halliwell B. The antioxidant paradox. Lancet 2000; 355: 1179-1180. [ Links ]
2. Choksi RB, Boylston WH, Rabek JP, Widger WR, Papaconstantinou J. Oxidatively damaged proteins of heart mitochondrial electron transport complexes. Biochim Biophys Acta 2004; 1688 (2), 95-101. [ Links ]
3. Yilmaz S, Ozan S, Benzer F, Canatan H. Oxidative damage and antioxidant enzyme activities in experimental hypothryroidism. Cell Biochem Function 2003; 21: 325-340. [ Links ]
4. Szeto YT, Collins AR, Benzie LFF. Effects of dietary antioxidants on DNA damage in lysed cells using a modified comet assay procedure. Mutat Res 2002; 500: 31-38. [ Links ]
5. Mark R, McCalland B. Can antioxidants vitamins materially reduce oxidative damage in humans?. Free Radic Biol Med 1999; 26(7/8), 1034-1053. [ Links ]
6. Dinçer Y, Akçay T, Ilkova H, Alademir Z, Özbay G. DNA damage and antioxidant defense in peripheral leukocytes of patients with Type I diabetes mellitus. Mutat Res 2003; 527: 49-55. [ Links ]
7. Sierens J, Hartley JA, Campbell MJ, Leatherm AJC. In vitro isoflavone supplementation reduces hydrogen peroxide induced DNA damage in sperm. Teratog Carcinog Mutagen 2002; 22: 227-234. [ Links ]
8. Da Silva J, Herrmann SM, Heuser V, Peres W, Possa Marrón N, González-Gallego J, et al. Evaluation of the genotoxic effect of rutin and quercetin by comet assay and micronucleus test. Food Chem. Toxicol 2002; 40: 941-947. [ Links ]
9. Wilms LC, Hollman PCH, Boots AW, Leinjans JCS. Protection by quercetin and quercetin-rich juice against induction of oxidative DNA damage and formation of BPDE-DNA adducts in human lymphocytes. Mutat Res 2005; 582: 155-162. [ Links ]
10. Fuchs J. Potentials and limitations of the natural antioxidants alpha-tocopherol, L-ascorbic acid and beta-caroteno in cutaneus photoprotection. Free Radic Biol Med 1998; 25(7), 848-873. [ Links ]
11. Bush RK, Taylor SL. Adverse reactions to food and drug additives, in allergy: principles and practice. 5th ed.St Louis: Mosby; 1998. [ Links ]
12. Ito N, Fukushima S, Hasegawa A, Shibata M, Ogiso T. Carcinogenecity of butylated hydroxyanisole in F344 rats. J Natl Cancer Inst 1983; 70: 343-347. [ Links ]
13. Prior RL, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. J Agric Food Chem 2005; 43: 4290 - 4302. [ Links ]
14. Rojano B, Figadère B, Martin MT, Recio MC, Giner R, Schinella G, et al. Constituents of Oxandra cf. xylopioides with antiinflammatory activity. J Nat Prod 2007; 70(5), 835-838. [ Links ]
15. Rojano B, Saez J, Schinella G, Quijano J, Vélez E, Gil A, et al. Experimental and theoretical determination of the antioxidant properties of isoespintanol (2-Isopropyl-3,6-dimethoxy-5-methylphenol). J Mol Struct 2008, 877, 1-6. [ Links ]
16. Hocquemiller R, Cortés D, Arango GJ, Myint S, Cavé A, Angelo A, et al. Isolement et synthese de l´espintanol, nouveau monoterpene antiparasitaire. J Nat Prod 1991 ; 54: 445 - 452. [ Links ]
17. Maatooq GT, El Gamal A, Furbacher T, Cornuelle T, Hoffmann J. Triterpenoids from Parthenium argentatum x P. tomentosa. Phytochemistry 2002; 60: 755-760. [ Links ]
18. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 1999; 26: 1231-1237. [ Links ]
19. Slater TF, Sawyer BC. An immuno-electrophoretic assay of beta-lipoprotein and albumin in human aortic intima by direct electrophoresis from the tissue sample into an antibody-containing gel. Biochem J 1971; 123: 39-40. [ Links ]
20. Halliwel B. How to characterise a biological antioxidant. Free Rad Research Commun 1990; 9:1-32. [ Links ]
21. Pompella A, Maellaro E, Casini A, Ferrali M, Ciccoli L, Comporti M. Measurement of lipid peroxidation in vivo: a comparison of different procedures. Lipids 1987; 22 (3), 206-211. [ Links ]
22. Yamaguchi F, Ariga T, Yoshimura Y, Nakazawa H. Antioxidative and anti-glycation activity of garcinol from Garcinia indica fruit rind. J Agric Food Chem 2000; 48:180-185. [ Links ]
23. Noro T, Oda Y, Toxhio M, Ueno A, Fukushima S. Inhibition of xantina oxidase from the flowers and buds of Daphene genkwa. Chem Pharm Bull 1983; 31: 3984-3987. [ Links ]
24. Rosas-Romero AJ, Rojano B, Herrera JC, Silva J, Hernández CA, Martínez C. A novel approach to quantitative structure-property relationships in antioxidants. Ciencia 1999; 7 (1), 78-87. [ Links ]
25. Antolovich M, Prenzler PD, Patsalides E, McDonald S, Robards K. Methods for testing antioxidant activity. The Analyst 2002; 127: 183-198. [ Links ]
26. Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. Lebensm.-Wiss U Technol 1995; 28: 25-30. [ Links ]
27. Espín JC, Soler-Rivas C, Wichers HJ. Characterization of the total free radical scavenger capacity of vegetable oils and oil fractions using 2,2-diphenyl-1-picrylhydrazyl radical. J Agric Food Chem 2000a; 48: 648-656. [ Links ]
28. Espín JC, Soler-Rivas C, Wichers HJ, García-Viguera C. Anthocyanin-based natural colorants: a new source of antiradical activity for foodstuff. J Agric Food Chem 2000b; 48: 1588-1592. [ Links ]
29. Bondet V, Brand-Williams W, Berset C. Kinetics and mechanisms of antioxidant activity using the DPPH free radical method. Lebensm.-Wiss U Technol 1997; 30: 609-615. [ Links ]
30. Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay. Anal Biochem 1996; 239: 70-76. [ Links ]
31. Brigati GL, Verónica M, Pedulli F, Franco G. Determination of the substituent effect on the O-H bond dissociation enthalpies of phenolic antioxidants by the EPR Radical Equilibration technique. J Org Chem 2002; 67: 4828-4832. [ Links ]
32. Borges RM, Martinho JA. Energetics of the O-H bond in phenol and substituted phenols: A critical evaluation of literature data. J Phys Chem 1998; 27[3]: 707 - 739. [ Links ]
33. Wright JS, Johnson ER, DiLabio GA. Predicting the activity of phenolic antioxidants: theoretical method, analysis of substituent effects and application to major families of antioxidants. J Am Chem Soc 2001; 123: 1173-1183. [ Links ]
34. Lucarini M, Verónica M, Pedulli F, Gian F. Bond dissociation enthalpies of polyphenols: the importance of cooperative effects. J Org Chem 2002; 67: 928 - 931. [ Links ]
35. Prior RL, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. J Agric Food Chem 2005; 53: 4290-4302. [ Links ]
36. Frankel EN. Recent advances in lipid oxidation. J Sci Food Agric 1991; 54: 495-511. [ Links ]
37. Nedyalka VY, Emma MM. Stabilisation of edible oils with natural antioxidants. Eur J Lipid Sci Technol 2001; 103, 752-767. [ Links ]
38. Yanishlieva NV, Marinova EM, Gordon MH, Raneva V. Antioxidant activity and mechanism of action of thymol and carvacrol in two lipid systems. Food Chemistry 1999; 64:59-66. [ Links ]
AGRADECIMIENTOS
Los autores agradecen a la División de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín (DIME, proyecto: 20201006745), a la Vicerrectoría de Investigación, Universidad Nacional de Colombia (Convocatoria Nacional de Investigación), a la Universidad de Antioquia a través del programa ECOS-NORD, ICFES, COLCIENCIAS por la financiación del proyecto.
Recibido: Marzo 7 de 2008; Aceptado: Mayo 13 de 2008
* Autor a quien se debe dirigir la correspondencia: brojano@unal.edu.co, Teléfono: 4-4309381