Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.2 Medellín July/Dec. 2008
INGENIERÍA Y TECNOLOGÍA DE ALIMENTOS
DETERMINACIÓN DE LA ACTIVIDAD ANTIOXIDANTE EN UN MODELO DE PEROXIDACIÓN LIPÍDICA DE MANTEQUILLA INHIBIDA POR EL ISOESPINTANOL
ANTIOXIDANT ACTIVITY DETERMINATION IN A LIPIDIC PEROXIDATION MODEL OF BUTTER INHIBITED BY ISOESPINTANOL
Benjamín A. ROJANO.1*; Carlos A. GAVIRIA.1; Jairo A. SÁEZ.2
1 Laboratorio de Ciencia de Alimentos. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia.
2 Grupo de Química de Plantas Colombianas. Universidad de Antioquia. Instituto de Química, A.A. 1226, Medellín, Colombia.
RESUMEN
En este trabajo se evalúa la actividad antioxidante (Φ), definida como la pendiente de la regresión simple lineal de fo /fi contra la concentración µM, en un modelo de inhibición de la peroxidación lipídica de mantequilla a 60ºC, donde fi es el efecto de cada concentración del isoespintanol y fo es el control. Se encuentra que la formación de hidroperóxidos (valor de peróxido PV) y las especies mas oxidadas reactivas al ácido tiobarbiturico (TBARS) fueron retardadas de manera similar por el isoespintanol (ΦTBARS=9.46x10-5 ± 1.33x10-5 y ΦPV = 9.41x10-5 ± 1.62x10-5). De igual manera, el butilhidroxi tolueno y el isoespintanol inhiben el proceso oxidativo de mantequilla en un 28.0 y 23.3 % a concentraciones de 2380.9 y 3809.5 µM respectivamente.
Palabras clave: Peroxidación lipídica, mantequilla, isoespintanol, valor de peróxido, valor TBA
ABSTRACT
The antioxidant activity (Φ) is defined as the slope of the simple linear regression of f0/fi against the concentration µM, in an inhibition model of lipid peroxidation of butter at 60° C, where fi is the concentration effect of isoespintanol and f0 is the control. It is found that the formation of: hydroperoxides (peroxide value of PV) and the most oxidized species reactive to thiobarbituric acid (TBARS), were similarly delayed by isoespintanol (ΦTBARS = 9.46x10-5 ± 1.33x10-5 and ΦPV = 9.41x10-5 ± 1.62x10-5). Likewise, the butilhidroxy toluene and isoespintanol inhibit the oxidative process of butter in a 28.0 and 23.3% at concentrations of 2380.9 and 3809.5 µ M respectively.
Keywords: Lipid peroxidation, butter, isoespintanol, peroxide value, TBA value.
INTRODUCCIÓN
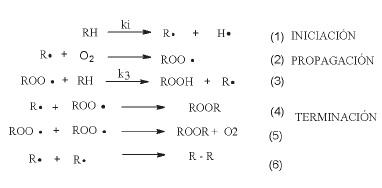
La autoxidación de los lípidos ocurre fundamentalmente debido a los ácidos grasos insaturados a través de una serie de reacciones en cadena de radicales libres, que tiene las fases de iniciación, propagación y terminación [1]. En la etapa de iniciación (1) el radical lipídico, R se forma a partir del lípido (RH), usualmente por el ataque de radicales, luz, calor, irradiaciones o por trazas de metales. El radical lipídico (R
se forma a partir del lípido (RH), usualmente por el ataque de radicales, luz, calor, irradiaciones o por trazas de metales. El radical lipídico (R ) formado reacciona rápidamente con oxígeno (2) para dar un radical peroxilo (ROO
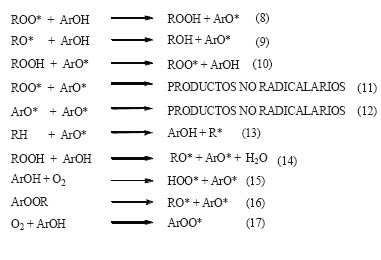
) formado reacciona rápidamente con oxígeno (2) para dar un radical peroxilo (ROO ), el cual ataca otra molécula de lípido (RH) y sustrae un átomo de hidrógeno para formar un hidroperóxido lipídico (ROOH), y un nuevo radical lipídico, que inicia de nuevo la secuencia de propagación (3). De esta manera, muchas moléculas de lípidos pueden ser oxidadas hasta hidroperóxidos por muchas formas de iniciación. El ciclo de propagación es interrumpido por las reacciones de terminación (4-6), en las cuales hay consumo de los radicales. Las interacciones bimoleculares de radicales libres originan productos no-radicales muy estables. El proceso de autoxidación sin antioxidantes se resume a continuación.
), el cual ataca otra molécula de lípido (RH) y sustrae un átomo de hidrógeno para formar un hidroperóxido lipídico (ROOH), y un nuevo radical lipídico, que inicia de nuevo la secuencia de propagación (3). De esta manera, muchas moléculas de lípidos pueden ser oxidadas hasta hidroperóxidos por muchas formas de iniciación. El ciclo de propagación es interrumpido por las reacciones de terminación (4-6), en las cuales hay consumo de los radicales. Las interacciones bimoleculares de radicales libres originan productos no-radicales muy estables. El proceso de autoxidación sin antioxidantes se resume a continuación.
En los alimentos con alto contenido de lípidos, la etapa más importante es la formación y descomposición de los hidroperóxidos, que generan una serie de compuestos oxidados como cetonas, aldehídos, alcanos y alquenos de bajo peso molecular y de alta volatilidad, que determinan el valor sensorial del alimento. Este fenómeno se denomina rancidez. Los antioxidantes pueden retardar la rancidez, pero nunca la detienen, porque la oxidación ocurre a bajas presiones de oxígeno y se hace inevitable, a pesar del uso de todas las metodologías de conservación, como frío, escaldado y empaque [1, 3].
Los antioxidantes de mayor uso en la industria de alimentos y farmacéutica, son los compuestos sintéticos butilhidroxianisol (BHA) y butilhidroxitolueno (BHT), los cuales presentan efectos secundarios como el aumento del colesterol, hepatomegalia e inducción de cáncer en células de ratas [4-6]. Estos hallazgos, junto al gran interés del consumidor en el uso de aditivos inocuos para la salud, ha potenciado el uso de compuestos naturales de baja toxicidad en la industria de alimentos. Además, muchos compuestos naturales como mono y polifenoles con actividad antioxidante, tienen la capacidad de proteger células, membranas y organismos sometidos al estrés oxidativo que pueden causar envejecimiento, enfermedades degenerativas y cáncer, entre otras [7, 8].
Son muchos los informes sobre la aplicación de compuestos naturales antioxidantes en la conservación de grasas o aceites; los isopropilmetil fenoles, como timol y carvacrol, han sido objeto de muchos estudios [9, 10, 11]. Los informes de peroxidación lipídica con timol y carvacrol se han desarrollado en diferentes sistemas, por ejemplo, Aeschbach et al 1994 [12], encontraron que el timol y el carvacrol inhibieron la peroxidación de lipososomas fosfolípidicos; de igual manera Lagouri et al 1993 [13], reportaron la efectividad de ambos isómeros en la autoxidación de cebo de vacuno a 35° C a una concentración del 0.1%. Además, Lagouri y Boskou, en 1993, Castillo et al, 2007, y Loziene et al, 2007 [13, 14, 15], encontraron que la oxidación de aceites esenciales de orégano, era altamente dependiente del contenido de timol y carvacrol. El grupo de Yanishlieva y Marinova, 1999 [16] informa el mecanismo y la cinética de oxidación de diferentes sistemas lípidicos inhibidos por el timol y carvacrol, hallando mayor efectividad del timol, debido a la mayor estabilidad del radical timoil, causada por un efecto electrónico del grupo isopropil en posición orto al O-H.
El isoespintanol (2-isopropil-3,6-dimetoxi-5-metilfenol), un derivado biosintético del timol, es un antioxidante natural aislado de los extractos hexánicos de Oxandra cf xylopioides (Annonaceae), que actúa como un buen reductor y con una alta capacidad para atrapar radicales libres en diferentes medios; que, además, posee baja cito y genotoxicidad a 1000 ppm; siendo un buen candidato para ser utilizado en medios alimenticios [17, 18, 19].
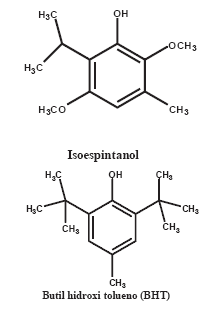
En este trabajo se propone una nueva estrategia para calcular la actividad antioxidante (Φ) de compuestos y extractos como inhibidores de peróxidos y de especies reactivas al acido tiobarbitúrico. Además, estudiamos la capacidad inhibitoria del isoespintanol sobre la peroxidación lipídica de mantequilla, comparando contra BHT (Figura 1); haciendo el seguimiento del deterioro oxidativo, monitoreando la velocidad de aparición de peróxidos usando el método FOX (valor de peróxidos) y la capacidad de los compuestos oxidados para reaccionar con el ácido tiobarbiturico (valor TBARS).
Figura 1. Compuestos inhibidores de la peroxidación lipídica de mantequilla
MATERIALES Y MÉTODOS
Reactivos: Butilhidroxitolueno (BHT), 1,1,3,3 tetraetoxipropano (TEP) y ácido tiobarbitúrico (TBA) fueron obtenido de Sigma Chemical Co. (St.Louis, MO). Naranja de xilenol (XO), ácido acético, cloruro de hierro II (FeCl2), cloruro de hierro III (FeCl3) fueron obtenidos de Merck. El isoespintanol (2-Isopropil-3,6-dimetoxi-5-metilfenol) fue aislado de las hojas de Oxandra cf xylopioides (Annonaceae). La mantequilla sin ningún aditivo, fue obtenida de la planta de lácteos de la Universidad Nacional de Colombia, sede Medellín, Colombia.
Obtención de la grasa clarificada de mantequilla. La mantequilla se clarificó de la siguiente forma:en un vaso de precipitados la mantequilla se fundió a 70° C., con baja agitación por un período de tres horas para separar el suero y precipitar las proteínas presentes. La fase lipídica se separó y se clarificó pasándola a través de algunas capas de tela filtrante para queso, posteriormente se filtró en papel Watman numero 2 [20].
Análisis de la mantequilla clarificada. La mantequilla clarificada es la matriz alimenticia oxidable a la cual se le adicionan cantidades de isoespintanol hasta obtener concentraciones de 952.4, 1666.7, 2381.0, 3095.2, 3809.5 µM (equivalentes a 200, 350, 500, 650 y 800 ppm respectivamente). Como patrón se utilizó BHT a una concentración de 2381.0 µM (500 ppm), y como control se utilizó una muestra de mantequilla clarificada sin antioxidante.
Determinación del contenido de sustancias reactivas con el ácido 2-tiobarbitúrico (TBARS). La determinación se llevó a cabo teniendo en cuenta el procedimiento de Guzmán-Chozas et al 1999 [21] con ligeras modificaciones: En un frasco de vidrio ámbar se colocan 5 ml del reactivo de TBA recién preparado (ácido 2- tiobarbitúrico 0.02 M en ácido acético glacial al 90 %), y 0.5 g de mantequilla clarificada El tubo se sumerge en un baño de agua a 90° C durante 45 minutos. También se prepara un blanco con el mismo procedimiento anterior. Luego los tubos son enfriados en agua durante 10 minutos. Una porción de la muestra se llevó a una cubeta y la absorbancia de la muestra fue leída a 532 nm en un espectrofotómetro (Jenway 6405 UV/ Vis). Las lecturas fueron convertidas a mg de malonaldehído por kilogramo de muestra usando una curva estándar. La curva estándar fue construida realizando diluciones apropiadas de una solución acuosa de 1,1,3,3 tetraetoxipropano 1.0x10-3 M, para obtener concentraciones de 1*10-8 a 7*10-8 moles de malonaldehído en 1 ml de solución. Estas soluciones fueron tratadas con el reactivo de TBA, como se indicó anteriormente, y la absorbancia fue medida a 532 nm.
Determinación del valor de peróxidos (PV). El valor de peróxidos se determinó por el método de oxidación ferrosa/ naranja de xilenol (FOX) [22], que se fundamenta en la capacidad que presentan los peróxidos lípidicos de oxidar el Fe2+ hasta Fe3+, a bajos pH. A 0.01 gramos de muestra, se adicionan 9.9 ml de cloroformo-metanol (7:3) y se agita por 10 segundos, luego se adiciona 50 µl de una solución acuosa de naranja de xilenol 10 mM mas 50 µl de solución de FeCl2, se agita por 10 segundos y se incuba por un período de 5 minutos, y se lee a 560 nm. Las lecturas fueron convertidas a meq. de oxígeno activo/ Kg. de muestra usando una curva estándar de Fe3+. La curva estándar fue construida mediante la adición de diferentes cantidades de cloruro de hierro III al medio formado por la mezcla cloroformo - metanol (7:3) y la solución de naranja de xilenol; finalmente se monitorea la absorbancia a 560 nm.
Análisis estadístico. Las muestras fueron preparadas por cuadriplicado para cada una de las concentraciones y los datos son reportados como la media ± la desviación estándar. Las diversas regresiones se calcularon con el programa Statgraphics Plus versión 5.0 (Statistical Graphics Corp., Rockville, MD), con un nivel de significancia de p<0.05 de exactitud.
RESULTADOS Y DISCUSIÓN
En este trabajo se evaluó la oxidación de mantequilla clarificada de vacuno, libre de aditivos, acelerada a 60° C, durante un periodo de tiempo de 15 días. Los cambios ocurridos en el proceso oxidativo se siguieron monitoreando la cinética de aparición de hidroperóxidos, midiendo el valor de peróxido (PV), expresado como meq de peróxido de hidrógeno por Kg. de muestra (meq Oact/Kg.); y midiendo la formación de productos oxidados reactivos al ácido tiobarbitúrico (TBARS) y expresados como miligramos de malonaldehído por Kg de mantequilla (mg MA/ Kg. de Muestra).
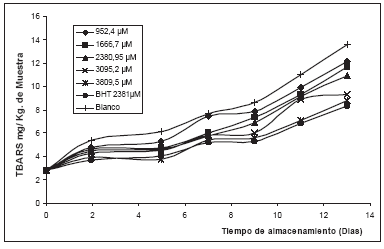
En la Figura 2 se observan los cambios en la concentración de especies producto del proceso de oxidación lipídica, evaluadas mediante el seguimiento de la formación de especies reactivas al ácido tiobarbiturico (TBARS). En todo el experimento hay una buena relación dosis-respuesta; es decir, con el aumento de concentración del isoespintanol hay una disminución de las TBARS, respecto al control (todo el sistema, sin antioxidante). Además, se observa un aumento en el periodo de inducción al aumentar la concentración del antioxidante, tiempo en el cual el valor TBARS se mantiene bajo.
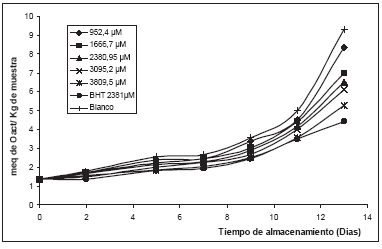
Los hidroperóxidos, son los primeros productos del proceso de oxidación de lípidos que posteriormente originan una gran variedad de compuestos secundarios volátiles y no-volátiles [23]. En el método FOX, el Fe II en medio ácido con el naranja de xilenol forma un cromóforo azul púrpura el cual presenta su máximo de absorción a 560 nm [23]. El método FOX ha sido reportado en la evaluación de conservación de aceites con una gran sensibilidad y precisión [24-28]. En la Figura 3 se observan los cambios en los periodos de inducción que provoca el isoespintanol a las diversas concentraciones de isoespintanol y BHT en el proceso de oxidación de la matriz. Puede observase que existe una buena relación dosis - inhibición en el rango de experimentación para el isoespintanol.
Figura 3. Cambios en PV en mantequilla clarificada conteniendo isoespintanol a diferentes concentraciones, BHT y sin ningún aditivo.
CÁLCULO DE LA ACTIVIDAD ANTIOXIDANTE (Φ)
Ensayo TBARS: las curvas de valor de peróxido y especies reactivas al TBA contra el tiempo, son regresiones simples exponenciales, cuyas pendientes dependen de la concentración y de la naturaleza del antioxidante. Por esto, se hace necesario obtener un parámetro (Φ) que determine la acción antioxidante de cualquier compuesto en un proceso oxidativo.
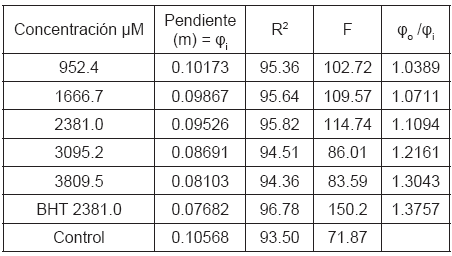
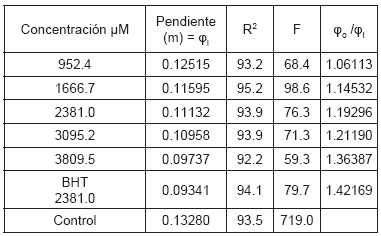
Para calcular la actividad antioxidante (Φ) del compuesto en los ensayos TBARS, realizamos el siguiente procedimiento: a partir de los datos con los cuales se construyó la figura 2, determinamos el parámetro fi, que es la pendiente de la regresión simple exponencial de los mg de malonaldehido/ Kg de mantequilla producidos contra el tiempo en días; el valor de fi, mide el efecto inhibitorio de la concentración i del isoespintanol sobre el proceso oxidativo de la mantequilla. En la Tabla 1 se observan los diferentes valores de fi para cada concentración, con una alta significancia estadística. Con los valores de fi, calculamos la relación fo/fi; donde fo es la pendiente del control.
Tabla 1. Cálculo de la actividad fi para cada concentración del isoespintanol en el ensayo TBARS.
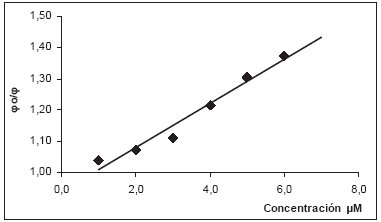
La pendiente de la regresión simple lineal de fo/fi contra la concentración µM, es el valor Φ, que refleja el efecto integral del isoespintanol como inhibidor del proceso oxidativo de la mantequilla de vacuno, en la producción de compuestos oxidados reactivos al TBA, bajo las condiciones de nuestra experimentación (Figura 4). Luego la actividad antioxidante global del isoespintanol en la inhibición de la formación de compuestos reactivos con el TBA es: ΦTBARS = 9.46x10-5 ± 1.33x10-5, con una r2 = 94.42, r = 0.972, F = 50.7 y p = 0.0057.
Figura 4. Cálculo de la actividad antioxidante (ΦTBARS) para el isoespintanol, a partir de la regresión de fo/fi vs concentración (µM).
Valor de peróxido: A partir de los datos con los cuales se construyó la Figura 3, se calculan los valores fo, fi y las relaciones de fo/fi para el método FOX (Tabla 2). De igual manera que en el caso anterior, se obtiene el valor de la actividad antioxidante global ΦPV = 9.41x10-5 ± 1.62x10-5 para inhibir la formación de hidroperóxidos en el proceso de oxidación de mantequilla acelerada a 60°C. Rosas Romero, Rojano et al 1999, realizaron cálculos quimiométricos de una forma similar para determinar la actividad antioxidante (?) para compuestos fenólicos en la decoloración de beta caroteno en un medio emulsificado [29].
Tabla 2. Cálculo de la actividad fi para cada concentración del isoespintanol en la determinación de peróxidos.
De acuerdo a los datos obtenidos encontramos que el isoespintanol en ambos procesos inhibe de igual manera la formación de hidroperóxidos y la formación de productos oxidados, debido a que los valores de las Φ no tienen diferencias significativas entre sí, explicando la eficiencia del isoespintanol en ambos procesos.
De otro lado, a partir de los valores de fi/f0 se puede calcular el porcentaje de inhibición para cada concentración de antioxidante [17], expresándolo como:
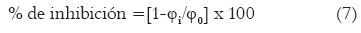
Aunque se estudió a una sola concentración se nota que el BHT tiene mayor capacidad para inhibir los procesos oxidativos acelerados a 60°C en mantequilla, comparado con el isoespintanol, porque a la concentración de 2381.0 µM inhibe un 28.0 %, mientras que el isoespintanol a 3809.5 µM, inhibe solamente el 23.3 %. Estos resultados de inhibición están acordes con diversos reportes bibliográficos de sustancias consideradas buenos antioxidantes del proceso de peroxidación lipídica [30]. El isoespintanol y el BHT son antioxidantes primarios interruptores de la cadena de oxidación atrapando los radicales libres ROO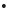 interrumpiendo las etapas de propagación de acuerdo a las reacciones (8) y (9), formando un radical ArO
interrumpiendo las etapas de propagación de acuerdo a las reacciones (8) y (9), formando un radical ArO de una reactividad muy baja, de tal manera que las otras reacciones de los lípidos no ocurren o lo hacen con muy baja velocidad. El isoespintanol y el BHT poseen una muy baja energía de disociación del enlace O-H (ΔBDE), que los caracteriza como buenos antioxidantes primarios que reaccionan con radicales libres, inhibiendo la peroxidación lipídica a través de un mecanismo de simple transferencia de un protón (HAT) [18, 31].
de una reactividad muy baja, de tal manera que las otras reacciones de los lípidos no ocurren o lo hacen con muy baja velocidad. El isoespintanol y el BHT poseen una muy baja energía de disociación del enlace O-H (ΔBDE), que los caracteriza como buenos antioxidantes primarios que reaccionan con radicales libres, inhibiendo la peroxidación lipídica a través de un mecanismo de simple transferencia de un protón (HAT) [18, 31].
CONCLUSIONES
Los cálculos de la actividad antioxidante expresada como Φ, es la respuesta del antioxidante para inhibir integralmente el proceso oxidativo. Esta forma de cálculo para determinar la actividad antioxidante en procesos oxidativos, no ha sido reportada en la literatura y es una buena alternativa para hacer comparaciones entre compuestos, e incluso con extractos, de una manera más razonable, porque en casi todos los casos se hacen relaciones comparativas a un solo valor de concentración [32, 33].
La efectividad del isoespintanol y el BHT para inhibir la autoxidación de la mantequilla a 60° C, se observa en las figuras 2 y 3, por el aumento del periodo de inducción comparado con el control; este efecto es una función directa de las concentraciones de cada antioxidante, en este tiempo la peroxidación de lípidos ocurre a una velocidad muy lenta. El periodo de inducción comienza a aumentar hasta cuando queda remanente más o menos el 10% del antioxidante [21].
El isoespintanol es un compuesto natural que puede ser una buena alternativa como inhibidor de la oxidación de alimentos con alto contenido de grasas; su modo de acción, de acuerdo a los resultados (ΦTBARS = ΦPV), es la capacidad que tiene para interactuar con los radicales peroxilos (ROO ) y controlar la formación de hidroperóxidos a igual velocidad que la descomposición de los mismos para formar productos altamente oxidados, como aldehídos, cetonas y ácidos de cadenas cortas.
) y controlar la formación de hidroperóxidos a igual velocidad que la descomposición de los mismos para formar productos altamente oxidados, como aldehídos, cetonas y ácidos de cadenas cortas.
AGRADECIMIENTOS
Este trabajo fue financiado por la Dirección de Investigaciones de la Universidad Nacional de Colombia, sede Medellín (DIME) – código 20101006745 y agradece a los profesores Uriel Sepúlveda y Víctor Higuera por aportar la mantequilla libre de aditivos, y a los profesores Alfredo Rosas Romero, de la Universidad Simón Bolívar (Venezuela), y Guillermo Schinella, de la Universidad Nacional de la Plata (Argentina), por su apoyo permanente en la temática de antioxidantes.
REFERENCIAS BIBLIOGRÁFICAS
1. Rodríguez A, Lozada V, Larraín MA, Quitral V, Vinagre J, Aubourg, SP. Development of lipid changes related to quality loss during the frozen storage of farmed coho salmon. JAOCS. 2007; 84: 727-734. [ Links ]
2. Nedyalka VY, Emma MM. Stabilisation of edible oils with natural antioxidants. Eur J Lipid Sci. Technol. 2001; 103(11): 752–767. [ Links ]
3. Aubourg, SP, Piñeiro C, González MJ. Quality loss related to rancidity development during frozen storage of horse (Trachurus trachurus). JAOCS. 2004; 81(7): 671-678. [ Links ]
4. Lindenschmidt RC, Trika AF, Guard ME, Witschi HP. The effect of butylated hydroxytoluene on liver and colon tumor development in mice. Toxicology. 1986; 38(2): 151-160. [ Links ]
5. Bush RK, Taylor SL. Adverse reactions to food and drug additives, in allergy: principles and practice. 5ª ed. St. Louis: Mosby; 1998; p.1183. [ Links ]
6. Kahl R, Kappus H. Antioxidantien BHA and BHT im Vergleich mit dem [ Links ]
7. natuerlichen Antioxidans Vitamin E. Z. Lebens-mitt. Unters. Forsch. 1993; 196(4): 329-338. [ Links ]
8. Fabris S, Momo F, Ravagna G, Stevanato R. Antioxidant properties of resveratrol and piceid on lipid peroxidation in micelles and monolamellar liposomes. Biophys. Chem. 2008, 135: 76–83. [ Links ]
9. Dinçer Y, Akçay T, Ilkova H, Alademir Z, Özbay G. DNA damage and antioxidant defense in peripheral leukocytes of patients with Type I diabetes mellitus. Mutat. Res. 2003; 527(1): 49–55. [ Links ]
10. Álvarez MJ, Guarán CY, Belén DR, García-Pantaleón D, Medina CA. Efecto de los extractos de flavonoides de harinas de cáscaras y semillas de pomelos sobre la estabilidad de aceite de soja. Grasas y aceites. 2007; 58 (4): 351-358. [ Links ]
11. Carelli A, Franco I, Crapiste G. Effectiveness of added natural antioxidants in sunflower oil. Grasas y aceites. 2005; 56(4): 303-310. [ Links ]
12. Aeschbach R, Loèliger J, Scott BC, Murcia A, Butler J, Halliwell B, et al. Antioxidant action of thymol, carvacrol, 6-gingerol, zingerone and hydroxytyrosol. Food Chem .Toxicol. 1994; 32(1): 31-36. [ Links ]
13. Lagouri V, Blekas G, Tsimidou M, Kokkini S, Boskou D. Composition and antioxidant activity of essential oils from oregano plants grown in Greece. Z Lebensmitt. Unters. Forsch. 1993; 197(1): 20-23. [ Links ]
14. Castillo-Herrera G, García-Fajardo J, Estarrón-Espinosa M. Extraction method that enriches phenolic content in oregano (Llippia graveolens H.B.K.) Essential oil. Journal of Food Process Engineering. 2007; 30: 661–669. [ Links ]
15. Loziene K, Venskutonis PR, Sipailiene A, Labokas J. Radical scavenging and antibacterial properties of the extracts from different Thymus pulegioides L. Food Chem. 2007; 103: 546–559. [ Links ]
16. Yanishlieva NV, Marinova EM, Gordon MH, Raneva V. Antioxidant activity and mechanism of action of thymol and carvacrol in two lipid systems. Food Chem. 1999; 64(1): 59-66. [ Links ]
17. Rojano, B, Sáez, J, Schinella G, Tournier H, Gaviria C, Gil AM. Comportamiento antioxidante del isoespintanol en diferentes medios. Vitae. 2008; 15(1): 169-177. [ Links ]
18. Rojano B, Sáez J, Schinella G, Quijano J, Vélez E, Gil A, et al. Experimental and theoretical determination of the antioxidant properties of isoespintanol (2-Isopropyl-3,6-dimethoxy-5-methylphenol). J. Mol. Struct. 2008; 877 (1/3): 1-6. [ Links ]
19. Lopez JB, Rojano B, Lasso C, Sánchez I. Evaluación genotóxica y citotóxica del isoespintanol en cultivos de linfocitos humanos. Tercer Congreso Colombiano De Biotecnología - Segundo Seminario Internacional de Bionegocios. Cartagena, 2008. [ Links ]
20. Özkanli O, Kaya A. Storage stability of butter oils produced from sheep's non-pasteurized and pasteurized milk. Food Chem. 2007; 100(3): 1026- 1031. [ Links ]
21. Guzmán-Chozas M, Vicario I, Guillén-Sans R. Spectrophotometric profiles of off-flavor aldehydes by using their reactions with 2-thiobarbituric acid. J. Agric. Food Chem. 1997; 45(7): 2452-2457. [ Links ]
22. Gay C, Collins J, Gebicki J. Hydroperoxide assay with the ferric xylenol orange Complex. Anal. Biochem. 1999; 273(2): 149-155. [ Links ]
23. Mortensen G, Sørensen, J, Stapelfeldt H. Comparison of peroxide value methods used for semi hard cheeses. J. Agric. Food Chem. 2002; 50(18): 5007-5011. [ Links ]
24. Guillén-Sans R, Guzmán-Chozas M. The thiobarbituric acid (TBA) reaction in foods: a review. Crit. Rev. Food Sci. Nutr. 1998; 38(4); 315-330. [ Links ]
25. Jiang ZY, Woollard ACS, Wolff SP. lipid hydroperoxide measurement by oxidation of Fe2+ in the presence of xilenol orange. Comparison with the TBA assay and the iodometric method. Lipids. 1991; 26: 853–856. [ Links ]
26. Nourooz-Zadeh J, Tajaddini-Sadani J, Wolff SP. Measurement of hydroperoxides in edible oils using the ferrous oxidation-xylenol orange assay in conjunction with triphenylphosphine. Anal. Biochem. 1994; 220: 403–409. [ Links ]
27. Nourooz-Zadeh J, Tajaddini-Sadani J, Birlouez-Aragón I, Wolff SP. Measurement of hydroperoxides in edible oils using the ferrous oxidation-xylenol orange assay. J. Agric. Food Chem. 1995; 43: 17–21. [ Links ]
28. Burat KM, Borzkurt O. Improvement of calibration curve for determining peroxide values in food lipids by the modified ferrous oxidation- xylenol orange method. J. AOAC Int. 1996; 79(4): 995–997. [ Links ]
29. Rosas-Romero AJ, Rojano B, Hernández CA, Martínez Manchado C, Silva J, Herrera JC. A novel approach to quantitative structure-activity relationships in antioxidants. CIENCIA. 1999; 7(1): 78-87. [ Links ]
30. Wanasundara U, Shahidi F. Stabilization of canola oil with flavonoids. Food Chem. 1994; 50 (4); 393-396. [ Links ]
31. Wright JS, Johnson ER, di Labio GA. Predicting the activity of phenolic antioxidants: theoretical method, analysis of substituent effects, and application to major families of antioxidants. J. Am. Chem. Soc. 2001; 123(6): 1173-1183. [ Links ]
32. Pekkarrinen SS, Heinonen M, Hopia AI. Flavonoids quercetin, myricetin, kaemferol and (+) catechin as antioxidants in methyl linoleate. J. Sci. Food Agric. 1999; 79(4): 499-506. [ Links ]
33. Siriwardhana N, Jeon YJ. Antioxidative effect of cactus pear fruit (Opuntia ficus-indica) extract on lipid peroxidation inhibition in oils and emulsion model systems. Eur. Food Res. Technol. 2004; 219(4): 369–376. [ Links ]
Recibido: Junio 3 de 2008; Aceptado: Agosto 19 de 2008
* Autor a quien debe dirigir la correspondencia: brojano@unal.edu.co