Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.2 Medellín July/Dec. 2008
FARMACOLOGÍA Y TOXICOLOGÍA
ACTIVIDAD TIPO ANTI-AUSENCIA DEL EXTRACTO METANÓLICO DE Cecropia membranacea Trécul EN RATONES
KIND OF ACTIVITY ANTIABSENCE IN MICE PRODUCED BY THE METHANOLIC EXTRACT FROM Cecropia Membranacea Trécul
Dúmar A. JARAMILLO H.1; Javier RINCÓN V.2; Mario F. GUERRERO P.2*
1 Universidad de los Llanos, Facultad de Ciencias Agropecuarias y Recursos Naturales, Escuela de Ciencias Animales Programa de Medicina Veterinaria y Zootecnia. Villavicencio, Meta. Sede Barcelona, Km 12 vía a Puerto López.
2 Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Farmacia, Bogotá, DC. AK 30 # 45-03, Edif. 450, ofic. 311. AA: 14490.
RESUMEN
En este artículo se describe el efecto anticonvulsivante del extracto obtenido de Cecropia membranacea Trécul (Urticaceae, N.V: “yarumo”), especie utilizada en Colombia con fines tranquilizantes. El extracto metanólico (0.5 g/kg v.o.), administrado a ratones albinos ICR, ejerce actividad anticonvulsivante (73% de protección) frente a las convulsiones mioclónicas inducidas por pentilentetrazol (PTZ), modelo químico de las crisis de ausencia. También confiere protección significativa frente a las convulsiones inducidas por electroshock (80% de protección), modelo de las crisis tónicas clónicas generalizadas; y ejerce efectos positivos en el parámetro de frecuencia de la prueba de laberinto en cruz elevado, modelo de trastornos de ansiedad (p<0.05). En contraste, carece de efectos significativos en las pruebas de sueño barbitúrico y de nado forzado, sugiriendo ausencia de efectos de tipo hipnótico y antidepresivo. En el análisis fitoquímico se detecta la presencia de taninos, terpenoides y flavonoides. El estudio sugiere que la especie C. membranacea podría ser fuente de sustancias con propiedades anticonvulsivantes y ansiolíticas.
Palabras clave: Cecropia, pentilenetetrazol, electroshock, terpenoides, flavonoides.
ABSTRACT
The methanolic extract obtained from Cecropia membranacea Trécul (0,5 g/kg v.o.) administered to mice albinos ICR, elicits antiseizure activity (73% of protection) in mice exposed to pentilentetrazol (PTZ, 80 mg/kg, sc.), chemical model of absence crisis. Additionally, the extract conferred significant protection against the maximal electroshock seizure, model of tonic clonic seizures and the parameter of frequency in the elevated plus maze test, screening model of anxiety. On the other hand, the extract lacked effect on the pentobarbitone induced sleep test and in the forced swimming test, screening model for antidepressants. Phytochemical preliminary analysis showed presence of tannin, terpenoid and flavonoid metabolites. This study suggests that C. membranacea could be source of substances with anticonvulsant and anxiolitic properties.
Keywords: Cecropia, pentylenetetrazole, electroshock, terpenoids, flavonoids
INTRODUCCIÓN
La epilepsia es un conjunto de trastornos neurológicos potencialmente serios que afectan alrededor de 1-2% de la población, cuya mayor proporción reside en países en vía de desarrollo, especialmente en la población infantil y adulta mayor (1-3). Aunque comprende un amplio tipo de crisis, las que predominan son las “tónicas clónicas generalizadas” y las de “ausencia”. Pese a los avances en el desarrollo de la terapia farmacológica, ésta sigue siendo de carácter sintomático, problema al que se agrega su perfil, nada infrecuente, de efectos adversos. Esto hace necesaria la búsqueda de nuevas alternativas farmacológicas, una de cuyas fuentes la pueden constituir los productos naturales, habida cuenta de su inmensa diversidad química, los avances en las técnicas de su aislamiento e identificación y el aporte que han hecho y siguen haciendo al arsenal terapéutico.
Entre las especies vegetales utilizadas popularmente en Colombia con fines “tranquilizantes” se encuentran varias que, en conjunto, reciben la denominación popular de “yarumo” y que pertenecen al género Cecropia (Urticaceae), muy propio de la región centro y suramericana (4, 5). Una de las más estudiadas por sus efectos sobre el sistema nervioso central, posiblemente de tipo antidepresivo y ansiolítico, es C. glazioui, cuyos principales componentes parecen ser catequinas, con mecanismos de acción posiblemente ligados a la inhibición de monoaminas centrales (6,7). A esta especie también se le han estudiado sus efectos antihipertensivos y broncodilatadores (8-10). C pachystachya, a la que se le han detectado efectos sedantes, es otra de las especies de este género con efectos documentados sobre el sistema nervioso central; posee además efectos cardiotónicos e hipotensores (11, 12). Otras especies estudiadas incluyen a C obtusifolia, por sus propiedades hipoglicemiantes y antiinflamatorias (13 - 15) y C lyratiloba, como fuente de triterpenoides, posiblemente antineoplásicos (16).
Pese a que C membranacea es una especie de alta distribución en Colombia, hasta la fecha no se habían estudiado sus efectos farmacológicos. En este trabajo se muestra su perfil en pruebas de tamizado en ratones albinos que señalan su posible interés como fuente de sustancias anticonvulsivantes y ansiolíticas.
METODOLOGÍA
Preparación del extracto y análisis fitoquímico preliminar:
La recolección de las hojas de Cecropia membranacea Trécul se realizó en la Universidad de los Llanos (Villavicencio, Meta) y se clasificó en el Herbario Nacional Colombiano. Allí se depositaron dos ejemplares bajo los números COL 507233 y 507234. El material vegetal se secó en un horno de aire circulante a 50○C durante 72h y luego se trituró con un molino de discos. El polvo obtenido (1400 g) se sometió a percolación con metanol (98%) hasta agotamiento durante 72 h, luego se filtró y concentró en evaporador rotatorio a una temperatura de 35° C bajo presión reducida hasta retirar completamente el solvente. El extracto obtenido, 379 g (rendimiento: 26%), se destinó a las pruebas biológicas y al análisis fitoquímico preliminar (17).
Animales de experimentación
Se utilizaron ratones albinos ICR machos, suministrados por el bioterio del Departamento de Farmacia, Facultad de Ciencias, UNCSB, con un peso de 25-35 g, mantenidos en condiciones constantes de temperatura (22° ± l C), ciclos de 12 horas luz/oscuridad y consumo de agua y alimento según su libre demanda. Se les dejó en ayuno de cuatro horas el día de la prueba y finalizado cada experimento se les realizó eutanasia por dislocación cervical (18).
Pruebas biológicas
Convulsión inducida por pentilentetrazol (PTZ): se aplicó PTZ (80 mg/kg sc) a ratones que recibieron previamente los tratamientos respectivos (ver adelante diseño experimental) para provocar, en caso de ausencia de protección, convulsiones mioclónicas en cabeza, tronco o extremidades, durante un período de observación de 30 minutos. El criterio para admitir la convulsión fue la aparición de esas sacudidas mioclónicas con duración mayor a cinco segundos (19).
Convulsión inducida por electroshock: previa instilación de una gota de SSN en la córnea, se aplicó una descarga de corriente alterna de 60 Hz, 50 mA y 20 ms vía para provocar convulsiones tónicas clónicas generalizadas en los animales no protegidos. El criterio de protección fue la ausencia de la extensión tónica de los miembros posteriores (19).
Suelo agujereado: como prueba clasificatoria para determinar el nivel basal de exploración de los animales antes de efectuar tanto la prueba del laberinto en cruz elevado como la de nado forzado, se aplicó la prueba de la placa perforada. Para ello se colocó al animal en el centro de una plataforma de acrílico de 50x50 cm, a 10 cm de altura, con 16 orificios equidistantes de dos cm de diámetro. Se registró durante 3 min el número de veces que el ratón introdujo la cabeza en algún agujero hasta por lo menos el nivel de las orejas (20).
Laberinto en cruz elevado (LCE): se utilizó una plataforma de 25 cm de altura, formada por dos brazos abiertos opuestos de 30x5 cm y dos brazos cerrados de 30x5x5 cm, con un área central denominada zona neutra, de 5x5 cm. Se colocó a cada animal en la zona neutra, mirando hacia uno de los brazos cerrados y se observó durante 5 minutos, registrando el número de veces que ingresó a cada una de las zonas y el tiempo de permanencia en éstas (21).
Nado forzado: se colocó a cada animal en el interior de un cilindro de acrílico transparente, de 35 x 24 cm, que contenía agua hasta la altura de 14cm, registrando el tiempo de nado y de inmovilidad durante cinco minutos. Se asumió como inmovilidad el estado en que el animal realizó apenas los movimientos necesarios para mantener la cabeza fuera del agua (22, 23).
Sueño barbitúrico: se administró a cada animal sometido a la prueba, pentobarbital (50 mg/kg, ip) y se registró tanto el tiempo en que tardó en perder el equilibrio (período de latencia) como el tiempo en que tardó en recuperarlo (período de sueño, 24).
Diseño experimental y análisis estadístico
En los experimentos de convulsiones (química y eléctrica) y en los de sueño barbitúrico, se asignaron aleatoriamente ratones albinos ICR a uno de tres tratamientos: extracto, control y patrón. Estos mismos tratamientos se asignaron aleatoriamente en los experimentos de nado forzado y laberinto en cruz, una vez los animales fueron clasificados según su actividad motriz en la prueba de la placa perforada. Se utilizó un tamaño de muestra (n) por tratamiento de 10-12 animales. Los tratamientos se administraron por vía oral una hora antes de cada prueba, en volúmenes de 0,1 ml/10 g de peso (excepto en el caso de diazepam que se administró i.p.). El extracto se administró en la dosis de 0,5 g/kg. El tratamiento control correspondió al vehículo en el que se suspendió el extracto: la mezcla de glicerina, propilenglicol y polisorbato en concentraciones de 10, 10 y 2 % V/V, completando con agua destilada. En cada modelo se utilizaron patrones con demostrada actividad en ellos: clonazepam (0,5 mg/kg), fenitoína sódica (20 mg/kg), diazepam (0,5 mg/kg) e imipramina (15 mg/kg) para PTZ, electroshock, laberinto en cruz y nado forzado respectivamente.
En todas las pruebas, excepto en la de sueño barbitúrico, los datos se expresan en términos de porcentaje con respecto al total. En el caso de la prueba de laberinto en cruz, el 100% del tiempo corresponde a la duración total descontando el transcurrido en la zona neutra.
En los modelos de laberinto en cruz, nado forzado y sueño barbitúrico se efectuó un análisis de varianza de una vía seguido de la prueba Tukey/Kramer. En las pruebas de convulsiones, cuyas respuestas fueron cuantales (protección o convulsión), se aplicó la prueba de Fisher. Se asumió una p<0,05. Los datos se procesaron utilizando los programas de computador Excel® y Open Stat®.
Reactivos y solventes: se utilizaron los siguientes fármacos, reactivos y solventes: metanol, glicerina, propilenglicol 400 (Merck); polisorbato (Tween 80), pentilentetrazol (Sygma); difenilhidantoína (Epamín, Parke Davis); Clonazepam, Diazepam (Rivotril, Valium, Roche), pentobarbital sódico (Pentothal, Abbot).
RESULTADOS
Convulsiones por PTZ
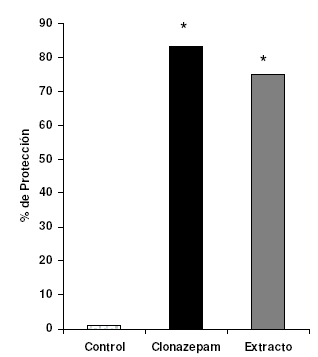
El extracto de C. membranacea confirió una protección del 73%, comparable estadísticamente a la obtenida con el clonazepam (80%), en tanto que la arrojada por el control fue nula.
Figura 1. Porcentaje de protección del extracto metanólico de C. membranacea (0,5 g/kg, v.o.) y clonazepam (0,5 mg/kg, v.o.) en la prueba de convulsión química inducida por PTZ (80 mg/kg, sc) en ratones albinos ICR; *p<0,05 respecto al control.
Convulsiones por electroshock
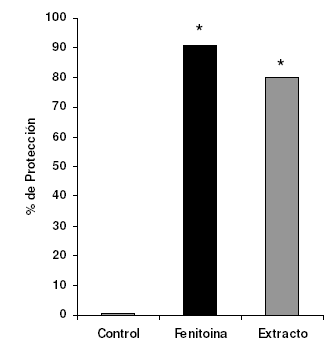
De modo similar, en la prueba de electroshock C. membranacea confirió protección del 80%, ligeramente inferior a la observada con el patrón, fenitoína sódica, que fue del 91% mientras que el control careció totalmente de efecto protector.
Figura 2. Porcentaje de protección del extracto metanólico de C. membranacea (0,5 g/kg, v.o.) y fenitoína sódica (20 mg/kg, v.o.) en la prueba de convulsión inducida por electroshock en ratones albinos ICR; *p<0,05 respecto al control.
Prueba de laberinto en cruz elevado
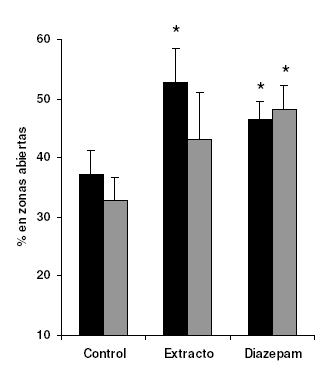
El extracto ejerció efectos significativos (53 ± 6%), en el parámetro de porcentaje de frecuencia de acceso a las zonas abiertas, superiores incluso a los observados con el patrón, diazepam (47 ± 3%). En el parámetro de tiempo de acceso a esas zonas se observó efecto significativo con diazepam, mas no con el extracto (48 ± 4% y 43 ± 8% respectivamente). El control arrojó respuestas de 37 ± 4% y 33 ± 4% en las variables de frecuencia y tiempo respectivamente.
Figura 3. Efecto del extracto metanólico de C. membranacea (0,5 g/kg, v.o.) y diazepam (0,5 mg/kg, i.p.) en el porcentaje de tiempo (barras negras) y de frecuencia (barras grises) de ingreso a las zonas abiertas en la prueba de laberinto en cruz elevado de ratones albinos ICR, *p<0,05 con respecto al control.
Prueba de nado forzado
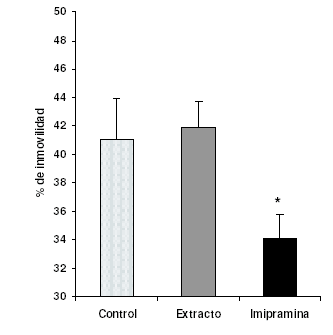
Sólo el patrón, imipramina, ejerció efectos positivos, arrojando porcentajes de tiempos de inmovilidad de 34 ± 2% (209 ± 9 s), frente a 42 ± 2% (209 ± 9% s) del extracto y 41 ± 3% (206 ± 14 s) del control.
Figura 4. Efecto del extracto metanólico de C. membranacea (0,5 g/kg, v.o.) e imipramina (15 mg/kg, v.o.) en el porcentaje de tiempo de inmovilidad en la prueba de nado aplicada a ratones albinos ICR, *p<0,05 con respecto al control.
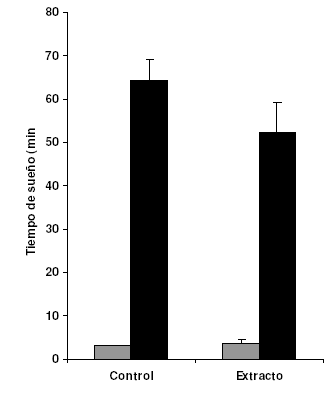
Prueba de sueño barbitúrico
El extracto de C. membranacea no modificó significativamente ni el tiempo de latencia (3,4 ± 1 min) ni el tiempo total de sueño (52 ± 7 min) con respecto al control (3,2 ± 0 min y 64 ± 5 min respectivamente).
Figura 5. Efecto del extracto metanólico de C. membranacea (0,5 g/kg, v.o.) en el tiempo de latencia (barras grises) y tiempo total de sueño (barras negras) en la prueba de potenciación de sueño inducido por pentobarbital (50 mg/kg, i.p.) aplicada a ratones albinos ICR.
DISCUSIÓN
Los resultados de este estudio sugieren que, en una primera aproximación a las posibles propiedades farmacológicas inducidas por C. membranacea sobre el sistema nervioso central, el extracto ejercería efectos de tipo anticonvulsivante y ansiolítico según las pruebas de PTZ, electroshock y laberinto en cruz, a la vez que carecería de efectos de tipo antidepresivo e hipnótico, según las pruebas de nado forzado y potenciación de sueño barbitúrico.
En vista de la protección conferida en el modelo de convulsiones inducidas por PTZ, esta especie surge entonces como una fuente posible de compuestos con actividad frente a las crisis de ausencia, un tipo particular de trastorno epiléptico generalizado especialmente frecuente en población pediátrica. Los compuestos activos de C. membranacea ejercerían efectos en favor del restablecimiento del equilibrio sináptico entre circuitos excitatorios e inhibitorios que se altera en las crisis de ausencia y que son reproducidos de cierta manera con PTZ. Para apoyar esa efectividad, pruebas posteriores tendrían que mostrar que esa protección se presenta no sólo por su capacidad para evitar las convulsiones por PTZ sino también por evitar las alteraciones electroencefalográficas propias de las crisis de ausencia. En efecto, existe una buena correlación farmacológica y electroencefalográfica entre PTZ y la crisis de ausencia. Farmacológica, porque las sustancias efectivas para prevenir la convulsión por PTZ suelen ser efectivas en clínica para el control de este tipo de crisis (25, 26). Electroencefalográfica, porque el patrón tan característico de esta alteración: la espiga onda lenta, es reproducido por PTZ (27). Parece ser que este agente facilita la apertura del canal Cl- del recetor GABAA (28). De ahí que los agonistas de este receptor, como las benzodiacepinas, sean útiles en este trastorno. Es posible que la despolarización neuronal inducida por PTZ lleve a la apertura de canales de Ca+2T, en particular en el tálamo anterior, generando las sacudidas tan particulares de las crisis de ausencia (29, 30). Dado que el canal de Ca+2T se activa por el receptor GABAB, el efecto de PTZ conduciría a un desbalance entre los efectos mutuamente antagónicos de los receptores GABAA y GABAB a favor de éste en el tálamo. Precisamente, ácido valproico y etosuximida, comparten mecanismos antagonistas de ese tipo de canal de calcio y son efectivos en el manejo farmacológico de pacientes con ese trastorno (26, 31). Por tanto, es necesario examinar si este tipo de interacciones se presentan en los principios activos de C. membranacea, además de posibles mecanismos gabaérgicos. Infortunadamente, PTZ tiene limitantes de sensibilidad y especificidad como modelo de crisis de ausencia. Lamotrigina, por ejemplo, no previene las convulsiones inducidas por PTZ, no obstante lo cual es útil en el manejo de las crisis de ausencia (32). Fenobarbital, por otro lado, que actúa sobre el sitio específico de barbitúricos en el receptor GABAA no es efectivo en las crisis de ausencia (33). Esto hace necesario evaluar el extracto y/o los principios activos de C. membranacea en otros modelos de ausencia, entre ellos la utilización de γ-hidroxibutirato (26).
En vista de la protección conferida por C. membranacea también en el modelo de convulsión por electroshock, su espectro se ampliaría hasta cubrir las crisis tónicas clónicas generalizadas. Fármacos que bloquean canales de sodio, como carbamazepina y fenitoína, son efectivas en este modelo pero inefectivas frente a PTZ (26) por lo que luce improbable que los principios activos de C. membranacea actúen a través de este mecanismo. Los antagonistas del receptor de glutamato también son efectivos en el modelo de electroshock, especialmente los de tipo ionotrópico (34). Uno de los ejemplos más notables es felbamato, que bloquea el receptor de NMDA, efectivo también frente a PTZ (35). Cabría considerar esa posibilidad en el caso de C. membranacea. De ser ese el caso, a esta especie se le abrirían perspectivas en el campo de la neuroprotección (36).
Los agonistas directos del receptor GABAA, como benzodiacepinas y barbitúricos, así como ácido valproico también confieren protección en estos dos modelos de convulsión (37) por lo que el estudio farmacodinámico de los principios activos de C. membranacea a acometer subraya la necesidad de explorar mecanismos gabaérgicos y corrientes de calcio de bajo umbral (Ca+2T).
Es interesante, además, observar que el extracto de C. membranacea confiera protección en el modelo de laberinto en cruz elevado, posiblemente la prueba más utilizada para detectar sustancias con posible actividad ansiolítica. Cotejando los resultados con los obtenidos en las pruebas anteriores, esto sugiere que desde el punto de vista farmacodinámico, C. membranacea ejercería mecanismos gabaérgicos, posiblemente de tipo benzodiacepínico o antiglutamato, en vista de la excelente sensibilidad de la prueba para este tipo de sustancias, a diferencia de aquellos compuestos ansiolíticos que modulan la actividad de circuitos serotoninérgicos o péptidos centrales (38). Hay que destacar, además, que al menos bajo el esquema de administración de dosis única, C. membranacea carece de efectos en la prueba de nado forzado, perfil que recuerda el comportamiento de benzodiacepinas y ácido valproico (39, 40).
Otro punto de interés es el hecho de que C. membranacea no parecería ejercer efectos sedantes, a juzgar por los resultados de la prueba de sueño barbitúrico. En ello diferiría de compuestos tipo benzodiacepinas, que son activas frente a los modelos de convulsión por electroshock, pentilentetrazol, laberinto en cruz e inactivas en el modelo de nado forzado, pero ejercen importantes efectos sedantes, característica de los agonistas directos del receptor GABAA, hecho por demás demostrado en la prueba de sueño barbitúrico (41). De ahí que quepa plantear dudas acerca de si los mecanismos de acción de los principios de C. membranacea están vinculados con la activación del sitio benzodiacepínico. No obstante, no se descartaría que C. membranacea ejerza algún tipo de selectividad sobre el subtipo de receptor GABAA, v.gr., sobre el subtipo α2, ligado a la protección anticonvulsivante y actividad ansiolítica, más que sobre el α1 ligado al efecto sedante (42).
La marcha fitoquímica del extracto de C. membranacea arrojó la presencia de taninos, terpenoides y flavonoides, metabolitos que se han identificado en especies con efectos anticonvulsivantes (43-45). Cabe destacar a rutina, como flavonoide con propiedades anticonvulsivantes cuando se administra vía icv, debido posiblemente a la activación alostérica del receptor GABAA (46). Estos resultados, por lo tanto, apuntan a la consideración de C. membranacea como una fuente potencial de origen natural de sustancias con actividad anticonvulsivante y ansiolítica y ayudan a dar soporte a su uso etnobotánico.
REFERENCIAS BIBLIOGRÁFICAS
1. Sander JW. The epidemiology of epilepsy revisited. Curr Opin Neurol 2003; 16: 165-70. [ Links ]
2. Takeuchi Y, Guevara JG. Prevalencia de las enfermedades neurológicas en el Valle del Cauca - Estudio Neuroepidemiológico Nacional (EPINEURO). Colomb. Med..1999; 30: 74-81. [ Links ]
3. Gómez J, Arciniégas E. Prevalence of epilepsy in Bogotá, Colombia. Neurology 1978; 28: 90-4. [ Links ]
4. Correa J, Bernal H. Especies vegetales promisorias de los países del Convenio Andrés Bello. Bogotá: Guadalupe; 1995 (11). p. 401. [ Links ]
5. García H. Flora medicinal de Colombia. Bogotá: Tercer Mundo; 1992 (3), p. 254-63. [ Links ]
6. Rocha FF, Lima MTR, Souccar C, Tanae MM, De Lima TCM, Lapa AJ. Antidepressant-like effect of Cecropia glazioui Sneth and its constituents - in vivo and in vitro characterization of the underlying mechanism. Phytomedicine 2007; 14: 396-402. [ Links ]
7. Rocha FF, Lapa AJ, De Lima TCM. Evaluation of the anxiolytic-like effects of Cecropia glazioui Sneth in mice. Pharmacol. Biochem. Behav. 2002; 71: 183- 190. [ Links ]
8. Lima MT, Borges AC, Cysneiros RM, De Lima TC, Souccar C, Lapa AJ. Antihypertensive effect of a standardized aqueous extract of Cecropia glaziovii Sneth in rats: an in vivo approach to the hypotensive mechanism. Phytomedicine 2007; 14: 314-20. [ Links ]
9. Ninahuaman MF, Souccar C, Lapa AJ, Lima MT. ACE activity during the hypotension produced by standardized aqueous extract of Cecropia glaziovii Sneth: a comparative study to captopril effects in rats. Phytomedicine 2007; 14: 321-7. [ Links ]
10. Delarcina S, Lima MT, Souccar C, Cysneiros RM, Tanae MM, Lapa AJ. Inhibition of histamine-induced bronchospasm in guinea pigs treated with Cecropia glaziovi Sneth and correlation with the in vitro activity in tracheal muscles. Phytomedicine 2007; 14: 328-32. [ Links ]
11. Consolini AE, Ragone MI, Migliori GN, Conforti P, Volonté MG. Cardiotonic and sedative effects of Cecropia pachystachya Mart. (ambay) on isolated rat hearts and conscious mice. J. Ethnopharmacol. 2006; 106: 90-96. [ Links ]
12. Consolini AE, Migliori GN. Cardiovascular effects of the South American medicinal plant Cecropia pachystachya (ambay) on rats. J. Ethnopharmacol. 2005; 96: 417-22. [ Links ]
13. Pérez G, Herrera MD, Ortiz R, Álvarez M, Fernández MA. A pharmacological study of Cecropia obtusifolia Bertol aqueous extract. J. Ethnopharmacol. 2001; 76: 279-84. [ Links ]
14. Andrade A, Wiedenfeld H. Hypoglycemic effect of Cecropia obtusifolia on streptozotocin diabetic rats. J. Ethnopharmacol. 2001; 78: 145-9. [ Links ]
15. Herrera A, Aguilar L, García B, Nicasio P, Tortoriello J. Clinical trial of Cecropia obtusifolia and Marrubium vulgare leaf extracts on blood glucose and serum lipids in type 2 diabetics. Phytomedicine 2004; 11: 561-6. [ Links ]
16. Rocha G, Simões M, Lúcio KA, Oliveira RR, Coelho MA, Gattass CR. Natural triterpenoids from Cecropia lyratiloba are cytotoxic to both sensitive and multidrug resistant leukemia cell lines. Bioorg. Med. Chem. 2007; 15(23):7355-60. [ Links ]
17. Sanabria A. Análisis Fitoquímico Preliminar. Bogotá: Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Farmacia; 1983. [ Links ]
18. Van-Zutphen LFM, Baumans V, Beynen AC. Principies of laboratory animal science. Amsterdam: Elsevier; 1993. p. 267-97. [ Links ]
19. Swinyard EA, Woodhead JH. Experimental detection, quantification, and evaluation of anticonvulsants. En: Woodbury DM, Penry JK, Pippenger CE, editors. Antiepileptic drugs. 2ª ed. New York: Raven Press; 1982. p. 111-26. [ Links ]
20. File SE, Pellos S. The effects of triazolobenzodiazepines in two animal tests of anxiety and in the holeboard. Br. J. Pharmacol. 1985; 86: 729-35. [ Links ]
21. Lister RG. Ethologically-based animal models of anxiety disorders. Pharmacol. Ther. 1990; 46: 321-40. [ Links ]
22. Porsolt RD, Bertini A, Jaipe M. Behavioral despair in mice: a preliminary screening test for antidepressants. Arch. Int. Pharmacodyn. 1977; 229: 327-336. [ Links ]
23. Lapa AJ, Souccar C, Lima MT, Monteiro TC. Métodos de evaluación de la actividad farmacológica de plantas medicinales. Sao Paulo/Florianópolis: Cyted/Rivaplamed; 2002. p. 83. [ Links ]
24. Carlini EA, Contar JDP, Silva Filho AR, Da Silveira NG, Frochtengarten ML, Bueno OF. Pharmacology of lemongrass (Cymbopogon citratus Stapf) I. Effects of teas prepared from the leaves on laboratory animals. J. Ethnopharmacol. 1986; 17: 37-64. [ Links ]
25. Kupferberg HJ, Schmutz M. Screening of new compounds and the role of the pharmaceutical industry. En: Engel J Jr, Pedley TA, editores. Epilepsy: a comprehensive textbook. Philadelphia: Lippincott-Raven; 1997. p. 1417-34. [ Links ]
26. Holmes GL, Zhao Q. Choosing the correct antiepileptic drugs: from animal studies to the clinic. Pediatr. Neurol. 2008; 38: 151-162. [ Links ]
27. Mirski MA, Tsai YC, Rossell LA, Thakor NV, Sherman DL. Anterior thalamic mediation of experimental seizures: selective EEG spectral coherence. Epilepsia 2003; 44: 355-65. [ Links ]
28. Huang RQ, Bell CL, Dibas MI, Covey DF, Drewe JA, Dillon GH. Pentylenetetrazole-induced inhibition of recombinant gamma-aminobutyric acid type a (gabaa) receptors: mechanism and site of action. J. Pharmacol. Exp. Ther. 2001; 298: 986-995. [ Links ]
29. Van Luijtelaar G, Wiaderna D, Elants C, ScheenenW. Opposite effects of T- and L-type calcium channels blockers in generalized absence epilepsy. Eur. J. Pharmacol. 2000; 406: 381-389. [ Links ]
30. Mirski MA, Tsai YC, Rossell LA, Thakor NV, Sherman DL. Anterior thalamic mediation of experimental seizures: selective EEG spectral coherence. Epilepsia 2003; 44: 355-65. [ Links ]
31. Frank JE. Pharmacotherapy of epilepsy: new armamentarium, new issues. J. Clin. Neurosci. 2007; 14: 813-823. [ Links ]
32. Frank LM, Enlow T, Holmes GL, Manasco P, Concannon S, Chen C, et al. Lamictal (lamotrigine) monotherapy for typical absence seizure in children. Epilepsia 1999, 40: 973-979. [ Links ]
33. Smith M, Wilcox KS, White HS. Discovery of antiepileptic drugs. Neurotherapeutics 2007; 4: 12-17. [ Links ]
34. Barton ME, Peters SC, Shannon HE. Comparison of the effect of glutamate receptor modulators in the 6 Hz and maximal electroshock seizure models. Epilepsy Res. 2003; 56: 17-26. [ Links ]
35. White HS, Johnson M, Wolf HH, Kupferberg HJ. The early identification of anticonvulsant activity: role of the maximal electroshock and subcutaneous pentylenetetrazol seizure models. Ital. J. Neurol. Sci. 1995; 16: 73-77. [ Links ]
36. Li X, Ketter TA, Frye MA. Synaptic, intracellular, and neuroprotective mechanisms of anticonvulsants: are they relevant for the treatment and course of bipolar disorders? J. Affect Disord. 2002; 69: 1-14. [ Links ]
37. Barton ME, Klein BD, Wolf HH, White HS. Pharmacological characterization of the 6 Hz psychomotor. Seizure model of partial epilepsy. Epilepsy Res. 2001; 47: 217-227. [ Links ]
38. Carobrez AP, Bertoglio LJ. Ethological and temporal analyses of anxiety-like behavior: The elevated plus-maze model 20 years on. Neurosci. Biobehav. Rev. 2005; 29: 1193-1205. [ Links ]
39. Cryan JF, Valentino RJ, Lucki I. Assessing substrates underlying the behavioral effects of antidepressants using the modified rat forced swimming test. Neurosci. Biobehav. Rev. 2005; 29: 547-569. [ Links ]
40. Bourina M, Prica C. The role of mood stabilisers in the treatment of the depressive facet of bipolar disorders. Neurosci. Biobehav. Rev. 2007; 31: 963-975. [ Links ]
41. Matsumoto K, Kohno SI, Ojima K, Watanabe H. Flumazenil but not FG7142 reverses the decrease in pentobarbital sleep caused by activation of central noradrenergic systems in mice. Brain Res. 1997; 754: 325-328. [ Links ]
42. Bateson AN. The benzodiazepine site of the GABAA receptor: an old target with new potential? Sleep Med. 2004; 5 Suppl 1: S9-S15. [ Links ]
43. Amabeoku GJ, Green I, Kabatende J. Anticonvulsant activity of Cotyledon orbiculata L. (Crassulaceae) leaf extract in mice. J. Ethnopharmacol. 2007; 112: 101-107. [ Links ]
44. Sayyah M, Mandgary A, Kamalinejad M. Evaluation of the anticonvulsant activity of the seed acetone extract of Ferula gummosa Boiss against seizures induced by pentylenetetrazole and electroconvulsive shock in mice. J. Ethnopharmacol. 2002; 82: 105-109. [ Links ]
45. Dos Santos JG. Blanco MM, do Monte FH, Russi M, Lanziotti VM, Leal LK et al. Sedative and anticonvulsant effects of hydroalcoholic extract of Equisetum arvense. Fitoterapia 2005; 76: 508-513. [ Links ]
46. Nassiri-Asl M, Shariati-Rad S, Zamansoltani F. Anticonvulsive effects of intracerebroventricular administration of rutin in rats. Prog. Neuropsychopharmacol. Biol. Psychiatry 2008; 32:989-993. [ Links ]
AGRADECIMIENTOS
Los autores agradecen el apoyo de: Proyecto “X-8 CYTED, Vicerrectoría de Investigación de la Universidad Nacional y Grupo Búsqueda de Principios Bioactivos en Plantas.
Recibido: Mayo 3 de 2008; Aceptado: Julio 22 de 2008
* Autor a quien debe dirigir la correspondencia: mfguerrerop@unal.edu.co