Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.15 no.2 Medellín July/Dec. 2008
PRODUCTOS NATURALES
EVALUACIÓN DE LA ACTIVIDAD BIOLÓGICA DE EXTRACTOS DE Crotalaria Juncea MEDIANTE EL MODELO Drosophila melanogaster
EVALUATION OF BIOLOGICAL ACTIVITY OF Crotalaria Juncea EXTRACTS THROUGH A Drosophila melanogaster MODEL
Giann C. PEÑALOZA A.1; Carlos A. PELÁEZ J.1*
1 Grupo Interdisciplinario de estudios Moleculares (GIEM). Facultad de Ciencias Exactas y Naturales, Instituto de Química, Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
RESUMEN
El crecimiento desmesurado de la población mundial ha presionado a la búsqueda de métodos para el control de plagas, de modo tal que sea posible una producción racional y sostenida de alimentos, y adicionalmente, se garantice la conservación de los ecosistemas. Con el modelo biológico Drosophila melanogaster es posible evaluar la actividad de extractos de diferente polaridad obtenidos a partir de Crotalaria juncea (Fabaceae). El modelo facilita la identificación y purificación de las fracciones activas, y permite establecer que dichos extractos ejercen dos tipos de actividad inhibitoria sobre su ciclo de vida. La primera,se manifiesta con la disminución del número de adultos en los tratamientos frente al control; y la segunda, causa la inhibición de los estadios larvarios del modelo, lo cual se manifiesta en una disminución en el número de pupas. Con el uso de ensayos biodirigidos y de técnicas espectroscópicas de resonancia magnética nuclear (RMN), se establece la estructura de un principio activo que causa los dos tipos de inhibición sobre el modelo, un alcaloide pirrolizidínico del tipo retronécico, conocido como Junceína. El uso del modelo biológico como herramienta analítica cuantitativa, permite establecer la correlación de las variables dosis y respuesta.
Palabras Clave: Crotalaria, juncea, Drosophila melanogaster, modelos biológicos
ABSTRACT
The disproportionate growth of world population has led the search methods to control pests that permit a rational and sustained production of food, which additionally ensure the conservation of ecosystems. The activity of extracts with different polarity obtained from C. juncea was evaluated using the biological model of Drosophila melanogaster. This model allows the identification and purification of active fractions, and allows establishing that these extracts exert two different inhibitory activities over the life cycle of Drosophila melanogaster. The first activity showed the reduction in the number of adults compared with the control group. The second activity caused the inhibition of the larval estate then it resulted in diminution of the pupal number. The use of the biological assay and spectroscopy techniques as Nuclear Magnetic Resonance, allowed the establishment that the structure of active principle of Crotalaria juncea is in agreement with a pyrrolizidinic alkaloid of retronecic type well known as Junceine. The use of biological model as quantitative analytical tool, allows the establishment of correlation between dosage and response variables.
Keywords: Crotalaria, juncea, Drosophila melanogaster, biological models
INTRODUCCIÓN
El género Crotalaria pertenece a la familia Leguminosae (Fabaceae), tribu Crotalarieae, distribuida en unas 300 especies alrededor del mundo (1). En Colombia se han reportado 19 especies, en su mayoría situadas en zonas cálidas y templadas por debajo de los 2000 m.s.n.m (2). Las especies de Crotalaria, por su condición de leguminosas, tienen un importante valor como forraje, abono verde y fuente de nitrógeno que potencia la aptitud agrícola de los suelos. La fitoquímica de este género ha permitido identificar un buen número de metabolitos secundarios, entre los que se encuentran varios tipos de alcaloides, aminas, flavonoides, coumarinas, lectinas, etc. (3).
Las especies de Crotalaria son consideradas la principal fuente de alcaloides pirrolizidínicos, los cuales son tóxicos para mamíferos (4); en humanos se han reportado actividades toxicológicas causadas por alcaloides pirrolizidínicos insaturados, que están asociadas a mecanismos de bioactivación mediados por Citocromo P450, que en muchos casos producen metabolitos genotóxicos (4, 5, 6, 7). A pesar del reconocido efecto toxicológico atribuido a este tipo de alcaloides, en muchos países, incluyendo a Colombia, algunas especies de Crotalaria son usadas en medicina popular (2). C. juncea es reconocida por contener bajos niveles de alcaloides pirrolizidínicos, contiene Junceina y Tricodesmina (8), se ha demostrado que, al someter el ganado a su consumo por un período de dos meses, no se producen cambios patológicos, lo que sugiere que C. juncea contiene una cantidad de alcaloides suficientemente baja como para utilizar esta planta en alimentación animal (9). Los alcaloides de tipo retronécico, en especial aquellos de tipo diéster macrocíclico, han sido ampliamente estudiados en su aspecto estructural, y evaluados exhaustivamente desde la perspectiva farmacológica (11); sin embargo, no existen informes detallados de análisis que relacionen este tipo de estructuras con una actividad insecticida promisoria.
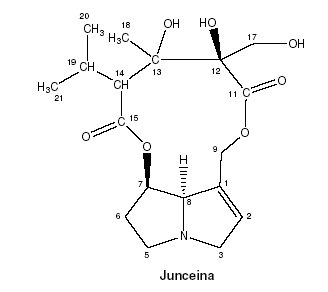
En este trabajo se evalúa la actividad biológica de extractos de diferentes partes vegetativas y reproductivas de Crotalaria juncea utilizando el modelo Drosophila melanogaster como herramienta analítica. El uso del modelo no sólo facilita el análisis cualitativo de la actividad, también permite valorar cuantitativamente los extractos. La combinación de diversas técnicas de RMN acopladas, sumadas al uso del modelo biológico, permite establecer que los desplazamientos químicos y las correlaciones de las señales obtenidas para el metabolito responsable de las actividades biológicas inhibitorias del ciclo de vida del modelo, son equivalentes a las reportadas para el alcaloide junceína, ver figura 1.
Figura 1. Representación estructural del alcaloide junceína.
La numeración utilizada está basada en el Chemical Abstracts Method (11)
MATERIALES Y MÉTODOS
Colonias de Drosophila melanogaster (CEPA CANTON).
Las colonias de moscas genéticamente estables, se obtuvieron del laboratorio del Grupo Interdisciplinario de Estudios Moleculares (GIEM), del Instituto de Química de la Universidad de Antioquia, donde son mantenidas a una temperatura promedio de 23 ºC, con una humedad relativa del 65% y un fotoperíodo de 12 horas (10).
Material vegetal
El material vegetal es suministrado por el CIAT (Centro Internacional de Agricultura Tropical. Palmira, Valle).
Extractos totales
Las diferentes partes vegetativas y las semillas fueron sometidas a un proceso de secado a temperatura ambiente durante 48 horas. Los extractos se obtuvieron con solventes de diferente polaridad, éter de petróleo (fracción 45-60ºC), diclorometano y metanol, en su orden. Para estimar la actividad de los extractos se realizaron bioensayos sobre Drosophila melanogaster usando pruebas de ingestión que permitieron evaluar el ciclo de vida del insecto.
Extracto de alcaloides totales
La purificación del principio activo comienza con la obtención de los extractos de alcaloides totales. Las semillas secas y molidas se humectan con hidróxido de amonio (NH4OH) al 5%; el material alcalinizado se extrae en un Soxhlet, usando como solvente diclorometano; el extracto de diclorometano se somete a sucesivas extracciones ácido/base con HCl e hidróxido de amonio al 5%. El extracto de alcaloides totales se fracciona por cromatografía en columna, utilizándose TLC para comprobar la pureza de las fracciones.
Separaciones Cromatográficas
Los cromatogramas en TLC se realizan sobre placas de sílica gel 60 unida a aluminio (MERCK®5554) y asperjadas con el reactivo de Dragendorff para determinar la presencia de alcaloides. La cromatografía en columna se corrió en columna de vidrio (1.5 cm de ancho X 75 cm de alto) empacada con silica gel 60 (MERCK®. Kieselgel 60G, Art. 7731).
Bioensayo: Interrupción del ciclo de vida
Para evaluar la bioactividad de los extractos, se selecciona un intervalo de concentraciones entre 50 y 10.000 ppm. El ensayo se realiza en viales de vidrio (5 cm de ancho X 10 cm de alto), en los cuales se deposita el volumen de extracto correspondiente a cada concentración y se completa a un volumen final de 15 mL con el alimento (que se prepara con 450 mL de agua, 7.0 g de agar, 50.0 g de harina de maíz, 15.0 g de levadura, 40 mL de melaza y 2.5 mL de ácido propiónico) (10). Los viales se dejan en reposo por 12 horas antes de realizar el cruce de los individuos. En cada vial se depositan tres parejas de individuos jóvenes, de cuatro días de edad. El tiempo de cruce varía con el objeto del análisis. Para realizar el recuento de huevos, las parejas se cruzan por un período de 24 horas, lo que permite tener la mayor oviposición. En el caso de la evaluación del ciclo de vida, los individuos se cruzan por 48 horas.
Identificación de los metabolitos
La identificación del principio activo aislado, se realiza mediante espectrometría de resonancia magnética nuclear, en un equipo marca BRUKER AMX 300, con 300 MHz para 1H y 75 MHz para13 C. Los espectros son tomados en DMSO-d6 a 25 ºC.
RESULTADOS Y DISCUSIÓN
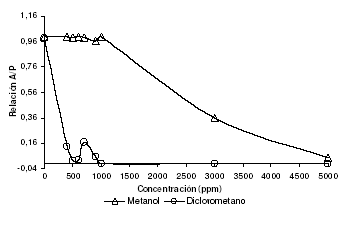
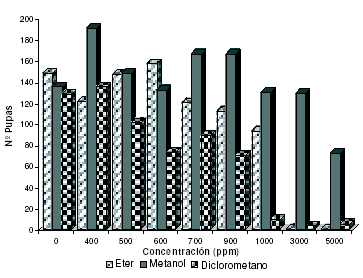
Se evalúa la actividad biológica de extractos de diferente polaridad (éter de petróleo fracción (45-60 ºC), diclorometano y metanol), obtenidos de las semillas de C. juncea y se encuentran dos tipos de actividad inhibitoria del ciclo de vida del modelo biológico, la primera de ellas se manifiesta con la disminución de la Relación Adulto/Pupa (R A/P), que implica la inhibición en la eclosión de las pupas y por tanto evita su paso al estado adulto. Como se observa en la figura 2, la actividad inhibitoria del paso pupa-adulto se ve maximizada con el extracto de polaridad media-baja (diclorometano), ya que al evaluar la relación dosis/respuesta se obtiene que a una concentración de 400 ppm, este extracto causa una inhibición del 87 %.
Para el extracto metanólico también se evidencia la actividad inhibitoria del paso pupa-adulto a una concentración de 3.000 ppm que alcanza el 35.7 %, para concentraciones mas bajas; la relación A/P se mantiene constante y cercana a 1.0. El resultado del análisis biológico del extracto no polar de éter de petróleo, no se muestra, debido a que la actividad inhibitoria del 100 % que se presenta a 3.000 ppm, no se debe a la disminución de la relación A/P; a esta concentración el extracto evita totalmente la aparición de pupas. La inhibición en la aparición de pupas constituye la otra bioactividad de los extractos, que se discutirá mas adelante.
Figura 2. Actividad biológica de extractos “crudos” de semillas de C. juncea obtenidos con solventes de diferente polaridad.
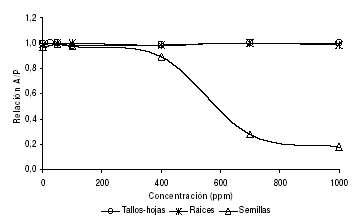
Las demás partes vegetativas de C. juncea (tallos-hojas y raíces) se sometieron a extracción con el solvente de mayor actividad (diclorometano). En la figura 3 se muestra el resultado del análisis de bioactividad, que permitió establecer que el extracto de diclorometano de las partes vegetativas de C. juncea no evidencia actividad biológica sobre D. melanogaster.
Figura 3. Actividad biológica del extracto total de diclorometano de diferentes partes vegetativas de C. juncea
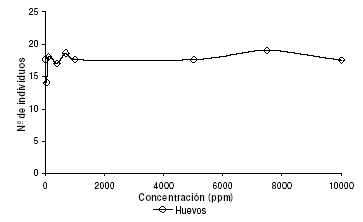
Con el fin de determinar el estadio del modelo biológico en el cual los metabolitos ejercen su actividad inhibitoria, se realizó el recuento de huevos del modelo, pudiéndose determinar que para el intervalo de concentraciones evaluado, el extracto de diclorometano de semillas de C. juncea no presenta actividad inhibitoria en la oviposición ni sobre los estadios larvarios, ya que la Relación Huevo/Pupa (R h/p) es igualmente constante. Los resultados de la prueba se muestran en la figura 4.
En resumen, el análisis de bioactividad permitió determinar que existe actividad insecticida promisoria en los extractos de polaridad media-baja de semillas de C. juncea, manifestada por la interrupción del ciclo de vida de D. melanogaster al interrumpir el paso pupa-adulto del insecto modelo.
Figura 4. Actividad biológica del extracto total de diclorometano de C. juncea sobre la oviposición en el modelo biológico D. melanogaster
Como se mencionó anteriormente, existe otra actividad inhibitoria ejercida sobre los estados inmaduros del modelo D. melanogaster, manifestada con la disminución del número de pupas de los tratamientos con respecto al control, como se aprecia en la figura 5. Este efecto es mas notorio con el extracto de diclorometano, ya que, a una concentración de 1.000 ppm, el número de pupas ha disminuido en un 93 % respecto al control; para el extracto de éter de petróleo (fracción 45-60) a 3.000 ppm la inhibición alcanza el 100%. Con el extracto metanólico no se aprecia una dependencia dosis/respuesta; por lo tanto, para el intervalo de concentraciones evaluado, este extracto no ejerce actividad inhibitoria sobre los estadios inmaduros del modelo.
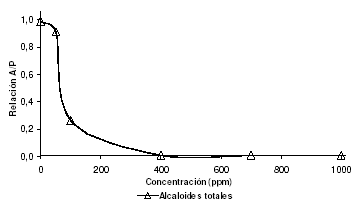
Para aislar e identificar los metabolitos responsables de las actividades observadas, se realizó la extracción de alcaloides totales de semillas de C. juncea. Los resultados del análisis de bioactividad de este extracto se muestran en la figura 6, donde se aprecia que el extracto de alcaloides totales mantiene la actividad inhibitoria sobre el ciclo de vida del modelo biológico al impedir el paso pupa-adulto.
Figura 5. Actividad biológica de extractos “crudos” de C. juncea, obtenidos con solventes de diferente polaridad, sobre los estadios inmaduros del modelo D. melanogaster
Con el extracto de alcaloides totales se observa la potencialización de la actividad inhibitoria, puesto que, a una concentración de 100 ppm el 70% de los individuos no alcanzan el estado adulto, a diferencia del extracto “total” de diclorometano, que a una concentración de 400 ppm presenta una inhibición del 86.7%.
Figura 6. Actividad biológica del extracto de alcaloides totales de semillas de C. juncea, sobre el modelo D. melanogaster
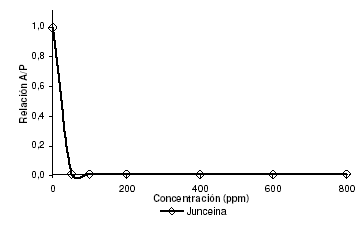
El extracto de alcaloides totales se solubiliza en diclorometano para realizar su separación mediante cromatografía en columna, presentándose un precipitado que se separa por medios físicos, y posteriormente se prueba su actividad biológica. En la tabla 1 se muestran las señales de RMN 1-D 13C, 1-D 1H, que permitieron la asignación estructural de este metabolito. El ensayo de bioactividad no permite establecer correlaciones numéricas entre concentración y actividad, puesto que a 50 ppm la inhibición del paso pupa-adulto ya alcanza el 100 % (ver figura 7); se evidencia, entonces, que la respuesta inhibitoria del modelo es igual para los dos extractos, pero se presenta un aumento significativo de la potencia con la purificación del compuesto.
Figura 7. Actividad biológica del alcaloide junceína purificado de semillas de C. juncea
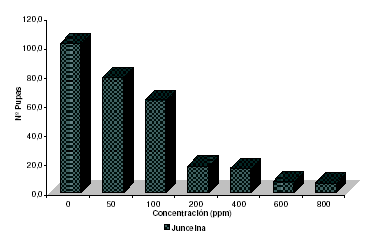
Se puede establecer que, de los compuestos presentes en el extracto de alcaloides totales, el alcaloide junceína, al igual que el extracto “crudo” de diclorometano, presenta las dos actividades inhibitorias del ciclo de vida de D. melanogaster. Como se aprecia en la figura 8, el número de pupas disminuye con el aumento de la concentración del alcaloide junceína. De esta forma el modelo biológico contribuyó al hallazgo de la fracción activa de los extractos de C. juncea.
Figura 8. Actividad biológica del alcaloide Junceina sobre los estadios inmaduros del modelo D. melanogaster
Análisis estructural del metabolito aislado
La asignación de las señales de 1H RMN y de 13C RMN, que se muestran en la tabla 1 y 2 respectivamente, se realizó mediante la combinación de las técnicas: RMN 1-D 13C, 1-D 1H, bidimensionales y la comparación de los desplazamientos químicos para los compuestos evaluados con los reportados en la literatura, muestran una estrecha relación, tal y como se indicó en la figura 1, para la que se empleó la numeración basada en el Chemical Abstracts Method (11).
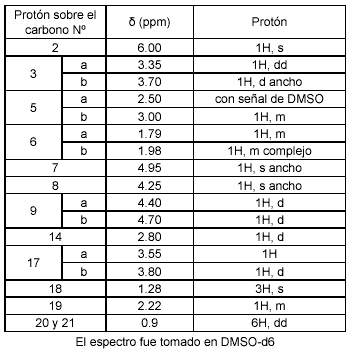
Del espectro 1H RMN cabe destacar las señales de los protones ubicados sobre C9 (9a y 9b), presentan dos señales con forma de dobletes con desplazamientos químicos de 4.4 y 4.7 ppm respectivamente. Estos desplazamientos químicos indican que esta posición de la base necina se encuentra esterificada.
Tabla 1. Señales 1H RMN para el alcaloide junceína
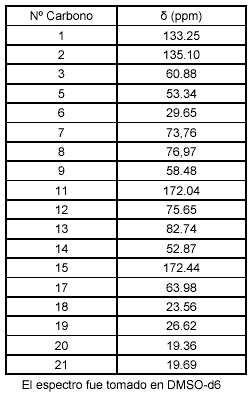
La separación (∆H−9) de 0.3 ppm entre estas dos señales es consecuente con el tamaño del macrociclo diéster propuesto para este metabolito, anillo macrocíclico de once (11) miembros (12, 13). El espectro de 13C RMN, cuyos desplazamientos químicos se muestran en la tabla 2, confirma la presencia de 18 carbonos en la molécula, de los cuales cinco (5) corresponden a carbonos cuaternarios, cinco (5) corresponden a CH2, cinco corresponden a CH, y los tres restantes corresponden a CH3.
Tabla 2. Señales 13C RMN para el alcaloide junceína
De los cinco carbonos cuaternarios, dos corresponden a grupos carbonilo con ambiente químico diferente (C11 y C15), con desplazamiento químicos de 172.04 y 172.44 ppm respectivamente. Los desplazamientos de los carbonos que conforman la base necina son consistentes con los reportados en la literatura, particularmente los que se presentan a campo bajo y que corresponden a las señales para los carbonos C1 y C2 (133.25 y 135.10 ppm respectivamente), confirman la presencia de una insaturación en el anillo pirrolizidínico (14).
De esta forma se concluye que, bajo las condiciones experimentales descritas, el alcaloide de tipo retronécico conocido como junceína ejerce dos tipos de actividades, ambas inhibitorias del ciclo de vida de D. melanogaster. Su uso potencial como insecticida aún es objeto de análisis y estudios.
REFERENCIAS BIBLIOGRÁFICAS
1. Ko HH, Weng JR, Tsao LT, Yen MH, Wang JP, Lin ChN. Anty-inflammatory flavonoids and pterocarpanoid from Crotalaria pallida and C. assamica. Bioorg. Med. Chem. Lett. 2004; 14: 1011-14. [ Links ]
2. Bernal HY. Flora de Colombia. 4. Crotalaria. Santa Fe de Bogotá: Guadalupe; 1986. [ Links ]
3. Wink M, Mohamed GIA. Evolution of chemical defense traits in the leguminosae: mapping of distribution patterns of secondary metabolites on a molecular phylogeny inferred from nucleotide sequences of the rbcL gene. Biochem. System. Ecol. 2003; 31: 897-917. [ Links ]
4. Asres K, Sporer F, Wink M. Patterns of pyrrolizidine alkaloids in 12 ethiopian crotalaria species. Biochem. System. Ecol. 2004; 32: 915-930. [ Links ]
5. Fu PP, Xia Q, Lin G, Chou MW. Genotoxic pyrrolizidine alkaloids- mechanisms leading to DNA adduct formation and tumorigenicity. Int. J. Mol. Sci. 2002; 3: 948-964. [ Links ]
6. Xia Q, Chou MW, Kadlubar FF, Chan P, Fu PP. Human liver microsomal metabolism and ADN adduct formation of the tumorigenic pyrrolizidine alkaloid, Riddelliine. Chem. Res. Toxicol. 2003; 16: 66-73. [ Links ]
7. Couet CE, Hopley J, Hanley AB. Metabolic activation of pyrrolizidine alkaloids by human, rat and avocado microsomes, Toxicon. 1996; 39 (9): 1058-1061. [ Links ]
8. Adams R, Gianturco M. J. Am. Chem. 1956 b; 78: 1919-1921 [ Links ]
9. Srungboonmee KR, Makasame C (1982) Chem. Abstr. 1982; 96. [ Links ]
10. Granados H. et al. In vitro insecticidal activity of the Annona aff. Spraguei seeds (annonaceae) on two biological model of Diptera order. Drosophila melanogaster and Aedes aegypti. Afinidad. 2001; 58: 44-48. [ Links ]
11. Segall JH, Dallas LJ. 1H NMR spectroscopy of pyrrolizidine alkaloids; Phytochem. 1983; 22 (5): 1271-1273. [ Links ]
12. Logie GC, Grue MR, Liddell JR. Proton NMR spectroscopy of pyrrolizidine alkaloids, review article Nº 93. Phytochem. 1994; 37 (1): 43-109. [ Links ]
13. Mattocks AR. Chemistry and toxicology of pyrrolizidine alkaloids. Orlando-(Florida): Academic Press; 1986. [ Links ]
14. Molineux JR, Roitman JN, Benson M, Lundin RE. 13C RMN Spectroscopy of pyrrolizidine alkaloids. Phytochem. 1982; 21 (2): 439-443. [ Links ]
AGRADECIMIENTOS
Los autores agradecen al CIAT por el material vegetal, a la Universidad de Antioquia y al grupo GIEM por la financiación del presente trabajo.
Recibido: Mayo 8 de 2008; Aceptado: Agosto 5 de 2008
* Autor a quien debe dirigir la correspondencia: cpelaez@matematicas.udea.edu.co