Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.1 Medellín Jan./Apr. 2009
BIOTECNOLOGÍA
Transformación microbiana del arilpropanoide cinamaldehido con el hongo fitopatógeno Colletotrichum acutatum
Microbial transformation of arylpropanoid cinnamaldehyde by the phytopathogen fungus Colletotrichum acutatum
Yaned M. CORREA N.1; Diego L. DURANGO R.1; Carlos M. GARCÍA P. 1,*
1Grupo de Química de los Productos Naturales y los Alimentos, Facultad de Ciencias, Escuela de Química, Universidad Nacional de Colombia, Calle 59A No. 63-020 Autopista Norte, A.A. 3840. Medellín, Colombia
RESUMEN
Los hongos fitopatógenos tienen la capacidad de modificar químicamente una amplia variedad de compuestos orgánicos convirtiéndolos en productos estructuralmente relacionados. En el presente trabajo se evalúan las biotransformaciones realizadas por el hongo filamentoso fitopatógeno Colletotrichum acutatum sobre el sustrato arilpropanoide trans-cinamaldehído A, empleando el medio de cultivo líquido Czapeck-Dox. En la biotransformación se obtienen los productos metabólicos alcohol cinamílico B, 3-fenil-1-propanol C, 3-fenil-oxiranometanol D y 1-fenil-1,3-propanodiol E. Los productos de la transformación microbiana se identifican mediante cromatografía de gases acoplada a espectrometría de masas (CG-EM) y resonancia magnética nuclear de protón y carbono (RMN 1H y 13C). Se observa una tendencia del hongo fitopatógeno a producir hidroxilaciones sobre el sustituyente del anillo aromático; asimismo tiene la capacidad de reducir el grupo carbonilo y el doble enlace. En el proceso se generan varios productos metabólicos empleados como materia prima en diferentes industrias. Se discute una posible ruta metabólica para la transformación del sustrato.
Palabras clave: Actividad antifúngica, hidroxilación enzimática, biorreducción, quimioselectividad, regioselectividad, ruta metabólica.
ABSTRACT
Phytopathogenic fungi have the capacity to modify chemically a wide array of organic compounds turning them into structurally related products. In this study, biotransformation of the substrate arylpropanoid trans-cinnamaldehyde A achieved by the phylamentous phytopatogenic fungus Colletotrichum acutatum, is evaluated; the process is carried out in liquid media culture Czapeck-Dox. The biotransformation of the substrate A produces the metabolites cinnamyl alcohol B, 3-phenyl-1-propanol C, 3-phenyl-oxiranemethanol D and 1-phenyl-1,3-propanediol E. The structures of metabolic products are determined by gas chromatography coupled with mass spectrometry (GC-MS) and nuclear magnetic resonance of proton and carbon (1H and 13C NMR). The process is marked by the tendency of the pathogen to produce hydroxylations on the substituent of the aromatic ring. Additionally, it has the capability to reduce the carbonyl group and the double bond. In the process, several metabolic products used like raw materials for different industries are generated. A possible metabolic pathway of the biotransformation of transcinnamaldehyde by C. acutatum is also discussed.
Keywords: Antifungal activity, enzymatic hydroxylation, bioreduction, chemoslectivity, regioselectivity, metabolic pathway.
INTRODUCCIÓN
En la última década ha sido creciente el interés en en el campo científico e industrial, por los procesos de biotransformación de sustratos orgánicos, debido a la posibilidad de obtener sustancias con valor agregado, como precursores sintéticos y moléculas bioactivas a partir de sustratos económicos, abundantes y disponibles comercialmente (1-4). La importancia del empleo de los sistemas biológicos en la síntesis orgánica radica en las ventajas de esta tecnología comparada con los métodos químicos clásicos. Las reacciones catalizadas por enzimas son frecuentemente más quimio-, regio- y estereoselectivas (5); por esta razón, el uso de los sistemas biológicos en la química ha llegado a ser una alternativa económica para la preparación de compuestos ópticamente activos. La principal aplicación de las biotransformaciones en síntesis orgánica está en la preparación de compuestos enantiopuros, pero también es posible aprovechar las condiciones suaves (temperatura ambiente y presión atmosférica) en las cuales se llevan a cabo estos procesos biotecnológicos, para efectuar transformaciones de grupos funcionales aquirales, evitando condiciones de reacción extremas, que pueden conducir a la formación de productos secundarios (1).
Esta tecnología utiliza condiciones de reacción amigables con el ambiente, ya que las biotransformaciones se realizan principalmente en medios acuosos y los subproductos son biodegradables o reutilizables. Los aspectos mencionados anteriormente contribuyen a la generación de una química verde, de bajo impacto ambiental (6).
Los microorganismos, plantas y organismos superiores poseen la capacidad de realizar modificaciones estructurales sobre los sustratos orgánicos e inorgánicos de origen exógeno, sintético o natural. En los primeros, el grupo de los hongos es muy promisorio y varios géneros de fitopatógenos son reconocidos por su habilidad para modificar compuestos orgánicos; el género Colletotrichum se ha estudiado poco y se conoce que metaboliza fitoalexinas (7) y algunas sustancias xenobióticas (8). Dentro del género, una de las especies más empleada es Glomerella cingulata, teleomorfo de C. gloeosporioides (Penz.) Penz. & Sacc., de alta versatilidad y eficiencia en su capacidad para transformar, de manera regio- y/o estereoselectiva, terpenos, flavonoides y esteroides, entre otros (9). No obstante, muchas especies del género no han sido exploradas aún y se desconoce su potencialidad metabólica.
Desde el punto de vista sintético son muy llamativas las hidroxilaciones y reducciones que pueden realizar los hongos de este género sobre los grupos sustituyentes, saturados o insaturados, de compuestos aromáticos. En un estudio previo realizado por nuestro grupo de trabajo fue reportado que la especie C. acutatum efectúa diversas reacciones sobre los sustituyentes del anillo aromático en los sustratos 2-feniletanol y acetofenona, tales como hidroxilaciones, reducción del grupo carbonilo y esterificación de grupos hidroxilo (10). En el presente artículo se reportan los productos metabólicos resultantes del proceso de biotransformación del arilpropanoide trans-cinamaldehído A con este hongo y se analizan el progreso y la ruta metabólica seguida en el proceso de transformación microbiana.
MATERIALES Y MÉTODOS
Procedimiento experimental general
La cromatografía de capa fina (CCF) se realizó en cromatoplacas de sílica gel 60 F254, de 0.25 mm (Merck), se empleó como fase móvil la mezcla de n-hexano-AcOEt (8:2). Los compuestos se visualizaron bajo radiación UV a 254 y 365 nm, y mediante aspersión con la mezcla de AcOH: H2SO4:H2O (143:28:30), seguido por un calentamiento breve. La CCF preparativa (CCFP) se llevó a cabo empleando cromatoplacas de sílica gel 60 F254, 20x20 cm de 1mm (Merck); en la cromatografía de columna (CC) se emplearon como fases estacionarias sílica gel 60 (0.040-0.063 mm; Merck), y los análisis mediante cromatografía de gases (CG) se realizaron en un cromatógrafo Hewlett-Packard 6890 (Agilent Technologies), acoplado a un detector de masas Agilent MSD 5973, en el modo de ionización electrónica. Se empleó una columna HP-5 (30 m x 0.25 mm x 0.25 μm, Agilent Technologies). Las condiciones cromatográficas fueron las siguientes: temperatura de la columna 50°C, temperatura del inyector 150°C, temperatura del detector 280°C. El programa de temperatura para el horno se realizó con una rampa de calentamiento a razón de 10°C/ min hasta 250°C mantenida durante 6 minutos. El tiempo total del análisis fue de 30 minutos y el gas de arrastre utilizado fue N2 a un flujo de 1 mL/min. La composición relativa de los constituyentes individuales se determinó a partir del área promedio de los picos. Los espectros de masas se obtuvieron por ionización electrónica (EM-IE), mediante cromatografía de gases-espectrometría de masas (CG-EM), en las condiciones citadas previamente; los metabolitos se identificaron por comparación de sus espectros con los reportados en la literatura y en la base de datos NIST02. Los espectros de infrarrojo (IR) se realizaron en un Perkin Elmer Paragon 1000, empleando como solvente cloroformo. Los espectros de RMN de 1H y 13C se determinaron usando CDCl3 en un equipo Bruker AMX 300 con 300.12 MHz para 1H y 75.42 MHz para 13C. Los desplazamientos químicos están expresados como valores de δ (ppm) y las constantes de acoplamiento J en hertz (Hz). La biotransformación se realizó en un agitador orbital tipo shaker (Centricol-serie 0239), con cámara de incubación.
El microorganismo fitopatogénico se obtuvo de frutos comerciales de tomate de árbol, Solanum betaceae (Cyphomandra betacea Cav. (Sendt)), infectados con antracnosis. La identificación se realizó mediante caracterización morfológica y molecular en el Laboratorio de Fitopatología de la Universidad Nacional de Colombia, sede Medellín. Un cultivo monoespórico de Colletotrichum acutatum fue proporcionado gentilmente por dicho Laboratorio. Las cepas se mantuvieron en medio de cultivo sólido PDA (agar papa-dextrosa), a temperatura promedio de 24°C y humedad relativa del 45% al 60%.
Evaluación de la actividad antifúngica del sustrato
Las evaluaciones se llevaron a cabo empleando la metodología de la placa perforada y utilizando los frotis del microorganismo realizados sobre PDA e incubados durante 48 horas. Después de este tiempo se retiraron con un sacabocado de 6 mm de diámetro los correspondientes cilindros, que se utilizaron para inocular nuevas cajas que contenían el medio de cultivo y el trans-cinamaldehído en diferentes concentraciones. El inóculo se depositó en las perforaciones que se habían realizado previamente en estas cajas, con un sacabocado de diámetro idéntico. La actividad antifúngica se determinó midiendo los diámetros de crecimiento micelial cada 24 horas y durante un tiempo de 11 días (264 horas).
Las evaluaciones se realizaron por triplicado; cada ensayo se respaldo con los correspondientes controles (blanco absoluto y blanco de solvente). La actividad antifúngica del trans-cinamaldehído se evaluó como el porcentaje de inhibición: 100 x (diámetro promedio de crecimiento del micelio en el medio de control - diámetro promedio de crecimiento del micelio en el medio del ensayo) / diámetro promedio de crecimiento del micelio en el medio de control. Las evaluaciones se hicieron por triplicado y los resultados del porcentaje de inhibición del crecimiento radial del hongo se expresaron como la media ± la desviación estándar. A partir de las curvas de toxicidad del trans-cinamaldehído contra el patógeno, se determinó la concentración que produjo un porcentaje de inhibición fluctuante entre 40 y 50% al cabo de 6 días (144 horas) de evaluación. Este valor se utilizó como concentración inicial del sustrato en el proceso de biotransformación.
Proceso de biotransformación
En los procesos de biotransformación se utilizó el medio de cultivo líquido Czapeck-Dox, sustituyéndose la glucosa de la formulación original por sacarosa en la misma proporción. Los inóculos de C. acutatum se obtuvieron a partir de los trozos de cultivos esporulados, los cuales se depositaron en 6 erlenmeyers de 1.0 litro, cada uno con 500 mL de medio. Los erlenmeyers inoculados se taponaron con tarugos de algodón estéril y se preincubaron durante 10 días en un agitador orbital tipo shaker a 150 rpm; una vez terminado el periodo de preincubación se retiró la biomasa mediante filtración con un lienzo de nylon estéril y se transfirió a un nuevo medio de cultivo fresco. Sobre este material se adicionó el trans-cinamaldehido disuelto en etanol al 50% v/v. La biotransformación se realizó a 24°C con agitación a 150 rpm durante un periodo de 14 días; en el proceso se procuró que el hongo metabolizara la mayor parte del sustrato.
Aislamiento de los productos de biotransformación B -E
Transcurrido el tiempo de biotransformación, el micelio se separó del medio de cultivo mediante filtración con una malla de nylon; el filtrado obtenido se saturó con NaCl y AcOEt, se filtró sobre un lecho compacto de tierra de diatomeas (Celita 545). La solución obtenida se extrajo con 400 mL de AcOEt (x4); la fase orgánica se reunió y se secó con sulfato de sodio anhidro; posteriormente se filtró y destiló a presión reducida en un rotoevaporador. Una porción del extracto en AcOEt (1400 mg), se refinó mediante CC empleando como fase estacionaria sílica gel y como fase móvil un sistema de polaridad creciente de n-hexano-AcOEt obteniéndose 8 fracciones; la fracción 5 (44 mg) se sometió a CC empleando como fase móvil CHCl3 - AcOEt (80:20) produciéndose 2 fracciones (5a-5b). La subfracción 5b se procesó mediante CCFP con el sistema n-hexano-AcOEt 6:4, obteniéndose 3 mg del compuesto B. De otro lado, la fracción 6 (350 mg) se refinó mediante CC empleando como fase móvil n-hexano-AcOEt (85:15; 80:20; 75:25) produciéndose 5 fracciones (6a-6e); la fracción 6c (95 mg) se procesó mediante sucesivas CC sobre sílica gel utilizando sistemas de polaridad creciente de n-hexano-AcOEt, obteniéndose 16 mg del compuesto E. La fracción 2 (63 mg) se sometió a CC con n-hexano-AcOEt (9:1) obteniéndose 7 mg del compuesto C. Un análisis por CG-EM de una fracción refinada también reveló la presencia de D, cuya estructura se determinó mediante comparación de su EM-IE con el reportado en la base de datos NIST.
Compuesto B: se aisló como un semisólido de olor agradable. Mediante análisis por CG-EM presentó un tiempo de retención, tR = 13.47 min. EM-IE, m/z (% intensidad relativa): 134 [M+] (52), 115 [M-H2O-H]+(63), 105 (49), 103 [C8H7]+ (37), 92 (100), 91 [C7H7]+ (77), 78 (54), 77 [C6H5]+ (50); IR ν max (CHCl3) cm-1: 3300 (-OH), 3020 (=C-H), 2950, 1620 (C=C), 1500 (C=C), 1480, 1050 (C-O), 910, 750. RMN 1H (300 MHz, CDCl3): 7.20-7.40 (m, 5H), 6.50 (d, 1H, J = 16.0 Hz), 6.26 (dt, 1H, J = 6.0, 16.0 Hz), 4.20 (d, 2H, J = 6.0 Hz); RMN 13C (75 MHz, CDCl3): δ 61.6 (C-1), 124.3 (C-2",6"), 125.6 (C-2), 126.4 (C-3",5"), 126.5 (C-4"), 129.0 (C-3), 134.6 (C-1").
Compuesto C: se aisló como un líquido incoloro y viscoso. Mediante análisis CG-EM presentó un tiempo de retención, tR = 11.66 min. EM-IE, m/z (int. rel.) 136 [M+] (21), 118 [M-H2O]+ (54), 117 (88), 91 [C7H7]+ (100), 77 [C6H5]+ (26), 65 (25), 51 (17); IR ν max (CHCl3) cm-1 3350 (-OH), 3030 (=C-H), 2980, 1550 (C=C), 1500 (C=C), 1430, 1390, 1100 (C-O), 950. RMN 1H (300 MHz, CDCl3): δ 7.20-7.30 (m, 5H), 3.69 (t, 2H, J = 6.4 Hz), 2.70 (t, 2H, J = 7.7 Hz), 1.85-1.95 (dt, 2H, J = 6.4, 7.7 Hz); RMN 13C (75 MHz, CDCl3): δ 30.1 (C-3), 32.1 (C-2), 59.9 (C-1), 123.8 (C-4"), 126.3 (C-2", 3" ,5" y 6"), 139.9 (C-1").
Compuesto D: Mediante análisis CG-EM presentó un tiempo de retención, tR = 14.61 min. EM-IE, m/z (int. rel.) 134 [M+] (11), 132 [M-H2O]+ (66), 131 (99), 107 [C7H7O]+ (100), 104 (87), 91 (83), 90 (83), 89 (84), 79 (40), 77 [C6H5]+ (58).
Compuesto E: se aisló como un aceite amarillo y viscoso. Mediante análisis CG-EM presentó un tiempo de retención, tR = 16.68 min. EM-IE, m/z (int. rel.) 152 [M+] (43), 134 (19), 133 (30), 107 (100), 105 (42), 78 (16), 77 (45); IR ν max (CHCl3) cm-1 3300 (-OH), 3030 (=C-H), 2980, 1660 (C=C), 1200 (C-O), 1100 (C-O). RMN 1H (300 MHz, CDCl3): δ 7.27-7.31 (m, 5H), 4.95 (dd, 1H, J = 4.0, 8.5 Hz), 3.84 (t, 2H, J = 6.0 Hz), 1.93 - 1.97 (ddt, 2H, J = 4.0, 6.0, 8.5 Hz). RMN 13C (75 MHz, CDCl3): δ 41.1 (C-2), 62.0 (C-3), 74.9 (C-1), 126.3 (C-2", 6"), 128.2 (C-4"), 129.2 (C-3", 5"), 145.0 (C-1").
studios en el curso del tiempo (determinación de la dinámica del proceso de biotransformación)
Durante todo el proceso de biotransformación del trans-cinamaldehído en las condiciones descritas anteriormente, se realizaron muestreos cada 48 horas; en cada uno se retiraron mediante una sonda estéril 50.0 mL de medio de cultivo, que incluía parte del micelio. Este material se combinó con 50.0 mL de etanol al 95% con la finalidad de inhibir el proceso enzimático y detener la biotransformación. Cada una de las muestras se saturó con cloruro de sodio y se extrajo con tres porciones de AcOEt de 50.0 mL cada una. Los extractos se combinaron y secaron con sulfato de sodio anhidro y posteriormente se filtraron y destilaron a presión reducida en un rotoevaporador. Cada extracto en AcOEt, se re-disolvió con 5.0 mL de cloroformo grado analítico, se filtró a través de un microfiltro Whatman (0.45 μm) y se analizó por CCF y CG-EM. La relación entre el sustrato y los productos se determinó con base en el área de los picos en CG; los productos puros que se logró obtener mediante CCFP y CC se utilizaron como patrones de referencia en el análisis de CG-EM e igualmente se emplearon los compuestos puros adquiridos en casas comerciales reconocidas.
RESULTADOS Y DISCUSIÓN
Toxicidad del sustrato hacia C. acutatum
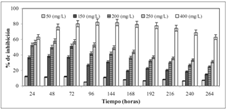
Antes de iniciar el proceso de biotransformación se evaluó la toxicidad del sustrato sobre el microorganismo, se utilizaron diferentes concentraciones y la exposición se prolongó por un periodo de 11 días (264 horas). El sustrato trans-cinamaldehído presentó unaactividad antifúngica moderada contra C.acutatum (Véase figura 1). Entre los días 2 -9 (48-216 horas) de exposición a una concentración de 400 mg/L, la inhibición del crecimiento radial alcanzo un valor aproximado del 80%. Partiendo de la información obtenida en la figura 1, se determinó que la inhibición del crecimiento radial a los 6 días de exposición (144 horas), alcanza los valores del 40-50% a una concentración del sustrato A de 200 mg/L; con esta concentración se llevó a cabo el procedimiento de biotransformación, procurando obtener una actividad enzimática que redundara en un proceso de conversión adecuado del arilpropanoide, por parte del microorganismo.
Figura 1. Actividad antifúngica del trans-cinamaldehído A contra el hongo C. acutatum durante 11 días.
Propiedades físicas y elucidación estructural de los productos de biotransformación
Propiedades físicas y elucidación estructural de los productos de biotransformación La fórmula molecular del compuesto B corresponde a una composición C9H10O determinada a partir de su espectro de masas. Otros datos espectrales indican la presencia de un grupo hidroxilo alílico (δC 61.6; νmax 3300, 1050 cm-1 ) y un doble enlace C-C (δH 6.26 y 6.50; νmax 3020, 1620 cm-1 ). Los espectros de RMN 1H y 13C corresponden con los del alcohol cinamílico; adicionalmente, las características espectroscópicas (EM-IE, RMN 1H y 13C) y el comportamiento cromatográfico (t R) se compararon con las de una muestra auténtica de este alcohol, obtenida en la casa comercial Sigma, observándose una coincidencia perfecta entre ellos. El compuesto C posee una fórmula molecular C9H12O, la cual se dedujo a partir del espectro de masas. A partir de los datos espectroscópicos, se deduce que C posee un grupo hidroxilo primario (δH 3.69; δC 59.9; νmax 3350, 1100 cm-1 ). Las propiedades cromatográficas y espectroscópicas de C, son totalmente concordantes con las de una muestra auténtica de 3-fenil-1-propanol (Sigma).
El espectro de masas para el compuesto D reveló un ion molecular en m/z = 134 um, acorde con la fórmula molecular C9H10O. Adicionalmente, los datos espectrométricos muestran la presencia de un grupo hidroxilo, [M-H2O]+. La estructura del compuesto se determinó por comparación del espectro de masas con los reportados en la base de datos NIST, correspondiendo con el 3-fenil-oxiranometanol.
El compuesto E presentó una fórmula C9H12O2 con base en su EM-IE. A partir de los datos espectroscópicos, se dedujo que E posee un grupo hidroxilo primario (δH 3.84; δC 62.0; νmax 3300, 1100 cm-1 ) y un grupo hidroxilo secundario (δH 4.95; δC 74.9; νmax 3300, 1200 cm-1 ). El análisis de los espectros de RMN 1H y 13C reveló que la estructura del compuesto coincide con la del 1-fenil-1,3-propanodiol.
Experimentos en el curso del tiempo
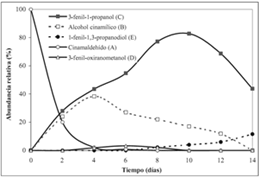
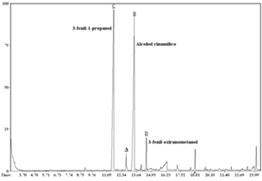
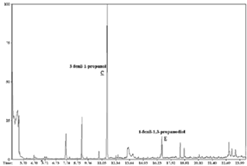
La abundancia relativa de los metabolitos durante el transcurso de la biotransformación se determinó cualitativamente por CCF y cuantitativamente mediante GC (Véase figura 2). En los cromatogramas (Véanse figuras 3 y 4), se aprecia que el sustrato es transformado en dos metabolitos mayoritarios (B y C) y algunos productos minoritarios (D y E, entre otros). Estos compuestos no fueron detectados por análisis mediante CCF y CG a partir de un cultivo de C. acutatum carente de sustrato.
Figura 2. Experimento en el curso del tiempo de la biotransformación de trans-cinamaldehído, A, por el hongo fitopatógeno C. acutatum.
Figura 3. Cromatograma de gases de la muestra colectada en el día 4 de la biotransformación.
Figura 4. Cromatograma de gases de la muestra colectada en el día 14 de la biotransformación.
La conversión del trans-cinnamaldehído por parte de C. acutatum fue rápida; casi todo el sustrato de partida A, aproximadamente el 90%, se consumió durante los 3 primeros días (72 horas). En este período, el sustrato de partida se transformó principalmente en B y C. Para este último producto de biotransformación, la abundancia relativa se incrementó rápidamente hasta alcanzar un valor máximo cercano al 80% a los 9 días (216 horas). El alcohol cinamílico, B, es una materia prima importante para la producción de perfumes, saborizantes, productos farmacéuticos y otros de química fina (11, 12). Este metabolito alcanzó la mayor concentración en el día 4 (96 horas) del proceso de biotransformación para luego disminuir su abundancia relativa; esta reducción coincide con el aumento en la concentración de los metabolitos C y E. El diol E comenzó a formarse a partir del día 6 de la biotransformación, coincidiendo con la reducción del producto metabólico B. El 1-fenil-1,3-propanodiol E es usado en la industria química y farmacéutica como un precursor sintético de varios productos, entre ellos la síntesis de agentes terapéuticos como la fluoxetina, fármaco utilizado como un inhibidor selectivo de la recaptación de serotonina, y comercializado con el nombre de (Prozac®) (13, 14). Actualmente se están adelantando estudios para determinar la estereoquímica de E.
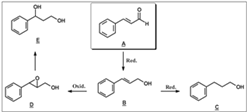
A partir de las estructuras de los productos obtenidos y de los experimentos realizados en el curso del tiempo, se planteó una posible ruta metabólica para la biotransformación del trans-cinamaldehído por el hongo fitopatogénico C. acutatum (Véase figura 5). En el proceso metabólico de A se manifiesta la capacidad del microorganismo para efectuar reacciones de reducción del grupo carbonilo y del doble enlace C-C, para la producción de B y C, respectivamente. Es un hecho interesante la ausencia del compuesto 3-fenilpropanal durante el proceso de biotransformación, el cual resultaría de la hidrogenación del doble enlace C-C del cinamaldehído. Lo anterior parece demostrar que la formación de C debe seguir un proceso secuencial, en el cual inicialmente se hidrogena de forma selectiva el grupo carbonilo de A para producir el alcohol alílico B y posteriormente se reduce el doble enlace C-C para formar C. La formación del alcohol alílico a partir del cinamaldehído, mediante hidrogenación selectiva del grupo carbonilo, utilizando catalizadores convencionales y especializados, es considerada una tarea desafiante, debido a que la hidrogenación del doble enlace C-C es cinética y termodinámicamente más favorable que la hidrogenación del grupo C=O; estos factores reducen ostensiblemente los rendimientos del alcohol cinamílico, que es el producto deseado (15). De esta manera, el uso de un biocatalizador como el hongo C. acutatum puede constituir una alternativa para la producción de alcohol cinamílico a partir de la hidrogenación selectiva de A.
Adicionalmente, se aprecia la formación de los productos de oxidación sobre la posición bencílica D y E. Es posible pensar que en la biotransformación del sustrato, el producto E se considere proveniente de la ruta (A → B → D → E); en esta secuencia, el trans-cinamaldehído A es inicialmente hidrogenado selectivamente para formar el alcohol cinamílico B, que a través de una oxidación conduce a la formación del epóxido D. De acuerdo a la información obtenida, el metabolito D es transitorio, ya que solo es detectado en proporciones bajas; la apertura reductiva del epóxido conduce a la formación del 1-fenil-1,3-propanodiol. La presencia del grupo hidroxilo en posición bencílica del diol E, demuestra la preferencia de la orientación en la apertura del sistema oxirano.
Figura 5. Posible ruta metabólica de A por C. acutatum
CONCLUSIONES
De la biotransformación del sustrato trans-cinamaldehído A con el hongo C. acutatum, se identificaron mediante una combinación de RMN 1H y 13C, EM-IE y por comparación con los datos cromatográficos y espectrales obtenidos para muestras auténticas, los metabolitos alcohol cinamílico B, 3-fenil-1-propanol C, 3-fenil-oxiranometanol D y 1-fenil-1,3-propanodiol E. Los resultados sugieren que el hongo fitopatógeno C. acutatum tiene la capacidad de modificar el sustrato mediante reacciones de reducción del grupo carbonilo (A → B) y el doble enlace C-C (B → C). Adicionalmente, C. acutatum hidroxila la posición bencílica para generar el diol E, posiblemente como resultado de una apertura reductiva regioselectiva. Esta versatilidad para efectuar conversiones por parte del microorganismo, puede ser aprovechada en la síntesis orgánica para la obtención de productos más especializados.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, Sede Medellín y a la Dirección Nacional de Investigación, por el apoyo para la realización de este trabajo (Proyecto Convocatoria Nacional de Investigación 2008 - Modalidad 6 “Apoyo a Tesis de Programas de Posgrado, Código Académico 7183).
REFERENCIAS BIBLIOGRÁFICAS
1. Luna H. Aplicación de la biocatálisis a la preparación de intermediarios para la síntesis de fármacos. J Mex Chem Soc. 2004; 48 (003): 211-219. [ Links ]
2. Leresche JE, Meyer HP. Chemocatalysis and biocatalysis (biotransformation): some thoughts of a chemist and of a biotechnologist. Org Process Res Dev. 2006; 10 (3): 572-580. [ Links ]
3. Lehman LR, Stewart JD. Filamentous fungi: potentially useful catalysts for the biohydroxylations of non-activated carbon centers. Curr Org Chem. 2001; 5 (4): 439-470. [ Links ]
4. Tao J, Xu JH. Biocatalysis in development of green pharmaceutical processes. Curr Opin Chem Biol. 2009; 13 (1): artículo en prensa. doi:10.1016/j.cbpa.2009.01.018/. [ Links ]
5. Woodley JM. New opportunities for biocatalysis: making pharmaceutical processes greener. Trends Biotechnol 2008; 26 (6): 321-327. [ Links ]
6. Ran N, Zhao L, Chen Z, Tao J. Recent applications of biocatalysis in developing green chemistry for chemical synthesis at the industrial scale. Green Chem 2008; 10 (4): 361-372. [ Links ]
7. Soby S, Caldera S, Bates R, Van Etten H. Detoxification of the phytoalexins maackiain and medicarpin by fungal pathogens of alfalfa. Phytochemistry. 1996; 41 (3): 759-765. [ Links ]
8. Vroumsia T, Steiman R, Seigle-Murandi F, Benoit-Guyod JL. Fungal bioconversion of 2,4-dichlorophenoxyacetic acid (2,4-D) and 2,4-dichlorophenol (2,4-DCP). Chemosphere. 2005; 60 (10): 1471-1480. [ Links ]
9. García-Pajón CM, Hernández-Galán R, Collado IG. Biotransformations by Colletotrichum species. Tetrahedron: Asymmetry. 2003; 14 (10): 1229-1239. [ Links ]
10. Aristizabal DA, Lezcano CS, García CM, Durango DL. Biotransformación de los sustratos 2-feniletanol y acetofenona con el hongo fitopatógeno Colletotrichum acutatum. Rev Col Quím. 2008; 37 (1): 7-19. [ Links ]
11. Li Y, Zhu PF, Zhou RX. Selective hydrogenation of cinnamaldehyde to cinnamyl alcohol with carbon nanotubes supported Pt-Co catalysts. Appl Surf Sci. 2008; 254 (9): 2609-2614. [ Links ]
12. Mäki-Arvela P, Hájek J, Salmi T, Murzin DY. Chemoselective hydrogenation of carbonyl compounds over heterogeneous catalysts, (review). Appl Catal A: Gen. 2005; 292 (1): 1-49. [ Links ]
13. Kira I, Suzuki T, Onishi N, Watanabe K, Nakanishi E. Microbial production of (S)-1-phenyl-1,3-propanediol by stereospecific reduction of 3-hydroxy-1-phenylpropane-1-one. J Mol Catal B: Enzym. 2008; Artículo en prensa. doi:10.1016/ j.molcatb.2008.05.013. [ Links ]
14. Fátima A, Lapis AA, Pilli R. A concise total synthesis of (R)-Fluoxetine, a potent and selective serotonin reuptake inhibitor. Rev Soc Quím Mex. 2005; 49 (002): 257-261. [ Links ]
15. Baeza BB,Ramos IR, Ruiz AG. Influence of Mg and Ce addition to ruthenium based catalysts used in the selective hydrogenation of a,b-unsaturated aldehydes. Appl Catal A: Gen. 2001; 205 (1-2): 227-237. [ Links ]
Recibido: Diciembre 3 de 2008.
Aceptado: Marzo 24 de 2009.
* Autor a quien se debe dirigir la correspondencia: cmgarcia@unalmed.edu.co