Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.1 Medellín Jan./Apr. 2009
FARMACOLOGÍA Y TOXICOLOGÍA
Citotoxicidad y actividad anticancerígena de dos flavonoides aislados y purificados de Brownea ariza Brenth
Cytotoxicity and anticarcinogenic activity of two flavonoids isolated and purified from Brownea ariza Brenth
Juan F. GIL R.1*; Milton GÓMEZ B.1; Juanita TREJOS S.1
1Laboratorio de Búsqueda de Principios Bioactivos -LBPB-, Programa Química, Universidad del Quindío. Cra 15 Cll 12 N. Armenia, Quindío, Colombia
2Grupo de Investigación en Inmunología Molecular, Centro de Investigaciones Biomédicas, Universidad del Quindío. Cra 15 Cll 12 N. Armenia, Quindío, Colombia
RESUMEN
La creciente resistencia a agentes anticancerígenos ha volcado la ciencia médica y farmacológica hacia la búsqueda de nuevos compuestos con estas características, en este campo los productos naturales tienen gran relevancia por la actividad antitumoral mostrada por muchos de ellos. Los flavonoides son metabolitos secundarios que tienen reportada actividad anticancerígena y pueden convertirse en fuente importante para tratar el cáncer; por esto se pretende aislar flavonoides de Brownea ariza Brenth, determinar su estructura y evaluar su actividad antitumoral. Los análisis fitoquímicos de las hojas de Brownea ariza Brenth (Caesalpiniaceae) permiten aislar un flavonol identificado como (1), y un glicósido de flavonol, Quercitrina (2). Las estructuras se determinan por técnicas espectroscópicas: UV-Vis con reactivos de desplazamiento; RMN 1D y 2D (1H, 13C, COSY, DEPT, HMBC; HMQC), y espectrometría de masas. Se evalúa la actividad citotóxica en línea celular VERO (ATCC:CCL-81) y la actividad anticancerígena en Mieloma Murino SP2/0-Ag14 (ATCC:CRL-1581), realizando conteo de células viables por exclusión con azul Tripan, obteniéndose una concentración citotóxica media para (1) de 300 μg/mL y no determinada para (2) en las concentraciones trabajadas; la actividad anticancerígena para (1) tiene una concentración efectiva media de 150 μg/mLy no determinada para (2) en las concentraciones trabajadas.
Palabras clave: Aislamiento, Purificación, Flavonoides, Citotóxicidad, Agentes anticancerígenos, Brownea ariza.
ABSTRACT
The growing resistance to anticancer agents has turned medical science and pharmacology towards finding new compounds with these characteristics; in this area the natural products have great relevance, since many of these have anticancer activity. Flavonoids as secondary metabolites have reported anti-tumor activity and can become important source for cancer treatment; why search isolate flavonoids Brownea ariza Brenth to evaluate their anticancer activity. The Phytochemical analysis of leaves of Brownea ariza Brenth. (Caesalpiniaceae) let isolate a flavonol identified as (1), and a glycoside flavonol described as Quercitrin (2). The structures are determined by spectroscopic techniques: UV-Vis with shift reagents; 1D and 2D NMR (1H, 13C, COSY, DEPT, HMBC; HMQC), and mass spectrometry. It evaluates the cytotoxic activity in VERO cell (ATCC: CCL-81) and anticancer activity in Myeloma Murino SP2/0-Ag14 (ATCC: CRL-1581), doing count the number of viable cells by graduation with tripan blue, obtaining a concentration cytotoxic average (1) of 300 μg/mL and not determined to (2) in concentrations of work; anticancer activity for (1) has a median effective concentration of 150 μg /mL and not given to (2) in concentrations of work.
Keywords: Isolation, Purification, Flavonoids, Cytotoxicity, Anti-cancer agents, Brownea ariza.
INTRODUCCIÓN
Gracias a su privilegiada posición ecuatorial, Colombia tiene una gran diversidad de flora. Una, gran parte de ella posee cualidades farmacológicas, lo cual permite emplearla para tratar una amplia gama de enfermedades (1), pero el número de plantas que actualmente se ha investigado no es muy amplio, motivo por el cual la ciencia tiene como campo de investigación la adquisición de metabolitos secundarios con propiedades farmacológicas (2, 3). Los flavonoides son metabolitos secundarios que poseen características anticancerígenas, citotóxicas, antibacterianas, antifúngicas, antiprotozoarias, antiinflamatorias y antioxidantes (4-10). Sus amplias propiedades se deben a que su estructura posee dos sistemas aromáticos, sistema benzoílo y cinamoílo, sitios activos en los cuales se pueden realizar diversos tipos de sustituciones, como hidroxilaciones (-OH), metoxilaciones (-OCH3), acetilaciones (CH3COO-), glicosidaciones (O-Gli), las cuales actúan sinérgicamente atacando la membrana celular, la membrana nuclear y generan acoplamiento con el ADN, entre otras acciones que impiden el crecimiento de agentes microbianos, virales y cancerígenos. (7,11-13). Por esto es importante extraer y determinar la estructura de los flavonoides presentes en las platas con reportada acción étnofarmacológica y su utilidad biológica, motivo por el cual en el presente trabajo se muestra la actividad citotóxica y anticancerígena de dos flavonoides, quercetina y quercitrina, aislados de Brownea ariza, sobre las líneas celulares Vero y Mieloma Murino, respectivamente.
METODOLOGÍA EXPERIMENTAL
Materiales
Material vegetal
Las hojas frescas de B. ariza fueron recolectadas en la vereda Aures, de la localidad de Caicedonia, Valle del Cauca, Colombia, a 1.650 m.s.n.m. Un ejemplar fue depositado en el Herbario de la Universidad del Quindío (HUQ).
Reactivos
La cromatografía en capa delgada (CCD) se realizó empleando cromatoplacas en sílica gel 60F254. La cromatografía en columna (CC) se llevó a cabo usando como fase estacionaria sílica gel 60 de tamaño de partícula 0.063-0.200 mm y sílica gel 60G para cromatografía preparativa en columna. Como reactivos de desplazamiento para UV-Vis se empleó acetato de sodio (AcONa), ácido bórico (H3BO3), ácido clorhídrico (HCl), hidróxido de sodio (NaOH) y cloruro de aluminio (AlCl3). Los solventes empleados en el aislamiento y purificación de los compuestos fueron diclorometano (CH2Cl2), cloroformo (CHCl3) y metanol (MeOH), adquiridos en la casa comercial Merck (Darmstadt, Alemania); el acetato de etilo (AcOEt) se obtuvo de Mallinckrodt (USA) y etanol 95% (EtOH) de grado comercial. Para las pruebas citotóxicas y anticancerígenas se empleó medio DMEM (Invitrogen, USA), antibiótico/antimicótico (Sigma, USA), L-Glutamina (Sigma USA), suero fetal bovino (Invitrogen, USA), azul tripan, dimetilsulfóxido (DMSO) (Sigma, USA).
Líneas celulares
Línea celular VERO referencia (ATCC:CCL81) y línea celular de Mieloma Murino SP2/0-Ag14 referencia (ATCC:CRL-1581) fueron donadas por el Grupo de Inmunología Molecular, GYMOL, de la Universidad del Quindío.
Métodos
Extracción y purificación
Para la preparación del extracto etanólico por el método de maceración-percolación, se tomaron 850 g de hojas de B. ariza, secas y molidas, en un percolador de 2 litros de volumen adicionando etanol del 95% hasta agotar la extracción. Se retiró el solvente evaporando a presión reducida a una temperatura inferior a 40ºC en rotaevaporador. El extracto etanólico obtenido de la percolación se secó y se le realizaron particiones sucesivas con CH2Cl2, AcOEt y MeOH, en un soxhlet, recibiendo 54, 30 y 14 g respectivamente. Cada extracto se sometió a prueba de Shinoda (1,2), para verificar la presencia de flavonoides. Al extracto en acetato de etilo se le realizó cromatografía en columna asistida por vacío (CC-Flash), utilizando como fase móvil AcOEt-MeOH (95:5), recogiendo 30 fracciones, realizando seguimiento por CCD, utilizando AcOEt-MeOH (95:5) como solvente de elusión y revelando con AlCl3 5% / MeOH. Se observaron dos manchas amarillas bajo la luz UV en una longitud de onda de 254 nm la primera, con un Rf de 0.84, compuesto 1, y otra a un Rf de 0.54, compuesto 2. Las fracciones de la 5 a la 15 que mostraban el compuesto 1 se reunieron, nombrándose como fracción A; la fracción B se constituyó con las fracciones resultantes desde la número 16 hasta la número 30.
La fracción A se llevó a CC-Flash usando como eluente CHCl3-MeOH (95:5) logrando 30 fracciones, de las cuales se reunieron las fracciones 15 a 30 (por su similitud apreciada mediante CCD) y se realizó cromatografía preparativa en columna empleando como eluente AcOEt-CHCl3 (95:5), logrando 15 fracciones, de las cuales se tomaron de la 4 a la 10 para unificarlas y de nuevo se realizó cromatografía preparativa en columna eluyendo con AcOEt-MeOH (95:5) para purificar. Se obtiene un sólido amarillo con una pureza de 98.34%, lo cual se estableció a través de cromatografía líquida de alta eficiencia (HPLC) con una columna RP-18, de 0.78 x 30 cm, eluyendo con una mezcla de EtOH-MeOH-MeCN (30:30:40) a un flujo de 0.6 mL/ min, a una λ de 254 nm y con un tR de 10 min.
La fracción B se procesó por CC-Flash usando AcOEt-MeOH (70:30) como solvente de elusión, obteniendo un total de 15 fracciones, en las cuales estaba presente el compuesto 2, según CCD. El proceso de purificación continuó con cromatografía preparativa en columna eluyendo con AcOEt -MeOH (90:10), logrando 10 fracciones, de las cuales se tomaron de la 1 a la 7 para unificarlas y realizar cromatografía preparativa utilizando como eluente AcOEt-MeOH (95: 5). La determinación de la pureza de los cristales obtenidos se realizó mediante HPLC con una columna RP-18, de 0.78 x 30 cm, eluyendo con mezcla MeCN-EtOH-MeOH (40:30:30) a un flujo de 0.6 mL/min, a una λ de 254 nm, observándose un pico con un tR de 8.97 min y obteniendo una pureza de 97.95%.
Posteriormente, se realizó la verificación de la presencia del núcleo flavonoide en los compuestos obtenidos utilizando reactivos de desplazamiento en UV-Vis (Hewlett Packard Diode Array 8453 UV); asimismo, la determinación de grupos funcionales con IR (Thermo Nicolet 340), cromatografía de gases acoplado a masas (GC/MS) en un equipo Shimadzu GCMS-QP 2010, usando He como gas de transporte a una velocidad lineal de 37.6 cm/s, con una columna capilar de sílice fundida RTX5MS (5% difenil), de 30 mm × 0,25 mm ID y con una fase de recubrimiento de 0.25, temperatura de inyección de 310ºC, inyectando 2 μL de muestra para el compuesto 1; y espectroscopia de masas por inyección directa (IDMS) al compuesto 2 (Shimadzu GCMS-QP 2010). Simultáneamente se realizaron los espectros de RMN 1H, 13C, COSY, DEPT, HMBC; HMQC (Bruker AMX-400 MHz).
Ensayo de citotoxicidad
La línea celular VERO (células de riñón de mono verde: Cercopithecus aethiops) (ATCC:CCL-81) se mantuvo con medio DMEM, antibiótico/antimicótico 1X, L-glutamina 1X, suero fetal bovino al 5% e incubado 37°C en 5% de CO2 en cajas de cultivo celular Nunc® de 25 mL. Se realizó pase a placa de 96 pozos de 4.0 x 105 células/pozo y se agregaron 100 μL de las muestras (compuesto en concentraciones de 1200 μg/mL en DMSO 10% v/v, en dilución seriada hasta 37.5 μg/mL) y se mantuvieron en iguales condiciones de suplementos e incubación por 48 horas, al cabo de este tiempo se realizó conteo del número de células viables, por exclusión con azul Tripan. En cada caso se determinó la concentración citotóxica media (CC50), concentración que reduce el número de células viables al 50%. Como control negativo se utilizó el cultivo celular sin adición de la muestra, al cual también se le hizo conteo celular como punto de comparación del crecimiento logarítmico a las 48 horas. Todos los ensayos se llevaron a cabo por duplicado.
Ensayo de actividad anticancerígena
La línea celular de mieloma murino SP2/0Ag14 (ATCC:CRL-1581) se mantuvo con medio DMEM (Invitrogen, USA), antibiótico/antimicótico 1X (Sigma, USA), L-Glutamina 1X (Sigma USA), suero fetal bovino (Invitrogen, USA) al 5% e incubado 37°C en 5% de CO2 en cajas de cultivo celular Nunc® de 25 mL. Se realizó pase a placa de 96 pozos de 5.0 x 105 células/pozo y se agregaron 100 μl de las muestras (compuesto en concentraciones de 1200 μg/mL en DMSO 10% v/v, en dilución seriada hasta 37.5 μg/mL) y se mantuvieron en iguales condiciones de suplementos e incubación por 24 y 48 horas, al cabo de las cuales se realizó conteo celular de número de células viables, por exclusión con azul Tripan, para determinar la disminución o no del crecimiento celular en presencia del flavonoide. Como control negativo se utilizó el cultivo celular sin adición de la muestra, al cual también se le realizó conteo celular como punto de comparación del crecimiento logarítmico en los diferentes intervalos de tiempo. Todos los ensayos se realizaron por duplicado.
Determinación de citotoxicidad y actividad anticancerígena
La citotóxicidad y actividad anticancerígena de los compuestos 1 y 2 se realizó mediante el recuento de las células viables 48 horas después de la adición de los compuestos en las concentraciones desde 1200 μg/mL hasta 37.5 μg/mL. El porcentaje de células viables se calcula a partir del valor medio del recuento de los cultivos tratados con cada concentración de los compuestos con respecto al control, que es el 100% de viabilidad (14,15).
Identificación de flavonoides
Compuesto 1: Se obtuvieron 80 mg de un sólido amarillo amorfo, con punto descomposición a 180ºC, positivo prueba de shinoda, que indica la presencia de un grupo benzoílo y uno cinamoílo unidos (1) y negativa la presencia de azúcares.
UV λ max (nm) (MeOH) (Logε): 256 (0.81); 274 (sh); 292 (sh); 372 (0.79). UV λ max (nm) (MeOH-AcONa) (Logε): 256; 272 (0.77); 326 (sh); 380 (0.78). UV λ max (nm) (NaOH) (Logε): 314 nm (Nueva banda) (0.89); 395 (sh). UV λ max (nm) (MeOH-AcONa-H3BO3) (Logε): 260 (1.00) (Aumento intensidad); 300 (sh); 388 (Aumento intensidad) (0.86). UV λ max (nm) (MeOH-AlCl3) (Logε): 269 (0.41); 422 (0.41). UV λ max (nm) (MeOH-AlCl3-HCl) (Logε): 366 (0.54) (disminución intensidad). IR λ max KBr (cm-1): 3405.8 (Puente H-OH); 2927.6 (CH); 2854.3 (CH); 1662.4 (C=O); 1612.3 (C-O); 1562.1 (Ar); 1519.7 (C-OH); 1458.0 (Ar); 1377.0 (C6H6 Sustituido); 1203.4 (Tensión C-O); 1134.0; 1010.6; 794.6; 694.3 (C6H6 Sustituido). (16-18). GCMS (EI) 70 eV, m/z (int. Rel.): 302 [M]+(100), 285 [M-OH]+ (23.3), 153 [M-C8H5O2-OH]+ (9.3), 137 [M-C7H4O4-OH]+.
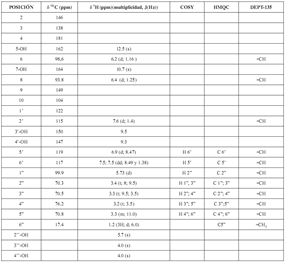
Los datos obtenidos de los espectros de RMN 1H, COSY, 13C, DEPT, HMQC, HMBC para el compuesto 1 están consignados en la tabla 1.
Tabla 1. Espectros RMN (400 MHz, DMSO-d6) del compuesto 1.
Compuesto 2: Se obtienen 53 mg de un sólido amarillo brillante con cristales en forma de agujas, punto descomposición a 153ºC, positivo prueba de shinoda, que indica la presencia de un grupo benzoílo y uno cinamoílo unidos (1), y prueba positiva para azúcares reductores, ensayo de Fehling (1, 19). Con rotación óptica de [α]24+79º(MeOH, c 0,3).
UV λmax (nm) (MeOH) (Logε): 256 (0.83); 272 (hombro); 326 (hombro); 358 (0.75). UV λmax (nm) (MeOH-AcONa) (Logε): 272 (0.79); 326 (sh); 380 (0.78). UV λmax (nm) (NaOH) (Logε): 319 (nueva banda) (0,77). UV λmax (nm) (MeOH-AcONa-H3BO3) (Logε): 260 (1.00) (aumento intensidad), 300 (sh), 388 (aumento intensidad) (0.86). UV λ max (nm) (MeOH-AlCl3) (Logε): 271 (0.67); 451 (0.69). UV λ max (nm) (MeOH-AlCl3-HCl) (Logε): 366 (0.55) (disminución intensidad). IR λ max KBr(cm-1): 3378.8 (puente H-OH); 3081.8 (CH); 2927.6 (CH); 1614.2 (C-O); 1521.6 (C-OH); 1442.6 (Ar); 1259.4; 1112.8; 1064.6 (C6H6 sustituido). IDMS (EI) 70 eV, m/z (int. Rel.): 488 [M]+ (60); 302 [M-C6H11O4]+ (100); 285 [M-C6H11O4]+ (23.35); 153 [M-C8H5O2-OH]+ (9.3); 147 [M-C15H9O7]+ (80); 137 [M-C7H4O4-OH]+(40). Los datos obtenidos de los espectros de RMN 1H, COSY, 13C, DEPT, HMQC, HMBC para el compuesto 2 están consignados en la tabla 2.
Tabla 2. Espectros RMN (400 MHz, DMSO-d6) del compuesto 2.
Ensayo de citotoxicidad en línea Celular Vero
La evaluación de la citotoxicidad de ambos f lavonoides aislados de B. ariza se realizó en línea celular VERO (ATCC: CCL-81), cuyos resultados pueden observarse en la tabla 3.
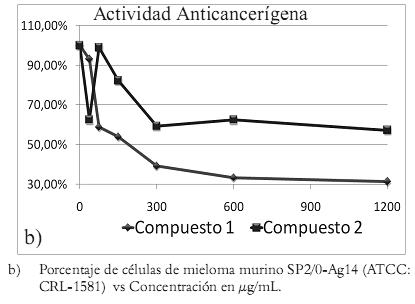
Ensayo de actividad anticancerígena Los resultados de la actividad antitumoral en mieloma murino SP2/0-Ag14 (ATCC:CRL-1581) se tabulan en la tabla 4.
Tabla 3. Resultados de actividad citotóxica frente a línea celular VERO (ATCC:CCL-81) del compuesto 1 y 2 a las diferentes concentraciones en un tiempo de 48 h.
Tabla 4. Resultados de actividad antitumoral frente a mieloma murino SP2/0-Ag14 (ATCC:CRL-1581) del compuesto 1 y 2, a las diferentes concentraciones en un tiempo de 48 h.
DISCUSIÓN DE RESULTADOS
Identificación de flavonoides
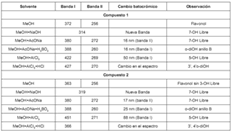
La presencia de hidroxilos fenólicos en diferentes posiciones de la molécula puede establecerse estudiando el comportamiento del espectro UV metanólico al añadirle los denominados reactivos de desplazamiento: hidróxido de sodio (NaOH), acetato de sodio (NaOAc), cloruro de aluminio (AlCl3) con y sin HCl, y ácido bórico (H3BO3) (2, 20, 21). La tabla 5 muestra los diferentes cambios sufridos en el espectro de cada compuesto en metanol con la adición de cada uno de los reactivos de desplazamiento, y la relación de este cambio con las sustituciones presentes en cada uno (2, 20-23). El espectro IR del compuesto 1 arrojó bandas de absorción de hidroxilos, carbonilos conjugados y grupos aromáticos.
El espectro de masas determinó un peso molecular de 302 u.m.a, el RMN de 13C y el DEPT 135 arrojaron un total de 15 carbonos, 5 CH aromáticos (δ 93.8, 98.6, 115.5, 116.0, 120.4 ppm). Un grupo carbonilo con δ 176.3 ppm, seis carbonos aromáticos con sustituyente heteroátomo (δ, 164.3; 161.2; 156.6; 148.1; 147.3; 145.5 ppm), un carbono oxigenado δ 136.15 y dos carbonos cuaternarios (δ 103.5 y 122.4 ppm). Los que describen la fórmula molecular como C15H10O7. El espectro RMN 1H muestra un patrón de acoplamiento AB (δ 7.7 y 6.9 ppm) para el anillo A y un sistema ABX (δ 6.2 y 6.4 ppm) para el anillo B. Con esto se define al compuesto 1 como 3,5,7,3",4"-pentahidroxiflavona, comúnmente llamado quercetina, estructura que se confirma mediante las relaciones observadas en HMBC, HMQC y COSY.
Compuesto 2. Los datos de los espectros UV muestran que el flavonoide posee el grupo 3-OH ocupado. El espectro IR arrojó bandas de absorción de hidroxilos, carbonilos conjugados y grupos aromáticos. La espectrometría de masas se realizó por inyección directa pues la prueba positiva para azúcares arrojada por el compuesto 2 impidió el uso del GC-MS. El DIMS mostró un peso molecular de 448 u.m.a. El RMN 13C y el DEPT-135 tuvieron un total de 21 señales, 5 CH aromáticos (δ 93.8; 98.6; 115; 117; 119 ppm), 5 CH pertenecientes al azúcar 4 a campo bajo (δ 76.2; 70.8; 70.5; 70.3 ppm) y uno a campo alto del carbono anomérico (δ 99.9 ppm). Un grupo carbonilo con δ 181 ppm, seis carbonos aromáticos con sustituyente heteroátomo (δ, 164; 162; 150; 149; 146; 147 ppm), un carbono oxigenado en región no aromática δ 138 ppm, dos carbonos cuaternarios (δ 104 y 122 ppm), y un CH3 a campo bajo δ 17,4 ppm, datos que definen una fórmula molecular de C21H20O11.
Tabla 5. Dezplazamientos batocrómicos en el espectro UV del los compuestos 1 y 2.
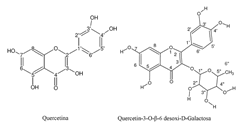
Las técnicas espectroscópicas y espectrométricas definen al flavonoide como un glicósido de quercetina, con un azúcar monosacárido en la posición 3; la rotación óptica de +79º muestra que el carácter dextrógiro del azúcar. El COSY 1H-1H permitió asignar las señales del monosacárido. El HMQC se aplicó para asociar los protones con la resonancia del carbono correspondiente. El HMBC correlaciona el pico que fue observado a δ 5.73 ppm, hidrógeno del carbono anomérico (C 1”) con el carbono C-3 del aglicón situado a δ 138 ppm, confirmando el glicósido en la posición C-3. Los datos recopilados definen al compuesto 2 como 5,7,3",4"-tetrahidroxiflavona-3-O-Ramnosido (quercitrina). Las estructuras de los compuestos se muestran en la figura 1.
Figura 1. Estructura del Compuesto 1, (Quercetina) (a), y Compuesto 2, (Quercitrina) (b)
Actividad citotóxica y anticancerígena
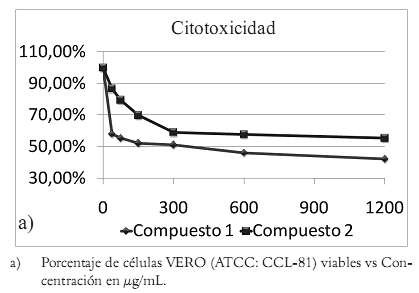
La figura 2a, muestra cómo decrece el número de células en los pozos que contienen los compuestos, constantemente, en relación con la concentración a las 48 horas. El compuesto 1 mostró que su actividad frente a células VERO alcanzó una concentración citotóxica media (CC50 ) a 300 μg/mL. En el caso del compuesto 2 se evidencia la existencia de una acción citotóxica contra células Vero, en aumento desde la concentración de 37.5 hasta 1200 μg/mL, pero esta acción no llega hasta la CC50, al menos en las concentraciones trabajadas.
Figura 2. Gráficas de actividad citotóxica y anticancerígena.
En la figura 2b se grafican los resultados de la actividad contra el mieloma murino SP2/Ag0-14 de cada compuesto. El compuesto 1 presenta mayor actividad anticancerígena que el compuesto 2, pues el primero alcanza una concentración efectiva media (CE50) entre 150 y 300 μg/mL, y el segundo no la alcanza aun a una concentración de 1200 μg/mL. El compuesto 1, quercetina, posee actividad anticancerígena frente a mieloma murino SP2/0-Ag14, y se le ha reportado actividad anticancerígena en otras líneas celulares (24-26), lo que es interesante ya a que la citotoxicidad frente a células Vero es más baja que su actividad antitumoral. El compuesto 2, quercitrina, aislado de B. ariza, posee características similares en cuanto a actividad anticancerígena y citotóxica a las de la quercetina, pero menguadas debido a la presencia de un glicósido en su estructura, pues las sustituciones glicosídicas y metilaciones disminuyen la actividad biológica de los f lavonoides (13).
CONCLUSIONES
Se identificó la presencia de dos flavonoides en B. ariza no registrados antes en el género Brownea, 5,7,3",4"-tetrahidroxiflavona-3-O-Ramnosido, (Quercitrina). y 3,5,7,3",4"-tetrahidroxiflavona (Quercetina), los cuales poseen actividad anticancerígena frente a mieloma murino SP2/0-Ag14 y citotoxicidad frente a células VERO.
AGRADECIMIENTOS
Agradecimientos al Programa de Química de la Universidad del Quindío, al Grupo de Investigación en Inmunología Molecular, GYMOL, del Centro de Investigaciones Biomédicas de La Universidad del Quindío, y al Laboratorio de Calidad de Productos Naturales, Grupo de Polifenoles, Universidad Tecnológica de Pereira (UTP).
REFERENCIAS BIBLIOGRÁFICAS
1. Sanabria A. Análisis fitoquímico preliminar: Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. Bogotá: Universidad Nacional de Colombia; 1983. [ Links ]
2. Martínez A. Flavonoides. Medellín: Facultad de Química Farmacéutica, Universidad de Antioquia; 2005. [ Links ]
3. DominguezXA.Métodosdeinvestigaciónfitoquímica.México: Limusa; 1973. [ Links ]
4. Mbaveng AT, Ngamenib B, Kuete V, Simob IK, Ambassab P, Royc R, et al. Antimicrobial activity of the crude extracts and five flavonoids from the twigs of Dorstenia barteri (Moraceae). J Ethnopharmacol. 2008; 116 (3): 483-489. [ Links ]
5. Ajali U, Chukwurah BKC. Antimicrobial activity of Securidaca longipedunculata. Phytomedicine. 2004; 11 (7-8): 701-703. [ Links ]
6. Mimaki Y, Watanabe K, Ando Y, Sakuma C, Sashida Y, Shigenori F, Sakagami H. Flavonol glycosides and steroidal saponins from the leaves of Cestrum nocturnum and their cytotoxicity. J Nat Prod. 2001; 64 (1): 17-22. [ Links ]
7. Canales M, Hernández T, Serrano R, Hernández LB, Durán A, Ríos V, et al. Antimicrobial and general toxicity activities of Gymnosperma glutinosum: A comparative study. J Ethnopharmacol. 2007; 110 (2): 343-347. [ Links ]
8. Macías FA, Molinillo JMG, Torres A, Varela RM, Castellano D. Bioactive flavonoids from Helianthus annuus cultivars. Phytochemistry. 1997; 45 (4): 683-687. [ Links ]
9. Sharon A, Ghirlando R, Gressel J. Isolation, purification, and identification of 2-(p-Hydroxyphenoxy)-5,7-Dihydroxychromone: A fungal-induced phytoalexin from Cassia obtusifolia. Plant Physiology. 1992; 98 (1): 303-308. [ Links ]
10. Salem M, Werbovetz KA. Isoflavonoids and other compounds from Psorothamnus arborescens with antiprotozoal activities. J Nat Prod. 2006; 69 (1): 43-49. [ Links ]
11. Marston A, Hostettmann K. Separation and quantification of flavonoids. En: Andersen øM, Markham KR, editores. Flavonoids: chemistry, biochemistry and applications. Boca Ratón: CRC Press; 2006. p. 38-118. [ Links ]
12. Stobiecki M, Kachlicki P. Isolation and identification of flavonoids. En: Grotewold E, editor. The science of flavonoids. Columbus: Springer; 2006. p. 47-70, [ Links ]
13. Cushnie TP, Lamb AJ. Antimicrobial activity of flavonoids (Review). Int J Antimicro Ag. 2005; 26 (5): 343-356. [ Links ]
14. Echemendía OA, Carballo MT, García M, Monteagudo R, Bolaños G, Lago V, et al. Ensayo de la actividad antiviral in vitro de un extracto vegetal del genero Erythrina contra el herpes simple tipo 1 y herpes simple tipo 2. En: Farmacología SCd, editor. IV Congreso Nacional de Farmacología y Terapéutica; La Habana Cuba; 2002. [ Links ]
15. Carballo MT, Echemendía O, Torres MG, Bolaños G, Monte-agudo R, Lago V, et al. Estudio antiviral in vitro de un extracto proveniente de la mangifera indica l. frente al herpes simple tipo 1.En: Farmacología SCd, editor. IV Congreso Nacional de Farmacología y Terapéutica. La Habana, Cuba; 2002. [ Links ]
16. Hernández N, Tereschuk ML, Abdala LR. Antimicrobial activity of flavonoids in medicinal plants from Tafí del Valle (Tucumán, Argentina). J Ethnopharmacol. 2000; 73 (1-2): 317-322. [ Links ]
17. Fossen T, Andersen øM. Spectroscopic techniques applied to flavonoids. En: Andersen øM, Markham KR, editores. Flavonoids: chemistry, biochemistry and applications. Boca Ratón: CRC Press; 2006. p. 38-118.
18. Bhattacharyya J, Majetich G, Spearing P., Almeida RN. Dioclenol, a minor flavanonol from the root-bark of Dioclea grandiflora. Phytochemistry. 1997; 46 (2): 385-387. [ Links ]
19. Shriner R, Fuson R, Curtin D. Identificación sistemática de los compuestos orgánicos. México: Limusa; 1995. [ Links ]
20. Coleska ZN, Dorevski K, Klisarova L, Milosevic L. Identification of phenolic constituents isolated from Macedonian propolis. Bulletin of the Chemists and Technologists of Macedonia. 1995; 14 (1): 13-17. [ Links ]
21. Markham KR. Techniques of flavonoid identification. Londres: Academic Press; 1982. [ Links ]
22. Cornard JP, Boudet AC, Merlin JC. Complexes of Al (III) with 3"4"-dihydroxy-flavone: characterization, theoretical and spectroscopic study. Spectrochim Acta A. 2001; 57 (3): 591-602. [ Links ]
23. Cornard JP, Merlin J. Structural and spectroscopic investigation of 5-hydroxyflavone and is complex with aluminum. J Mol Struct. 2001; 569 (1-3): 129-138. [ Links ]
24. Kinichi H, Atsushi A. Radiolanthanides as promising tumor scanning agents. J Nucl Med. 1973; 14 (8): 615-617. [ Links ]
25. Zava DT, Duwe G. Estrogenic and antiproliferative properties of genistein and other flavonoids in human breast cancer cells in vitro. Nutr Cancer. 1997; 27 (1): 31-40, [ Links ]
26. Shen F, Weber G. Synergistic action of quercetin and genistein in human ovarian carcinoma cells. Oncol Res. 1997; 9 (11-12): 597-602. [ Links ]
Recibido: Junio 23 de 2008.
Aceptado: Noviembre 4 de 2008
* Autor a quien se debe dirigir la correspondencia: jfgilr@uqvirtual.edu.co