Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.1 Medellín Jan./Apr. 2009
PRODUCTOS NATURALES
Obtención de aceites esenciales y pectinas a partir de subproductos de jugos cítricos
Obtencion of essential oils and pectins from by-products of citrus juice
Jennifer P. ROJAS Ll.1; Aidé PEREA V.1*; Elena E. STASHENKO.2
1Centro de Investigación en Ciencia y Tecnología de Alimentos -CICTA-. km 2 Vía Refugio Sede UIS Guatiguará. Piedecuesta , Santander, Colombia
2 Centro Nacional de Investigaciones para la Agroindustrialización de Especies Vegetales Aromáticas y Medicinales Tropicales -CENIVAM, Escuela de Química, Universidad Industrial de Santander. Calle 9, Carrera 27. Bucaramanga, Colombia
RESUMEN
Los aceites esenciales y pectinas se obtienen de los subproductos de la extracción de los jugos de mandarina, naranja, toronja y pomelo. Para la extracción de los aceites esenciales se emplea la técnica de hidrodestilación asistida por radiación de microondas. La identificación de sus componentes se lleva a cabo mediante cromatografía de gases acoplada a espectrometría de masas, calculándose sus cantidades relativas. Las pectinas se extraen mediante hidrólisis ácida. Los mayores rendimientos de aceite esencial (0.23%) y pectina (25.2% en base seca) se obtienen del pomelo.
Palabras clave: Aceites esenciales, Pectinas, Cítricos, Hidrodestilación, Microondas.
ABSTRACT
Essential oils and pectins are obtained from the mandarin, orange, grapefruit and pommelo by-products. The essential oils are isolated by microwave-assisted hydrodistillation. The compounds identification is carried out by gas chromatography coupled to mass spectrometry and their relative amounts are calculated. The pectins are extracted by acid hydrolysis. The highest essential oil (0.23%) and pectins (25.2% dry basis) yields are obtained from pommelo.
Key words: Essential oils, Pectins, Citrus, Hydrodistillation, Microwave.
INTRODUCCIÓN
La fase industrial de la cadena productiva de cítricos cobija productos como jugos, concentrados, néctares, purés, pastas, pulpas, jaleas y mermeladas (1). Los subproductos en la industria de jugos, constituidos por cáscaras (albedo y flavedo), semillas, membranas y vesículas de jugo, representan aproximadamente el 50% del peso de la fruta entera original (2). Estos subproductos pueden emplearse como nutrientes en alimentación animal, comercializados en forma de pellets, pero sus precios no son lo suficientemente altos para proporcionar rentabilidad al proceso de aprovechamiento (3) de manera que el desarrollo de productos alternativos de mayor valor agregado beneficiaría a los procesadores de frutos cítricos.
Los aceites esenciales (AE) y las pectinas son algunos de los productos que pueden obtenerse a partir de los residuos cítricos (4). Los AE se emplean para la elaboración de licores, perfumes, artículos de aseo, como enmascaradores de olores de pinturas y caucho, y como materias primas para la elaboración de productos farmacéuticos, entre otras aplicaciones (5).
Las pectinas se usan en la industria de alimentos como espesantes, gelificantes, emulsificantes y estabilizantes (6), y en el campo farmacológico como agentes antimetástasis, inmunoestimulantes y antiulcerosos (7). Además la pectina, por ser una fibra soluble, disminuye las fracciones de lipoproteína de baja densidad en la sangre, sin modificar los niveles de lipoproteína de alta densidad, que es buena para la salud humana (7).
Para la obtención de AE a partir de frutos cítricos se emplean diferentes técnicas de extracción, que incluyen métodos directos como la compresión de cáscara, y métodos indirectos como la destilación por arrastre con vapor y la destilación con agua asistida por radiación de microondas (HDMO). En esta última técnica el efecto de la radiación calienta el agua hasta ebullición de tal manera que el vapor generado penetra y rompe las estructuras celulares que contienen la esencia, la cual es liberada y arrastrada por el vapor de agua para su posterior condensación y separación. La HDMO es un proceso muy rápido y relativamente económico y los AE obtenidos se encuentran libres de productos de descomposición térmica y de contaminantes (8).
Industrialmente la extracción de pectinas se lleva a cabo mediante hidrólisis ácida o enzimática. Los solventes más usados son agua, etanol y metanol. El pretratamiento con microondas del material vegetal incrementa sus características porosas capilares y su capacidad de absorción de agua; además, las altas temperaturas implicadas pueden inhibir la actividad pectinesterasa que degrada las pectinas antes de su extracción. Estos cambios permiten mejorar la producción de pectina y su masa molecular, así como la fortaleza del gel (9).
El objetivo del presente estudio fue determinar el contenido y composición de AE, y la cantidad de pectinas presentes en los subproductos de los frutos de mandarina (variedades Común y Reina), naranja (variedades Valencia Campbell y Valencia Frost), toronja (variedad Ica Hatico) y pomelo (variedad Star Ruby), cultivados en el Departamento de Santander. La extracción de AE se realizó empleando la técnica de hidrodestilación asistida por radiación de microondas. La identificación de sus componentes se llevó a cabo mediante cromatografía de gases acoplada a espectrometría de masas, y se calcularon sus cantidades relativas. Las pectinas se extrajeron mediante hidrólisis ácida, tanto de los subproductos de la extracción de jugos, como de los residuos de la hidrodestilación.
MATERIALES Y MÉTODOS
Recepción de los frutos cítricos
Las variedades de mandarina (Reina y Común) se obtuvieron en la finca El Pintoresco, ubicada en la vereda Llano del Municipio de Rionegro, y las variedades de naranja (Valencia Campbell y Valencia Frost), toronja (Ica Hatico) y pomelo (Star Ruby) provinieron de la finca La Sabana, ubicada en la vereda Peñas, del Municipio de Girón, Santander. Las frutas, con grado de maduración pintón, textura firme, color uniforme y sin signos de deterioro, se lavaron, se secaron, se pesaron, se partieron en dos y se exprimieron. El jugo obtenido se pesó, así como las cáscaras, semillas y bagazo residuales.
Extracción de aceites esenciales por hidrodestilación asistida por radiación de microondas
La extracción de los AE se llevó a cabo empleando un equipo de destilación tipo Clevenger, con reservorio de destilación tipo Dean-Stark y calentamiento por radiación de microondas mediante un horno convencional LG Intellowave (Korea), con potencia de salida de 720 W. Para ello, las cáscaras, junto con las membranas y las vesículas de jugo remanentes, picadas en trozos de 4 cm2, se mezclaron con 150 mL de agua destilada y se procedió a la extracción, que duró 40 min, dividida en intervalos de 10 min (10 min x 4).
Análisis cromatográfico de aceites esenciales
La identificación de los componentes de los AE se realizó empleando la técnica analítica de cromatografía de gases acoplada a espectrometría de masas, usando columnas capilares de fases estacionarias apolar y polar. Se utilizó un cromatógrafo de gases Agilent Technologies 6890 Series GC System (Palo Alto, EE.UU.), acoplado a un detector selectivo de masas Agilent Technologies 5973, equipado con un puerto de inyección split/splitless (split 1:30) y un sistema de datos HP ChemStation 1.05. Para la separación de las mezclas se utilizó una columna capilar DB-5MS ( J & W Scientific, Folsom, EE.UU.) con fase estacionaria de 5% fenil-polimetilsiloxano (60 m x 0,25 mm, D.I. x 0,25 μm, df). La temperatura del horno se programó desde 45ºC (5 min) hasta 150ºC (2 min) a 4ºC/min, luego se incrementó hasta 250ºC (5 min) a 5ºC/min, finalmente, la temperatura aumentó a 10ºC/min, hasta alcanzar 275ºC (15 min). Las temperaturas de la cámara de ionización y de la línea de transferencia fueron de 230 y 285ºC, respectivamente. El gas de arrastre empleado fue helio (99.995%). Los espectros de masas y corriente iónicas reconstruidas se obtuvieron por medio de barrido automático de frecuencia ( full scan), a 4.75 scan s-1, en el rango de masas m/z 30-450.
Para el análisis por la columna polar se empleó un cromatógrafo de gases Agilent Technologies 6890 Network GC System, acoplado a un detector selectivo de masas Agilent Technologies 5975, equipado con un puerto de inyección split/splitless (250ºC, split 1:14) y un sistema de datos HP ChemStation D.02.00.275. El proceso de separación se llevó a cabo en una columna capilar DB-WAX ( J & W Scientific, Folsom, CA, EE.UU.) con fase estacionaria entrecruzada e inmovilizada de polietilenglicol (60 m x 0,25 mm, D.I. x 0,25 μm, df). La temperatura del horno se programó desde 45ºC (10 min) hasta 220ºC (30 min) a 3 ºC/min. Las temperaturas de la cámara de ionización y de la línea de transferencia fueron de 230 y 250ºC, respectivamente.
La identificación de los diferentes compuestos se realizó empleando los índices de retención de Kováts (10), calculados mediante el uso de una serie homóloga de patrones de hidrocarburos desde C10 hasta C25, y comparando sus espectros de masas con los de las bases de datos, ADAMS, WILEY 138K o NIST02. Posteriormente se determinaron las cantidades relativas de cada metabolito secundario.
Se efectuaron tres extracciones independientes para cada tipo de cítrico, con el fin de determinar la reproducibilidad de los datos obtenidos y de los análisis cromatográficos realizados.
Extracción de pectinas
Los subproductos (cáscaras, membranas y vesículas de jugo remanentes) de la extracción de jugos, así como los residuos de la hidrodestilación, se pasaron por una picadora Hamilton Beach 70550 (Washington, EE.UU.). Se pesaron 10 g de muestra y se colocaron en un vaso de precipitados de 250 mL. Se agregaron 50 mL de agua destilada en ebullición, se adicionó HCl 6 N con el fin de reducir el pH hasta 2 y se dejó hervir durante 15 min. Se filtró, y con el residuo se repitió la extracción ácida 2 veces más. El último residuo se lavó varias veces con agua a ebullición. Al filtrado se agregó un volumen de alcohol comercial, igual al volumen total obtenido en las filtraciones anteriores; la mezcla se dejó en reposo durante 2 h para precipitar la pectina. Posteriormente se centrifugó a 5000 rpm durante 20 min, se separó la pectina, se secó a 40°C, y se cuantificó por gravimetría.
Previamente se le determinó la humedad a cada muestra, con el fin de calcular el rendimiento de pectina en base seca.
RESULTADOS Y DISCUSIÓN
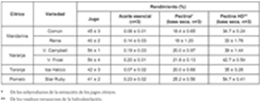
En la tabla 1 se registra el rendimiento del jugo obtenido a partir de las diferentes variedades de cítricos. Se observa que los residuos representan entre el 60% (mandarina Reina) y el 46% (variedades de naranjas analizadas) del peso de la fruta entera original. Estos porcentajes coinciden con los reportados por las industrias citrícolas de otras partes del mundo (2), lo que justifica el aprovechamiento de los residuos en la obtención de productos de mayor valor agregado.
Extracción de aceites esenciales
En el rendimiento de los aceites esenciales (Véase tabla1), se observa que los subproductos del pomelo presentan el mayor rendimiento, seguidos de los de naranja Valencia Frost y Valencia Campbell, mandarina Reina, toronja Ica Hatico y mandarina Común. En la bibliografía se han reportado ren-estudio, los rendimientos para los AE de naranja y dimientos del 0.4% (11) para los AE de naranja, y mandarina, extraídos por hidrodestilación asistida del 0.05-0.6% (11, 12, 13) para los de mandarina, por radiación de microondas, fueron del 0.2% y extraídos por prensado en frío. El rendimiento del 0.06-0.14% respectivamente. Debe tenerse en reportado para los mismos aceites, obtenidos cuenta que se utilizaron las cáscaras, membranas y mediante destilación por arrastre con vapor es de vesículas de jugo remanentes, lo que disminuye el 0.2%. La disminución con la última técnica se debe rendimiento respecto a las referencias mencionadas a la absorción de agua por el albedo (11). En este dónde sólo se utilizaron las cáscaras.
Tabla 1. Rendimientos de aceites esenciales extraídos de las cáscaras de frutos cítricos.
Caracterización química de aceites esenciales
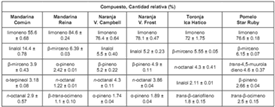
Los cinco principales compuestos de los AE de los residuos de las naranjas Valencia Campbell y Valencia Frost son los mismos, variando sólo sus cantidades relativas (Véase tabla 2). El limoneno, el linalol y el octanal, al igual que en los AE de las naranjas, se encuentran entre los principales constituyentes del AE de la toronja Ica Hatico, a diferencia del trans-β-cariofileno, que no se identificó ni en los AE de mandarina ni en los de naranja, pero está entre los cinco principales componentes del AE de toronja. El trans -4,5-muuroladieno es el tercer constituyente más abundante en el AE de pomelo, en los AE de toronja y mandarina también se detectó pero en menor cantidad relativa, mientras que en los AE de naranja no se registró. El (E)-β-ocimeno se detectó en los AE de los frutos analizados, pero sólo se encuentra entre los compuestos mayoritarios del AE de pomelo. El β-mirceno no se registró en el AE de naranja, pero se encuentra entre los principales compuestos de los AE de mandarina, toronja y pomelo.
La mandarina común es la única variedad en cuyo AE se determinaron el α-terpineno (0.64 ± 0.03%), el timol metil éter (1.4 ± 0.13%), el timol
(0.29 ± 0.03%) y el α-sinensal (0.21 ± 0.01%).
El valenceno (0.07 ± 0.01%) se encontró sólo en el AE de la naranja Valencia Frost, mientras que el cis-p-menta-2,8-dien-1-ol (0.22 ± 0.02%) se detectó sólo en el AE de la toronja Ica Hatico, y el δ-elemeno (0.20 ± 0.01%) se encontró sólo en el AE de pomelo. El alcanfor se registró en el AE de las dos variedades de mandarina, el δ-3-careno se encontró en el AE de las variedades de naranja, mientras que el componente 2(3H)-naftalenona se determinó únicamente en los AE de toronja (1.2 ± 0.10%) y de pomelo (0.74 ± 0.01%). Este compuesto orgánico es un sesquiterpeno con un grupo cetona y es uno de los principales compuestos responsables del olor y sabor de estas frutas (14).
El compuesto mayoritario en el AE de todos los frutos es el limoneno, pero su cantidad relativa cambia considerablemente dependiendo de la variedad del fruto, con valores de 55.6% en el AE de mandarina Común, 72% en el de pomelo Star Ruby, 76.4% en el de naranja Valencia Campbell, 78.1% en el de naranja Valencia Frost y 84.6% en el de mandarina Reina. En el caso del AE de mandarina, los resultados obtenidos son consistentes con los que aparecen en la bibliografía, en los cuales se encuentra que el limoneno es el compuesto dominante, y su contenido oscila entre 52.2-96.7% (12 -13).
Tabla 2. Principales compuestos de los aceites esenciales extraídos de las cáscaras de frutos cítricos.
Las cantidades relativas de limoneno para los AE de las variedades de naranja analizadas, Valencia Campbell (76.4%) y Valencia Frost (78.1%), son menores que las registradas en la bibliografía, donde se encuentran porcentajes para el AE de la naranja común de 91.74% (11); 92.5% (15); 94.0% (16); 94.25% (11); 94.29% (17) y 99.5% (18). Para el AE de la naranja agria la cantidad relativa de limoneno reportada es de 93.9% (19), para el de la Washington Navel es de 94.81%, para el de la Sanguinello es 92.48%; 95.29% para el AE de la naranja Tarocco; 91.14% para el de la Moro y 94.95% para el de la Valencia Late (20).
En el caso del AE de la toronja Ica Hatico sucede lo mismo, la cantidad relativa de limoneno encontrada es de 72%, mientras la que aparece en la bibliografía para el AE de la toronja Marsh Seedless es de 93,59%, y para la toronja Red Blush es de 93.70% (20).
Las diferencias entre las cantidades relativas encontradas en este estudio y las reportadas en la bibliografía, pueden atribuirse a las condiciones de cultivo, a la variedad de las frutas y, posiblemente, a la técnica de extracción del AE.
Extracción de pectinas
En este estudio se observa que, en todos los casos, el rendimiento de pectina es mayor cuando ésta se obtiene de los subproductos de la extracción del AE por hidrodestilación (PECTINA HD), que cuando se extrae directamente de los subproductos cítricos sin tratar (PECTINA) (Véase tabla 1). Ello se debe, posiblemente, a que en la hidrodestilación el material se somete a un tratamiento con microondas y la radiación incrementa sus características porosas capilares, aumentando la capacidad de absorción de agua por el material vegetal y promoviendo la liberación de pectina de la matriz. Además, las altas temperaturas producidas en el pretratamiento con microondas, pueden inhibir la actividad de la pectinesterasa, que degrada las pectinas antes de su extracción (9).
El mayor contenido de pectina se obtuvo a partir de los subproductos de pomelo Star Ruby, seguido de los de naranja Valencia Frost, naranja Valencia Campbell, toronja Ica Hatico, mandarina Común y mandarina Reina.
Los porcentajes de pectina obtenidos de los subproductos de la extracción de jugos de naranja y mandarina, concuerdan con los que aparecen en la bibliografía, donde se encuentran rendimientos del 16.9% para la naranja Navel (9), del 20.0% para la naranja Valencia (22), del 23.02% para la naranja dulce (2) y del 16.01% para la mandarina Satsuma (2). Para la toronja en base seca se han informado rendimientos del 28.4-33.7% (23); sin embargo, en este trabajo la extracción se hizo empleando las cáscaras, membranas y vesículas de jugo, remanentes de la extracción de los jugos, y en las referencias mencionadas sólo utilizaron las cáscaras.
Se ha informado de rendimientos del 14-18% en base seca (9) para la pectina extraída de las cáscaras de naranja Navel pretratadas con radiación de microondas durante 5, 10 y 15 min. En este estudio las muestras se sometieron, durante el proceso de hidrodestilación, a radiación de microondas por un tiempo total de 40 min, y los rendimientos de pectina obtenidos a partir de las cáscaras de naranja remanentes de este proceso, fueron mayores (39% para la naranja Valencia Campbell y 42.7% para la naranja Valencia Frost) que los informados por la bibliografía (9), posiblemente debido al mayor tiempo de exposición del material vegetal a la radiación.
CONCLUSIONES
Los subproductos del pomelo Star Ruby presentaron el mayor rendimiento en AE (0.23%), seguidos de los de naranja Valencia Frost (0.20%) y Valencia Campbell (0.19%), mandarina Reina (0.14%), toronja Ica Hatico (0.07%) y mandarina Común (0.06%). El compuesto mayoritario en los AE de los cítricos estudiados es el limoneno. Sin embargo, la cantidad relativa de este compuesto cambia considerablemente dependiendo de la variedad de la fruta, con valores de 55.6% en el AE de la mandarina Común, 72% en el de la toronja Ica Hatico, 76.4% en el de la naranja Valencia Campbell, 76.6% en el AE del pomelo Star Ruby, 78.1% en el de la naranja Valencia Frost y 84.6% en el de la mandarina Reina.
Los mayores rendimientos de pectina se obtuvieron con los subproductos de pomelo Star Ruby (25.2%), seguidos de los de naranja Valencia Frost (21.8%), naranja Valencia Campbell y toronja Ica Hatico (20.0%), mandarina Común (18.4%) y mandarina Reina (18%). Estos porcentajes aumentaron cuando la extracción se hizo con los subproductos de la hidrodestilación asistida por radiación de microondas.
AGRADECIMIENTOS
Al Centro Nacional de Investigaciones para la Agroindustrialización de Especies Vegetales Aromáticas y Medicinales Tropicales, CENIVAM, y a COLCIENCIAS, contrato CENIVAM-COLCIENCIAS RC 432-2004, por la financiación de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Espinal CF, Martínez HJ, Peña Y. La cadena de cítricos en Colombia: Una mirada global de su estructura y dinámica 1991-2005. Bogotá: Ministerio de Agricultura y Desarrollo Rural, Observatorio Agrocadenas Colombia. [Sitio en Internet]. Disponible en: http://www.agrocadenas.gov.co. Consultado: 15 marzo 2005. [ Links ]
2. Marín RF, Soler C, Benavente O, Castillo J, Pérez JA. By-products from different citrus processes as a source of customized functional fibres. Food Chem. 2007; 100(2): 736-741. [ Links ]
3. Wilkins MR, Widmer WW, Grohmann, K, Cameron RG. Hydrolysis of grapefruit peel waste cellulase and pectinase enzymes. Bioresource Technol. 2007; 98 (8): 1596-1601. [ Links ]
4. Kim WC, Lee DY, Lee CH, Kim CW. Optimization of narirutin extraction during washing step of the pectin production from citrus peels. J Food Eng. 2004; 63 (2): 191-197. [ Links ]
5. Instituto de Investigación de Recursos Biológicos “Alexander von Humboldt”. Biocomercio sostenible. Estudio del mercado colombiano de aceites esenciales. Bogotá, 2003, 109 p. [Sitio en Internet]. Disponible en http://www1.minambiente.gov.co/vicemi-nisterios/ambiente/mercados_verdes/INFO%20SECTORIAL/ Mercado%20nacional%20de%20aceites%20esenciales.pdf. Consultado: 10 de Octubre de 2008.
6. Mesbahi G, Jamalian J, Farahnaky A. A comparative study on functional properties of beet and citrus pectins in food systems. Food Hydrocolloid. 2005; 19 (4): 731-738. [ Links ]
7.Liu Y, Shi J, Langrish TAG. Water-based extraction of pectin from flavedo and albedo of orange peels. Chem Eng J. 2006 (3); 120: 203-209. [ Links ]
8. Kingston, HM, Jassie, LB. Introduction to microwave sample preparation, theory and practice. Washington: American Chemical Society; 1988. p. 7-31. [ Links ]
9. Liu Y, Ahmad H, Luo Y, Gardiner DJ, Gunasekera RS, McKeehan WL, Patil BS. Citrus pectin: characterization and inhibitory effect on fibroblast growth factor - receptor interaction. J Agric Food Chem. 2001; 49 (6): 3051-3057. [ Links ]
10. Adams RP. Identification of essential oil components by gas chromatography/quadrupole mass spectroscopy. Illinois: Allured; 2004. [ Links ]
11. Blanco C, Stashenko EE, Combariza MY, Martínez JR. Comparative study of Colombian citrus oils by high-resolution gas chromatography and gas chromatography-mass spectrometry. J Chromatogr A. 1995; 697 (1-2): 501-513. [ Links ]
12. Lota ML, Serra D, Tomi F, Casanova J. Chemical variability of peel and leaf essential oils of 15 species of mandarins. Biochem Sys Ecol. 2001; 29 (1): 77-104. [ Links ]
13. Lota ML, Serra D, Tomi F, Casanova J. Chemical variability of peel and leaf essential oils of 15 species of mandarins from Citrus reticulata Blanco. Biochem Sys Ecol. 2000; 28 (1): 61-78. [ Links ]
14. Tassaneeyakul W, Guo LQ, Fukuda K, Ohta T, Yamazoe Y. Inhibition selectivity of grapefruit juice components on human cytochromes P450. Arch Biochem Biophys. 2007; 378 (2): 356-363. [ Links ]
15. Hôgnadóttir A, Rouseff RL. Identification of aroma active compounds in orange essence oil using gas chromatographyolfatometry and gas chromatography-mass spectrometry. J Chromatogr A. 2003; 998 (1-2): 201-211. [ Links ]
16. Stashenko EE, Martínez JR, Pinzón MH, Ramírez J. Changes in chemical composition of catalytically hydrogenated orange oil (Citrus sinensis). J Chromatogr A. 1996; 752 (1-2): 217-222. [ Links ]
17. Maróstica MR, Pastore GM. Production of R-(+)-α-terpineol by the biotransformation of limonene from orange essential oil, using cassava waste water as medium. Food Chem. 2007; 101 (1): 345-350. [ Links ]
18. Mira B, Blasco M, Berna A, Subirats S. Supercritical CO2 extraction of essential oil from orange peel..Effect of operation conditions on the extract composition. J Supercrit Fluid. 1999; 14 (2): 95-104. [ Links ]
19. Moussaid M, Lacroix M, Nketsia J, Boubekvi C. Effects of irradiation in combination with waxing on the essential oils in orange peel. Radiat Phys Chem. 2000; 57 (3-6): 269-271. [ Links ]
20. Caccioni DRL, Guizzardi M, Biondi DM, Renda A, Ruperto G. Relationship between volatile components of citrus fruit essential oils and antimicrobial action on Penicillium digitatum and Penicillium italicum. Int J Food Microbiol. 1998; 43 (1-2): 73-79. [ Links ]
21. Devia JE. Proceso para producir pectinas cítricas. Revista Universidad Eafit. 2003; 39 (129): 21-30. [ Links ]
22. El-Nawawi SA. Extraction of citrus glucosides. Carbohyd Polym. 1995; 27 (1): 1-4. [ Links ]
23. Wang YC, Chuang YC, Hsu HW. The flavonoid, carotenoid and pectin content in peels of citrus cultivated in Taiwan. Food Chem. 2007; 106 (1): 277-284. [ Links ]
Recibido: Junio 20 de 2008.
Aceptado: Noviembre 4 de 2008.
* Autor a quien debe dirigirse la correspondencia: aperea@uis.edu.co