Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.1 Medellín Jan./Apr. 2009
PRODUCTOS NATURALES
Evaluación de la fitotoxicidad y la actividad antifúngica contra Colletotrichum acutatum de los aceites esenciales de tomillo (Thymus vulgaris), limoncillo (Cymbopogon citratus), y sus componentes mayoritarios
Evaluation of phytotoxicity and antifungal activity against Colletotrichum acutatum of essential oils of thyme (Thymus vulgaris), lemongrass (Cymbopogon citratus), and its main constituents
Diego A. ALZATE O.1; Gonzalo I. MIER M.1; Lucía AFANADOR K.1; Diego L. DURANGO R.2; Carlos M. GARCÍA P. 2*
1Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia. Calle 64 x Cra. 65 Autopista Norte. A.A. 1779. Medellín, Colombia
2Grupo de Química de los Productos Naturales y los Alimentos, Escuela de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Calle 59 A nº 63-020 Autopista Norte. A.A. 3840. Medellín, Colombia
RESUMEN
La antracnosis del tomate de árbol, ocasionada por el hongo Colletotrichum acutatum, es la enfermedad más importante de este cultivo en Colombia por su amplia distribución y las pérdidas que ocasiona. En el presente trabajo se evalúa la actividad antifúngica contra la especie C. acutatum de los aceites esenciales (AE) de tomillo (Thymus vulgaris), limoncillo (Cymbopogon citratus), y sus componentes mayoritarios, timol y citral. Los resultados demuestran que el timol a 125 mg/L y el citral a 300 mg/L inhiben el crecimiento micelial completamente durante once días de incubación. La germinación de las esporas se evita en un 100% con el AE de limoncillo a 350 y 400 mg/L, timol a 100 y 125 mg/L, y citral a 250 y 300 mg/L, después de un período de doce horas. Adicionalmente, el timol a 125 mg/L y el citral a 300 mg/L inhiben completamente la esporulación y el AE de tomillo a 350 mg/L la permite en baja extensión. Las evaluaciones de fitotoxicidad revelan que la aplicación de gotas localizadas sobre la superficie foliar de Solanum betacea, a concentraciones entre 150 y 5000 mg/L, no ocasionan ningún daño aparente. Asimismo, la aspersión foliar completa y sistemática cada 2 días, durante 2 meses continuos con concentraciones de 1500 mg/L de los materiales, no produce ningún síntoma de marchitamiento, deterioro del crecimiento o alteración del desarrollo general de las plantas.
Palabras Clave: Cymbopogon citratus, Thymus vulgaris, Cyphomandra betacea, citral, timol, antracnosis, tomate de árbol.
ABSTRACT
Anthracnose of tree tomato, caused by the fungus Colletotrichum acutatum, is the major postharvest disease of this crop in Colombia due to its widespread distribution and economic loss. In the present work, antifungal activity against C. acutatum specie with the essential oils (EO) of thyme (Thymus vulgaris), lemon grass (Cymbopogon citratus), and the main components of the EO, thymol and citral, is evaluated. Experimental result indicates that thymol at a concentration of 125 mg/L and citral at 300 mg/L, inhibits completely the mycelial growth during eleven days. Spore germination is affected 100% with lemon grass oil at 350 and 400 mg/L, thymol at 100 and 125 mg/L, and citral at 250 and 300 mg/L, during the period of evaluation of twelve hours. In addition, thymol at 125 mg/L and citral at 300 mg/L, inhibits completely the sporulation of the fungus whereas thyme oil at 350 mg/L shows a lower degree of affectation. Phytotoxicity evaluations of all materials by applying drops located at the leaf surface of Solanum betacea to concentrations between 150 and 5000 mg/L, demonstrate that treatments do not induce any apparent damage. Also, foliar spraying complete and systematically every 2 days, for the period of 2 months with constant concentration of 1500 mg/L for each evaluated materials, produces no sign of wilting, deteriorating growth or alteration of the overall development of the plants.
Key Words: Cymbopogon citratus, Thymus vulgaris, Cyphomandra betacea, citral, timol, anthracnose, tree tomato.
INTRODUCCIÓN
La antracnosis del fruto, ocasionada por el hongo filamentoso fitopatógeno Colletotrichum acutatum, es la enfermedad más importante del cultivo de tomate de árbol ó tamarillo (Solanunm betacea, syn: Cyphomandra betacea), por su amplia distribución y por las pérdidas económicas que ocasiona (1,2). El departamento de Antioquia es actualmente uno los mayores productores de tomate de árbol en Colombia y la antracnosis es la mayor limitante que se presenta en los cultivos comerciales y en las pequeñas explotaciones domésticas (3). La incidencia de la enfermedad ha llevado a que se utilicen cada vez mayores cantidades de pesticidas.
Los productos químicos sintéticos destinados a controlar esta enfermedad han tenido un papel muy marcado en el incremento de la producción agrícola. Sin embargo, el uso continuo e indiscriminado de agroquímicos con baja especificidad ha generado diversos inconvenientes, tales como el incremento en los costos de producción, el desarrollo de resistencia por parte de algunos microorganismos, la presencia de residuos de pesticidas en los alimentos y, en consecuencia, los riesgos que acarrean para la salud humana y el medio ambiente (4,5). Por estos motivos, desde las últimas décadas del siglo XX se ha incrementado el interés en la búsqueda de alternativas más seguras que permitan mitigar el impacto negativo de este tipo de productos. Una estrategia que ha resultado satisfactoria para reducir la utilización de agroquímicos costosos y potencialmente dañinos y peligrosos, ha sido el manejo integrado de plagas –mejor conocido como MIP- y dentro de esta opción, la utilización de sustancias de origen natural, consideradas más seguras para la salud humana y el medio ambiente, y más aceptadas por los consumidores (6,7).
La aplicación de aceites esenciales (AE) es un método muy atractivo para controlar enfermedades tanto en cosecha como en post-cosecha. Estos materiales son una mezcla compleja de compuestos volátiles producidos en diferentes partes de las plantas, y han sido reconocidos por poseer diversas funciones, incluyendo conferir la resistencia a plagas y enfermedades (8); algunos AE, así como sus constituyentes, han demostrado poseer propiedades antibacterianas y antifúngicas (9,10).
El AE de tomillo, Thymus vulgaris, presenta como componente mayoritario el timol y en algunas variedades su composición puede alcanzar valores hasta del 80% (11). Tanto los AE obtenidos de las especies de Thymus, como el timol, han sido reconocidos por su actividad antibacteriana y antifúngica, razón por la cual se emplean industrialmente en la preparación de desinfectantes de uso humano, enjuagues bucales y otros agentes antimicrobianos utilizados a nivel doméstico (12,13). De otro lado, el AE de limoncillo, Cymbopogon citratus, presenta como componente mayoritario el citral, alcanzando valores entre el 65 y el 85% (14). Por su aroma a limón, la planta ha sido muy apreciada para la elaboración de saborizantes y aromas alimenticios (15); las propiedades antifúngicas y antibacterianas del AE de esta planta se han asociado con la presencia de citral y sus isómeros, geranial (trans-citral, llamado citral A) y neral (cis-citral, llamado citral B) (16,17). Tanto el AE de C. citratus, como el citral y sus derivados, tienen una alta demanda industrial y son utilizados en la preparación de desinfectantes de uso doméstico.
En el presente trabajo se evaluó la actividad antifúngica tanto de los AE provenientes de las especies Thymus vulgaris y Cymbopogon citratus, obtenidos mediante destilación por arrastre con vapor, como de sus componentes mayoritarios adquiridos de casas comerciales, contra la especie Colletotrichum acutatum. Adicionalmente, debido a que la fitotoxicidad puede ser un problema para la aplicación en campo de los AE de tomillo (Thymus vulgaris), limoncillo (Cymbopogon citratus), o sus constituyentes principales en el control de C. acutatum, se llevó a cabo la evaluación de su efecto sobre plantas de tomate de árbol, Solanum betacea.
MATERIALES Y MÉTODOS
Materiales y métodos generales
Los medios de cultivo y los nutrientes utilizados en el mantenimiento de los hongos fueron de calidad microbiológica. El timol, y la mezcla de isómeros cis y trans del citral de calidad grado analítico se obtuvieron de las casas comerciales Aldrich y Merck. Los solventes de calidad grado técnico se bidestilaron antes de su utilización. Los tensoactivos empleados para posibilitar la dispersión en agua de los AE y compuestos puros fueron igualmente de calidad técnica. Las plantas de tomate de árbol (S. betacea) se obtuvieron de semillas certificadas de la variedad común y se cultivaron en un sistema hidropónico; el medio nutritivo utilizado fue la solución estándar Hoagland, preparada con sales inorgánicas de calidad grado técnico; el pH de la mezcla final se ajustó a 6.5 mediante la adición de NaOH al 5%; se utilizó como sustrato de soporte cuarzo triturado comercial de tamaño de partícula pequeño y grande, mezclado en proporción 1/1, y esterilizado en autoclave.
Las cepas del patógeno fueron obtenidas de aislamientos monospóricos, procedentes del Laboratorio de Fitopatología de la Universidad Nacional de Colombia, Sede Medellín, caracterizados morfológica y molecularmente. La cepa se aisló de frutos maduros de tomate de árbol afectados con antracnosis, obtenidos en los centros de mercadeo de la ciudad de Medellín-Antioquia. El mantenimiento de las colonias y las evaluaciones de actividad antifúngica se realizaron en el medio de cultivo PDA, bajo condiciones controladas de temperatura, a 22 y 23 °C, y humedad relativa de 70 a 75%. Los conteos de esporas se realizaron en una cámara de Neubauer.
Los aceites esenciales se obtuvieron a partir de material fresco proveniente de la ciudad de Guarne-Antioquia. El transporte se hizo en sacos de malla de polipropileno muy amplia para facilitar la aireación. El proceso de arrastre con vapor de agua se realizó a 94 oC en un equipo artesanal, en los laboratorios de la Escuela de Química de la Universidad Nacional de Colombia, Sede Medellín. Se procesaron 10 kg de cada una de las plantas completas, con un máximo de cosechadas de 4 horas. Los AE se analizaron mediante Cromatografía de Gases-Espectrometría de Masas (CG-EM), obteniéndose un contenido de citral del 65% en C. citratus y de timol del 84.5% en el AE de T. vulgaris. Las cantidades obtenidas de la extracción de los AE fueron respectivamente, para C. citratus de 35.0 mL y para T. vulgaris de 8.5 mL.
Fitotoxicidad de los AE y sus componentes mayoritarios mediante gotas localizadas
Para esta evaluación se desarrolló un método en el cual se determinó el posible efecto deletéreo causado por las gotas localizadas de una dispersión acuosa de los AE y los compuestos timol y citral, aplicadas sobre una área foliar pequeña; el estudio se realizó sobre plantas de S. betacea de cuatro a cinco meses de edad sembradas en macetas de plástico de color negro. Las plantas se ubicaron en un mesón con fotoperíodo de doce horas, regulado con un temporizador PET-007. La luminosidad se suministró mediante lámparas fluorescentes de 75 Watt dispuestas a 40 cm de altura de las plantas. Se evaluaron 24 dispersiones fungicidas preparadas con los AE de limoncillo, tomillo, y los compuestos timol y citral a 150, 750, 1500, 2000, 3000, 5000 mg/L. Se adicionaron algunas gotas de tensoactivo y solvente para mejorar la solubilidad de los AE y los compuestos puros. La aplicación de las mezclas se realizó por triplicado sobre las hojas número cinco y seis contadas a partir del meristemo apical; cada hoja se parceló en seis cuadrantes hipotéticos, de tal manera que la nervadura central dividiera tres a lado y lado. En cada cuadrante se aplicó un total de 10 gotas de 10.0 μL de mezcla distribuidas al azar. Los tratamientos se aplicaron aleatoriamente en los cuadrantes de hojas diferentes, empleando cinco réplicas por planta, junto con un testigo negativo (agua) y un testigo de referencia que incluía los solventes y tensoactivos utilizados en la preparación de las dispersiones. Las mezclas se aplicaron semanalmente durante un mes y se examinó la aparición de posibles lesiones en el tejido expuesto a las alícuotas de la emulsión. La escala de daño utilizada fue la siguiente: 0: Ningún daño aparente-igual al testigo absoluto; 1: Daño apenas perceptible (amarillamiento zonal); 2: Necrosamiento leve, y 3: Necrosamiento acentuado y/o perdigoneo.
Fitotoxicidad de los AE y sus componentes mayoritarios mediante aspersión foliar
Se determinó el posible efecto deletéreo causado por la aplicación de las mezclas acuosas de los AE y sus componentes mayoritarios mediante aspersión foliar. Las evaluaciones se realizaron sobre plantas de tres y cuatro meses de edad, cultivadas individualmente en vasos plásticos desechables de 12 onzas y color azul oscuro para limitar el desarrollo de algas; todas fueron expuestas a condiciones ambientales idénticas a las empleadas en el método de gota localizada. A cada vaso se le hicieron cuatro perforaciones de un diámetro de cinco mm, a una altura de 1.0 cm, medido desde la base y fueron colocados en cubetas de germinación plásticas de 5.0 cm de profundidad, con una lámina de solución nutritiva de 1.5 cm de altura; el nivel de los nutrientes se mantuvo regulado reponiendo las pérdidas causadas por evaporación y consumo. Las mezclas se asperjaron con un atomizador plástico hasta lograr un cubrimiento total del área foliar de las plantas. La concentración de los AE, timol y citral aplicada fue de 1500 mg/L. Para evitar la contaminación del sustrato de soporte durante la aplicación, se cubrió toda la base del tallo con una tela plástica de polietileno colocada en forma de ruana.
Todas las aplicaciones se llevaron a cabo en las horas de la mañana, inicialmente durante intervalos de siete días durante un mes y posteriormente cada 3 días durante un período de 60 días. La calificación de los daños ocasionados se realizó de acuerdo a las normas ICONTEC-1976 (18), con una escala entre 0 y 5, así: 0: Plantas iguales al testigo absoluto; 1: Leve clorosis y presencia de pecas; 2: Clorosis acentuada y ligera reducción distinguible en el crecimiento o presencia de pocas manchas; 3: Inhibición del crecimiento, clorosis marcada y anormalidades morfológicas; 4: Planta muy afectada, sin posibilidad de recuperación, hay presencia de algunas partes de tejido aun verde, y 5: Necrosis y muerte de la planta. A cada una de las plantas se le determinó la altura al inicio y al final de los ensayos. Igualmente, se determinó la biomasa obtenida mediante la estimación del peso seco ± 0.1 mg al finalizar la evaluación y se realizó la comparación con los testigos absolutos; el secado se llevó a cabo en una estufa con flujo de aire forzado durante 72 horas a 60oC. Las evaluaciones se efectuaron con cinco repeticiones por tratamiento (cinco plantas por tratamiento), los correspondientes testigos absolutos (aplicación de agua solamente) y los testigos de referencia conteniendo únicamente los solventes y tensoactivos utilizados en la preparación de las dispersiones acuosas.
Inhibición del crecimiento micelial de C. acutatum con los AE y sus componentes mayoritarios
Se evaluaron ocho mezclas, correspondientes a dos concentraciones de cada uno de los materiales (AE y componentes mayoritarios): los AE de T. vulgaris y C. citratus a 350 y 400 mg/L, citral a 250 y 300 mg/L, y timol a 100 y 125 mg/L; como sistema de referencia se comparó su actividad con la de los fungicidas comerciales Chlorotalonil®, a 200 y 250 mg/L, y Manzate® (Mancozeb®), a 150 y 200 mg/L. Las evaluaciones se realizaron en cajas petri de nueve centímetros de diámetro. Las dispersiones de las mezclas fungicidas en el medio de cultivo PDA se efectuaron en una cámara de flujo laminar vertical utilizando cristalería esterilizada en autoclave.
La inoculación se llevó a cabo colocando en el centro de la caja un disco de PDA de seis milímetros de diámetro colonizado por el hongo durante dos días de incubación. El crecimiento micelial se midió con una regla milimetrada cada 24 horas por un período de tiempo máximo de 11 días. El crecimiento del micelio se expresó en términos de porcentaje de inhibición mediante la siguiente ecuación: I = (T- t) / T x 100; I = % inhibición; T = crecimiento en mm de los testigos de referencia cada 24 horas; t = crecimiento en mm de los tratamientos cada 24 horas. En las evaluaciones se empleó un diseño completamente al azar con análisis de medidas repetidas en el tiempo; como testigo absoluto se emplearon cajas de petri que contenían el medio de cultivo inoculado con el hongo sin fungicida. Cada ensayo contenía cinco réplicas por tratamiento.
Evaluación de la inhibición de la esporulación de C. acutatum
En esta evaluación se utilizaron los cultivos del procedimiento anterior, 11 días después de la inoculación. La esporulación se determinó en suspensión acuosa; para ello se adicionaron a cada una de las cajas de petri 20.0 mL de agua estéril. La suspensión de conidias se obtuvo mediante raspado de la colonia y se extrajeron alícuotas que posteriormente se llevaron a la zona de conteo en la cámara de Neubauer; se realizaron cuatro conteos por caja y se determinó el valor promedio. Los cálculos respectivos se llevaron a cabo empleando la expresión: N = n x 10000; siendo N = Número de conidias, n = Número de conidias contadas en el área del hemocitómetro, y 10000 = Factor de conversión a mililitros.
Evaluación de la germinación de las esporas de C. acutatum
En esta evaluación se utilizó una cepa del hongo incubada durante 10 días en PDA y a la cual se le agregaron 200 mL de agua destilada para extraer las esporas. Cada tratamiento se realizó en una mezcla de 10 mL de una solución de agar-agua al 2%, a la cual se le adicionaron los AE o sus componentes mayoritarios. Los resultados se confrontaron nuevamente con los dos fungicidas comerciales Chlorotalonil® y Manzate®. Se utilizaron las mismas concentraciones de ingrediente activo empleadas en las pruebas de crecimiento radial. Para la evaluación, cada caja se dividió en sextantes y en cada uno de ellos se adicionó una alícuota de la suspensión de esporas mediante una pipeta Pasteur. Los conteos de las esporas germinadas se llevaron a cabo con la ayuda de un microscopio cada dos horas después de la siembra y durante un período total de 12 horas; en cada sextante de la caja petri se analizaron 50 esporas, teniendo en cuenta los siguientes parámetros:
Esporas germinadas: El tubo germinativo alcanza el doble del diámetro mayor de la conidia. Esporas no germinadas: No hay desarrollo del tubo germinativo. En el tratamiento estadístico se empleó un diseño completamente al azar con análisis de medidas repetidas en el tiempo. Se realizaron cinco repeticiones por tratamiento, evaluando dos concentraciones por material y un testigo absoluto como sistema de referencia.
Tratamiento estadístico
Se realizó un análisis de varianza (ANOVA) y la prueba de comparación de medias de Tukey para un nivel de significancia P≤ 0.05, usando el programa estadístico SAS (SAS/IML software; Version 6; SAS Institute).
RESULTADOS
Fitotoxicidad de los AE y sus componentes mayoritarios
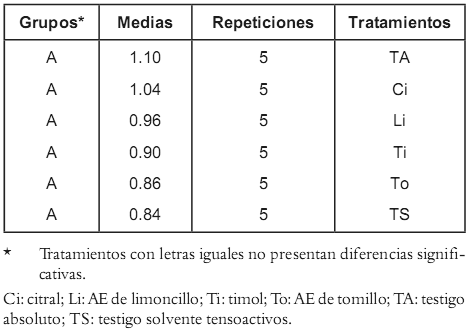
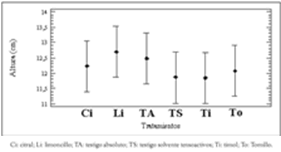
En la evaluación mediante la aplicación de gotas localizadas sobre el área foliar no se observó ninguno de los efectos descritos en la escala de daño; por lo tanto, se puede afirmar que los materiales estudiados no causan ningún tipo de lesión local en los sitios de aplicación de las gotas. Al utilizar esta metodología se observó la presencia de material aceitoso depositado en los puntos de aplicación y su permanencia superó en muchos casos los tres días; este hecho permitió la ubicación de los sitios de aplicación original y sobre ellos se colocaron reiteradamente las gotas correspondientes a tratamientos posteriores. En forma idéntica, en la evaluación realizada mediante la utilización del método de aspersión foliar, no se observó ninguno de los efectos nocivos contemplados en la escala de daño establecida como criterio de fitotoxicidad, ICONTEC (18). El análisis estadístico realizado con la variable peso de biomasa vegetal, no presentó diferencias significativas entre todos los tratamientos, con relación a los testigos (Véanse tablas 1 y 2); tampoco se observaron diferencias estadísticas significativas en la variable altura de las plantas (Véase figura 1). Considerando la información obtenida en las evaluaciones descritas en este apartado se puede afirmar que los materiales evaluados no ocasionan daños aparentes en las plantas de S. betacea.
Tabla 1. Análisis de varianza de la evaluación de fitotoxicidad de las soluciones antifúngicas con relación a la variable peso de biomasa (P≤ 0.05).
Tabla 2. Comparaciones múltiples de promedios para la variable peso de biomasa mediante la prueba de Tukey (P≤0.05).
Alteración del ciclo biológico de C. acutatum
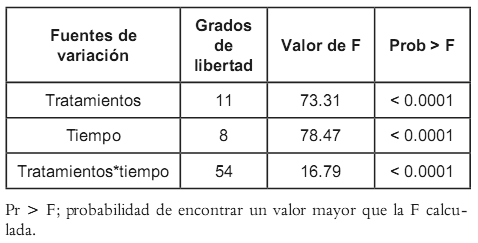
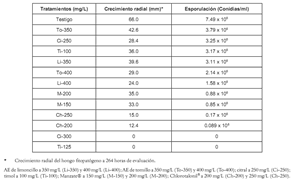
La inhibición del crecimiento micelial del hongo a las 48 horas de evaluación con todos los tratamientos es total (100% de inhibición), y los testigos presentan un desarrollo notorio en este lapso de tiempo. Debido a este comportamiento las comparaciones de medias se realizaron considerando valores de tiempo superiores a 48 horas; la información obtenida se compila en la tabla 3, y se incluyen los diferentes niveles de interacción de los tratamientos con el tiempo. El citral a 300 mg/L y el timol a 125 mg/L mantuvieron un porcentaje de inhibición del 100% durante el tiempo que duró la evaluación. Por este motivo se excluyeron en las comparaciones de medias. Con base en el criterio de información bayesiano –BIC- se seleccionó el modelo con estructura simétrica de los datos, es decir, las lecturas en todos los tiempos tienen igual varianza y todos los pares de medidas en la misma unidad experimental tienen la misma correlación (datos no mostrados). En el análisis realizado se evidenció la importancia tanto del tiempo como de los tratamientos (Véase tabla 3).
Figura 1. Comparación de promedios para la variable altura de las plantas en la prueba de fitotoxicidad. Ci: citral; Li: limoncillo; TA: testigo absoluto; TS: testigo solvente tensoactivos; Ti: timol; To: Tomillo.
Tabla 3. Resultado del análisis de varianza para el modelo de covarianza seleccionado.
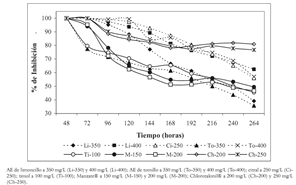
El efecto inhibitorio de los tratamientos con respecto al tiempo se resume en la figura 2; las evaluaciones se suspendieron a las 264 horas, debido a que el crecimiento radial de los testigos alcanzó a llenar completamente el área de las cajas petri con lo cual se imposibilitó, a partir de este tiempo, la cuantificación de los porcentajes de inhibición. Se observa que todos los materiales presentan como tendencia general la disminución de la capacidad de inhibición del crecimiento micelial de C. acutatum al avanzar el tiempo de exposición. El timol a 100 mg/L, Manzate® a 150 y 200 mg/L y el AE de T. vulgaris a 350 mg/L muestran la tendencia descendente mas pronunciada, indicando que el efecto inhibitorio que puede ser alcanzado con estos compuestos disminuye ostensiblemente y es muy significativo después de 72 horas. A 264 horas de evaluación, casi todos los tratamientos mostraron un porcentaje de inhibición inferior al 60%, excepto la agrupación conformada por Chlorotalonil® a 200 y 250 mg/L, el AE de C. citratus a 400 mg/L, citral a 250 mg/L y el AE de T. vulgaris a 400 mg/L, que mantienen su poder de inhibición por encima del 80% hasta las 144 horas (6 días posteriores a la aplicación). En esta agrupación, el mas destacable es el Chlorotalonil® a 200 y 250 mg/L, que conserva una capacidad inhibitoria muy alta aun a las 264 horas (11 días de aplicación); los porcentajes observados en este tiempo para el Chlorotalonil® a 200 y 250 mg/L fueron del 81% y 78%, respectivamente. Asimismo, el AE de C. citratus a 400 mg/L, el citral a 250 mg/L y el AE de T. vulgaris a 400 mg/L, poseen una buena capacidad de control del patógeno, lo cual le confiere potencialidad práctica a las aplicaciones de los AE y sus componentes mayoritarios en el control racional de la antracnosis del tomate de árbol. La tendencia decreciente de la capacidad inhibitoria observada en todos los materiales puede ser asociada con una disminución de la efectividad de los tratamientos, ocasionada por una asimilación favorable de los componentes activos por parte del hongo cuando estos son suministrados en concentraciones bajas, o al hecho de que el patógeno posee una capacidad de detoxificación significativa hacia esos compuestos.
Figura 2. Porcentajes de inhibición del crecimiento micelial de C. acutatum en el tiempo.
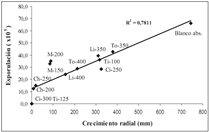
La evaluación del efecto de los tratamientos vulgaris a 350 mg/L, citral a 250 mg/L y timol a sobre la esporulación de C. acutatum reveló que el 100 mg/L; sin embargo, permiten la esporulación en timol a 125 mg/L y el citral a 300 mg/L la inhiben forma significativa. Los resultados se consignan en totalmente, mientras que el Chlorotalonil® a 200 la tabla 4. Una correlación positiva entre el número y 250 mg/L, y el Manzate® a 150 y 200 mg/L la de esporas y el diámetro de crecimiento micelial de permiten en una baja proporción. Los AE de T. C. acutatum, se representa en la figura 3.
Tabla 4. Crecimiento radial y esporulación de C. acutatatum para los diferentes tratamientos.
Figura 3. Correlación entre el crecimiento radial de C. acutatum a 264 horas de evaluación y el número de esporas.
Con respecto a la inhibición de la germinación de las esporas de C. acutatum, se observó que el único material que no fue activo en un 100% es el AE de T. vulgaris a 350 y 400 mg/L; para este tratamiento se observó que el proceso de germinación se inició seis horas después del montaje del ensayo y los porcentajes de germinación obtenidos con relación al testigo absoluto al finalizar las observaciones (doce horas de evaluación), fueron del 28 y 21.2% respectivamente. El valor alcanzado por el testigo fue de 42 esporas germinadas con relación a 50 esporas evaluadas (84% de germinación). Los demás materiales no permitieron la germinación durante el tiempo en que se realizó el seguimiento.
DISCUSIÓN DE RESULTADOS
Con base en los resultados obtenidos en las evaluaciones de fitotoxicidad se puede afirmar que ninguno de los tratamientos afecta el desarrollo foliar de las plantas de tomate de árbol (S. betacea.). Los riesgos de fitotoxicidad inherentes a su aplicación bajo las condiciones evaluadas son muy bajos o nulos, incluso manejando dosis y frecuencias de aplicación altas. No obstante, es aventurado asegurar de manera contundente que estos productos sean totalmente inocuos para las estructuras vegetativas y reproductivas de las plantas; es necesario practicar evaluaciones que permitan verificar los efectos sobre la floración, el crecimiento y el desarrollo de frutos, entre otros.
Los estudios de actividad antifúngica del AE de T. vulgaris y C. citratus, y sus componentes mayoritarios, timol y citral, muestran que todos son activos contra C. acutatum bajo condiciones in vitro. La actividad observada puede ser atribuida a daños letales sobre la célula fúngica, ya que se alteran la capacidad reproductiva y germinativa; sin embargo, no se cuenta con la información adecuada que posibilite determinar el sitio o sistemas biológicos afectados por estos materiales. El timol a 125 mg/ L y citral a 300 mg/L presentaron el efecto más significativo, ya que no permitieron el desarrollo micelial del hongo e inhibieron completamente la esporulación y la germinación de las esporas. Los resultados obtenidos con timol coinciden con la publicación de Hernández et al. (19); quienes reportan que este compuesto inhibió totalmente el crecimiento micelial de los hongos Microsporum canis y Trichophytum mentagrophytes a 100 mg/L y de T. rubrum a 50 mg/L. Bravo et al. (20) encontraron que el timol inhibe en un 100% el desarrollo micelial del hongo fitopatógeno Fusarium moniliforme, e igualmente Muller-Rieabau et al. (21) registran que el timol y su isómero estructural, carvacrol (componente mayoritario de los AE de Satureja thymbra y Thymbra spicata), inhiben completamente el crecimiento micelial de los hongos Rhizoctonia solani, Fusarium moniliforme, Sclerotinia sclerotiorum y Phytopthora capsici a 100 mg/L. Asimismo, el citral también ha sido reconocido por su actividad antifúngica; García et al. (22) informan que el citral y el citronelal inhiben la germinación de las conidias y el crecimiento micelial de Colletotrichum musae.
Los aceites esenciales de tomillo (Thymus vulgaris) y limoncillo (C. citratus) ocasionaron una inhibición total del crecimiento micelial in vitro de C. acutatum durante las primeras 72 horas de análisis, superando incluso la actividad mostrada por el Manzate® en las concentraciones evaluadas. Adicionalmente, el AE de limoncillo a 350 y 400 mg/L inhibe la germinación de esporas en un 100%, mientras que el AE de tomillo a 350 y 400 mg/L la permite en baja extensión, 21.2 y 28.0% respectivamente. Los AE de T. vulgaris y C. citratus a 400 mg/L mantienen un porcentaje de inhibición que oscila entre el 80 y 90 % al cabo de 96 y 168 horas de evaluación, comparable con aquellos obtenidos con el fungicida comercial Chlorotalonil® a 200 y 250 mg/L, y el citral a 250 mg/L. Los resultados obtenidos con los tratamientos realizados con los aceites esenciales de tomillo y limoncillo presentan correspondencia con los reseñados en la literatura. En las evaluaciones realizadas por Maruzzuella y Balter (23), utilizando los aceites esenciales de estas plantas sobre diferentes hongos, encontraron que los porcentajes de inhibición del crecimiento del fitopátogeno Fusarium oxysporum, oscilan entre 32 y 38 %. Asimismo, Bravo et al. (20) encontraron que el aceite esencial de T. vulgaris inhibe el desarrollo del hongo Fusarium moniliforme en un 55%. La actividad de los AE de tomillo y limoncillo guarda una relación muy estrecha con los constituyentes mayoritarios presentes en ellos, timol y citral, respectivamente. Sin embargo, para determinar el potencial real de este tipo de materiales como sustancias para el control del hongo fitopatógeno, se requiere de evaluaciones de actividad más profundas y a nivel de campo.
De otro lado, el fungicida comercial Manzate® presentó una baja capacidad inhibitoria del crecimiento micelial al ser comparado con los demás materiales evaluados; sin embargo, es ampliamente utilizado en el control de la antracnosis en los cultivos de tomate de árbol; Osorio (24) plantea que la baja efectividad observada en las evaluaciones in vitro de este fungicida puede estar ocasionada por su baja solubilidad en agua y limitada difusión de los iones metálicos cobre y manganeso de este carbamato, en los medios de cultivo.
AGRADECIMIENTOS
Los autores agradecen a la División de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín (DIME), por la financiación del proyecto código 030802662.
REFERENCIAS BIBLIOGRÁFICAS
1. Freeman S, Katan T, Shabi E. Characterization of Colletotrichum species responsible for anthracnose diseases of various fruits. Plant Dis. 1998; 82 (6): 596-605. [ Links ]
2. Jeffries P, Dodd JC, Jeger MJ, Plumbey RA. The biology and control of Colletotrichum species on tropical fruit crops. Plant Pathol. 1990; 39 (3): 343-366. [ Links ]
3. Afanador KL, Dror M, Maymon M, Stanley F. Characterization of Colletotichum isolates from tamarillo, passiflora, and mango in Colombia and identification of a unique specie from Genus. Ecology and Populations Biology. 2003; 93 (5): 579-587. [ Links ]
4. Capdeville G, Beer SV, Watkins CB, Wilson CL, Tedeschi LO, AistJR.Pre-and post-harvest harpintreatmentsofapples induce resistance to blue mold. Plant Dis. 2003; 87 (1): 39-44. [ Links ]
5. Wilson CL, Wisniewiski ME, editores. Biological control of postharvest diseases of fruits and vegetables. Theory and practice. Florida: CRC Press; 1995. [ Links ]
6. Tripathi P, Dubey NK. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest Biol Tec. 2004; 32 (3): 235-245. [ Links ]
7. Addor RW. Insecticides. En: Godfrey CRA, editor. Agrochemicals from Natural Products. New York: Marcel Dekker; 1995. p. 1-63. [ Links ]
8. Oxenham SK. Classification of an Ocimum basilicum germplasm collection and examination of the antifungal effects of the essential oil of basil [Tesis doctoral]. Glasgow: University of Glasgow; 2003. [ Links ]
9. Ahmet C, Saban K, Hamdullah K, Ercan K. Antifungal properties of essential oil and crude extracts of Hypericum linarioides Bosse. Biochem Syst Ecol.2005; 33 (3): 245-256. [ Links ]
10. Karmen V, Bojana B, Margareta V, Pohleven F. Effect of the antifungal activity of oxygenated aromatic essential oil compounds on the white-rot Trametes versicolor and the brown-rot Coniophora puteana. Int Biodeter and Biodegr. 2003; 51 (1): 51-59. [ Links ]
11. Dawidowicz A, Rado E, Wianowska D, Mardarowicz M, Gawdzik J. Application of PLE for the determination of essential oil components from Thymus vulgaris L. Talanta. 2006; 76 (4): 878-884. [ Links ]
12. Winward GP, Avery LM, Stephenson T, Jefferson B. Essential oils for the disinfection of grey water. Water Res. 2008; 42 (8-9): 2260-2268. [ Links ]
13. Rota MC, Herrera A, Martínez RM, Sotomayor JA, Jordán MJ. Antimicrobial activity and chemical composition of Thymus vulgaris, Thymus zygis and Thymus hyemalis essential oils. Food Control. 2008; 19 (7): 681-687. [ Links ]
14. Wilson ND, Ivanova MS, Watt RA, Moffat AC. The quantification of citral in lemongrass and lemon oils by near-infrared spectroscopy. J Pharm Pharmacol. 2002; 54 (9): 1257-1267. [ Links ]
15. Carlini EA, Contar J, Silva-Filho AR, Silveira-Filho N, FrochtengartenML, BuenoO. Pharmacology of lemongrass (Cymbopogon citratus Stapf). I. Effects of teas prepared from the leaves on laboratory animals. J Ethnopharmacol. 1986; 17 (1): 37-64. [ Links ]
16. Mishra AK, Dubey NK. Evaluation of some essential oils for their toxicity against fungi causing deterioration of stored food commodities. Appl Environ Microbiol. 1994; 60 (4): 1101-1105. [ Links ]
17. Wannisorn B, Jarikasem S, Soontorntanasart T. Antifungal activity of lemon grass oil and lemon grass oil cream. Phytother Res. 1996; 10 (7): 551-554. [ Links ]
18. Norma Técnica Colombiana NTC 736 - Plaguicidas. Ensayos para determinar la fitotoxicidad simulando aplicaciones convencionales. Bogotá: Instituto Colombiano de Normas Técnicas y Certificación, ICONTEC; 1976. [ Links ]
19. Hernández L, Rodríguez JM, García D, Pino AJ. Actividad antidermatofítica in vitro de aceites esenciales. Rev Cubana Plant Med. 2003. 8 (2).[ Sitio en internet]. Disponible en: http://bvs. sld.cu/revistas/pla/vol8_2_03/pla04203.htm. Consultado: 20 de octubre de 2008. [ Links ]
20. Bravo LL, Bermúdez TK, Montes-Belmont R. Inhibición del Fusarium moniliforme Sheld mediante polvos vegetales y algunos de sus componentes químicos. Manejo Integrado de Plagas. 2000; 57: 29-34. [ Links ]
21. Muller-Riebau MF, Berger B, Yegen O. Chemical composition and fungitoxic properties of phytopathogenic fungi of essential oils selected aromatic plants growing wild in Turkey. J. Agric Food Chem. 1995; 43 (8): 2262-2266. [ Links ]
22. García R, Alves ESS, Santos MP, Viégas GMF, Fernándes AA, Santos R, Ventura JA, Fernándes PMB. Antimicrobial activity andpotentialuseof monoterpenes astropicalfruits preservatives. Braz J Microbiol. 2008; 39 (1): 163-168. [ Links ]
23. Marruzuella JC, Balter J. The action of essential oils on phytopatogenic fungi. Plant Dis Rep. 1959; 43 (11): 1143-1147 [ Links ]
24. Osorio CJ. Control químico de la antracnosis del ñame Diascorea alata, L. causada por Colletotrichum gloesporiodes Penz. Fitopatología Colombiana. 1989; 13 (2): 72-77. [ Links ]
Recibido: Julio 31 de 2008.
Aceptado: Noviembre 18 de 2008.
* Autor a quien debe dirigirse la correspondencia: cmgarcia@unalmed.edu.co; cmgarcia@unal.edu.co