Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.1 Medellín Jan./Apr. 2009
REVISIONES
Neurotoxinas de invertebrados como alternativas terapéuticas y herramientas en investigación básica
Neurotoxins from invertebrates as alternative therapeutic agents and tools in basic research
Jaime A. PEREAÑEZ,1*; Leidy J. VARGAS.1
1Programa Ofidismo/Escorpionismo. Universidad de Antioquia. A.A. 1226. Medellín, Colombia
RESUMEN
Los venenos que producen los animales son una mezcla compleja de proteínas, péptidos, enzimas y trazas de elementos no proteicos tales como carbohidratos y sales, cuya finalidad es inmovilizar la presa y comenzar a digerirla. Las toxinas son sustancias aisladas de venenos, con una o varias acciones específicas sobre las víctimas. Entre estos compuestos, son numerosos los que tienen acción sobre receptores específicos ubicados en el sistema nervioso central y/o periférico, mientras que otros ejercen sus efectos actuando sobre otras proteínas. Desde el descubrimiento en 1971, del péptido que dio origen al Captopril, y teniendo en cuenta que muchas toxinas son útiles como herramientas para el estudio de procesos fisiológicos, se comenzó a mirar los venenos de animales como fuentes ricas en compuestos bioactivos y a pensar en su uso potencial como agentes terapéuticos. Así pues, en la actualidad disponemos de diferentes medicamentos y herramientas diagnósticas o de investigación básica derivados de toxinas. Esta revisión, basada en publicaciones realizadas en los últimos 10 años, busca proporcionar una visión actual del uso de algunas de estas moléculas como herramientas en diferentes campos de la biomedicina y la farmacia, y en su aplicación como nuevas alternativas terapéuticas o como modelos en el diseño de las mismas.
Palabras clave: Veneno, neurotoxina, receptor, agentes terapéuticos.
ABSTRACT
Animal venoms are a complex mixture of proteins, peptides, enzymes and trace elements such as carbohydrates and salts, which aim to immobilize the prey and begin digestion. Toxins are isolated substances from venons, with one or more specific actions on victims. Many of these compounds have action on specific receptors located on the central and/or peripheral nervous system, while others exert their effects by acting on other proteins. Since the discovery in 1971 of the peptide that gave rise to Captopril and the fact that a lot of toxins are useful as tools for physiological process studies, animal venoms began to be watched as sources rich in bioactive compounds and its potential use as therapeutic agents is now considered. There are now different drugs and diagnostic or basic investigation tools derivated from toxins. This review based on publications from the last 10 years pretends to provide a current view of the use of some of these molecules as tools in different fields of biomedicine and pharmacy, and in the application of these as new alternative therapeutic agents or as models in designing them.
Key words: Venom, neurotoxin, receptor, therapeutic agents.
INTRODUCCIÓN
Existen animales con la capacidad de producir sustancias que pueden alterar los procesos fisiológicos normales de otras especies. Tales sustancias reciben el nombre de venenos, los cuales están compuestos por proteínas, péptidos, enzimas y trazas de elementos no proteicos tales como carbohidratos y sales. El veneno, utilizado para inmovilizar la presa y/o comenzar a digerirla, es producido y almacenado en reservorios especiales conocidos como glándulas venenosas (1). Por otro lado, se llama toxina a una molécula aislada, extraída o derivada del veneno de un animal, planta o microorganismo y que posee una acción específica (2). Los mecanismos de acción de las toxinas incluyen acciones sobre diversos órganos y sistemas, como por ejemplo el sistema nervioso central o periférico, donde actúansobre canales iónicos,operando como agonistas o antagonistas de receptores de neurotransmisores e inhibiendo los transportadores de los mismos, entre otras acciones (3, 4, 5, 6).
Desde el descubrimiento de Ondetti y colaboradores en 1971, del péptido que dio origen al Captopril a partir del veneno de la serpiente Bothrops jararaca se comenzó a observar los venenos de animales como fuentes ricas en compuestos bioactivos y a pensar en el uso potencial de dichas sustancias (7, 8). Los venenos de invertebrados no han sido ajenos a estas investigaciones, ya que desde 1985, después del descubrimiento del péptido ω-MVIIA, aislado de Conos magus y que dio origen al Ziconitide (fármaco para el tratamiento del dolor en pacientes con cáncer), se han descrito diferentes toxinas aisladas de conos, arañas, avispas y escorpiones, que han llevado al desarrollo de otros agentes terapéuticos y a la descripción de procesos involucrados en la neuroquímica (9, 10). Debido a las actividades descritas y las investigaciones realizadas acerca del uso potencial de toxinas, esta revisión busca proporcionar una visión actual del uso de las neurotoxinas aisladas de animales invertebrados, como herramientas en diferentes campos de la biomedicina y la farmacia, y en su aplicación como nuevas alternativas terapéuticas o como modelos en el diseño de las mismas.
Neurotoxinas aisladas de caracoles marinos (Conotoxinas)
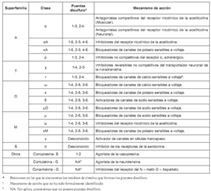
Las conotoxinas son péptidos obtenidos de los caracoles del genero Conus, predadores de moluscos que emplean su veneno para inmovilizar a sus presas; poseen entre 8 y 30 residuos aminoacídicos, pero a pesar de su pequeño tamaño contienen muchos de los elementos estructurales presentes en las grandes proteínas, tales como α hélices, hojas β, giros β y puentes disulfuro. Interesante es anotar que ellas también son blanco de innumerables modificacionespostraduccionales, entre las que se destacan amidación en la region C - terminal,hidroxilación,carboxilación,bromación, glucosilación ysulfatación (11),porloqueson llamadas a menudo como Miniproteínas. Estas toxinas han sido divididas en superfamilias, dependiendo de la forma de sus puentes disulfuro, y subdivididas en clases, de acuerdo a su mecanismo de acción o a su blanco farmacológico (12) (Véase tabla 1).
α -Conotoxinas: Son toxinas antagonistas de los receptores nicotínicos de la acetilcolina (rACh-N); son canales iónicos dependientes de ligandos que juegan un papel muy importante en la transmisión sináptica a lo largo del sistema nervioso central (13). Existen dos subclases de α-Conotoxinas, capaces de discriminar entre rACh-N ubicados en el músculo y en las neuronas (14). Estos péptidos son antagonistas que actúan sobre un subtipo de receptor, por ejemplo, la toxina GID, aislada de Conus geographus, tiene actividad sólo sobre los receptores subtipo σ3β2, mientras que AuIB, aislado de C. audicus, es activa frente a los subtipo σ3β4 (15, 16). Tal especificidad sobre los subtipos de receptores convierte a este tipo de toxinas en una herramienta valiosa para el estudio de los subtipos de rACh-N. Por otro lado, otras α-Conotoxinas pueden llegar a tener implicaciones en el desarrollo de agentes terapéuticos; por ejemplo, el péptido Vc1.1 aislado de C. victoriae mostró resultados promisorios como molécula que puede conducir al desarrollo de fármacos analgésicos (Véase tabla 2), ya que ha sido demostrado que esta toxina disminuye la respuesta vascular al dolor en ratas (17). El descubrimiento de esta toxina permite asimismo el modelamiento computacional de las interacciones de ligandos que tienen acción sobre los rACh-N neuronales, y estos modelos derivados de la homología tridimensional de las proteínas que unen acetilcolina permiten identificar las interacciones precisas de este tipo de toxinas con los diferentes subtipos de receptores (18, 19).
Tabla 1. Clasificación de las conotoxinas y mecanismo de acción (12).
Tabla 2. Conotoxinas usadas en estudios preclínicos y clínicos para el tratamiento de algunas enfermedades.
ρ - Conotoxinas: Son moléculas del tipo inhibidor no competitivo de los receptores α1-adrenérgicos (20), aisladas de C. tulipa, los cuales median la respuesta de la liberación de noradrenalina en los nervios simpáticos (21). La liberación de este neurotransmisor está involucrada en la modulación del tono vascular; es así como las ρ -conotoxinas tienen potencial en el tratamiento de la hipertensión.
χ - Conotoxinas: Este tipo de moléculas son aisladas de C. marmoreus inhibidoras del transportador de la noradrenalina, (20). Estos transportadores son importantes en la reducción de la concentración de la noradrenalina liberada desde las neuronas, e influyen en los procesos de aprendizaje, memoria, así como en funciones autonómicas y endocrinas (22). Los fármacos que inhiben este tipo de transportadores tienen efectos antidepresivos y/o psicoestimulantes (23), producen analgesia, al mejorar la neurotransmisión por las vías descendentes de la medula espinal (24), y pueden ser útiles en el tratamiento de desórdenes cardiovasculares e incontinencia urinaria (25). También ha sido probado que el péptido χ -MrIA aislado de C. marmoreus produce analgesia en el ensayo del plato caliente después de su inyección intratecal en ratones (26). Su efecto en el tratamiento del dolor neuropático fue más potente que el de la morfina (27).
μ - Conotoxinas: Son péptidos obtenidos del veneno de C. geographus; inhibidores de los canales de sodio sensibles a voltaje, tienen una elevada especificidad y selectividad por los diferentes subtipos de canales, llegando a discriminar entre las diferentes isoformas de los poros sódicos ubicados en el músculo, neuronas o corazón. Tales características han hecho de ellos herramientas imprescindibles en el estudio de este tipo de canales (28,29).
ω -Conotoxinas: Son toxinas derivadas del cono C. geographus, inhibidoras de los canales de calcio sensibles a voltaje, los cuales controlan varios procesos fisiológicos, tales como la liberación de neurotransmisores y la contracción muscular (30). Este tipo de canales son de los más heterogéneos, poseen al menos seis tipos llamados L, N, P, Q, R y T, cada uno de ellos con diferentes subtipos (31). Como muchas de las anteriores, la selectividad por los diferentes subtipos de poros iónicos de las ω-conotoxinas han hecho de ellas excelentes herramientas fisiológicas para el estudio de este tipo de canales iónicos (32, 33, 34). Además, los péptidos de esta clase, con actividad sobre los canales de calcio del tipo N, poseen un potencial terapéutico en el tratamiento del dolor agudo y neuropático (35); ejemplo de ello es el péptido CVID (AM-336, AMRAD), aislado de C. catus, actualmente en la fase II de estudios clínicos, mientras que un análogo sintético del MVIIA (Ziconitide), aislado de C. magus, está en la fase III de estudios clínicos para el tratamiento del dolor en pacientes con cáncer (36) (Véase tabla 2).
δ -Conotoxinas: Son toxinas aisladas del veneno de C. textile que, a diferencia de las μ - Conotoxinas, que bloquean los canales de sodio dependientes de voltaje, causan un retraso en la inactivación de este tipo de canales iónicos, por lo que constituyen activadores de los mismos. Recientemente, el péptido EVIA, aislado de C. ermeneus, mostró efectos sobre los canales sódicos neuronales, pero no sobre los musculares, por lo que se considera su potencial en el tratamiento de enfermedades caracterizadas por una defectuosa conducción nerviosa defectuosa (37, 38).
Conantokinas: Son pequeños péptidos (17-27 aminoácidos) encontrados en venenos de Conus sp, que bloquean el receptor del N - metil - D - Aspartato (NMDA), un tipo de receptor del glutamato (39), el cual está relacionado con acciones inhibitorias sobre el sistema nervioso central. Dentro de este grupo de conotoxinas se encuentra la canantokina G, en el momento en estudio clínico como medicamento en el tratamiento de la epilepsia (Véase tabla 2). Esta toxina produjo hiperactividad cuando fue inyectada en el cerebro de ratones adultos; así mismo demostró ser un potente bloqueador de las actividades del NMDA en porciones cerebrales extraídas de rata, tal bloqueo es no competitivo; también se ha demostrado que esta conotoxina es neuroprotectora en el modelo de isquemia cerebral transitoria en ratas (40), y también fue activo en el modelo de enfermedad de Parkinson (41). A este grupo también pertenecen las conantokinas R, L y T que, de la misma manera, han demostrado su potencial como anticonvulsivantes (42).
μ - Conotoxinas: Son péptidos obtenidos del veneno de C. geographus; inhibidores de los canales de sodio sensibles a voltaje, tienen una elevada especificidad y selectividad por los diferentes subtipos de canales, llegando a discriminar entre las diferentes isoformas de los poros sódicos ubicados en el músculo, neuronas o corazón. Tales características han hecho de ellos herramientas imprescindibles en el estudio de este tipo de canales (28,29).
ω -Conotoxinas: Son toxinas derivadas del cono C. geographus, inhibidoras de los canales de calcio sensibles a voltaje, los cuales controlan varios procesos fisiológicos, tales como la liberación de neurotransmisores y la contracción muscular (30). Este tipo de canales son de los más heterogéneos, poseen al menos seis tipos llamados L, N, P, Q, R y T, cada uno de ellos con diferentes subtipos (31). Como muchas de las anteriores, la selectividad por los diferentes subtipos de poros iónicos de las ω-conotoxinas han hecho de ellas excelentes herramientas fisiológicas para el estudio de este tipo de canales iónicos (32, 33, 34). Además, los péptidos de esta clase, con actividad sobre los canales de calcio del tipo N, poseen un potencial terapéutico en el tratamiento del dolor agudo y neuropático (35); ejemplo de ello es el péptido CVID (AM-336, AMRAD), aislado de C. catus, actualmente en la fase II de estudios clínicos, mientras que un análogo sintético del MVIIA (Ziconitide), aislado de C. magus, está en la fase III de estudios clínicos para el tratamiento del dolor en pacientes con cáncer (36) (Véase tabla 2).
δ -Conotoxinas: Son toxinas aisladas del veneno de C. textile que, a diferencia de las μ - Conotoxinas, que bloquean los canales de sodio dependientes de voltaje, causan un retraso en la inactivación de este tipo de canales iónicos, por lo que constituyen activadores de los mismos. Recientemente, el péptido EVIA, aislado de C. ermeneus, mostró efectos sobre los canales sódicos neuronales, pero no sobre los musculares, por lo que se considera su potencial en el tratamiento de enfermedades caracterizadas por una defectuosa conducción nerviosa defectuosa (37, 38).
Conantokinas: Son pequeños péptidos (17-27 aminoácidos) encontrados en venenos de Conus sp, que bloquean el receptor del N - metil - D - Aspartato (NMDA), un tipo de receptor del glutamato (39), el cual está relacionado con acciones inhibitorias sobre el sistema nervioso central. Dentro de este grupo de conotoxinas se encuentra la canantokina G, en el momento en estudio clínico como medicamento en el tratamiento de la epilepsia (Véase tabla 2). Esta toxina produjo hiperactividad cuando fue inyectada en el cerebro de ratones adultos; así mismo demostró ser un potente bloqueador de las actividades del NMDA en porciones cerebrales extraídas de rata, tal bloqueo es no competitivo; también se ha demostrado que esta conotoxina es neuroprotectora en el modelo de isquemia cerebral transitoria en ratas (40), y también fue activo en el modelo de enfermedad de Parkinson (41). A este grupo también pertenecen las conantokinas R, L y T que, de la misma manera, han demostrado su potencial como anticonvulsivantes (42).
Neurotoxinas aisladas de arañas y avispas
En la década de los años 80 se dio a conocer un nuevo grupo de toxinas; philanthotoxina, jorotoxina y argiotoxina, aisladas de los venenos de la avispa solitaria Philanthus triangulum y de las arañas Nephila clavata y Argiope trifasciata respectivamente. Fueron clasificadas como acilpoliaminas o toxinas poliamínicas, que han demostrado actividad bloqueadora de las sinapsis glutaminérgicas (43, 44, 45). Se han subdividido en dos tipos: (a) toxinas poliamínicas que contienen aminoácidos y (b) Toxinas poliamínicas que no contienen aminoácidos.
Neurotoxinas aisladas de arañas y avispas
En la década de los años 80 se dio a conocer un nuevo grupo de toxinas; philanthotoxina, jorotoxina y argiotoxina, aisladas de los venenos de la avispa solitaria Philanthus triangulum y de las arañas Nephila clavata y Argiope trifasciata respectivamente. Fueron clasificadas como acilpoliaminas o toxinas poliamínicas, que han demostrado actividad bloqueadora de las sinapsis glutaminérgicas (43, 44, 45). Se han subdividido en dos tipos: (a) toxinas poliamínicas que contienen aminoácidos y (b) Toxinas poliamínicas que no contienen aminoácidos.
Las acilpoliaminas son toxinas que bloquean de forma no competitiva los receptores catiónicos del glutamato, especialmente los del NMDA (46, 47, 48). Además, algunas tienen una característica importante: su capacidad selectiva para antagonizar otros receptores glutaminérgicos permeables al calcio, como los del ácido α - amino - 3 - hidroxi -5 - metil - 4 - isoxazol propiónico (AMPA) o el de la kainita (KA); adicionalmente la estructura y función de dichos receptores han sido estudiados con las argiotoxinas, jorotoxinas y philanthotoxinas (49, 50). Los efectos biológicos de la jorotoxina sobre estos receptores se hicieron evidentes después de una inyección intracerebroventricular a ratones (4.7 nmol/ratón). En estas dosis, la toxina antagonizó las convulsiones inducidas por el AMPA, pero no demostró ninguna acción sobre el NMDA, además no presentó toxicidad alguna (51). Los efectos de las poliaminas sobre este tipo de receptores las constituyen en posibles compuestos que lleven al desarrollo de fármacos anticonvulsivantes o antiepilépticos, o en el tratamiento de enfermedades neurodegenerativas como el Parkinson (50).
El veneno de las arañas del género Agelenopsis también ha sido estudiado y se ha aislado un grupo de toxinas conocido como ω - agatoxinas, las cuales son polipéptidos heterogéneos ricos en cisteínas y puentes disulfuro; su peso molecular varía entre 5 y 10 KDa y actualmente se clasifican de acuerdo con su homología, selectividad y mecanismo de acción (52). Por ejemplo, la ω - agatoxina IVA ha sido particularmente útil en la elucidación del papel de varios tipos de canales de calcio en la liberación de neurotrasmisores. Esta toxina es un potente bloqueador de los canales de calcio tipo P/Q en mamíferos, asociados con la contracción en los vasos renales de resistencia y no posee efectos sobre los canales del tipo T, L o N, asociados con despolarización de las células de músculo liso vascular de mamíferos (53, 54); además, esta toxina demostró actividad anticonvulsivante en ensayos en los que se usaron ratones DBA/2 estimulados con ruido intenso (55).
La araña de las bananeras de Suramérica, Phoneutria nigriventer, también posee una fracción neurotóxica llamada PhTx3, capaz de proteger el hipocampo y las células SN56 contra el daño causado por isquemia, al actuar sobre canales de calcio tipo P/Q. Tal mecanismo de acción evita tanto la liberación de glutamato dependiente de este catión, como el incremento de las concentraciones del mismo, inducidas por la despolarización con K+ (56, 57).
Por otro lado la Psalmotoxina 1, aislada de la tarántula suramericana Psalmopoeus cambridgei, bloquea los canales de voltaje sensibles a H+ (58). Ha sido reportado que este tipo de canales juega un papel importante en innumerables condiciones patológicas, tales como isquemia cerebral y epilepsia, y también son responsables de la sensación de dolor que acompaña la acidosis en los tejidos y la inflamación (59). Así pues, su mecanismo de acción hace de ella un posible agente en el desarrollo de fármacos analgésicos y anticonvulsivantes.
Neurotoxinas aisladas de escorpiones
Los venenos de escorpiones son una mezcla de polipéptidos neurotóxicos que actúan sinérgicamente sobre un amplio rango de estructuras, en particular canales iónicos de Na+, K+, Cl- o Ca2+, presentes en células excitables y no excitables (60).
Toxinas que bloquean los canales de K+: El uso de este tipo de péptidos ha proporcionado información importante en cuanto a los canales de K+. La identificación de la región del poro del canal iónico (61, 62), y la determinación de la composición tetramérica del mismo (63), sólo fue posible después del uso de toxinas de escorpión, las cuales, además, han sido herramientas invaluables en la purificación de canales iónicos, la determinación del tipo de subunidades que los componen (64) y la comprensión del papel fisiológico de canales específicos (65).
Se ha propuesto su potencial uso terapéutico como inmunosupresores (66), porque algunos canales de K+ ejercen acciones fisiológicas importantes en los linfocitos T, por ejemplo, los canales iónicos tipo Kv1.3 controlan el potencial de membrana en reposo, su bloqueo causa despolarización, lo que lleva a una disminución del Ca2+ intracelular, contrario a lo que ocurre en la activación de estas células. Con respecto a esta acción, la margarotoxina, aislada de Centruroides margaritatus, causó disminución de la hipersensibilidad inmune en minicerdos de Yucatán (usados porque su sistema inmune se asemeja en gran proporción a el de los humanos) (67). Recientemente la kaliotoxina, aislada de Androctonus mauretanicus, redujo la severidad clínica de la encefalitis autoinmune, que es un modelo de la esclerosis múltiple realizado en ratones (68, 69). A pesar de estos resultados promisorios, se requieren estudios posteriores que lleven al desarrollo de herramientas que discriminen entre los diferentes tipos de canales, para evitar los posibles efectos colaterales, tales como la diarrea y la sudoración (70).
Toxinas que bloquean los canales de Na+: Son péptidos clasificados en α y β toxinas, las cuales respectivamente se unen a los sitios 3 y 4, del loop extracelular del dominio II del canal de sodio sensible a voltaje (71), e igualmente han proporcionado información importante acerca de la estructura y el funcionamiento de tales canales iónicos (72, 73).
Otra aplicación importante de estas toxinas se basa en su capacidad para distinguir entre los canales sódicos de vertebrados e invertebrados. Las toxinas que son selectivas para los canales de insectos, pueden ser útiles como modelos en el desarrollo de insecticidas (74, 75, 76). Dado que el uso intensificado e inconsciente de múltiples insecticidas ha llevado a una gran cantidad de especies de insectos a desarrollar resistencia, han surgido numerosos proyectos para reemplazar dichas sustancias químicas. Por ejemplo, la ausencia de toxicidad de AaIT, péptido aislado de Androctonus australis Hector, hacia los canales sódicos de mamíferos y su alta especificidad por los canales de insectos, han permitido usar este péptido como potenciador de la capacidad insecticida del bacuolovirus (77), que son un grupo de virus específicos de artrópodos. La inserción en el virus del gen que codifica para AaIT, ocasionó un aumento en la velocidad con la que el virus mata los insectos, particularmente lepidópteros. Aunque los resultados son prometedores, son necesarias más investigaciones antes de que los bacuolovirus recombinantes puedan ser considerados como una alternativa o complemento para los insecticidas que se usan actualmente (78).
Por otro lado, del escorpión Buthus martensi también se han aislado péptidos con actividad sobre estos poros iónicos, pero su preferencia se dirige hacia los canales de Na+ de vertebrados. Uno de éstos péptidos es el BmKAEP, que demostró actividad anticonvulsivante, aunque aún no se sabe a ciencia cierta si la acción sobre tales poros iónicos es la responsable de sus efectos anticonvulsivantes (79). Otros péptidos, como BmKIT2 (80) y el BmKAS (81), han demostrado actividad analgésica al actuar sobre el mismo tipo de canales iónicos, en vías aferentes nociceptoras. En conclusión, estos péptidos pueden llegar a ser útiles como modelo en el desarrollo de moléculas analgésicas y anticonvulsivantes.
Toxinas que bloquean los canales de Cl-: Estos canales se encuentran entre las muchas proteínas de membrana que se sobreexpresan en diferentes tipos de cáncer. La clorotoxina aislada de Leiurus quinquiestratus (82) se une a canales de cloro de baja conductancia; además, la 131I-Clorotoxina posee actividad citolítica, por lo tanto tiene cierta selectividad por tumores y gliomas de origen neuroectodérmico (83, 84). Con base en estos hallazgos, TransMolecular Inc. está llevando a cabo estudios clínicos con 131I -TM - 601 (131I-Clorotoxina) como nuevo fármaco en el tratamiento de gliomas.
Neurotoxinas aisladas de anémonas
En los últimos años se ha reportado que varias especies de anémonas producen péptidos citolíticos y proteínas, los cuales han sido clasificados de acuerdo a su estructura y función. Uno de estos grupos bloquea canales de potasio (85, 86, 87). Así, el veneno de Stichodactyla helianthu, una anémona de amplia distribución en las costas de Cuba, ha sido utilizado como fuente de bloqueadores de potasio y citolisinas (88, 89). La toxina ShK, aislada de esta especie, bloquea los canales de potasio sensibles a voltaje del tipo Kv1.1 y Kv1.3, mientras que su derivado sintético, ShK - Dap 22, en el cual la Lys 22 ha sido sustituida por un ácido diaminopropiónico, bloquea los canales de potasio tipo Kv1.3 (86, 90). Como se mencionó anteriormente, estos canales tienen un papel muy importante en la activación de los linfocitos T (66, 67) y deben tenerse en cuenta como posibles blancos farmacológicos para el tratamiento de enfermedades autoinmunes mediadas por este tipo de células, tales como la esclerosis múltiple; además, se podría pensar en su posible utilidad en la prevención del rechazo crónico de trasplantes (90).
CONCLUSIONES
Durante miles de años la naturaleza ha sido una fuente rica de sustancias bioactivas. Las toxinas derivadas del veneno de numerosos animales, las cuales pueden ser péptidos, proteínas y/o enzimas, que además presentan actividades farmacológicas importantes, son ejemplo de ello. Estudios básicos sobre la estructura, actividad y blanco farmacológico de las toxinas, han llevado no sólo a un mejor entendimiento del papel de tales proteínas blanco en los procesos fisiológicos, sino también al desarrollo de nuevos fármacos dirigidos a la activación o inhibición de un proceso fisiológico en particular.
Dado que en la actualidad, el uso intensificado e inconsciente de múltiples insecticidas ha llevado a una gran cantidad de especies de insectos a desarrollar resistencia, han surgido numerosos proyectos que tienen como objetivo reemplazar dichas sustancias químicas y las toxinas se convierten ahora en una fuente viable para su desarrollo. Así mismo, hay en curso estudios clínicas de numerosas toxinas, otras son usadas en laboratorios para obtener mayor información sobre diversos procesos fisiológicos y como agentes diagnósticos, pero existe un tercer grupo que requiere una gran atención por parte de los químicos farmacéuticos, así como de otros científicos y clínicos, ya que se han obtenido resultados promisorios que pueden llevar a nuevos agentes terapéuticos, además de que algunas de ellas no pueden ser utilizadas directamente como tales dado su carácter tóxico. Los estudios futuros con este último grupo de toxinas deben estar dirigidos a la obtención del farmacóforo, tomando como punto de partida toda la información estructural y funcional disponible y las nuevas técnicas, como la síntesis de péptidos en fase sólida y la espectrometría de masas.
Además, el posible descubrimiento y caracterización de nuevas toxinas conducirá, sin duda, a la descripción de nuevos blancos farmacológicos, lo que traerá consigo profundos beneficios terapéuticos.
Finalmente, los venenos, por su propia complejidad y riqueza en moléculas bioactivas, tienen un gran potencial como fuente de agentes terapéuticos, propiedad que debe ser aprovechada por el hombre.
REFERENCIAS BIBLIOGRÁFICAS
1. Meier J, Stocker KH. Biology and distribution of venomous snakes of medical importance and the composition of snake venoms. En: Meier J, White J, editores. Handbook of Clinical Toxicology of Animal Venoms and Poisons. Boca Raton, FL: CRC Press; 1995. pp. 367-412. [ Links ]
2. Gawade S. Therapeutic alternatives from venoms and toxins. Indian J Pharmacol. 2007; 39 (6): 260-264. [ Links ]
3. Tsetlin V, Hucho F. Snake and snail toxins acting on nicotine acetylcholine receptors: fundamental aspects and medical applications. FEBS Lett. 2004; 557 (1-3): 9-13. [ Links ]
4. Silveira R, Dajas F. Neurotoxins in Neurobiology. En: Tripton KS, Dajas F,editores. Neurotoxins in Neurobiology: Their actions and applications. New York: Horwood; 1994. pp 3-26. [ Links ]
5. Sharpe IA, Gehrman J, Loughnan ML, Thomas L, Adams DA, Atkins A, et al. Two new classes of conopeptides inhibit the alpha1-adrenoceptor and noradrenaline transporter. Nat Neurosci. 2001; 4 (9): 902-907. [ Links ]
6. Donevan SD, McCabe RT. Conantokin G is an NR2B selective competitive antagonist of N-methyl-D-aspartate receptors. Mol Pharmacol. 2000; 58 (3): 614-623. [ Links ]
7. Ondetti MA, Williams NJ, Sabo EF, Pluscec J, Weaver ER, Kocy O. Angiotensin-converting enzyme inhibitors from the venom of Bothrops jararaca. Isolation, elucidation of structure, and synthesis. Biochemistry. 1971; 10 (22): 4033-4039. [ Links ]
8. Lewis R, García M. Therapeutic potential of venom peptides. Nature Rev. Drug Discov. 2003; 2 (10): 790-802. [ Links ]
9. Han TS, Teichert RW, Olivera BM, Bulaj G. Conus venoms - a rich source of peptide-based therapeutics. Curr Pharm Des. 2008; 14 (24): 2462-2479. [ Links ]
10. Beleboni RO, Pizzo AB, Fontana ACK, Carolino R, Countinho Netto J, Santos WF. Spider and wasp neurotoxins; pharmacological and biochemical aspects. Eur J Pharmacol. 2004; 493 (1-3): 1-17. [ Links ]
11. Craig AG, Bandyopadhyay P,,Olivera BM. Post-translationally modified peptides from Conus venoms. Eur J Biochem. 1999; 264 (2): 271-275. [ Links ]
12. Armishaw CJ, Alewood PF. Conotoxins as Research Tools and Drug Leads. Current Protein & Peptide Science. 2005; 6 (3): 221-240. [ Links ]
13. Nicke A, Wonnacott S, Lewis RJ. α-Conotoxins as tools for the elucidation of structure and function of neuronal nicotinic acetylcholine receptor subtypes. Eur J Biochem. 2004; 271 (12): 2305-2319. [ Links ]
14. Marshall IG, Harvey AL. Selective neuromuscular blocking properties of α-conotoxins In vivo. Toxicon 1990; 28 (2): 231-234. [ Links ]
15. Nicke A, Loughnan ML, Millard EL, Alewood PF, Adams DJ, Daly NL, et al. Isolation, Structure, and Activity of GID, a Novel α4/7-Conotoxin with an Extended N-terminal Sequence. J Biol Chem. 2003; 278 (15): 3137-3144. [ Links ]
16. Luo S, Kulak JM, Cartier GE, Jacobsen RB, Yoshikami D, Olivera B. et al . α -conotoxin AuIB selectively blocks alpha3 beta4 nicotinic acetylcholine receptors and nicotine-evoked norepinephrine release. J Neurosci. 1998; 18 (21): 8571-8579. [ Links ]
17. Sandall DW, Satkunanathan N, Keays DA, Polidano MA, Liping X, Pham V. A Novel α-Conotoxin Identified by Gene Sequencing Is Active in Suppressing the Vascular Response to Selective Stimulation of Sensory Nerves in Vivo. Biochemistry 2003; 42 (22): 6904-6911. [ Links ]
18. Dutertre S, Lewis RJ. Computational approaches to understand α-conotoxin interactions at neuronal nicotinic receptors. Eur J Biochem. 2004; 271 (12): 2327-2334. [ Links ]
19. Brejc K, van Dijk WJ, Klaasen RV, Schuurmans M, van der Oost J, Smit AB.et al. Crystal structure of an ACh-binding protein reveals the ligand-binding domain of nicotinic receptors. Nature. 2001; 411 (6835): 269-276. [ Links ]
20. Sharpe IA, Gehrmann J, Loughnan ML, Thomas L, Adams DA, Atkins A, et al. Two new classes of conopeptides inhibit the α1-adrenoceptor and noradrenaline transporter. Nat Neurosci. 2001; 4 (9): 902-907. [ Links ]
21. Langer SZ, Shepperson NB. Postjunctional α1and α2-adrenoceptors: preferential innervation of α1-adrenoceptors and the role of neuronal uptake. J. Cardiovasc. Pharmacol. 1982; 4 (1): S8-S13. [ Links ]
22. Ressler KJ, Nemeroff CB. Role of norepinephrine in the pathophysiology and treatment of mood disorders. Biol Psychiatry. 1999; 46 (9): 1219-1233. [ Links ]
23. Charney DS. Monoamine dysfunction and the pathophysiology and treatment of depression. J Clin Psychiatry 1998; 59 (14): S11-S14. [ Links ]
24. Millán MJ. Descending control of pain. Prog Neurobiol. 2002; 66: 355-474. [ Links ]
25. Andersson KE. Advances in the pharmacological control of the bladder. Exp Physiol. 1999; 84 (1): 195-213. [ Links ]
26. McIntosh JM, Corpuz GO, Layer RT, Garrett JE, Wagstaff JD, Bulaj G. Isolation and characterization of a novel Conus peptide with apparent antinociceptive activity. J Biol Chem. 2000; 275 (42): 32391-32397. [ Links ]
27. Nielsen CK, Ross FB, Lewis RJ, Drinkwater R, Smith MT. Antiallodynic efficacy of the conopeptide, Mr1A, in rats with neuropathic pain. Proc. 10th World Congress Pain 2002; A822-P92. [ Links ]
28. Moczydlowski E, Olivera BM, Gray WR, Strichartz GR. Discrimination of muscle and neuronal sodium channel subtypes by binding competition between 3H-saxitoxin and μ-conotoxins. Proc Natt Acad Sci. USA. 1986; 83 (14): 5321-5325. [ Links ]
29. Norton RS, Olivera BM. Conotoxins down under. Toxicon. 2006; 48 (7): 780-98. [ Links ]
30. Augustine GJ, Charlton MP, Smith SJ. Calcium action in synaptic transmitter release. Annu. Rev. Neurosci. 1987; 10: 633-693. [ Links ]
31. Randall AD. The molecular basis of voltage-gated Ca2+ channel diversity: is it time for T?. J Membr Biol. 1998; 161 (3): 207-213. [ Links ]
32. Olivera BM, McIntosh JM, Cruz LJ, Luque FA, Gray WR. Purification and sequence of a presynaptic peptide toxin from Conus geographus venom. Biochemistry. 1984; 23 (22): 5087-5090. [ Links ]
33. Hillyard DR, Monje VD, Mintz IM, Bean BP, Nadasdi L, Ramachandran J, et al. A new Conus peptide ligand for mammalian presynaptic Ca2+ channels. Neuron. 1992; 9 (1): 69-77. [ Links ]
34. Lewis RJ, Nielsen KJ, Craik DJ, Loughnan ML, Adams DA, Sharpe IA, et al. Novel ω-Conotoxins from Conus catus Discriminate among Neuronal Calcium Channel Subtypes. J Biol Chem. 2000; 275 (45): 35335-35344. [ Links ]
35. Miljanich GP, Ramachandran J. Antagonists of Neuronal Calcium Channels: Structure, Function, and Therapeutic Implications. Annu. Rev. Pharmacol Toxicol. 1995; 35: 707-734. [ Links ]
36. Miljanich GP. Neuronal calcium channel blocker for treating severe chronic pain. Curr Med Chem. 2004; 11 (23):29-40. [ Links ]
37. Barbier J, Lamthanh H, Le Gall F, Favreau P, Benoit E, Chen H, et al. A delta-conotoxin from Conus ermineus venom inhibits inactivation in vertebrate neuronal Na+ channels but not in skeletal and cardiac muscles. J Biol Chem. 2004; 279 (6): 4680-4685. [ Links ]
38. Volpon L, Lamthanh H, Barbie, J, Gilles N, Molgó J, Ménez A, et al. NMR solution structures of delta-conotoxin EVIA from Conus ermineus that selectively acts on vertebrate neuronal Na+ channels. J Biol Chem. 2004; 279 (20): 21356-21366. [ Links ]
39. Layer RT, Wagstaff JD, White HS. Conantokins: peptide antagonists of NMDA receptors. Curr Med Chem. 2004; 11 (23): 3073-3084. [ Links ]
40. Williams AJ, Dave JR, Phillips JB, Lin Y, McCabe RT, Tortella FC. Neuroprotective efficacy and therapeutic window of the high-affinity N - methyl - D - Aspartate antagonist Conantokin-G: In vitro (primary cerebellar neurons) and In vivo (Rat model of transient focal brain ischemia) studies. J Pharmacol. Exp Ther. 2000; 294 (1): 378-386. [ Links ]
41. Adams AC, Layer RT, McCabe RT, Keefe KA. Effects of conantokins on L - 3, 4 - dihydroxyphenylalanine - induced behavior and immediately early gene expression. Eur J Pharmacol. 2000; 404 (3): 303-313. [ Links ]
42. Mortari MR, Siqueira AO, Brandao L, Ferreira dos Santos W. Neurotoxins from invertebrades: From basic research to therapeutic application. Pharmacology & Therapeutics. 2007; 114 (2): 171-183. [ Links ]
43. Kawai N, Niwa A, Abe T. Spider venom contains specific receptor blocker of glutaminergic synapses. Brain Res. 1982; 247 (1): 169-171. [ Links ]
44. Piek T. 6-Philanthotoxin, a semi-irreversible blocker of ion channels. Comp Biochem Physiol. 1982; 72 (2): 311-315. [ Links ]
45. Spanjer W, May TE, Piek T, de Hann N. Partial purification of components from the paralysing venom of the digger wasp Philanthus triangulum and their action on neuromuscular transmission in the locust. Comp Biochem Physiol. 1982; 71 (2): 149-157. [ Links ]
46. Jones MG, Lodge D. Comparison of some arthropod toxins and toxin fragments as antagonists of excitatory amino acid-induced excitation of rat spinal neurones. Eur J Pharmacol. 1991; 204 (2): 203-209. [ Links ]
47. Karst H, Joels M, Wadman WJ, Piek T. Philanthotoxin inhibits Ca++-currents in rat hippocampal CA1 neurones. Eur J Pharmacol. 1994; 270 (4): 357-360. [ Links ]
48. Usherwood PNR, Blagbrough IS. Spider toxins affecting glutamate receptors: polyamines in therapeutic neurochemistry. Pharmacol Ther . 1991; 52 (2): 245-268. [ Links ]
49. Jones MG, Anis NA, Lodge D. Philanthotoxin blocks quisqualate-, AMPA-and kainate-, but not NMDA-, induced excitation of rat brainstem neurones in vivo. Br J Pharmacol. 1990; 101 (4): 968-970. [ Links ]
50. Stromgaard K, Mellor I. AMPA receptor ligands: synthetic and pharmacological studies of polyamines and polyamine toxins. Med Res Rev. 2004; 24 (5): 589-620. [ Links ]
51. Himi T, Saito H, Kawai N, Nakajima T. Spider toxin (JSTX-3) inhibits the convulsions induced by glutamate agonists. J Neural Transm Gen Sect. 1990; 80 (2): 95-104. [ Links ]
52. Uchitel OD. Toxins affecting calcium channels in neurons. Toxicon. 1997; 35 (8): 1161-1191. [ Links ]
53. Mintz IM, Venema VJ, widerek KM., Lee TD, Bean BP, Adams ME. P-type calcium channels blocked by the spider toxin omega- Aga-IVA. Nature 1992; 355 (6363): 827-829. [ Links ]
54. Rash LD, Hodgson WC. Pharmacology and biochemistry of spider venoms. Toxicon. 2002; 40 (3): 225-254. [ Links ]
55. Jackson HC, Scheideler MA. Behavioural and anticonvulsant effects of Ca++ channel toxins in DBA/2 mice. Psychopharmacology. 1996; 126 (1): 85-90. [ Links ]
56. Pinheiro AC, Gómez RS, Massensini AR, Cordeiro MN, Richardson M,Romano-Silva MA, et al. Neuroprotective effect on brain injury by neurotoxins from the spider Phoneutria nigriventer. Neurochem Int. 2006; 49 (5): 543-547. [ Links ]
57. Prado MA, Guatimosim C, Gómez MV, Diniz CR, Cordeiro MN, Romano-Silva MA. A novel tool for the investigation of glutamate release from rat cerebrocortical synaptosomes: the toxin Tx3-3 from the venom of the spider Phoneutria nigriventer. Biochem J. 1996; 314 (Pt 1): 145-150. [ Links ]
58. Escoubas P, de Weille JR, Lecoq A, Diochot S, Waldmann R, Champigny G, et al. Isolation of a tarantula toxin specific for a class of protongated Na+ channels. J Biol Chem. 2000; 275 (33): 25116-25121. [ Links ]
59. McCleskey EW, Gold MS. Ion channels and nociception. Annu. Rev. Physiol. 1999; 61: 835-856. [ Links ]
60. Possani LD, Merino E, Corona M, Bolívar F, Becerril B. Peptides and genes coding for scorpion toxins that affect ion-channels. Biochimie. 2000; 82 (9-10): 861-868. [ Links ]
61. MacKinnon R, Miller C. Mutant potassium channels with altered binding of charybdotoxin, a pore-blocking peptide inhibitor. Science. 1989; 245 (4924): 1382-1385. [ Links ]
62. Aiyar J, Withka JM, Rizzi JP, Singleton DH, Andrews GC, Lin W, et al. Topology of the pore-region of a K1 channel revealed by the NMR - derived structures of scorpion toxins. Neuron. 1995; 15 (5): 1169-1181. [ Links ]
63. MacKinnon R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 1991; 350 (6315): 232-235. [ Links ]
64. García-CalvoM,KnausH-G,McManusOB,GiangiacomoKM, Kaczorowski GJ, García ML. Purification and reconstitution of the high-conductance calcium-activated potassium channel from tracheal smooth muscle. J Biol Chem. 1994; 269 (1): 676-682. [ Links ]
65. García M L, Hanner M, Knaus H.-G, Koch R, Schmalhofer W, Slaughter RS, Kaczorowski GJ. Pharmacology of potassium channels. Adv. Pharmacol. 1997; 39: 425-471. [ Links ]
66. Chandy KG, Cahalan M, Pennington M, Norton RS, Wulff H, Gutman GA et al.. Potassium channels in T lymphocytes: toxins to therapeutic immunosuppressants. Toxicon. 2007; 39 (9): 1269-1276. [ Links ]
67. Koo GC, Blake JT, Talento A, Nguyen M, Lin S, Sirotina A, et al. Blockade of the voltage-gated potassium channel Kv1.3 inhibits immune responses in vivo. J Immunol. 1997; 158 (11): 5120-5128. [ Links ]
68. Beeton C, Barbaria J, Giraud P, Devaux J, Benoliel AM, Gola M, et al. Selective blocking of voltage-gated K+ channels improves experimental autoimmune encephalomyelitis and inhibits T cell activation. J Immunol. 2001; 166 (2): 936-944. [ Links ]
69. Beeton C, Wulff H, Barbaria J, Clot-Faybesse O, Pennington M, Bernard D, et al. Selective blockade of T lymphocyte K+ channels ameliorates experimental autoimmune encephalomyelitis, a model for multiple sclerosis. Proc Natl Acad Sci. U.S.A. 2001b; 98 (24): 13942-13947. [ Links ]
70. Suárez-Kurtz G, Vianna-Jorge R, Pereira B, García M, Kaczorowski G. Peptidyl inhibitors of Shaker-type Kv1 channels elicit twitches in guinea pig ileum by blocking Kv1.1 at enteric nervous system and enhancing acetylcholine release. J Pharmacol. Exp. Ther. 1999; 289 (3): 1517-1522. [ Links ]
71. Rodríguez de la Vega RC, Possani LD. Overview of scorpion toxins specific for Na+ channels and related peptides: biodiversity, structure-function relationships and evolution. Toxicon. 2005; 46 (8): 831-844. [ Links ]
72. Cestele S, Catterall WA. Molecular mechanisms of neurotoxin action on voltage-gated sodium channels. Biochimie. 2000; 82 (9-10): 883-892. [ Links ]
73. Cestele S, Scheuer T, Mantegazza M, Rochat H, Catterall WA. Neutralization of gating charges in domain II of the sodium channel alpha subunit enhances voltage-sensor trapping by a beta-scorpion toxin. J Gen Physiol. 2001; 118 (3): 291-302. [ Links ]
74. Arnon T, Potikha T, Sher D, Elazar M, Mao W, Tal T. BjalphaIT: a novel scorpion alpha-toxin selective for insects-unique pharmacological tool. Insect Biochem Mol Biol. 2005; 35 (3): 187-195. [ Links ]
75. Gordon D. A new approach to insect-pest control-combination of neurotoxins interacting with voltage sensitive sodium channels to increase selectivity and specificity. Invert Neurosci. 1997; 3 (2-3): 103 -116. [ Links ]
76. Zlotkin E, Fishman Y, Elazar M. AaIT: from neurotoxin to insecticide. Biochimie. 2000; 82 (9-10): 869-881. [ Links ]
77. Zlotkin E. The insect voltage-gated sodium channel as target of insecticides. Annu. Rev. Entomol. 1999; 44: 429-455. [ Links ]
78. Regev A, Rivkin H, Inceoglu B, Gershburg E, Hammock BD, Gurevitz M, et al. Further enhancement of baculovirus insecticidal efficacy with scorpion toxins that interact cooperatively. FEBS Lett. 2003; 537 (1-3): 106-110. [ Links ]
79. Wang CG, He XL, Shao F, Liu W, Ling MH, Wang DC, et al. Molecular characterization of an anti-epilepsy peptide from the scorpion Buthus martensi Karsch. Eur J Biochem. 2001; 268 (8): 2480-2485. [ Links ]
80. Goudet C, Chi CW, Tytgat J. An overview of toxins and genes from the venom of the Asian scorpion Buthus martensi Karsch. Toxicon. 2002; 40 (9): 1239-1258. [ Links ]
81. Chen B, Ji Y. Antihyperalgesia effect of BmK AS, a scorpion toxin, in rat by plantar injection. Brain Res. 2002; 952 (2): 322-326. [ Links ]
82. DeBin JA, Maggio JE, Strichartz GR. Purification and characterization of chlorotoxin, a chloride channel ligand from the venom of the scorpion. Am J Physiol. 1993; 264 (2 Pt 1): C361-C369. [ Links ]
83. Soroceanu L, Gillespie Y, Khazaeli MB, Sontheimer H. Use of chlorotoxin for targeting of primary brain tumors. Cancer Res. 1998; 58 (21): 4871-4879. [ Links ]
84. Lyons SA, O"Neal J, Sontheimer H. Chlorotoxin, a scorpionderived peptide, specifically binds to gliomas and tumors of neuroectodermal origin. Glia. 2002; 39 (2): 162-173. [ Links ]
85. Anderluh G, Macek P. Cytolytic peptide and protein toxins from sea anemones (Anthozoa: Actiniaria). Toxicon. 2002; 40 (2): 111-124. [ Links ]
86. Middleton RE, Sánchez M, Linde AR, Bugianesi RM, Dai G, Felix JP, et al. Substitution of a single residue in Stichodactyla helianthus peptide, ShK-Dap22, reveals a novel pharmacological profile. Biochemistry. 2003; 42 (46): 13698-13707. [ Links ]
87. Kalman K, Pennington MW, Lanigan MD, Nguyen A, Rauer H, Mahnir V, et al. ShK-Dap22, a potent Kv1.3-specific immunosuppressive polypeptide. J Biol Chem. 1998; 273 (49): 32697-32707. [ Links ]
88. Martínez D, Campos AM, Pazos F, Álvarez C, Lanio ME, Casallanovo F, et al. Properties of St I and St II, two isotoxins isolated from Stichodactyla helianthus: a comparison. Toxicon. 2001; 39 (10): 1547-1560. [ Links ]
89. Martínez D, Morera V, Álvarez C, Tejuca M, Pazos F, García Y, et al. Identity between cytolysins purified from two morphos of the Caribbean sea anemone Stichodactyla helianthus. Toxicon. 2002; 40 (8): 1219-1221. [ Links ]
90. Norton RS, Pennington MW, Wulff H. Potassium channel blockade by the sea anemone toxin ShK for the treatment of multiple sclerosis and other autoimmune diseases. Curr Med. Chem. 2004; 11 (23): 3041-3052. [ Links ]
Recibido: Diciembre 12 de 2008.
Aceptado: Febrero 17 de 2009.
* Autor a quien se debe dirigir la correspondencia: andres.pereanez@siu.udea.edu.co