Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.2 Medellín May/Sep. 2009
PRODUCTOS NATURALES
DOCKING DE CICLOARTANOS INHIBIDORES DE TIROSINASA
DOCKING OF TYROSINASE CICLOARTANE INHIBITORS.
Pablo A. GUTIÉRREZ1*; Benjamín A. ROJANO2
1 Grupo de Biotecnología Microbiana, Escuela de Biociencias, Facultad de Ciencias, Universidad Nacional de Colombia Sede Medellín. Calle 59A No 63—20. Bloque 19A-211, A.A. 3840. Medellín, Colombia.
2 Grupo de Productos Naturales y de los Alimentos, Laboratorio de Ciencia de los Alimentos, Facultad de Ciencias, Universidad Nacional de Colombia Sede Medellín. Calle 59A No 63—20. Bloque 19A-211, A.A. 3840. Medellín, Colombia.
RESUMEN
El berenjenol (21:24-epoxi-24-metil-cicloartano), aislado a partir las hojas de Oxandra cf. xylopioides (Annonaceae), y sus derivados hemisintéticos, berenjenol-3-acetato y 3-oxo-berenjenol son inhibidores de la enzima tirosinasa (EC 1.14.18.1). Estos compuestos son triterpenos de tipo cicloartano, y pese a que existen estudios de estructura actividad sobre compuestos similares, su mecanismo de inhibición no está bien establecido. En este trabajo se realiza un estudio de docking sobre el berenjenol y sus derivados, que sugiere un marco racional para interpretar la actividad de estos compuestos teniendo en cuenta sus interacciones con la tirosinasa. Este estudio permite concluir que el berenjenol actúa como inhibidor competitivo uniéndose al sitio activo de la tirosinasa mediante interacciones con los aminoácidos Ile42, Met43 Arg55, Trp184, Asn191, His194, Val195, Ala202, Met201 y Thr203.
Palabras clave:docking, tirosinasa, cicloartano, inhibidor.
ABSTRACT
Berenjenol (21:24-epoxy-24-methyl-cicloartane) isolated from leaves of Oxandra cf. xylopioides (Annonaceae), and its synthetic derivatives Berenjenol-3-acetate and 3-Oxoberenjenol are tyrosinase inhibitors (EC 1.14.18.1). These compounds are triterpenoids type cycloartanes, whose structure-activity relationship has been studied on similar compounds. However, the mechanism of inhibition of these molecules is not well understood. This paper present the results of a docking study between Berenjenol and its derivatives on tyrosinase enzyme that provides a rational framework for understanding the activity of these compounds. According to this work, Berenjenol acts as a competitive inhibitor of tyrosinase through interactions with Ile42, Met43 Arg55, Trp184, Asn191, His194, Val195, Ala202, Met201 and Thr203.
Key words: docking, tyrosinase, cicloartane, inhibitor.
INTRODUCCIÓN
La tirosinasa (EC 1.14.18.1) es una metaloenzima multifuncional que puede catalizar la oxidación de monofenoles, o-difenoles y o-quinonas (1). Esta enzima se encuentra ampliamente distribuida en bacterias, hongos, plantas y animales donde está involucrada en la formación de pigmentos de melanina. La tirosinasa es responsable del pardeamiento enzimático de frutas y vegetales, afectando drásticamente su apariencia y sabor, y juega un papel importante en el desarrollo y mecanismo de defensa de insectos al estar involucrada en la melanogénesis, curación de heridas, encapsulación de parásitos y esclerotización (2,3). En humanos, esta enzima es responsable de anormalidades en la pigmentación de piel y se ha reportado su relación con el mal de Parkinson y otras enfermedades neurodegenerativas (4).
La tirosinasa pertenece a la familia de las proteínas de cobre tipo 3, donde están incluidas además, la catecol oxidasa (EC 1.10.3.1) y el pigmento respiratorio hemocianina (5,6). El sitio activo de la enzima contiene un centro formado por dos átomos de cobre, que durante el ciclo catalítico existe en tres estados de oxidación diferentes. La forma deoxi [Cu(I)-Cu(I)] es una especie reducida que se une al oxígeno dando lugar a la forma oxi [Cu(II)-O22--Cu(II)]. En este estado, el oxígeno molecular se une como peróxido en una configuración que desestabiliza y activa el enlace O-O. La forma met [Cu(II)-Cu(II)] corresponde al estado de reposo de la enzima, donde los iones Cu[II] interactúan con ligandos pequeños como el agua o iones OH- (1).
Entre los inhibidores de tirosinasa se han reportado algunos triterpenoides, que son un grupo especial de productos naturales presentes en plantas, hongos y otros organismos vivos; estos compuestos están asociados a diversas actividades biológicas y farmacológicas (7). Los cicloartanos son triterpenos con un anillo ciclopropano que les confiere un arreglo especial, y son pocos los reportes de su actividad farmacológica. Khan et al (8), a partir de ocho cicloartanos glicosidados aislados de los géneros Astragalus (Leguminoseae) y Bryonia (Cucurbitaceae), estudiaron la relación estructura actividad en la inhibición de tirosinasa, encontrando que el askendosido B exhibió una potente inhibición (CI50 = 13.95µM), con gran potencial como medicamento para enfermedades de la piel relacionadas con la expresión de la enzima tirosinasa, como la hiperpigmentación, importantes en la industria cosmética. De igual manera, Casañola-Martín et al (9) reportan estudios teóricos de cicloartanos y otros compuestos naturales como inhibidores de tirosinasa, empleando modelos basados en descriptores moleculares tipo TOMOCOMD CARDD.
Rojano et al (10), aislaron un triterpenoide tipo cicloartano de nombre trivial berenjenol (21:24-epoxi-24-metil-cicloartano) de las hojas de Oxandra cf xylopioides (Annonaceae), que tiene propiedad insecticida sobre el gusano cogollero del maíz, sobre el que ejerce un efecto muy rápido y con CL50 de 319.6 ppm a las 24 horas. El berenjenol también inhibe el proceso inflamatorio inducido por carragenina en ratón y no produce efectos citotóxicos frente a macrófagos murinos RAW 264.7 (11). Ríos et al (12), estudiaron el efecto inflamatorio y proinflamatorios del berenjenol y sus derivados acetilados y oxidados en diferentes modelos como efectos sobre las enzimas cicloxigenasa-2 (COX-2) y la oxido nítrico oxidasa inducible; además, se examinaron los efectos sobre el factor de necrosis tumoral (TNF)-α y la interleuquina (IL)-1β, citoquinas implicadas en la resolución de la inflamación.
En este trabajo se realiza un estudio de docking molecular del berenjenol y sus derivados sintéticos, berenjenol-3-acetato y 3-oxo-berenjenol, en el sitio activo de la tirosanasa. Este trabajo sirve como base para comprender mejor el mecanismo de inhibición de cicloartanos y racionalizar los estudios de relación estructura actividad (SAR) en el contexto de su blanco de acción, así como el efecto de la variación de la secuencia de tirosinasas sobre la unión de cicloartanos, facilitando el diseño de nuevos inhibidores del pardeamiento enzimático en frutas y medicamentos para la hiperpigmentación en la piel.
MATERIALES Y MÉTODOS
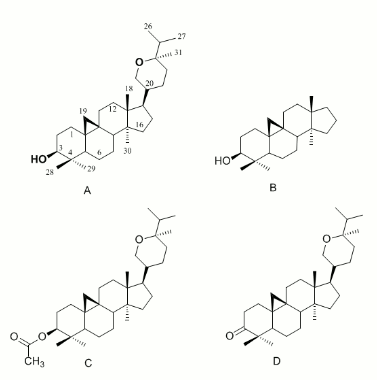
La estructura del berenjenol (A), el núcleo básico de los cicloartanos cicloartano (B), berenjenol-3-acetato (C) y 3-oxo-berenjenol (D), fueron construidas con el programa Ghemical (Véase figura 1) (13). La geometría de los ligandos fue optimizada con un algoritmo de gradiente conjugado utilizando 2500 pasos de minimización y la conformación de mínima energía hallada mediante una búsqueda de Montecarlo. Previo al docking, se equilibró la estructura de la forma oxi [Cu(II)-O22- Cu(II)] de la tirosinasa de S. bisporus con el programa NAMD utilizando el campo de fuerzas CHARMM27 y los hidrógenos reconstruidos utilizando la rutina psfgen del mismo programa (14). La estructura de la tirosinasa fue obtenida del Protein Data Bank con el código 1WX5 (1). Las histidinas neutrales del sitio activo fueron modeladas con protonación en el átomo Nε2. La tirosinasa fue equilibrada en 5000 pasos de 2 ps a 310 K, en un cubo de 60x60x60 Å3 con 9260 moléculas de agua en condiciones periódicas. Todos los ligandos fueron encajados a la estructura de la tirosinasa mediante un protocolo de docking de cuerpo flexible con el programa AutoDock 4.0 (15). Los mapas que representan la proteína fueron calculados con la opción AutoGrid utilizando una caja de 58x68x64 puntos en xyz con un espaciado de 0.375 Å. Las cargas del berenjenol fueron calculadas por el método Gasteiger según el protocolo implementado en AutoDock (16). Para la modelación del ión de cobre se utilizó una carga de +2 y los parámetros de van der Waals del campo de fuerzas CHARMM (17). Para el docking se utilizó un algoritmo genético Lamarquiano y se realizaron 100 simulaciones con una población inicial de 150 moléculas y un máximo de 2500000 evaluaciones de energía. Las tasas de mutación y entrecruzamiento fueron de 0.02 y 0.8 respectivamente. Los resultados fueron agrupados en grupos con valores de RMSD menores de 0.5 Å.
Figura 1. Estructura del berenjenol y sus derivados analizados en este trabajo.
RESULTADOS Y DISCUSIÓN
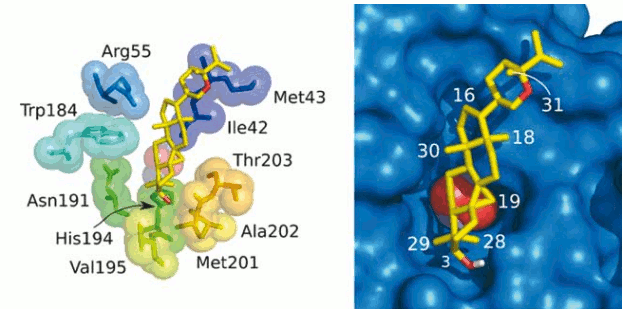
La estructura de la tirosinasa de S. castaneoglobisporus está compuesta por 7 hélices alfa y unas cuantas láminas beta entre las regiones N y C terminal. Las hélices α2, α3, α6 y α7 forman el sitio activo de la enzima, donde cada uno de los iones de cobre está coordinado por residuos de histidina. El primero de ellos, CuA, está unido a His38, His54 y His63, mientras que el segundo ión, CuB, lo hace con His190, His 194 y His 216. Este centro de coordinación del cobre está localizado en el fondo de una concavidad de la proteína perteneciente al sitio de unión del sustrato (1). Según nuestros resultados, el berenjenol se posiciona en el sitio activo de la tirosina, justo encima de los iones de cobre y el peróxido, actuando como inhibidor competitivo que impide el acceso del sustrato al sitio activo.
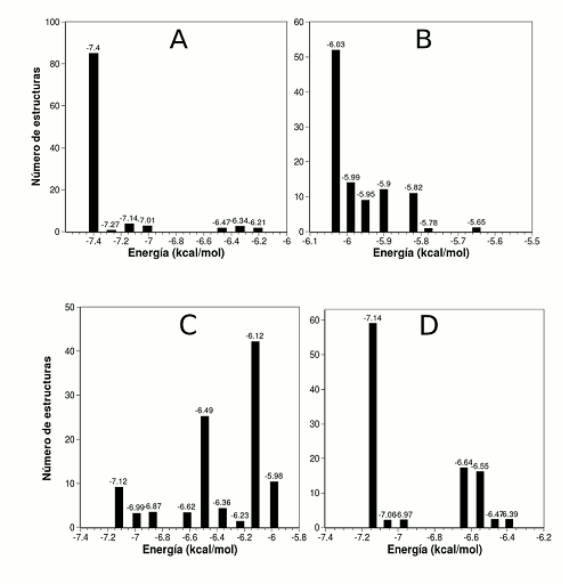
De los 100 confórmeros calculados, 85 corresponden al mínimo de energía (-7.5 kcal/mol), con una constante de disociación teórica promedio de 5.42 µM (Véase figura 2A). Al analizar los aminoácidos cercanos al berenjenol en una distancia menor a 4.0 Å se identificaron 11 residuos que pueden estar implicados en la unión al sitio activo de la tirosinasa: Ile42, Met43 Arg55, Trp184, Asn191, His194, Val195, Ala202, Met201 y Thr203. De acuerdo a nuestro modelo, el anillo ciclopropano se inserta en una cavidad formada por los carbonos alfa de Thr203 y Gly204 y el Cγ de Ile42, los cuales se encuentran unidos por fuerzas de van der Waals con el carbono 19. El grupo OH del carbono 3 establece un puente de hidrógeno con el oxígeno carbonílico de Ala202, encontrándose a una distancia de 2.14 Å. El grupo metilo 28 establece contactos con el Cβ de la histidina 194 (3.41 Å) y el Cα de Ala202 (4.21 Å) mientras el metilo 29 establece contacto co n el Cα y Cβ de la asparagina 191 (3.65 Å y 4.08 Å), y el Cδ de la histidina 194 (3.34 Å). El carbono C7 se encuentra a una distancia de 3.78 Å del Cη2 del triptófano 184. El carbono 30 se encuentra a 3.43 y 3.02 Å de Cη2 de Trp184 y Nη2 de Arg55. El C18 a 2.95 y 3.29 Å de Cγ1 y Cγ2 de Ile 42.
Figura 2. Distribución de energías de los confórmeros de cada compuesto.
En resumen, todos los grupos que se encuentren en posición cis respecto al anillo ciclopropano están orientados hacia el interior de la tirosinasa mediante interacciones tipo van der Waals y, por lo tanto, no pueden ser sustituidos por grupos voluminosos, porque crearían un gran impedimento estérico, perdiéndose completamente la actividad. Como todos estos grupos pertenecen al núcleo básico compartido por todos los cicloartanos, es evidente que esta familia de compuestos debe presentar interacciones similares. Es importante anotar que la mayoría de los contactos se dan con el esqueleto polipeptídico de la enzima y no con las cadenas laterales de aminoácidos, de tal manera que las interacciones no deben variar significativamente entre diferentes tipos de tirosanasas. Los contactos de la cadena sustituyente en el carbono 20 están determinados por los aminoácidos Ile42 y Met43, localizados al final de la hélice α2. De acuerdo al docking planteado, se puede determinar que existen tres cavidades que pueden acomodar grupos sustituyentes en los cicloartanos (Véase figura 3). La primera cavidad puede alojar sustituyentes en C2 en configuración trans respecto al anillo ciclopropano, la segunda cavidad admite sustituyentes en la misma posición pero en configuración cis respecto al anillo ciclopropano. De acuerdo con nuestro modelo, no existe espacio suficiente para adicionar sustituyentes en el grupo OH del C3 sin distorsionar la conformación del asa conectora entre las hélices 6 y 7. La tercera cavidad se encuentra cerca a los carbonos 11, 12 y 18 y permitiría la adición de nuevos grupos sustituyentes en estos sitios.
Figura 3. Unión del berenjenol al sitio activo de la tirosinasa.
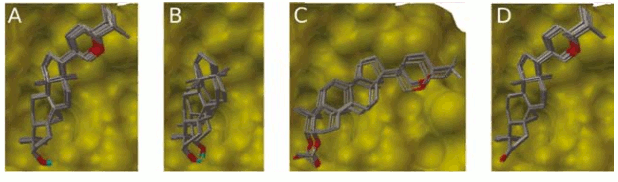
Con el fin de determinar el efecto del grupo sustituyente en la posición 20, se llevó a cabo un docking con el núcleo cicloartano básico, es decir, sin sustitución en la posición C20. De 100 estructuras, 52 convergieron en el mínimo de energía (Véase figura 2B). Es sorprendente que este compuesto puede unirse al sitio activo en dos conformaciones de igual energía, siendo la única diferencia la disposición del grupo OH en la posición 3 (Véanse figura 4A y 4B). Este resultado sugiere que la sustitución en la posición 20 tiene un efecto estabilizante sobre la conformación adoptada por el núcleo cicloartano, lo que se verifica al comparar la constante de inhibición promedio, 42.38 µM, la cual difiere en casi un orden de magnitud respecto al berenjenol.
Figura 4. Superposición de confórmeros en el sitio activo de la tirosinasa.
El análisis del derivado 3-oxo-berenjenol revela que éste se une de manera similar la berenjenol, siendo la única diferencia la orientación del oxígeno carbonílico, el cual se encuentra en posición ecuatorial con un ángulo de 78.70° respecto al oxígeno en el berenjenol (Véanse figuras 4C y 4D). Como el grupo carbonilo no puede formar puentes de hidrógeno con la alanina 202, la constante de disociación teórica aumenta ligeramente (9.17 µM). Al igual que en los casos anteriores, la mayoría de las estructuras, 60 de 100 confórmeros, se agruparon en la conformación de mínima energía (Véase figura 2D).
El compuesto que presentó mayores diferencias en el mecanismo de unión a la tirosinasa fue el derivado sintético berenjenol-3-acetato. La distribución de confórmeros es bastante diferente a la de los compuestos anteriores ya que solamente 9 de ellos se encuentran en la conformación de mínima energía (Véase figura 2C). Este problema de convergencia es evidencia de que este compuesto no es un buen ligando para la tirosinasa, porque para acomodar el grupo acetilo, el berenjenol-3-acetato debe desplazar el sitio de unión del anillo ciclopropano a una distancia de 1.3 Å. Este cambio hace que, para acomodar el grupo sustituyente en la posición C20, el cicloartano deba inclinarse en un ángulo de aproximadamente 35° respecto al berenjenol. Estos resultados implican que el berenjenol-3-acetato no puede unirse fácilmente al sitio activo de la tirosinasa, lo que se ve también reflejado en su constante de disociación teórica promedio de 21.72 µM.
En un trabajo previo, el berenjenol y sus derivados sintéticos fueron evaluados en dos modelos de inflamación y se encontró que el acetato de berenjenol presentó la menor actividad de los tres compuestos (12). Estos resultados son compatibles con lo descrito en nuestro análisis de docking. Recientemente Khan et al (7,8) han descrito otra serie de inhibidores de tipo cicloartano aislados de las familias Compositae y Leguminoseae. De la familia Compositae fueron aislados ocho compuestos, de los cuales siete presentaron actividad antitirosinasa significativa (7). En el análisis de estructura actividad se encontró que la presencia de un grupo OH en la posición 2 incrementa el efecto inhibitorio de estos compuestos, al igual que la presencia de grupos OH en el grupo sustituyente en posición C20. Es de resaltar que las tres cavidades descritas anteriormente se encuentran expuestas al solvente y presentan una gran cantidad de aminoácidos polares que podrían formar puentes de hidrógeno con sustituyentes polares con el grupo OH, tal como lo propone el estudio de estructura actividad.
La segunda serie de compuestos, aislada a partir de la familia Leguminoseae, presenta sustituciones glicosídicas en los oxígenos 3 y 6; y grupos OH en las posiciones 16 y 7 (8). Como es de esperarse, solo cuatro de estos ocho compuestos demostraron actividad inhibitoria (14-102 µM); y según nuestro modelo, para poder ajustar el sustituyente en la posición 3, la tirosinasa debe sufrir cambios confomacionales muy rigurosos. Aunque las sustituciones en las posiciones restantes no se encuentran cerca a las cavidades descritas, todos estos grupos estarían de cara al solvente, donde no ocurriría ningún efecto estérico sobre el mecanismo de unión. Se observa que todos los compuestos presentan un grupo OH en la posición 16 cuyo carbono queda ubicado en nuestro modelo en una cavidad polar donde podría alojarse un sustituyente pequeño que podría formar puentes de hidrógeno con el oxígeno carbonílico del aspartato 45. Al cambiar este grupo OH por una unidad de monosacárido, como en el caso del cicloorbicósido, la actividad inhibitoria se pierde, como es de esperarse (8).
CONCLUSIONES
El berenjenol es un inhibidor de la tirosinasa, enzima que está involucrada en el proceso de muda de los insectos, en la hiperpigmentacion de piel y en el pardeamiento enzimático de frutas (10,11). Según nuestro trabajo, el mecanismo de inhibición no se da mediante una reacción de oxidación directa del berenjenol con los iones cobre del sitio activo de la enzima, como normalmente ocurre con inhibidores de tipo aromático (2), sino por un bloqueo espacial del sitio activo de la enzima e impide el acceso de otros sustratos oxidables, es decir, una inhibición competitiva de la enzima tirosinasa. La unión a la tirosinasa se da mediante interacción con 11 residuos: Ile42, Met43 Arg55, Trp184, Asn191, His194, Val195, Ala202, Met201 y Thr203. El berenjenol se une al sitio activo, de tal manera que el anillo ciclopropano queda oculto al solvente mediante interacciones de van der Waals con la enzima; por lo tanto, cualquier sustitución del berenjenol en posición cis respecto a este grupo tendrá efectos negativos sobre la constante de disociación. La tirosinasa puede acomodar fácilmente nuevos grupos sustituyentes en el berenjenol en las posiciones 2, 11, 12 y 18. Para los otros carbonos en posición trans respecto al anillo ciclopropano, es necesario que la enzima sufra pequeños cambios conformacionales lo que puede perturbar ligeramente la afinidad del inhibidor.
AGRADECIMIENTOS
Este proyecto se realizó con financiación de la Dirección de Investigaciones de la Universidad Nacional de Colombia Sede Medellín (DIME, proyecto 20101006544).
REFERENCIAS BIBLIOGRÁFICAS
1. Matoba Y, Kumagai T, Yamamoto A, Yoshitsu H, Sugiyama M. Crystallographic evidence that the dinuclear copper center of tyrosinase is flexible during catalysis. J Biol Chem. 2006; 281 (13): 8981—8990. [ Links ]
2. Kim YJ, Uyama H. Tyrosinase inhibitors from natural and synthetic sources: structure, inhibition mechanism and perspective for the future. Cell Mol Life Sci. 2005; 62 (15): 1707—1723. [ Links ]
3. Wu JJ, Cheng K, Li E, Wang M, Ye W. Antibrowning activity of MRPs in enzyme and fresh-cut apple slice models. Food Chem. 2008; 109 (2): 379-385. [ Links ]
4. Asanuma M, Miuazaki I, Ogawa N. Dopamine - or L-DOPA-induced neurotoxicity: The role of dopamine quinone formation and tyrosinase in a model of Parkinson's disease. Neurotox Res. 2008; 5 (3): 165—176. [ Links ]
5. Ronning DR, Klabunde T, Besra GS, Vissa VD, Belisle JT, Sacchettini JC. Crystal structure of the secreted form of antigen 85C reveals potential targets for mycobacterial drugs and vaccines. Nat Struct Bio. 2000; 7 (2): 141—146. [ Links ]
6. Cuff ME, Miller KI, van Holde KE, Hendrickson WA. Crystal structure of a functional unit from octopus hemocyanin. J Mol Biol. 1998; 278 (4): 855-870. [ Links ]
7. Khan MT H, Khan SB, Ather A. Tyrosinase inhibitory cycloartane type triterpenoids from the methanol extract of the whole plant of Amberboa ramosa Jafri and their structure-activity relationship. Bioorg Med Chem. 2006; 14 (4): 938—943. [ Links ]
8. Khan MTH, Choudhary MI, Rahman A, Mamedova RP, Agzamova MA, Mukhlis N, et al. Tyrosinase inhibition stud- ies of cycloartane and cucurbitane glycosides and their structure-activity relationships. Bioorg Med Chem. 2006; 14 (17): 6085—6088. [ Links ]
9. Casañola-Martín GM, Khan MT, Marrero-Ponce Y, Ather A, Sultankhodzhaev MN, Torrens F. New tyrosinase inhibitors selected by atomic linear indices-based classification models. Bioorg Med Chem Let. 2006; 16 (2): 324—330. [ Links ]
10. Rojano B, Gaviria CA, Sáez JA, Yepes F, Muñoz F, Ossa F. Berenjenol aislado de Oxandra cf xylopioides (Annonaceae) como insecticida. Vitae. 2007; 14 (2): 95—100. [ Links ]
11. Rojano B, Pérez E, Figadère B, Martin MT, Recio MC, Giner R, et al. Constituents of Oxandra cf. xylopioides with anti-inflammatory activity. J Nat Prod. 2007; 70 (5): 835—838. [ Links ]
12. Ríos JL, Aguila S, Rojano B, Sáez J, Schinella G, Recio MC, et al. Antiinflamatory activity of berenjenol and related compounds. Planta Méd. 2009, 75 (1): 18—23. [ Links ]
13. Hassinen T, Peräkylä M. New energy terms for reduced protein models implemented in an off-lattice force field. J Comput Chem. 2001; 22 (12): 1229—1242. [ Links ]
14. Phillips JC, Braun R, Wang W, Gumbart J, Tajkhorshid E, Villa E, et al. Scalable molecular dynamics with NAMD. J Comput Chem. 2005; 26 (16): 1781—1802. [ Links ]
15. Goodsell DS, Morris GM, Olson AJ. Automated docking of flexible ligands: applications of AutoDock. J Mol Recognit. 1996; 9 (1): 1—5. [ Links ]
16. Gasteiger J, Marsili M. New model for calculating atomic charges in molecules. Tetrahedron Lett. 1978 (34): 3181—3184. [ Links ]
17. Momany FA, Rone R. Validation of the general purpose QUANTA 3.2/CHARMm forcefield. J Comput Chem. 1992; 13 (7): 888—900. [ Links ]
Recibido: Octubre 20 de 2008; Aceptado: Junio 11 de 2009
* Autor a quien debe dirigir la correspondencia: paguties@gmail.com