Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.2 Medellín May/Sep. 2009
PRODUCTOS NATURALES
EVALUACIÓN FITOQUMICA PRELIMINAR DE Heliconia psittacorum Y Heliconia rostrata Y DE LA POTENCIAL ACTIVIDAD INHIBITORIA DE ALGUNOS DE LOS EFECTOS DEL VENENO DE Bothrops asper (mapaná X).
PRELIMINARY PHYTOCHEMISTRY ASSESSMENT OF Heliconia psittacorum AND Heliconia rostrata AND THE POTENTIAL INHIBITORY ACTIVITY OF SOME EFFECTS OF THE Bothrops asper (mapaná X) VENOM.
Sebastián ESTRADA G.1*; Juan C. QUINTANA1,2; Silvia L. JIMÉNEZ1,2; Juan C. ALARCON P.1,2; Jaime A. PEREAÑEZ J.1,2; Leidy J. VARGAS1
1 Programa de Ofidismo/Escorpionismo, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
2 Facultad de Química Farmacéutica, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
RESUMEN
Algunas especies de la familia Heliconaceae han demostrado capacidad neutralizante parcial/total de las actividades letal, hemolítica indirecta, hemorrágica, proteolítica, coagulante, mionecrosante y edematizante del veneno de Bothrops asper (mapaná equis). Este trabajo evalúa dos especies de heliconias: Heliconia psittacorum y Heliconia rostrata, contra las actividades hemolítica indirecta, proteolítica y coagulante del veneno de B. asper, sin que ninguna de ellas ejerza inhibición sobre la actividad hemolítica indirecta y proteolítica. Por el contrario, sus extractos retardan el efecto coagulante del veneno con respecto al control positivo hasta 45.59 segundos. Al realizar el perfil electroforético, se observa una banda perteneciente al extracto de H. psittacorum, y además se evidencia disminución y aumento en la intensidad de algunas bandas (66 y 31 KDa respectivamente), que pueden indicar una posible degradación por parte de los extractos. La evaluación fitoquímica de los extractos muestra la presencia de metabolitos primarios de carácter glúcido y protéico; y secundarios como compuestos fenólicos, terpenoides y cumarinas, algunos de los cuales han sido reportados en otras especies vegetales como responsables de la actividad antiofídica.
Palabras clave:Bothrops asper, Heliconiaceae, compuestos fenólicos, cumarinas, actividad coagulante.
ABSTRACT
Some Heliconiaceae family species, had demonstrated to be effective neutralizing partial or totally the lethal, indirect hemolytic, hemorrhagic, proteolytic, clotting, miotoxic and edema-forming activities from the Bothrops asper (mapaná equis) venom. This work evaluates two species of heliconias: Heliconia psittacorum and Heliconia rostrata against the indirect hemolytic, proteolytic and clotting activities induced by B. asper without any inhibitory effect on the indirect hemolytic and proteolytic effects. On the contrary, the extracts retard the venom clotting effect with regard to the positive control up to 45.59 seconds. In the electrophoretic profile a band belonging to the H. psittacorum is observed, moreover a decrease and increase in the intensity of some bands (66 y 31 KDa respectively) possibly indicate its degradation by the extracts. The phytochemical evaluation of the extracts shows the presence of primary metabolites as glucids and proteins; and secondary metabolites as phenolics compounds, terpenoides and cumarins, some of them reported in others vegetal species as responsible of the anti-ophidian activity.
Key words: Bothrops asper, Heliconiaceae, phenolic compounds, cumarins, clotting activity.
INTRODUCCIÓN
En América Latina, cerca del 90% de las mordeduras de serpiente son ocasionadas por serpientes del género Bothrops (1, 2 ), cuyos venenos inducen efectos locales y sistémicos como mionecrosis, hemorragia, desordenes hemostáticos y nefrotoxicidad (2-4); una de ellas, Bothrops asper (mapaná), es en Colombia la causante del 70 al 90% de los 3.000 accidentes reportados cada año, dejando secuelas en el 5% y ocasionando la muerte en el 6% de los casos (4-6).
Durante varios siglos, la medicina tradicional ha utilizado plantas para el tratamiento de los accidentes ofídicos como alternativa primaria al tratamiento específico debido a factores culturales, dificultades geográficas, la escasa disponibilidad de los antivenenos en zonas alejadas y una limitada efectividad del tratamiento específico para neutralizar algunos efectos locales como hemorragia, edema y mionecrosis originados por los venenos de víboras (7-9).
A nivel mundial se han reportado más de 700 plantas usadas como antiofídicas (10-14), y en Colombia, donde el 60% de las mordeduras son atendidas inicialmente por curanderos o chamanes, se usan al menos 100 especies de plantas medicinales en diferentes formas, de acuerdo al estado clínico del paciente (3, 4, 12). El extracto de una de estas plantas (Heliconia curtispatha) demostró ser efectivo para neutralizar el efecto letal, hemolítico indirecto, hemorrágico, proteolítico, coagulante, mionecrosante y edematizante de los venenos de Bothrops asper, Lachesis muta, Crotalus durissus cumanensis y Micrurus mipartitus (11,13, 15-17), propiedad que no es exclusiva de esta especie, pues se conoce la capacidad neutralizante parcial o total de otras heliconias sobre las actividades letal, hemolítica indirecta, hemorrágica, proteolítica, coagulante, mionecrosante y edematizante del veneno de Bothrops asper (17, 11).
Por la frecuencia de este tipo de accidentes y la amplia biodiversidad colombiana, se pretende verificar si las capacidades neutralizantes se encuentran en otras especies de heliconias, tales como la Heliconia psittacorum y la Heliconia rostrata y además, realizar una evaluación fitoquímica preliminar de algunos metabolitos primarios y secundarios, pues es poco lo que se conoce sobre la composición química de estas plantas y se hace necesario buscar en nuestro territorio, especies vegetales promisorias que puedan servir como coadyuvantes para el tratamiento de las mordeduras de serpiente, especialmente de la mapaná equis (18).
MATERIALES Y MÉTODOS
Venenos y extractos
Rizomas de H. rostrata y H. psittacorum, colectados en la ciudad de Medellín, Colombia, una vez secos (38°C), molidos, percolados con etanol al 96% durante 48 horas, son concentrados al vacío hasta sequedad en un producto sólido, y congelados a -20°C. La disolución de estos extractos para las pruebas biológicas se llevó a cabo utilizando como diluyente Buffer de fosfatos (PBS) pH: 7.2, agitación en vortex (2 min) y ultrasonido (previo a la preincubación con el veneno) 30 min. Para tal efecto se utilizó un baño de ultrasonido marca Fisher Scientific modelo FS 140, con capacidad para 12 litros sin calentamiento, operando a 40 kHz.
El veneno utilizado es una mezcla homogénea obtenida del ordeño manual de 40 especímenes adultos de B. asper de los departamentos de Antioquia y Chocó, mantenidas en cautiverio en el Serpentario de la Universidad de Antioquia. Luego de ser centrifugada (580 g, 10 min) su sobrenadante es liofilizado y congelado a -70°C hasta su uso.
Inhibición de la actividad hemolítica indirecta
Utilizando diferentes relaciones de veneno: extracto (1:10; 1:20) y preincubación por espacio de 30 minutos (37°C) con una Dosis Hemolítica indirecta mínima (DHim) del veneno de B. asper (2.2 µg), se verifica la inhibición de la actividad hemolítica indirecta por comparación, tras 20 horas de incubación con el halo de hemólisis (20 mm) causado por la DHim, según el método agarosa—yema de huevo—eritrocitos, descrito por Gutiérrez et al (19).
Inhibición de la actividad coagulante
Se mezclan e incuban (30 min/37°C) 1.0 µg de veneno de Bothrops asper con 10 µg de cada uno de los extractos, disueltos en 50 µL de PBS (pH 7.29), antes de su adición a 300 µL de plasma, y el correspondiente tiempo de coagulación se registra, como lo establece el método descrito por Theakston y Reid (20). Se utilizan como controles tanto el veneno como los extractos.
Inhibición de la actividad proteolítica
Utilizando como control positivo una DPm (Dosis Proteolítica mínima de 6.0 µg para el veneno de B. asper), se preincuban (30 min/37°C) diferentes relaciones de veneno: extracto (1:2; 1:10); en la prueba de inhibición, 100 µL de azocaseína (10mg/mL) y 20 µL de la mezcla veneno:extracto se incuban (90 min/37°C) previo a la adición de ácido tricloroacético al 5% para detener la reacción. Una vez logrado este objetivo, los tubos son centrifugados (2.000 rpm/5 min) y 100 µL de sobrenadante son transferidos a pozos de platos de 96 pocillos de fondo plano en los que posteriormente se agregan 100 µL de NaOH 0.5M antes de la lectura de la absorbancia a 280 nm en un lector de ELISA (AWARNESS, Stat Fax 3200) contra un blanco de reactivos, según el micrométodo de azocaseína propuesto por Wang et al (21).
Evaluación fisicoquímica preliminar
El análisis fitoquímico preliminar de los rizomas, para la detección de metabolitos secundarios como alcaloides, lactonas, esteroides y/o terpenoides, flavonoides, naftoquinonas, antraquinonas, saponinas, taninos y cumarinas, se realiza de acuerdo con los métodos propuestos por Sanabria (22) y Domínguez (23).
Cuantificación de carbohidratos totales
Para calcular el contenido total de carbohidratos, como gramos de glucosa, se utiliza una curva de calibración preparada con este carbohidrato, según
el método colorimétrico descrito por Dubois et al (24), utilizando fenol/acido sulfúrico.
Cuantificación de los fenoles totales
Los extractos se evalúan por espectrofotometría a una λ de 725 nm, utilizando el método de Folin-Ciocalteau (25), calculando el porcentaje total de compuestos fenólicos en una curva de calibración preparada con ácido tánico.
Cuali-cuantificación de proteínas (SDS-PAGE)
La cuantificación de proteínas se realiza aplicando el método de Bradford modificado por Spector (26), sobre una curva de calibración que utiliza albúmina bovina como estándar (15.63—1000.00 µg/µL) y registrando las absorbancias a una longitud 595 nm. Adicionalmente, 40 µg de veneno preincubados con 400 µg de cada extracto (30 minutos/37°C), dispuestos sobre geles de poliacrilamida (SDS-PAGE, 15%) en una cámara Mini Protean®, de BioRad (60 min/150 voltios) bajo condiciones no reducidas (27), permite cualificar la acción sobre el veneno y establecer un perfil electroforético preliminar del contenido proteico de los extractos. Una vez fijadas las proteínas, son coloreadas con azul de Coomasie y con nitrato de plata (Kit 161-0449, BIO-RAD).
Análisis estadístico
Todos los ensayos fueron realizados por triplicado. Se expresan los resultados como la media ± S.E.M (error estándar de la media) y se realiza un análisis de varianza de una vía, seguido por un test de Bonferroni, para determinar diferencias entre el grupo control y los grupos problemas, asumiendo las diferencias significativas cuando p< 0.05.
RESULTADOS
Inhibición de la actividad hemolítica indirecta, proteolítica y coagulante.
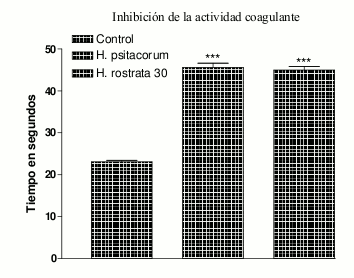
Los extractos de las dos heliconias no inhibieron el efecto hemolítico indirecto y proteolítico a las diferentes relaciones de veneno:extracto utilizadas (1:2; 1:10 y 1:20). Contrario a esto, ambos extractos presentan inhibición significativa de la actividad coagulante, siendo el extracto de H. psittacorum el que reportó mayor actividad inhibitoria (Véase figura 1). El tiempo de coagulación registrado por el control, fue negativo en todos los casos y superior a 480 segundos.
Figura 1. Inhibición de la actividad coagulante del veneno de Bothrops asper por el extracto etanólico de rizomas secos de H. psittacorum y H. Rostrata, relación 1:10. *** P<0,001 con respecto al control positivo (veneno).
Evaluación fitoquímica preliminar
Según los resultados de la marcha fitoquímica preliminar realizada a los extractos etanólicos de los rizomas de ambas Heliconias, los metabolitos presentes son: esteroides y/o terpenoides, taninos y cumarinas (Véase tabla 1).
Tabla 1. Resultados de la evaluación fitoquímica preliminar de rizomas de H. psittacorum y H. rostrata.(+ presencia; - ausencia)
Cuantificación de carbohidratos, fenoles y proteínas totales
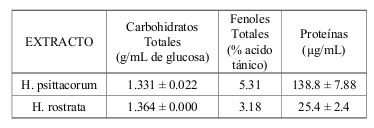
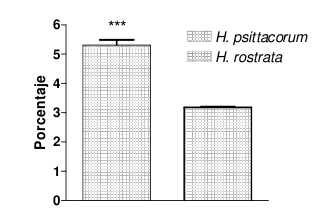
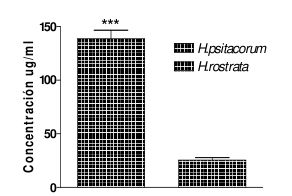
En general, el extracto de H. psittacorum presentó niveles más elevados comparado con el extracto de H. rostrata (Véase tabla 2), excepto en el momento de la cuantificación de carbohidratos, donde el extracto de H. rostrata presenta niveles un poco más altos (Véanse figura 2 y 3).
Tabla 2. Cuantificación de carbohidratos, fenoles y proteínas totales en los extractos de Heliconia psittacorum y Heliconia rostrata.
Figura 2. Porcentaje de compuestos fenólicos determinados por el método de Folin-Ciocalteau de los extractos etanólicos de rizomas secos de H. psittacorum y H. rostrata. ***P<0,001 comparado con el extracto de H. rostrata.
Figura 3. Cuantificación de proteínas, determinadas por el método de Bradford, de los extractos etanólicos de rizomas secos de H. psittacorum y H. rostrata. ***P<0,001 con respecto al extracto de H. rostrata
Cualificación de proteínas (SDS-PAGE)
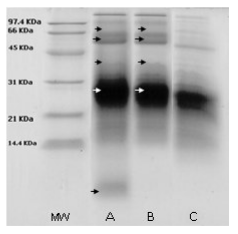
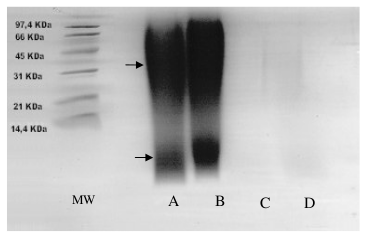
En la electroforesis de proteínas en geles de poliacrilamida se observó que H. rostrata y H. psittacorum provocaron una disminución en la intensidad de las bandas de proteína del veneno de peso molecular cercano a 66 KDa, aumento en la intensidad en las bandas que se encuentran cerca de los 31 KDa y por debajo de 66 KDa. Además, el extracto de H. psittacorum presenta una banda que se encuentra por debajo de los 14 KDa, que no pertenece a las proteínas del veneno (Véase figura 4). En una electroforesis posterior realizada al extracto de esta planta sola, se evidencia la presencia de esta banda, confirmando su procedencia vegetal (Véase figura 5). Revelando con plata, método altamente sensible para detectar proteínas en geles de poliacrilamida (~0.1 ng/mm2), se observan las mismas bandas que con el revelado con azul de Comassie para los extractos solos (resultados no mostrados).
Figura 4. SDS-PAGE revelados con azul de Comassie del veneno de B. asper después de 30 minutos de incubación con los extractos en una relación de 1:10. MW: Marcadores de peso molecular 97.4, 66, 45, 31, 21 y 14.4 KDa. A: H. psittacorum. B: H. rostrata. C: Veneno completo. Las flechas señalan las bandas de proteína, donde se observan cambios en relación con el veneno solo.
Figura 5. SDS-PAGE de los extractos de Heliconias revelados con azul de comassie. MW: Marcadores de peso molecular 97.4, 66, 45, 31, 21 y 14.4 KDa. A-B: H. psittacorum. C-D: H. rostrata. Las flechas señalan las bandas de proteína que se observan en esta planta.
DISCUSIÓN
Las plantas constituyen una fuente muy importante de compuestos biológicamente activos. En muchos países, en diferentes investigaciones, se ha reportado la presencia de actividad antiofídica en diversas plantas, como los extractos de Eclipta prostrata (28-30), Casearia sylvestris y Casearia mariquitensis (31-33), Bixa orellana (18), Heliconia curtispatha (11,12), por mencionar solo algunas, que neutralizaron eficazmente los efectos tóxicos de los venenos de diferentes serpientes con diferentes mecanismos de acción.
En la literatura científica y en bases de datos consultadas (NAPRALERT®, Duke), no se encontraron artículos relacionados con la composición metabólica de los rizomas de Heliconia psittacorum y Heliconia rostrata. En este trabajo se reporta, en ambos extractos, la presencia de carbohidratos, proteínas, compuestos fenólicos (cumarinas) y compuestos esteroidales, presentando el extracto de H. psittacorum los mayores contenidos. Sólo en la cuantificación de carbohidratos totales, la H. rostrata presentó niveles un poco más elevados de este tipo de metabolito. En cuanto al contenido proteico, la H. psittacorum presenta una diferencia significativa de valores respecto a la H. rostrata (p<0.001), lo cual guarda relación con los resultados obtenidos en las electroforesis de los extractos, ya que en el extracto de H. psittacorum se observa una banda por debajo de los 14.4 kDa y una banda profusa entre los 31 y 66 kDa, cuando se colorean estas bandas en ambas tinciones, lo que significa que corresponden a compuestos protéicos puesto que la plata tiene una alta especificidad por las proteínas, y por lo tanto, la prueba de confirmación se realiza dado que el azul de Comassie puede presentar falsos positivos con compuestos fenólicos (presentes en ambos extractos). Los cambios observados en el patrón electroforético cuando se preincuba el veneno de B. asper con los extractos de ambas heliconias, reflejan una posible fragmentación de proteínas con peso molecular cercano a 66 kDa, depositadas en la región cercana a los 30 KDa y 60 kDa, explicando el aumento y la disminución de intensidad de estas bandas. Entre los péptidos del veneno encontrados en este rango de peso molecular, se encuentran las metaloproteinasas, que varían su peso molecular de 24 a 100 kDa y son las enzimas responsables de alterar el sistema hemostático, provocando principalmente hemorragias, coagulopatías, entre otros efectos tóxicos. (34-36).
Para el caso de las heliconias, el mecanismo de la acción inhibitoria no es claro aún, pero la presencia de cumarinas, compuestos esteroidales y el porcentaje de compuestos fenólicos hallados en cada extracto, podría indicar una interacción entre las toxinas con los compuestos fenólicos y esteroidales de los extractos por medio de enlaces moleculares débiles formando puentes de hidrógeno entre estos, y/o sugerir la quelación de iones que son necesarios como cofactores de enzimas involucradas en el proceso de coagulación, tales como las metaloproteasas, toxinas que dependen de la presencia de Zn2+ para expresar su actividad catalítica (34, 36).
De manera similar, en otras especies de heliconias, como H. curtispatha, H. wagneriana y H. latispatha, que han resultado inhibidoras de la actividad coagulante del veneno de B. asper (17), se ha detectado la presencia de cumarinas, de compuestos esteroidales y fenólicos sin un mecanismo de acción establecido, donde se sugiere igualmente este tipo de interacciones moleculares con las toxinas o sus cofactores.
AGRADECIMIENTOS
Agradecemos al Dr. Norman Farnsworth, Director de NAPRALERT®, por la valiosa búsqueda de información etnomédica en esta base de datos, a la profesora María Ángeles Martínez Cuesta, del Departamento de Farmacología de la Facultad de Farmacia de la Universidad de Valencia por sus aportes a este manuscrito, y a la Universidad de Antioquia, por el soporte económico recibido para llevar a cabo este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Fan HW, Cardoso JLC. Clinical toxicology of snakebite in South America. En: Meier J, White J (Ed.). Handbook of Clinical Toxicology of Animal, Venoms and Poisons. Boca Raton, FL: CRC Press; 1995. p. 667—688. [ Links ]
2. Gutiérrez JM. Clinical toxicology of snakebite in Central America. En: Meier J, White J (ed.). Handbook of Clinical Toxicology of Animal, Venoms and Poisons. Boca Raton, FL: CRC Press; 1995. p. 645—665. [ Links ]
3. Otero R, Gutiérrez JM, Mesa MB, Duque E, Rodríguez O, Arango L, et al. Complications of Bothrops, Porthidium, and Bothriechis snakebites in Colombia. A clinical and epidemiological study of 39 cases attended in a university hospital. Toxicon. 2002; 40 (8): 1107—1114. [ Links ]
4. Otero R, Tobón GS, Gómez LF, Osorio RG, Valderrama R, Hoyos D, et al. Accidente ofídico en Antioquia y Chocó. Aspectos clínicos y epidemiológicos (marzo de 1989-febrero de 1990). Acta Médica Colombiana. 1992; 17: 229—249. [ Links ]
5. Quintana JC. Accidente ofídico. En: Vélez ID, Rodríguez E, Duarte R (ed). Enfermedades Tropicales. Guía de Manejo de ETV y Accidente Ofídico 2005. Medellín: Solingraf: 2005. p. 131—147. [ Links ]
6. Silva J. Las serpientes del género Bothrops en la Amazonia Colombiana. Aspectos biomédicos (epidemiologia, clínica y biología del ofidismo). Acta Médica Colombiana. 1989; 14: 148—165. [ Links ]
7. Bon C. The serum therapie was discovered 100 years ago. Toxicon. 1996; 34 (2): 142—143. [ Links ]
8. Gowda TV. Interaction of snake venom phospholipases A2 with plant isolates. En: Kini RM (ed.). Venom Phospholipase A2 Enzymes. Wiley, Chichester: s.e; 1997. p. 205—221. [ Links ]
9. Lomonte B, Lundgren J, Johansson B, Bagge U. The dynamics of local tissue damage induced by Bothrops asper snake venom and myotoxin II on the mouse cremaster muscle: an intravital and electron microscopic study. Toxicon. 1994; 32 (1): 41—55. [ Links ]
10. Houghton PJ, Osibogun IM. Flowering plants used against snakebite. J Ethnopharmacol. 1993; 39 (1): 1—29. [ Links ]
11. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000; 73 (1-2): 233—241. [ Links ]
12. Otero R, Núñez V, Jiménez SL, Fonnegra R, Osorio RG, García ME., et al. Snakebites and ethnobotany in the northwest region of Colombia: Part II: Neutralization of lethal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacol. 2000; 71(3):505—511. [ Links ]
13. Núñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R, et al. Neutralization of the edema-forming, defibrinating and coagulant effects of Bothrops asper venom by extracts of plants used by healers in Colombia. Braz J Med Biol Res. 2004; 37 (7): 969—977. [ Links ]
14. Núñez V, Castro V, Murillo R, Ponce-Soto LA, Merfort I, Lomonte B. Inhibitory effects of Piper umbellatum and Piper peltatum extracts towards myotoxic phospholipases A 2 from Bothrops snake venoms: isolation of 4-nerolidylcatechol as active principle. Phytochemistry. 2005; 66 (9): 1017—1025. [ Links ]
15. Núñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R, et al. Inhibition of the Toxic effects of Lachesis muta, Crotalus durissus cumanensis and Micrurus mipartitus Snake Venoms by Plant Extracts. Pharm Biol. 2004; 42 (1): 49—54. [ Links ]
16. Otero R, Fonnegra R, Jiménez SL, Núñez V, Evans N, Alzate SP, et al. Snakebites and ethnobotany in the northwest region of Colombia: Part I: Traditional use of plants. J Ethnopharmacol. 2000; 71 (3): 493—504. [ Links ]
17. Pereañez JA, Jiménez SL, Quintana JC, Núñez V, Fernández M, Restrepo Y. Inhibición de las actividades proteolítica, coagulante y hemolítica indirecta inducidas por el veneno de Bothrops asper por extractos etanólicos de tres especies de heliconias. Vitae. 2008; 15(1): 70—76. [ Links ]
18. Jiménez SL, Castaño PH, Quintana JC, Ciro G L, Quinchía L, Estrada S. Establecimiento de suspensiones celulares de Bixa orellana L. productoras de compuestos fenólicos, potencialmente antiofídicos. Vitae. 2008; 15(1):70—76. [ Links ]
19. Gutiérrez JM, Ávila C, Rojas C, Cerdas L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon. 1988; 26 (4): 411—413. [ Links ]
20. Theakston RDG, Reid HA. Development of simple standard assay procedures for the characterization of snake venoms. Bulletin of the World Health Organization. 1983; 61: 949—956. [ Links ]
21. Wang WJ, Shis SH, Huang TF. A novel P-I class metalloproteinase with broad substrate-cleaving activity, agkislysin, from Agkistrodon acutus venom. Biochem Bioph Res Co. 2004; 324 (1): 224—230. [ Links ]
22. Sanabria A. Análisis fitoquímico preeliminar. Bogotá: Departamento de Farmacia, Universidad Nacional de Colombia; 1983. [ Links ]
23. Domínguez XA. Métodos de investigación fitoquímica. México: Limusa; 1979. pp 84—218. [ Links ]
24. Dubois M, Giles K, Hamilton JK, Rebes PA, Smith F. Colorimetric method for determination of sugars and relatessubstances. Anal Chem. 1956; 28 (3): 350—356. [ Links ]
25. Makkar HPS, Bluemmel M, Borowy NK, Becker K. Gravimetric determination of tannins and their correlations with chemical and protein precipitation methods. J Sci Food Agric. 1993; 61 (2): 161—165. [ Links ]
26. Spector T. Refinement of the Coomassie blue method of protein quantitation. A simple and linear spectrophotometric assay for less than or equal to 0.5 to 50 micrograms of protein. Anal Biochem. 1978; 86 (1): 142—146. [ Links ]
27. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227: 680—685. [ Links ]
28. Melo PA, Do Nascimento MC, Mors WB, Suárez-Kurtz G. Inhibition of the myotoxic and hemorrhagic activities of crotalid venoms by Eclipta prostrate (Asteraceae) extracts and constituents. Toxicon. 1993; 32 (5): 595—603. [ Links ]
29. Melo PA, Ownby CL. Ability of wedelolactone, heparin, and p-bromophenacyl bromide to antagonize the myotoxic effects of two crotaline venoms and their PLA 2 myotoxins. Toxicon. 1999; 37 (1): 199—215. [ Links ]
30. Mors WB, Nascimento MC, Parente JP, Da Silva MH, Melo PA, Suárez-Kurtz G. Neutralization of letal and myotoxic activities of South American rattlesnake venom by extracts and constituents of the plant Eclipta prostata (Asteraceae). Toxicon. 1989; 27 (9): 1003—1009. [ Links ]
31. Borges HM, Soares AM, Rodrígues VM, Andriao-Escarso SH, Diniz H, Hamaguchi A, et al. Effects of acuos extract of Cassearia Sylvestris (Flacourtiaceae) on actions of snake and bee venoms and on activity of phospholipases A2. CBP Part B. 2000; 127: 21—30. [ Links ]
32. Borges HM, Soares AM, Rodrígues VM, Oliveira F, Franshescshi AM, Ruvacado A, et al. Neutralization of proteases from Bothrops snakes venoms by the aqueous extract from Casearia sylvestris (Flacourtiaceae). Toxicon. 2001; 39 (12): 1863—1869. [ Links ]
33. Izidoro LFM, Rodrígues VM, Rodrígues RS, Ferro EV, Hamaguchi S, Giglio JR., et al. Neutralization of some hematological and hemostatic alterations induced by neuwiedase, a metalloproteinase isolated from Bothrops neuwiedi pauloensis snake venom, by the aqueous extract from Casearia mariquitensis (Flacourtiaceae). Biochimie. 2003; 85 (7): 669—675. [ Links ]
34. Swenson S. Markland JR. F.S. Snake venoms fibrin(ogen)olytic enzymes. Toxicon. 2005; 45 (8): 1021—1039. [ Links ]
35. White J. Snakes venoms and coagulopathy. Toxicon. 2005; 45 (8): 951—967. [ Links ]
36. Manjinatha R. Anticoagulant proteins from snake venoms: structure, function and mechanism. Biochem J. 2006; 397 (3): 377—387. [ Links ]
Recibido: Diciembre 10 de 2008; Aceptado: Junio 3 de 2009
* Autor a quien debe dirigir la correspondencia: sebastian.estrada@siu.udea.edu.co