Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.3 Medellín Sept./Dec. 2009
FARMACOLOGÍA Y TOXICOLOGíA
CARACTERIZACIÓN DEL ESTRÉS OXIDATIVO EN RATAS WISTAR DIABÉTICAS POR ESTREPTOZOTOCINA
OXIDATIVE STRESS CARACTERIZATION IN STREPTOZOTOCIN-DIABETIC WISTAR RATS
Ángela C. MORA H.1, Diana M. ARAGÓN N.1, Luis F. OSPINA G.1*
1 Departamento de Farmacia. Universidad Nacional de Colombia-Sede Bogotá. A.A. 14490. Bogotá, Colombia.
RESUMEN
La diabetes es un trastorno metabólico crónico de gran alcance epidemiológico. Numerosos estudios han demostrado que la diabetes mellitus se encuentra asociada al incremento de la formación de radicales libres derivados del oxígeno y a la disminución del potencial antioxidante del organismo, generando el daño oxidativo de algunos componentes de la célula tales como las proteínas, carbohidratos, lípidos y ácidos nucleicos. Este trabajo pretende establecer, en ratas Wistar, la relación dosis-respuesta de estreptozotocina frente a los niveles de glucosa y a diferentes parámetros del estatus antioxidante. Como marcadores del daño asociado a las especies de oxígeno reactivas se evaluó la actividad enzimática de catalasa y de superóxido dismutasa, la capacidad antioxidante total del plasma y la peroxidación lipídica. Los resultados obtenidos evidencian una clara relación de la dosis de estreptozotocina con los niveles de glucosa y los parámetros de estrés oxidativo evaluados luego de 20 días de la inducción de la diabetes experimental.
Palabras clave: diabetes mellitus experimental, estrés oxidativo.
ABSTRACT
Diabetes is a chronic metabolic disease. Numerous studies have demonstrated that diabetes mellitus is associated to free radicals increase derived from oxygen and to the organism potential antioxidant decrease generating oxidative damage of some cell components like proteins, nucleic acids, carbohydrates and lipids. After 20 days of administration of streptozotocin in Wistar rats, we have found a relationship between levels of blood glucose and some markers from antioxidant status. We evaluate oxidative stress markers like catalasa and superoxide dismutase acivities, ferric reducing ability of plasma and thiobarbituric acid reactive species.
Keywords: experimental diabetes mellitus, oxidative stress.
INTRODUCCIÓN
La diabetes mellitus es un trastorno metabólico caracterizado principalmente por hiperglicemia. Varios procesos patogénicos están involucrados en su desarrollo, los que van desde la destrucción autoinmune de las células β en el páncreas, con la consecuente deficiencia en la insulina, hasta las anormalidades resultantes en la resistencia a la acción de la insulina (1).
Los síntomas de la marcada hiperglicemia incluyen poliuria, polidipsia, pérdida de peso, algunas veces con polifagia. El favorecimiento de la susceptibilidad a ciertas infecciones puede también presentarse con la hiperglicemia crónica. La morbilidad y mortalidad de la diabetes está relacionada con el desarrollo de complicaciones tanto micro como macrovasculares, para las que se ha sugerido al estrés oxidativo como la vía común que une los diferentes mecanismos para las patogénesis asociadas (2-4).
El estrés oxidativo se produce cuando se rompe el balance entre las sustancias pro y antioxidantes presentes en los organismos, favoreciéndose la producción y permanencia de las especies de oxígeno reactivas (EORs), debido a un incremento de su formación o a una deficiencia del sistema de defensa antioxidante, lo que conlleva a que se acumulen y se manifieste en diversos estados fisiopatológicos (5).
Dentro de los modelos para inducir diabetes en roedores se encuentran los que emplean agentes químicos, siendo los más utilizados en investigación el aloxano y la estreptozotocina (STZ). Estos compuestos en dosis diabetogénicas actúan específicamente sobre las células β pancreáticas. Igualmente, con este propósito pueden emplearse otros compuestos tales como el ácido caproico, los derivados del ácido ascórbico, el α-dipiridil, el ácido 5-hidroxiseudoúrico, el ácido picrolónico y los derivados del aloxano, entre otros (6). Las nitrosoúreas, como STZ, fotemustina, clomesone y procarbazine, inducen daño del ADN debido a la alquilación de sitios específicos de sus bases generando radicales libres, como el NO•, durante su metabolización. También se ha encontrado que estos compuestos aumentan la generación de radical superóxido por el sistema xantina oxidasa de las células pancreáticas, de la misma forma que estimulan la producción de H2O2 causando la fragmentación del ADN en islotes pancreáticos aislados de rata (7). Este daño pancreático causado por agente diabeogénicos se conoce como "hipótesis de Okamoto" (8).
El presente trabajo pretende establecer, en ratas Wistar, la posible relación dosis-respuesta de STZ frente a los niveles de glucosa y algunos parámetros del estatus antioxidante, con el fin de poder emplear este modelo de diabetes como herramienta para la evaluación del efecto modulador de algunos compuestos y/o extractos de plantas medicinales sobre la diabetes y el estatus oxidativo.
MATERIALES Y MÉTODOS
Animales
Se utilizaron ratas Wistar hembras, adultas jóvenes, con un peso corporal entre 160g y 200g, con edades entre 7 a 10 semanas, criadas y mantenidas en el Bioterio de experimentación del Departamento de Farmacia de la Universidad Nacional de Colombia, bajo condiciones estándar de fotoperíodo (12h luz/12h oscuridad), temperatura ambiental (22 ± 2°C), agua y comida ad libitum y esquemas de sanitización de su micro y macroambiente.
Inducción de la diabetes experimental
Se realizó la inducción de la diabetes mediante la administración de STZ por vía intraperitoneal (i.p.), en dosis representativas del rango más empleado en la literatura (9-12) (volumen de administración: 0,5 mL/100 g peso corporal). Se evaluaron tres dosis de STZ, agrupando los animales en la siguiente forma:
Grupo I: Control. Vehículo 0.5 mL/100 g
Grupo II: Dosis baja. STZ 33 mg/Kg
Grupo III: Dosis media. STZ 50 mg/Kg
Grupo IV: Dosis alta. STZ 75 mg/Kg
Las soluciones de estreptozotocina fueron preparadas inmediatamente antes de su administración, disolviendo la cantidad respectiva en un buffer de citrato de sodio 0,1 M pH 4,5. Una vez administrada la STZ, se administró a los animales una solución de glucosa al 20% durante las 24 horas siguientes con el fin de evitar la muerte por la hipoglicemia marcada que se produce en este período.
Los niveles de glucosa fueron evaluados a las 0 horas, 48 horas, 72 horas, 5 días, 9 días, 15 días y 20 días después de la administración de STZ. Adicionalmente, se realizó un seguimiento al peso, cantidad de alimento y agua consumida por los diferentes grupos con el propósito de establecer una tendencia en el comportamiento de los animales.
Determinación de niveles de glucosa en sangre (NGS)
Los niveles de glucosa fueron cuantificados mediante el método enzimático GOD-POD (Kit Glicemia enzimática AA de Wiener Lab). Las muestras de sangre fueron extraídas del seno retro-orbital de los animales mediante capilares heparinizados e inmediatamente adicionadas sobre 700 µL de Tungstato de Sodio 17 mM y se agitaron vigorosamente. Después de 5 minutos de reposo se centrifugaron durante 5 min a 5000 rpm para obtener el sobrenadante de cada muestra. Los NGS se determinaron por espectrofotometría a 490 nm en un lector de placas Biorad® 550, y el resultado fue comparado con una curva estándar preparada usando diferentes concentraciones (12,5 mg/dL - 500 mg/dL) de glucosa anhidra en agua destilada siguiendo el procedimiento descrito por el fabricante del Kit. Las concentraciones de glucosa se expresaron como mg/dL.
Marcadores del Estatus Antioxidante
El día 20, después de tomar los niveles de glucosa, se obtuvieron las muestras de sangre y órganos para evaluar los parámetros del estatus antioxidante, de acuerdo con los protocolos descritos en la literatura (9-14), con algunas modificaciones.
Uno a uno se llevó cada animal a un cuarto de procedimientos y allí se tomó una muestra de sangre de 400 µL mediante punción del plexo retro-orbital con capilares heparinizados, recolectando en tubos que contenían 300 µL de anticoagulante (Buffer citrato-adenina-fosfato) y manteniendo en baño de hielo. Posteriormente, las ratas se sacrificaron por dislocación cervical/decapitación. Inmediatamente se retiraron el hígado, los riñones y el páncreas y se mantuvieron en baño de hielo. Posteriormente, los órganos fueron lavados, troceados y homogenizados en tampón fosfatos 50 mM pH 7,40. Los homogenados se sometieron a centrifugación (10.000 rpm, 4°C, 10 min). El sobrenadante obtenido fue empleado para la determinación de los diferentes marcadores del estatus antioxidante.
A cada una de las fracciones de las muestras de sangre, hígado, páncreas y riñón se les cuantificó el contenido de proteína mediante el método descrito por Bradford en 1976.
Cuantificación de la capacidad antioxidante total plasmática (FRAP): Se empleó el método de la Capacidad del Plasma para Reducir el Hierro ("Ferric Reducing Ability of Plasma"), el cual cuantifica la capacidad de los antioxidantes contenidos en una muestra para reducir el tripiridil-triazina férrica (Fe3+-TPTZ) a la forma ferrosa (Fe2+), la cual tiene una absorbancia máxima a 593 nm (15).
El reactivo FRAP se preparó diariamente, mezclando: 10 volúmenes de la Solución A (buffer acetato 300 mM; pH 3,6); 1 volumen de la Solución B (TPTZ: 2,4,6-tripiridil-s-triazina 10 mM en HCl 40 mM) y 1 volumen de la Solución C (FeCl3 20 mM). Para la cuantificación se tomaron 200 mL del reactivo FRAP, se determinó su absorbancia a 593 nm y posteriormente se adicionaron 30 µL de agua desionizada y 20 µL de muestra. Se homogenizó la muestra y se realizó la lectura a 593 nm después de 4 minutos. Se realizaron blancos de muestra y de reactivo. El blanco de reactivo y el blanco de la muestra se restaron de la absorbancia final después de los 4 minutos y el resultado se comparó con una curva estándar preparada empleando diferentes concentraciones de FeSO4 (100-1.000 µmol/L) en agua desionizada y siguendo el procedimiento descrito. La capacidad antioxidante plasmática total se expresó como mg de FeSO4 por miligramo de proteína de la muestra.
El reactivo FRAP se preparó diariamente, mezclando: 10 volúmenes de la Solución A (buffer acetato 300 mM; pH 3,6); 1 volumen de la Solución B (TPTZ: 2,4,6-tripiridil-s-triazina 10 mM en HCl 40 mM) y 1 volumen de la Solución C (FeCl3 20 mM). Para la cuantificación se tomaron 200 mL del reactivo FRAP, se determinó su absorbancia a 593 nm y posteriormente se adicionaron 30 µL de agua desionizada y 20 µL de muestra. Se homogenizó la muestra y se realizó la lectura a 593 nm después de 4 minutos. Se realizaron blancos de muestra y de reactivo. El blanco de reactivo y el blanco de la muestra se restaron de la absorbancia final después de los 4 minutos y el resultado se comparó con una curva estándar preparada empleando diferentes concentraciones de FeSO4 (100-1.000 µmol/L) en agua desionizada y siguendo el procedimiento descrito. La capacidad antioxidante plasmática total se expresó como mg de FeSO4 por miligramo de proteína de la muestra.
Indice de peroxidación lipídica (cuantificación de sustancias que reaccionan con el Acido Tiobarbitúrico: TBARs). Para evaluar el índice de peroxidación lipídica en los tejidos, se tomaron 450 µL del homogenado del respectivo órgano, se adicionaron 50 µL de tampón fosfatos 50 mM pH 7,40 y 1 mL de ácido tricloroacético (TCA) al 10%. Se centrifugó a 1850 xg durante 10 min a 4°C. Se tomó 1 mL del sobrenadante y se le adicionó 1 mL de ácido tiobarbitúrico (TBA) al 0,67%. Esta mezcla se calentó a 92°C durante 30 min y posteriormente se enfrió en baño de hielo para posteriormente medir la absorbancia a 532 nm. Los resultados fueron expresados como TBARs (mmoles/mL)/mg de proteína de tejido, calculando la concentración de TBARs de la expresión ε=A/c*h con un ε=153000.
Cuantificación de la actividad enzimática Superóxido Dismutasa (SOD). La actividad de la Cu-SOD y la Mn-SOD en las muestras fue determinada utilizando el ensayo de la riboflavina-o-dianisidina descrito por Paynter (16). La mezcla de reacción empleada para el ensayo tenía la siguiente composición: 2,7 mL de fosfato de potasio pH 7,80 que contenía ácido etilendiaminotetraacético (EDTA) 0,1 mM; 0,1 mL de o-dianisidina diclorhidrato 6 mM en agua y 0,1 mL de riboflavina 0,29 mM. Esta mezcla es estable durante 12 horas si es almacenada a 4°C y protegida de la luz. Para la cuantificación, a 200 mL de la mezcla de reacción se adicionaron 4 mL de homogenado y/o su dilución. Se mezcló e incubó durante 5 min a 25°C en la oscuridad. Se leyó la absorbancia a 415 nm. La mezcla se expuso a una luz fluorescente ubicada a 5 cm de distancia durante 8 minutos exactos y posteriormente se leyó la absorbancia a 415 nm. En la construcción de la curva de calibración se reemplazó la cantidad de muestra adicionada por SOD a diferentes concentraciones dentro de un rango de 0,01-1 U/mL. Por interpolación en esta curva se determinó la cantidad de SOD presente en los homogenados de los diferentes órganos.
Cuantificación de la actividad enzimática catalasa (CAT). Este método de cuantificación empleado, descrito por Aebi (17), se basa en la determinación de la constante de velocidad, k, para la descomposición de peróxido de hidrógeno, mediante la cuantificación del cambio de absorbancia por minuto. Las actividades se expresan como k (s-1) por mg de proteína. Se colocaron 250 µL de peróxido de hidrógeno 10 mM en una microcelda de cuarzo, se adicionó 5 µL del homogenado o su dilución y 45 µL de Buffer fosfatos 50 mM pH 7,0. Se midió inmediatamente el cambio de absorbancia a 240 nm, durante 30 seg. La actividad de catalasa se expresó como cambio de absorbancia por mg de proteína del homogenado.
Anáalisis estadístico
Los resultados fueron expresados como la media aritmética de los valores ± desviación estándar de la media y fueron analizados estadísticamente mediante ANOVA de una vía; seguido de un test de Dunnett para comparaciones múltiples. Se consideró que la diferencia entre los grupos tratados y el grupo control fue significativa (*) cuando p < 0,05.
RESULTADOS Y DISCUSIÓN
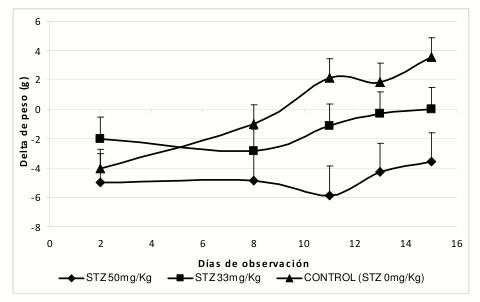
Para la determinación de la relación entre la dosis de STZ y el efecto diabetogénico en ratas Wistar, se administraron tres dosis de STZ (33, 50 y 75 mg/ Kg). Si bien las dosis de STZ más utilizada en ratas Wistar está alrededor de 50 mg/Kg, aquí exploramos dosis mayores y menores a esta en un factor de 1.5; esto con el fin de evaluar la sensibilidad de nuestra colonia local de ratas Wistar. Es de anotar que en otros trabajos se han usado dosis tan bajas como 40 mg/Kg (12) y mayores a 75 mg/Kg (18). A estos animales se les realizó seguimiento a la variación del peso y los niveles de glucosa, en diferentes tiempos de muestreo durante 20 días (Véase figura 1).
Figura 1. Evolución del peso de ratas diabéticas por STZ. Los datos están reportados como la media ± D.E. de las observaciones (n=10 a tiempo t=0).
En los resultados es importante resaltar que todos los animales que recibieron la dosis más alta de STZ (75 mg/Kg) murieron antes del quinto día de observación, dosis que podría considerarse una DL100. Una verdadera DL100 para esta colonia de ratas Wistar debe encontrarse en valores menores a 75 mg/Kg. Sin embargo, dada la magnitud de la toxicidad sobre células beta-pancreáticas, se espera que estos agentes diabetogénicos tengan un margen de seguridad muy estrecho.
En el grupo de animales "control normoglicémicos" (no tratados con STZ) se observó una tendencia constante al aumento de peso. Los animales que como consecuencia de la administración de un agente diabetogénico como la STZ entran en fase de hiperglicemia sufren una mayor disminución del peso corporal. La disminución en el peso corporal observado en diabéticos no controlados puede ser el resultado de la pérdida de proteínas debido a la imposibilidad de usar los carbohidratos como fuente de energía. Esta disminución de peso también es asociada a la excesiva diuresis característica en los cuadros diabéticos. En la figura 1 se evidencia que esta pérdida de peso puede llegar a considerarse dosis-dependiente para la STZ.
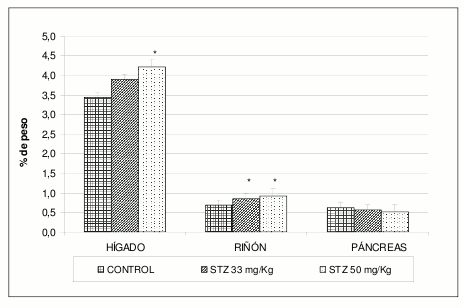
El principal órgano blanco para la toxicidad de la STZ es el páncreas, aunque otros órganos implicados en el metabolismo y eliminación de la glucosa reflejan alteraciones funcionales y/o anatómicas. Los hallazgos postmortem después de 20 días de inducción de la diabetes reflejan un aumento leve pero significativo en el peso de hígado y riñón, en una aparente relación dosis-respuesta para STZ (Véase figura 2).
Figura 2. Efecto de la dosis de STZ sobre el peso de órganos de ratas. Los datos están reportados como la media ± D.E. de las observaciones (n=7 para grupo 50 mg/Kg y n=10 para grupo control y 33 mg/Kg). "t" Dunnett *p < 0,05 frente al control.
Estos hallazgos coinciden con lo reportado en la literatura para el modelo de diabetes inducida con aloxano. Es de resaltar que en la literatura disponible no se encuentran reportes de esta relación en el modelo inducido con STZ. En el presente estudio se encontró que el hígado, el riñón y el páncreas presentan un aumento de la relación peso órgano / peso corporal en comparación con el grupo normoglicémico, lo que sugiere la ocurrencia de procesos inflamatorios de estos órganos (19).
Los anteriores resultados muestran una clara relación dosis-respuesta de la STZ en cuanto a la alteración del peso de los órganos y a la variación de peso de los animales. Sin embargo, el parámetro más relevante en la caracterización de este modelo de diabetes es el NGS, el cual permite identificar claramente el tiempo de inducción necesario (tiempo después de la administración de STZ en el cual el mayor porcentaje de los animales resulta diabético y sus NGS empiezan a tornarse estables), tiempo que según los reportes de la literatura oscila entre 3 y 5 días (9-12).
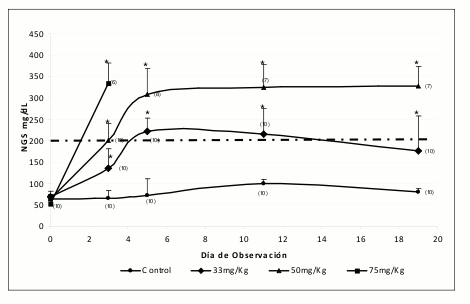
Simultáneamente, se presenta de manera global la evolución de los NGS de cada uno de los grupos durante los 20 días de observación (Véase figura 3). Antes del día 5 todos los animales de dosis 75 mg/ Kg murieron, a la vez que el grupo control mantuvo sus niveles normales de glucosa durante los días de observación. En cuanto al grupo de 33 mg/Kg se observó una disminución de los niveles de glucosa después del día 5 llegando a niveles inferiores a 200 mg/dL, mientras que el grupo de 50 mg/Kg mantuvo los NGS por encima de 300 mg/dL con tendencia a estabilizarse.
Figura 3. Evolución del efecto de STZ sobre NGS (Relación Dosis-Respuesta). Los datos están reportados como la media ± D.E. de las observaciones "t" Dunnett *p < 0,05 frente al control.
En el día cero, en los animales normoglicémicos se encontraron niveles de glucosa entre 52 y 68 mg/ dL, uniformemente distribuidos en las diferentes dosis de STZ, no encontrándose diferencia estadísticamente significativa en la prueba de ANOVA. Por lo tanto, los posibles incrementos posteriores en los niveles de glucosa pueden ser atribuibles a la dosis de STZ administrada.
En el día 3 del experimento, los animales que no recibieron STZ continuaban con niveles de glucosa inferiores a 70 mg/dL mientras que aquellos que recibieron alguna dosis de STZ poseían elevados NGS, estadísticamente diferentes a los del grupo control y diferentes entre las dosis evaluadas.
Como criterio de selección, previamente se había establecido que aquellos animales con valores de glucosa superiores a 200 mg/dL eran considerados diabéticos. Esta condición se logró en el día 3 para el 10% de los animales que recibieron la dosis de 33 mg/Kg (NGS = 135 ± 13 mg/dL), el 50% en el grupo de 50 mg/Kg (NGS = 200 ± 33 mg/dL) y el 100% de los que recibieron 75 mg/Kg (NGS = 335 ± 13 mg/dL), aunque en esta última se presentó la muerte del 40% de la población asociada a la toxicidad de la dosis de STZ empleada. Los promedios presentados incluyen todos los animales del grupo (diabéticos y no diabéticos).
Al día 5, el grupo control continuaba con NGS que podían considerarse normales (75 ± 9 mg/ dL), todos los animales de la dosis de 75 mg/Kg habían muerto y los demás grupos presentaban NGS estadísticamente diferentes al grupo control y entre ellos. Se encontró que el 60% de lo animales con 33 mg/Kg de STZ (NGS = 222 ± 27 mg/dL) y el 100% de los animales con 50 mg/Kg de STZ (NGS = 288 ± 54 mg/dL) poseían NGS superiores a nuestro valor de referencia (200 mg/dL). Estos resultados evidencian que es necesario un tiempo de estabilización de al menos cinco días después de la inducción con una dosis de 50 mg/Kg de STZ, para así obtener animales francamente diabéticos. La dosis de 33 mg/Kg no la consideramos efectiva para este fin debido a que solo el 60% de los animales podrían considerarse diabéticos después del 5 día de inducción. Además, se observa una alta variabilidad en las respuestas.
En los días 11 y 19, los animales del grupo control mantuvieron sus niveles de glucosa normales, por debajo de 100 mg/dL, mientras los demás grupos mantuvieron altos los NGS, estadísticamente diferentes al grupo control. Es importante resaltar que el día 19 el grupo de 33 mg/Kg presentó NGS inferiores a los presentados en el día 11 (176 y 215 mg/dL, respectivamente), aunque todavía el 50% de los animales eran diabéticos. Es de anotar que a pesar del aparente descenso paulatino en los NGS, estos animales siguen siendo "hiperglicémicos" pues los NGS en los días 11 y 19 representan el 316% y 259%, respectivamente, de los NGS basales (día cero). En estos mismos días de muestreo, el grupo de animales con dosis de 50 mg/Kg de STZ mostró NGS estables (325 y 327 mg/dL, respectivamente).
Efecto de STZ sobre marcadores de estrés oxidativo
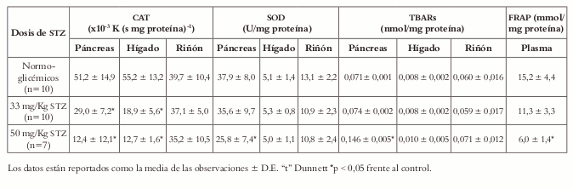
A continuación se describe el efecto de STZ sobre diferentes marcadores de estrés oxidativo en páncreas, hígado, riñón y plasma de ratas Wistar (Véase tabla 1).
Tabla 1. Niveles de marcadores de estrés oxidativo en plasma y órganos de ratas Wistar diabéticas por STZ.
Cuantificación de la capacidad antioxidante total en plasma, mediante el método de la Capacidad del Plasma para Reducir el Hierro (FRAP "Ferric reducing ability of plasma"). En este ensayo, valores altos de FRAP reflejan una buena presencia de compuestos antioxidantes pequeños no enzimáticos capaces de reducir al reactivo TPTZ. En otras palabras, se refiere a "scavengers" pequeños que se oxidan protegiendo a sustratos vulnerables como son los tejidos diana para el estrés oxidativo. Dentro de esta categoría se consideran antioxidantes como el ácido ascórbico, el ácido úrico y el glutatión (20).
En los animales diabéticos, la STZ en dosis de 50 mg/Kg redujo en un 60% el parámetro FRAP, lo cual fue significativo respecto al grupo control normoglicémico. Con la dosis de 33 mg/Kg la reducción de este parámetro no fue estadísticamente significativa frente al control. Estos resultados son esperables y sugieren que la utilización de STZ en 50 mg/Kg como dosis diabetogénica permitiría evidenciar el posible efecto de un tratamiento antiabético/antioxidante sobre la modificación del parámetro FRAP.
Cuantificación de la actividad enzimática de la Superóxido Dismutasa. El efecto de las diferentes dosis de STZ sobre los niveles de SOD en los órganos estudiados es presentado en la tabla 1. La STZ redujo la actividad enzimática de SOD en animales diabéticos. Se muestra que en el páncreas la STZ en dosis de 50 mg/Kg reduce en un 32% la actividad SOD en relación al grupo normoglicémico. En los otros órganos analizados, el hígado y el riñón, esta actividad no se vió alterada significativamente.
Ravi et al (21) reportan en su trabajo que las actividades de las enzimas SOD y CAT en ratas diabéticas por STZ están significativamente incrementadas comparadas frente al grupo control. Por el contrario, Milani et al (9), Ravi et al (21) y Jin et al (22) muestran en sus ensayos que la actividad de las enzimas antioxidantes (SOD y CAT) en hígado y riñones de ratas diabéticas, con elevada peroxidación lipídica, presentan un descenso en la actividad. Esta dualidad en la respuesta de la SOD según el órgano puede estar asociada a que el estrés oxidativo induce la producción de enzimas, como mecanismos compensatorios, incrementando su actividad en los animales diabéticos con el fin de mantener la homeostasis. La reducción de la actividad de SOD observada en algunos experimentos puede asociarse, en parte, a una inactivación de la enzima debido a elevadas concentraciones de EROs y a procesos de glicación no enzimatica favorecidos por la hiperglicemia persistente en los cuadros de diabetes (21,22).
Cuantificación de la actividad enzimática de la Catalasa. El efecto de la administración de las diferentes dosis de STZ sobre los niveles de Catalasa en ratas Wistar está descrito en la tabla 1. El tratamiento de las ratas con STZ produjo una disminución significativa en la actividad CAT, con una respuesta dosis-dependiente. La dosis de 50 mg/Kg de STZ logró reducir esta actividad en un 76% en el páncreas y un 78% en el hígado, con respecto a los valores del animal normoglicémico. En el riñón no se evidenció una alteración aparente en la actividad CAT. Esta respuesta está acorde con los reportes de la literatura en los que la actividad de la CAT es significantemente disminuida en diferentes órganos (11,24) y en donde, al igual que la SOD, las altas concentraciones de EROs y la posible glicación que sufren las enzimas disminuye su actividad.
Índice de peroxidación lipídica, cuantificación de sustancias que reaccionan con el ácido tiobarbitúrico: TBARs. El ensayo denominado "TBARs" (en inglés, sustancias que reaccionan con el ácido tiobarbitúrico) siempre se ha considerado como un buen "marcador analítico" del estrés oxidativo que se traduce en una intensa peroxidación lipídica de membranas biológicas. Muchos estudios con modelos animales y en humanos han mostrado incrementos en la peroxidación lipídica de las membranas del hígado y el riñón en el estado diabético, frente a individuos normoglicémicos (22).
El estrés oxidativo incrementado y el pobre estatus antioxidante llevan al incremento de la peroxidación lipídica en los tejidos de los animales diabéticos. Las elevadas concentraciones de peróxidos lipídicos pueden propagar el daño oxidativo por el incremento de radicales peroxilo e hidroxilo, contribuyendo al deterioro funcional de los diferentes órganos (21).
Como se mencionó anteriormente, el hígado, el páncreas y el riñón son órganos diana para la toxicidad del STZ como agente diabetogénico. Entre estos tres órganos, el páncreas resultó ser el más afectado en términos de peroxidación lipídica, pero únicamente con la dosis de 50 mg/Kg, la que consideramos como dosis efectiva para generar diabetes.
Bajo las condiciones establecidas en este modelo, frente a una peroxidación lipídica basal (la del grupo control normoglicémico), STZ en dosis de 50 mg/Kg incrementa en más del doble este parámetro de estrés oxidativo. Es esperable que en ensayos donde se emplee este modelo, la administración de extractos y/o compuestos con posible actividad antioxidante logre atenuar este fenómeno. En nuestros animales diabéticos encontramos niveles de TBARs mucho mayores a los de animales normoglicémicos (relación aproximada 5:1) y de magnitud similar en los tres órganos diana analizados, lo que está en concordancia con lo descrito en la literatura (24).
CONCLUSIONES
Los resultados obtenidos permiten evidenciar que existe una relación entre la dosis de STZ y la severidad del cuadro de diabetes generado en ratas Wistar. La dosis de STZ de 33 mg/Kg parece generar un efecto no estable después del quinto día de inducción, reflejado en niveles de glucosa inferiores a 200 mg/dL. La dosis de 50 mg/Kg genera una diabetes estable durante, al menos, 20 días después de una única administración, caracterizada por NGS superiores a 300 mg/dL. La dosis de 75 mg/Kg presenta un alto efecto diabetogénico que induce la muerte al 100% de los individuos (Dosis letal 100).
Los parámetros de estrés oxidativo evaluados demuestran una alteración dosis dependiente de la STZ empleada para la inducción de la diabetes. Esta relación es afectada tanto por la susceptibilidad de cada uno de los órganos evaluados como por la selectividad de la acción de la estreptozotocina que genera una disminución del estatus antioxidante de los animales.
Los anteriores resultados permiten establecer que empleando una dosis de 50 mg/Kg de STZ en ratas Wistar bajo las condiciones descritas, se obtiene en los animales un cuadro de diabetes que afecta de forma significativa diferentes marcadores de estrés oxidativo, por lo cual podría emplearse como herramienta para la evaluación del efecto modulador de sustancias sobre la diabetes y el estatus oxidativo.
AGRADECIMIENTOS
A la División de Investigación de la Universidad Nacional de Colombia, sede Bogotá, por la financiación de este proyecto; al grupo de investigación "Principios Bioactivos en Plantas Medicinales" y al Departamento de Farmacia de la Universidad Nacional de Colombia.
REFERENCIAS BIBLIOGRÁFICAS
1. Gavin JR, Alberti MM, Davidson MB, de Fronzo RA, Drash A, Gabbe SG, et al. Report of the Expert Committee on the diagnosis and classification of diabetes mellitus. Diabetes Care. 2002; 25 (S1): 5-15. [ Links ]
2. Rahimi R, Nikfar S, Larijani B, Abdollahi M. A review on the role of antioxidants in the management of diabetes and its complications. Biomed Pharmacother. 2005; 59 (7): 365-373. [ Links ]
3. Feldman EL. Oxidative stress and diabetic neuropathy: a new understanding of an old problem. J Clin Invest. 2003; 111 (4): 431-433. [ Links ]
4. Triana ME. La hiperglicemia y sus efectos tóxicos. Un concepto patogénico para la micro y macroangiopatía diabética. Rev Cuba Angiol y Cir Vasc. 2001; 2 (2): 131-141. [ Links ]
5. Castell PP, Pérez de Alejo J. Métodos para medir el daño oxidativo. Rev Cubana Med Milit. 2000; 29 (3): 192-198. [ Links ]
6. Ramos HG, Méndez JD. Diabetes mellitus experimental. Cien Vet. 1994; 6 (1): 347-377. [ Links ]
7. Bolzán AD, Bianchi MS. Genotoxicity of Streptozotocin. Mutat Res. 2002; 512 (2): 21-134. [ Links ]
8. Takasu N, Komiya I, Asawa T, Nagasawa Y, Yamada T. Streptozocin- and alloxan-induced H2O2 generation and DNA fragmentation in pancreatic islets. H2O2 as mediator for DNA fragmentation. Diabetes. 1991; 40 (9): 1141-1145 [ Links ]
9. Milani E, Nikfar S, Khorasani R, Zamani MJ, Abdollahi M. Reduction of diabetes-induced oxidative stress by phosphodiesterase inhibitors in rats. Comp Biochem Physiol C. 2005; 140 (2): 251-255. [ Links ]
10. Okutan H, Ozcelik N, Yilmaz HR, Uzb E. Effects of caffeic acid phenethyl ester on lipid peroxidation and antioxidant enzymes in diabetic rat heart. Clin Biochem. 2005; 38 (2): 191-196. [ Links ]
11. Gupta S, Kataria M, Gupta PK, Murganandan S, Yashroy RC. Protective role of extracts of neem seeds in diabetes caused by streptozotocin in rats. J Ethnopharmacol. 2004; 90 (2-3): 185-189. [ Links ]
12. Yazdanparast R, Ardestani A, Jamshidi S. Experimental diabetes treated with Achillea santolina: Effect on pancreatic oxidative parameters. J Ethnopharmacol. 2007; 112 (1): 13-18. [ Links ]
13. Bhor VM, Raghuram N, Sivakami S. Oxidative damage and altered antioxidant enzyme activities in the small intestine of streptozotocin-induced diabetic rats. Int J Biochem Cell Biol. 2004; 36 (1): 89-97. [ Links ]
14. Lee JS. Effects of soy protein and genistein on blood glucose, antioxidant enzyme activities, and lipid profile in streptozotocininduced diabetic rats. Life Sci. 2006; 79 (16): 1578-1584. [ Links ]
15. Beltowski J, Wójcicka G, Górny D, Marciniak A. The effect of dietary-induced obesity on lipid peroxidation, antioxidant enzymes and total plasma antioxidant capacity. J Physiol Pharmacol. 2000; 51 (4): 883-896. [ Links ]
16. Paynter J. Changes in activity of the manganese superoxide dismutase enzyme in tissues of the rat with changes in dietary manganese. J Nutr. 1980; 110 (3): 437-447. [ Links ]
17. Aebi H. Catalase in vitro. Methods Enzymol.1984; 105 (1): 121126. [ Links ]
18. Garden M, Podgorska M, Szutowicz A, Pawelczyk T. Diabetesinduced alterations of adenosine receptors expression level in rat liver. Exp Mol Pathol. 2007; 83 (3): 392-398. [ Links ]
19. Liu Z, Li J, Zeng Z, Liu M, Wang M. The antidiabetic effects of cysteinyl metformin, a newly synthesized agent, in alloxan- and streptozocin-induced diabetic rats. Chem Biol Interact. 2008; 173 (1): 68-75. [ Links ]
20. Pincemail J, Deby C, Thirion A, Dethier A, Deby-Dupont G, Goutier R. Stimulation of cyclooxygenase by activated human neutrophils is enhanced by uric acid. Prostaglandins.1986; 32 (1): 101-105. [ Links ]
21. Ravi K, Ramachandran B, Subramanian S. Effect of Eugenia jambolana seed kernel on antioxidant defense system in streptozotocin-induced diabetes in rats. Life Sci. 2004; 75 (22): 2717-2731. [ Links ]
22. Jin L, Chen J, Wang L, Peng W, Yan X, Zhang Q, et al. Increased glycated albumin and decreased esRAGE concentrations are associated with in-stent restenosis in Chinese diabetic patients. Clin Chim Acta. 2008; 396 (1): 33-37. [ Links ]
23. Andallua B, Varadacharyulu N. Antioxidant role of mulberry (Morus indica L. cv. Anantha) leaves in streptozotocin-diabetic rats. Clinic Chim Acta. 2003; 338 (1): 3-10. [ Links ]
24. Ugochukwu NH, Babady NE. Antioxidant effects of Gongronema latifolium in hepatocytes of rat models of non-insulin dependent diabetes mellitus. Fitoterapia. 2002; 73 (7-8): 612-620. [ Links ]
Recibido: Noviembre 5 de 2008; Aceptado: Agosto 13 de 2009
* Autor a quien debe dirigir la correspondencia: beatriz.lopez@siu.udea.edu.co