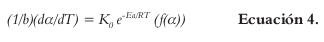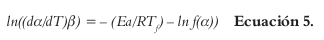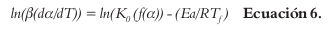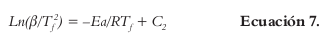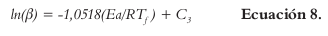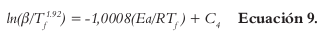Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.16 no.3 Medellín Sept./Dec. 2009
INDUSTRIAL FARMACÉUTICA
CARACTERIZACIÓN CINÉTICA DE DIFERENTES POLIMORFOS DE FENITOINA POR MEDIO DE LA TÉCNICA DE DSC
KINETIC CHARACTERIZATION OF DIFFERENT PHENYTOIN POLYMORPHS BY DSC TECHNIQUE
Oscar A. FLOREZ A.1*Gloria E. TOBÓN Z.1; Erika M. LOPERA G.1
1 Grupo Diseño y Formulación. Facultad de Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín-Colombia.
RESUMEN
La variación de la energía de activación puede ser utilizada como una medida ágil para diferenciar polimorfos de los ingredientes activos farmacéuticos. En este trabajo se obtienen diversos hábitos cristalinos de fenitoína mediante procesos de recristalización en diferentes solventes. Algunos de estos sólidos presentan diferencias en el punto de fusión por DSC, pero son similares en DRX e IR-TF. A partir de los resultados del punto de fusión, se seleccionan 4 sólidos por presentar los valores más disímiles, luego su energía de activación (Ea) se determina por medio de la técnica DSC, empleando 3 modelos teóricos de isoconversión no isotérmicos, encontrándose hasta 23 Kcal/mol de diferencia entre los valores más extremos.
Palabras clave:pseudopolimorfos, energía de activación, recristalización.
ABSTRACT
The activation energy variation can be used as a quick measure to differentiate polymorphs of active pharmaceutical ingredients. In this paper diverse phenytoin crystal habits have been obtained through processes of recrystallization in different solvents. Some of these solids differ in melting point by DSC, but are similar in XRD and FT-IR. From the results of melting point, 4 solids are selected by presenting the most dissimilar values. Their activation energy (Ea) is determined by DSC technique, using 3 theoretical isoconversional nonisothermal models and it is found even that 23 Kcal/ mol of difference separate the most extreme values.
Key words: pseudopolymorphs, activation energy, recrystallization.
INTRODUCCIÓN
Los ingredientes activos farmacéuticos (API, de sus siglas en inglés) que presentan polimorfismo pueden mostrar diferentes propiedades fisicoquímicas, entre ellas las termodinámicas como los puntos de fusión, sublimación o descomposición, energía interna, entalpía, entropía, solubilidad, entre otras; además de las propiedades cinéticas como: la estabilidad, las reacciones del estado sólido o la disolución (1, 2).
La fenitoína es un principio activo que presenta significativas modificaciones en su estructura externa al ser recristalizada por diferentes técnicas, además se ha reportado la obtención de pseudopolimorfos estructurales (3-7).
Tomando en cuenta las características anteriores, es posible emplear la variación de la energía de activación (Ea) a partir del punto de fusión (Tf) como parámetro cinético de diferentes formas sólidas de fenitoína, obtenidas por diversas técnicas de recristalización para determinar la presencia de polimorfos, de donde se puede inferir los posibles efectos en su desempeño farmacéutico, especialmente en la predicción de la disolución y de la estabilidad térmica de las sustancias.
La Ea es la barrera de energía necesaria para que los reactivos formen productos en una reacción química. Para la mayoría de principios activos farmacéuticos, en el caso de reacciones de degradación o de disolución, los valores de Ea pueden oscilar aproximadamente entre 40 y 126 KJ/mol (10 a 30 Kcal/mol); para la fenitoína se ha encontrado por técnicas de análisis térmicos, que la Ea está entre 18 y 21 Kcal/mol (8, 9).
Estudios cinéticos por medio de la técnica de calorimetría de barrido diferencial (DSC)
En el estudio de la cinética química de las sustancias, la ecuación de Arrhenius es la base del manejo de los datos obtenidos para estudios predictivos que son dependientes de la temperatura (T), de acuerdo con la siguiente ecuación:
Con esta ecuación, se puede obtener la velocidad total de la reacción (k) con cierto grado de precisión y la Ea, aún en los casos en los que esta última no está bien definida, ya que es la sumatoria de energías parciales comprometidas en el proceso. En la ecuación, K0, es el factor pre-exponencial y R es la constante de los gases.
Entre los diferentes métodos matemáticos para la obtención de los datos cinéticos por medio del análisis térmico como el DSC, las técnicas por isoconversión en los modelos independientes son las más ampliamente utilizadas. Estos modelos son llamados así, ya que la determinación de la Ea requiere mediciones a varias velocidades de calentamiento a una temperatura fija, a diferencia de los modelos fijos en donde solo es necesario hacer una medida, lo que los hace muy útiles para tener una rápida idea de los parámetros cinéticos de una sustancia (10).
Estos modelos, a su vez, pueden ser isotérmicos o no isotérmicos. Los isotérmicos amodelísticos, están basados en la siguiente expresión matemática:
En donde (ϝ(α)) es un factor dependiente de la fracción trasformada (α) y el otro, (k(T)), es una constante en función de la temperatura.
Consecuentemente, es posible relacionar las Ecuaciones 1 y 2, y asumiendo una reacción de orden uno, se obtiene la ecuación de velocidad de reacción (dα/dt), en unidades de 1/seg, correspondiente a:
Para pruebas no isotérmicas en donde la velocidad de calentamiento (β) es igual a dT/dt, se puede enunciar de la siguiente manera:
Reagrupando la Ecuación 4 y aplicando logaritmos a ambos lados, resulta lasiguiente ecuación:
A partir de estas ecuaciones se han formulado una multitud de variaciones, ya que todos los modelos de isoconversión deben ser ajustados con el fin de refinar el valor de la Ea debido a la inexactitud en las aproximaciones de la temperatura, de la medición de la velocidad de reacción y de la determinación de la temperatura por cada fracción transformada (11-14).
Entre los más populares modelos teóricos de isoconversión se encuentran:
El método diferencial de Friedman, el cual puede obtener directamente la Ea en contraste con los métodos integrales, y que esencialmente es la transformación logarítmica de la Ecuación 3, para obtener la Ecuación 6 (15, 16):
Esta fórmula permite determinar la Ea realizando varios ensayos, cada uno a diferente velocidad de calentamiento y se grafica ln (β(dα/dT)) versus 1/Tϝ.
Esta técnica, que puede ser llamada de velocidad de isoconversión, basa su popularidad en que no introduce ninguna aproximación y no se restringe a ningún tipo de calentamiento constante; sin embargo, presenta también algunas desventajas al hacer el cálculo, debido a la alta inestabilidad numérica e interferencia por ruido si no se realiza una adecuada interpolación (17).
Otro modelo matemático emplea aproximaciones a la integral de la temperatura. Como representantes más conocidos están: el método generalizado de Kissinger-Akahira-Sunose (KAS) y el de Flynn-Wall-Ozawa (FWO). El primero de ellos (KAS), puede ser obtenido por la transformación logarítmica de derivaciones de la Ecuación 6, hasta obtener la siguiente ecuación (18-20):
Siendo C2 el logaritmo de variables que no intervienen en el cálculo de la Ea, la cual se puede determinar a partir de la gráfica ln(β/Tϝ2) versus 1/Tϝ y se expresa como una función de la velocidad de calentamiento.
El segundo método (FWO), es una ecuación integral simplificada de la temperatura, empleando la aproximación de Doyle, descrita a continuación (21-23).
En este caso, la Ea se obtiene de la pendiente de la gráfica de ln(β) versus 1/Tϝ.
Tomando en cuenta las inexactitudes presentadas por otras aproximaciones de cálculo de la Ea por isoconversión no isotérmica, Starink propone la siguiente fórmula (Ecuación 9) para disminuir la inexactitud y aumentar la precisión con respecto a Tϝ, presente en otros modelos (24, 25):
MATERIALES Y MÉTODOS
La fenitoína como materia prima es sintetizada en el Laboratorio de Síntesis de Medicamentos de la Facultad de Química Farmacéutica de la Universidad de Antioquia, se recristaliza y purifica en varios solventes: etanol (etoh), acetona (acet), hexano (hex), e isopropanol (isop), todos éstos grado reactivo, bajo las modificaciones siguientes (3):
Recristalización. Se emplea el método de disolución en el punto de ebullición del solvente, para garantizar la sobresaturación y después de filtrar se procede de la siguiente manera:
En la primera recristalización (Me_rec1), la solución se deja durante 3 días a una temperatura de (-10°C), el precipitado obtenido se filtra al vacío; en la segunda (Me_rec2), la solución permanece a temperatura ambiente durante 24 horas, luego se lleva a enfriamiento (10-15°C) durante 48 horas y se filtra. En la tercera variación (Me_rec3), se obtienen los cristales por la completa evaporación del solvente a temperatura ambiente. En el cuarto método (Me_rec4), una vez saturado el solvente con la fenitoína y aún en ebullición, se adiciona rápidamente agua desionizada a 10°C (equivalente al doble del volumen del solvente), con agitación constante y el precipitado obtenido se filtra al vacío.
Determinación de posibles polimorfos. A los sólidos obtenidos se les realiza los análisis de espectroscopía infrarojo por transformadas de Fourier (IR-TF), se hacen corridos en longitudes de onda desde 500 a 3000 cm-1, por medio de un equipo PerkinElmer Spectrum BX®, triturando y diluyendo las muestras sólidas en KBr.
Los difractogramas de rayos X (DRX) se toman en un equipo Rigaku Miniflex°, con fuente de Cu Kα1, con mediciones de ángulo entre 3° y 50°.
Para la obtención de las mediciones térmicas del punto de fusión se utiliza un calorímetro de barrido diferencial (DSC), Netszch FOX-200. La escala de temperatura se calibra empleando como referencia In, con crisoles de Al y las pruebas se realizan en atmósfera de Nitrógeno.
La apreciación de la forma externa se obtiene por microscopía de luz óptica, empleando una cámara digital de 5 Megapixeles adaptada a un computador.
Modelos de cálculo de la energía de activación (Ea). Se aplican 3 modelos de isoconversión no isotérmica diferentes por medio del equipo DSC, en atmósfera de nitrógeno, en crisoles y tapas de aluminio, todos basados en el siguiente procedimiento:
- Se realizan corridos a 5 velocidades diferentes de calentamiento: (2, 4, 6, 8 y 10°C/min)
- Se determina la temperatura de fusión del compuesto.
- Luego se grafica según las coordenadas de cada uno de los tres modelos planteados más adelante.
- Desde la gráfica se determina la pendiente.
- Se calcula la energía de activación.
En el primer modelo se aplica la primera propuesta de la norma ASTM E698-05, graficanÂdo log10(β) contra 1/Tϝ (26). En este modelo es necesario utilizar un algoritmo para refinar la Ea hasta conseguir una aproximación a su valor final. El segundo método, que también aparece en la norma anterior, es el método FWO, en donde se grafica -(ln (β /Tϝ2)) versus (1/Tϝ). En el tercero, la Ea se evalúa por medio del modelo propuesto por Starink, en el cual se grafica ln(β /Tϝ1.92) contra 1/Tϝ.
RESULTADOS Y DISCUSIÓN
En la prueba no se consigue extraer suficiente cantidad de sólidos de los métodos de recristalización 2 (Me_rec2) en hexano y en isopropanol.
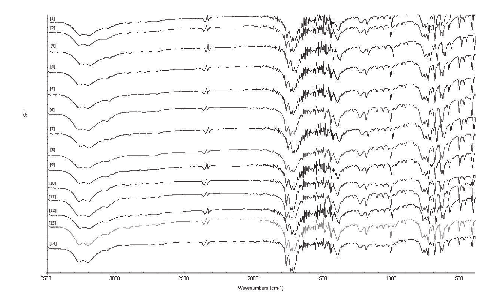
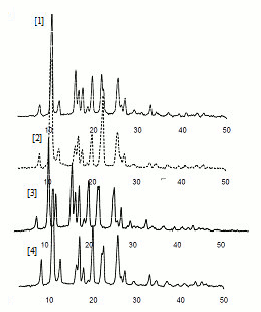
En las microfotografías de las muestras recristalizadas (Véase figura 1) se puede observar que algunas presentan hábitos cristalinos diferentes: aciculares, prismas, hojuelas, láminas y rombos; lo que es producto tanto del procedimiento como de los solventes empleados. Los resultados de la prueba de IR-TF son coherentes con lo encontrado en la literatura (26). Todos los espectros presentan las principales bandas de absorción: 1716, 1738, y 1772, 3200 y 3290 cmâ1; y sin cambios importantes en la región de las huellas digitales, lo que indica la coincidencia química de las muestras (Véase figura 2). Asimismo, los análisis de DRX no muestran diferencias sustanciales entre los diferentes tipos de sólidos; de donde se asume que su estructura interna no presenta modificaciones, en concordancia con publicaciones anteriores sobre fenitoína (3, 26) (Véase figura 3).
Figura 1. MicrofotografÃas representativas de las recristalizaciones, tomadas en un microscopio de luz óptico con un objetivo de 10x.
Figura 2. Espectros de IR-TF para todas las muestras obtenidas: [1] Me_rec1 en etanol, [2] Me_rec1 en acetona, [3] Me_rec1 en hexano, [4] Me_rec1 en isopropanol, [5] Me_rec2 en etanol, [6] Me_rec2 en acetona, [7] Me_rec3 en etanol, [8] Me_rec3 en acetona, [9] Me_rec3 en hexano , [10] Me_rec3 en isopropanol, [11] Me_rec4 en etanol, [12] Me_rec4 en acetona, [13] Me_rec4 en hexano , [14] Me_rec4 en isopropanol.
Figura 3. Difracción de rayos x para las 4 muestras escogidas: [1] Me_rec1 en etanol, [2] Me_rec4 en acetona, [3] Me_rec2 en hexano y [4] Me_rec4 en Isopropanol.
La prueba de DSC da como resultado diferencias relativas en los puntos de fusión de algunos de los sólidos y endotermas anchas en la región de evaporación de los solventes, lo que adicional a la prueba de DRX hace presumir la presencia de varios pseudopolimorfos (una clase de polimorfismo), que podrían presentar variaciones en sus propiedades fisicoquímicas.
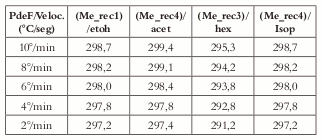
Los sólidos que muestran una diferencia más amplia en sus puntos de fusión se seleccionan para determinarles la Ea, midiendo los puntos de fusión corridos a diferentes velocidades de calentamiento por medio de la técnica de DSC (Véase figura 3 y tabla 1). Los sólidos escogidos son: Me_rec1 en etanol, Me_rec4 en acetona, Me_rec3 en hexano y Me_rec4 en Isopropanol.
Tabla 1. Puntos de fusión a diferentes velocidades de barrido en el DSC para diferentes procesos de recristalización.
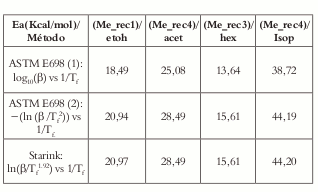
A partir de los cálculos de la Ea (Véase tabla 2) para las cuatro muestras seleccionadas se puede observar que los valores obtenidos del segundo modelo propuesto en la norma ASTM E689 (de Flynn-Wall-Ozawa) y el de Starink son muy similares entre sí, mientras que los propuestos por el primer modelo de la norma ASTM E689 entrega valores inferiores y la diferencia aumenta a medida que se va refinando el cálculo de la Ea.
Tabla 2. Valores obtenidos de Ea por tres modelos de isoconversión diferentes, para las muestras seleccionadas.
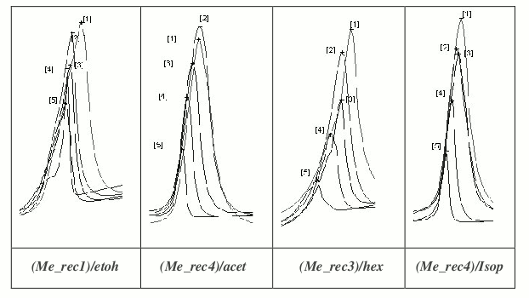
Figura 4. Termogramas de DSC corridas a diferentes velocidades de calentamiento para cada uno de los 4 métodos de recristalización seleccionados: [1] 10°C/seg; [2], 8°C/seg; [3] 6°C/seg; [4] 4°C/seg; [5] 2°C/seg.
Los resultados de la Ea muestran la diferencia energética encontrada entre algunos de los hábitos cristalinos de la fenitoína. Los sólidos aciculares recristalizados en etanol (Me_rec1/ etoh) presentan un punto de fusión aproximada de 298°C (a una velocidad de corrido de 10°C por minuto), que es el valor utilizado como referencia para la fenitoína y que genera una Ea de ± 20 Kcal/mol, valor que presentan la mayoría de las muestras recristalizadas en esta prueba. Las otras tres muestras seleccionadas para evaluar la Ea exhiben valores que la superan en 7 kcal/mol como los del método Me_rec4 recristalizados en acetona, que tienen forma externa rómbica. Los valores del método Me_rec4 recristalizado en Isopropanol superan la Ea hasta en 23 Kcal/mol, presentando un hábito cristalino laminar; y los valores del método Me_rec3 recristalizado en hexano son inferiores en 5 Kcal/mol.
CONCLUSIONES
La confirmación de la identidad química de las sustancias, por técnicas convencionales, no dan cuenta de las variaciones en la Ea que presentan los polimorfos, que pueden influir en el desempeño farmacéutico de los productos. Es recomendable que en el caso de los API que presentan variación durante el proceso de disolución o cuya estabilidad sea crítica, se realice un estudio de sus Ea de manera que se pueda elegir la mejor materia prima.
En este artículo se presenta el caso de la fenitoína, donde utilizando la técnica de análisis térmico por DSC se evalúan diferentes modificaciones cristalinas de esta sustancia y se observa que algunas de ellas presentan una Ea mayor hasta de 23 kcal/ mol de diferencia e inferior de 5 Kcal/mol, sobre el valor de referencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Grant DJ. Theory and Origin of Polymorphism. En: HG. Brittain, editores. Polymorphism in Pharmaceutical Solids. Vol 5. New York: Marcel Dekker; 1999. p. 1-33. [ Links ]
2. Gomes H, Carpentieri L, Watanabe S. Dissolution profile evaluation of solid pharmaceutical forms containing chloramphenicol. Biol Tech An Intern J. 2007; 50 (1): 57-65. [ Links ]
3. Nokhodchi A, Bolourtchian N, Dinarvand R. Crystal modification of phenytoin using different solvents and crystallization conditions. Int J Pharm. 2003; 250 (1): 85-97. [ Links ]
4. Zipp G, Rodriguez-Hornedo N. Phenytoin crystal growth rates in the presence of phosphate and chloride ions. J Cryst Growth. 1992; 123 (1-2): 247-254. [ Links ]
5. Yamamoto K, Nakano M, Arita T, Takayama Y, Nakai Y, Arita T. Dissolution behavior and bioavailability of phenytoin from a ground mixture with microcrystalline cellulose. J Pharm Sci. 1976; 65 (10): 1484-1488. [ Links ]
6. Koenigbauer MJ, Brooks SH, Rullo G, Couch RA. Solid-state stability testing of drugs by isothermal calorimetry. Pharm Res. 1992; 9 (7): 939-944. [ Links ]
7. Chow AH, Gordon JD, Szeitz A, Young JW. Modification of phenytoin crystals. III. Influence of 3-butanoyloxymethyl-5,5diphenylhydantoin on solution-phase crystallization and related crystal properties. Int J Pharm. 1995; 126 (1-2): 11-19. [ Links ]
8. Vlase G, Vlase T, Doca N. Thermal behavior of some phenitoine pharmaceuticals. J Therm Anal Cal. 2008; 92 (1): 259-262. [ Links ]
9. Burnham AK, Dinh LN. A comparison of isoconversional and model-fitting approaches to kinetic parameter estimation and application predictions. J Therm Anal Cal. 2007; 89 (2): 479-490. [ Links ]
10. Ozawa T. Estimation of activation energy by isoconversion methods. Therm Acta. 1992; 203: 159-165. [ Links ]
11. Starink MJ. A new method for the derivation of activation energies from experiments performed at constant heating rate. Therm Acta. 1996; 288 (1-2): 97-104. [ Links ]
12. Lyon RE. An integral method of nonisothermal kinetic analysis. Therm Acta. 1997; 297 (1-2): 117-124. [ Links ]
13. Li CR, Tang TB. A new method for analysing non-isothermal thermoanalytical data from solid-state reactions. Thermochim Acta. 1999; 325 (1): 43-46. [ Links ]
14. Budrugeac P, Homentcovschi D. Segal E. Critical considerations on the isoconversional methods. III. On the evaluation of the activation energy from non-isothermal data. J Therm Anal Cal. 2001; 66 (2): 557-565. [ Links ]
15. Friedman HL. Kinetics of thermal degradation of char-forming plastics from thermogravimetry. Aplication to a phenolic plastic. J Polym Sci. 1964; 6 (1): 183-195. [ Links ]
16. Wang J, Laborie MG. Wolcott MP. Comparison of model-free kinetic methods for modeling the cure kinetics of commercial phenol-formaldehyde resins. Thermochim Acta. 2005; 439 (1-2): 68-73. [ Links ]
17. Kissinger HE. Reaction kinetics in differential thermal analysis. Anal Chem. 1957; 29 (11): 1702-1706. [ Links ]
18. Coats AW, Redfern JP. Kinetic parameters from thermogravimetric data. Nature. 1964; 201: 68-69. [ Links ]
19. Mittemeijer EJ. Analysis of the kinetics of phase transformations. J Mater Sci. 1992; 27 (15): 3977-3987. [ Links ]
20. Doyle CD. Estimating isothermal life from thermogravimetric data. J Appl Polym Sci. 1962; 6 (24): 639-642. [ Links ]
21. Ozawa T. A new method of analyzing thermogravimetric data. Bull Chem Soc Jpn. 1965; 38 (11): 1881-1886. [ Links ]
22. Flynn JH, Wall LA. A quick direct method for the determination of activation energy from thermogravimetric data. Polym Lett. 1966; 4 (5): 323-328. [ Links ]
23. Starink MJ, Dion A. DSC study of precipitation in an Al-Mg-Mn alloy microalloyed with Cu. Thermochim Acta. 2004; 417 (1): 5-11. [ Links ]
24. Starink MJ. Activation energy determination for linear heating experiments: deviations due to neglecting the low temperature end of the temperature integral. J Mater Sci. 2007; 42 (2): 483489. [ Links ]
25. Standard Test Method for Arrhenius Kinetic Constants for Thermally Unstable Materials Using Differential Scanning Calorimetry and the Flynn/Wall/Ozawa Method. ASTM E698. ASTM International; West Conshohocken. PA; 2005. [ Links ]
26. Franco M, Trapani G, Latrofa A, Tullio C, Provenzano M, Serra M. et al. Dissolution properties and anticonvulsant activity of phenytoin-polyethylene glycol 6000 and polyvinylpyrollidone K-30 solid dispersions. Int J Pharm. 2001; 225 (1-2): 63-73. [ Links ]
Recibido: Agosto 8 de 2009; Aceptado: Septiembre 27 de 2009
* Autor a quien debe dirigir la correspondencia: oflorez@farmacia.udea.edu.co.