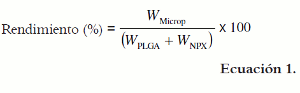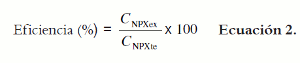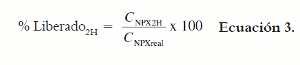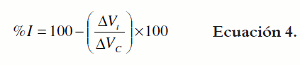Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.1 Medellín Jan./Apr. 2010
FARMACOLOGÍA Y TOXICOLOGÍA
EFECTO DE NAPROXENO MICROENCAPSULADO EN MICROESFERAS DE ÁCIDO POLI (LÁCTICO-CO-GLICÓLICO) SOBRE EDEMA PLANTAR INDUCIDO POR CARRAGENINA EN RATAS
EFFECT OF MICROENCAPSULATED NAPROXEN INTO POLY(LACTIDE-CO-GLYCOLIDE) MICROSPHERES ON CARRAGEENIN PAW EDEMA IN RATS
Diana M. ARAGÓN N.1; Nadezdha E. VERGEL B.1; Luis F. OSPINA G.1; Fleming MARTÍNEZ R.1; Jaiver E. ROSAS P.1*
1 Departamento de Farmacia. Universidad Nacional de Colombia. Sede Bogotá. Bogotá, Colombia.
RESUMEN
Las micropartículas son sistemas de entrega de fármacos ampliamente utilizados, que permiten mejorar la aplicabilidad terapéutica de fármacos tanto nuevos como convencionales. En el presente trabajo se elaboran micropartículas de un polímero biodegradable, ácido poli (láctico-co-glicólico), cargadas con naproxeno. Las mejores condiciones para la elaboración de las micropartículas son determinadas experimentalmente, encontrando que la relación fármaco: polímero, la cantidad de isopropanol, el volumen de fase acuosa, la velocidad de agitación y el tiempo de agitación influyen significativamente en las características de las micropartículas obtenidas. En el modelo de edema plantar inducido por carragenina en ratas Wistar, se encuentra que el naproxeno microencapsulado en dosis de 5 mg/Kg y 10 mg/Kg presenta mayor efecto antiinflamatorio que el naproxeno libre en dosis de 10 mg/Kg.
Palabras Clave: microencapsulación, naproxeno, inflamación.
ABSTRACT
Microparticles are pharmaceutical dosage forms widely used because they may improve the therapeutic application of new and conventional drugs. In this work we make biodegradable microparticles with poly (lactic-co-glicolic) acid as polymer loaded with naproxen. The best microencapsulation conditions are experimentally determinate. We have found that the drug:polymer ratio, the isopropanol amount, the aqueous phase volume, the stir speed and the time of stir affect the microparticles characteristics. In the carragenin paw edema model, we have found that the microencapsulated naproxen at 5 mg/Kg and 10 mg/Kg showed greater effect than free naproxen at 10 mg/Kg.
Keywords: microencapsulation, naproxen, inflammation.
INTRODUCCIÓN
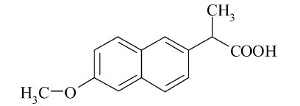
El naproxeno (NPX) es un fármaco analgésico y antiinflamatorio derivado del ácido propiónico, como se observa en la figura 1. Es ampliamente utilizado en la terapéutica actual para el tratamiento sintomático de procesos agudos o crónicos relacionados con dolor e inflamación (1). En el mercado farmacéutico colombiano, el NPX se presenta en tabletas, cápsulas y en suspensión para administración peroral (2).
Figura 1. Estructura molecular de naproxeno.
Al igual que otros AINEs (antiinflamatorios no esteroideos), el naproxeno es uno de los fármacos utilizados en el desarrollo de sistemas nano y microparticulados, por sus propiedades fisicoquímicas que los hacen fármacos modelos de baja solubilidad, y por sus características farmacológicas y su aplicación terapéutica. Según el sistema de clasificación biofarmacéutica NPX se encuentra en el grupo II, es decir, se considera que tiene baja solubilidad y alta permeabilidad (3).
Con el fin de mejorar su utilidad terapéutica, se ha logrado desarrollar micropartículas de ácido poli (láctico-co-glicólico, PLGA), que contienen ibuprofeno microencapsulado para administración intraarticular en el tratamiento de la artritis reumatoidea, logrando mantener in vitro concentraciones terapéuticamente adecuadas durante más de ocho días (4). De manera similar se han realizado estudios de microencapsulación de naproxeno en PLGA para administración parenteral (5). Por otro lado, utilizando polímeros biodegradables de polifosfacenos, se han desarrollado micropartículas de administración subcutánea que proveen concentraciones plasmáticas constantes hasta por 400 horas (6).
En el presente trabajo se determinaron experimentalmente las mejores condiciones para la elaboración de micropartículas de PLGA cargadas con NPX. Los sistemas microparticulares obtenidos con las condiciones previamente establecidas fueron evaluados para determinar su efecto en el modelo inflamatorio de edema plantar inducido por carragenina, en ratas Wistar.
MATERIALES Y MÉTODOS
Materiales
Naproxeno (NPX) USP; Poli-(D,L-láctico-co-glicólico) PLGA 50:50 (peso molecular prom. 10.000-25.000 Da) Birmingham Polymers; alcohol polivinílico (PVA) 87-89% hidrolizado (peso molecular prom. 31.000 – 50.000 Da) Sigma-Aldrich; carragenina λ Sigma-Aldrich; agua destilada; diclorometano (DCM) P.A. Merck; acetona (ACT) P.A. Mallinckrodt; cloruro de potasio R.A. Scharlau; fosfatos mono y disódico R.A. Merck; cloruro de potasio R.A Merck, ácido clorhídrico R.A. Merck; solución salina normal, NaCl 0.9% (SSN).
Animales de experimentación
En cada experimento se emplearon ratas Wistar de 200g de peso y 10-12 semanas de edad, criadas y mantenidas en condiciones controladas: ciclos 12 h luz / 12 h oscuridad, temperatura 21°C, agua y comida ad libitum. Los ensayos fueron realizados en el Bioterio de Experimentación del Departamento de Farmacia de la Universidad Nacional de Colombia. Todos los experimentos fueron realizados siguiendo consideraciones éticas en cuanto al cuidado y uso de animales de experimentación (7).
Diseño experimental
Con el fin de evaluar la influencia de algunas variables en la elaboración de micropartículas de PLGA cargadas con NPX, se utilizó un diseño estadístico experimental tipo Plakett-Burman con siete variables, a dos niveles. Las variables estudiadas fueron: concentración del polímero, concentración de PVA, relación fármaco:polímero, volumen de isopropanol al 2%, volumen de fase acuosa, velocidad de homogenización, tiempo de homogenización (8). Como variables respuesta se evaluaron a) el rendimiento del proceso, b) la cantidad de fármaco liberado después de 2 horas en un tampón de fosfatos PBS, pH 7,4 (efecto Burst) y c) la eficiencia de encapsulación.
Elaboración de las microesferas
Dada la baja solubilidad acuosa del fármaco en estudio, se utilizó el método de emulsificación-evaporación del solvente, recomendado para este tipo de compuestos (9) y previamente descrito para otros AINEs (4, 10).
Brevemente, el polímero de PLGA y el NPX se disolvieron en acetona. Posteriormente, esta fase orgánica se emulsificó con la fase acuosa, que contenía alcohol polivinílico (PVA) como agente estabilizante, para formar una emulsión mediante un proceso de homogenización a 15000 rpm, empleando un equipo Ultraturrax® T-25. Una vez formada la emulsión, se mantuvo en agitación constante para remover el solvente orgánico por evaporación e inducir la formación de las micropartículas. Las micropartículas formadas fueron separadas mediante centrifugación, a continuación lavadas con agua destilada, y finalmente sometidas a un proceso de liofilización.
Caracterización de las microesferas
Las microesferas obtenidas fueron caracterizadas según la forma y el tamaño de la partícula, rendimiento del proceso de microencapsulación, eficiencia de encapsulación, y determinación del fármaco absorbido, de acuerdo con los siguientes procedimientos:
Forma y tamaño de partícula
Para la determinación de la forma de las partículas obtenidas se empleó microscopía electrónica de barrido. Las micropartículas secas fueron cubiertas con oro y examinadas con un microscopio electrónico de barrido (FEI QUANTA 200). El tamaño de partícula se determinó por difracción de rayos láser (System Partikel-Technik, Sympatec GmbH).
Rendimiento del proceso de encapsulación
Las micropartículas obtenidas se pesaron y se determinó el rendimiento del proceso mediante la siguiente ecuación:
En donde WMicrop es la masa de las micropartículas obtenidas, y WPLGA y WNPX, la masa del polímero y de fármaco adicionado, respectivamente.
Eficiencia de encapsulación
Para determinar la cantidad de fármaco microencapsulado y la eficiencia de este proceso, se adaptó el procedimiento descrito por Fernández y col (4). Se pesaron 10 mg de micropartículas y se disolvieron en 10 mL de DCM. Posteriormente se adicionaron 10 mL de PBS, pH 7,4 y se mantuvo en agitación continua durante 3 horas. Una vez transcurrido el tiempo, el sistema se centrifugó y el fármaco presente en la fase acuosa fue cuantificado por espectrofotometría UV a 262 nm. Esta determinación se realizó por triplicado.
La eficiencia de encapsulación (%) se calculó a partir de la relación entre el fármaco incorporado y la cantidad de fármaco inicial en el proceso de microencapsulación, mediante la ecuación 2.
En donde CNPXex es la cantidad de fármaco encontrada experimentalmente, y CNPXte la cantidad total de fármaco adicionada.
Determinación de fármaco adsorbido (efecto Burst)
Para determinar la cantidad de fármaco liberada desde las micropartículas en las primeras dos horas, se adaptó el procedimiento descrito por Fernández y col. (4). Se pesaron 10 mg de micropartículas, se adicionaron 10 mL de tampón de fosfatos pH 7,4 y se dejó en agitación continua durante 2 horas. Una vez transcurrido el tiempo se filtró el sistema y el fármaco liberado fue cuantificado por espectrofotometría a 262 nm. El fármaco adsorbido fue calculado utilizando la ecuación 3.
En donde CNPX2H es la cantidad de fármaco encontrada después de 2 horas de agitación, y CNPXreal la cantidad de fármaco encapsulada.
Evaluación in vivo
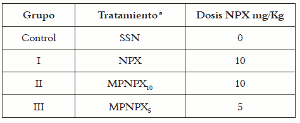
La respuesta inflamatoria fue inducida por la inyección de carragenina λ (0,05 mL; 3% en solución salina normal), vía subplantar, en las patas derechas de los animales (6 animales por grupo). Todos los tratamientos descritos en la tabla 1 fueron administrados vía i.p. media hora antes de la administración de la carragenina. El volumen de las patas fue medido en un pletismómetro (Ugo Basile), a las 1, 3, 5, 9 y 24 horas después de la administración de la carragenina.
Tabla 1. Esquema de administración de los tratamientos.
El porcentaje de inhibición de la inflamación fue calculado mediante la ecuación 4.
En la cual ΔVt: delta de volumen de las patas de cada animal tratado con NPX (libre o microencapsulado), y ΔVC: delta promedio del volumen de las patas del grupo control (vehículo).
Análisis estadístico
Los resultados de cada ensayo de caracterización fueron expresados como la media aritmética de los valores ± la desviación estándar. Para la evaluación del efecto de algunas variables en el proceso de microencapsulación se utilizó la prueba "t" de Student.
Los resultados obtenidos para las diferentes formulaciones fueron sometidos al análisis de varianza simple (ANOVA), seguido del análisis de comparaciones múltiples (Test de Tukey), empleando el programa estadístico GraphPad Prism® 4.0. Mediante este programa también se calculó el parámetro "Área bajo la curva", para analizar el efecto antiinflamatorio a lo largo del tiempo. Los supuestos de normalidad, homogeneidad e independencia de varianzas fueron validados previamente.
RESULTADOS Y DISCUSIÓN
La elaboración de sistemas micro y nanoparticulados se ha empleado como estrategia para mejorar algunas características de ciertos fármacos muy efectivos en ciertas patologías, pero cuyo uso clínico es limitado porque sus propiedades farmacocinéticas, toxicológicas, fisicoquímicas o de estabilidad no son las más adecuadas.
Los AINEs no han sido ajenos a este desarrollo y han sido estudiados en diferentes tipos de sistemas microparticulares, no sólo porque son fármacos liposolubles modelo sino también porque se ha querido contribuir a su aplicación terapéutica en enfermedades crónicas como la artritis reumatoidea (11). Con este fin se han estudiado sistemas de liberación controlada con diferentes polímeros y vías de administración, logrando resultados prometedores (10, 12). En el presente estudio elaboramos microesferas de PLGA (50:50) cargadas con naproxeno, un antiinflamatorio no esteroidal ampliamente utilizado en el tratamiento de enfermedades inflamatorias.
Con el fin de identificar algunas variables críticas en el proceso de microencapsulación de NPX en el polímero de PLGA utilizado, se empleó un diseño experimental de tipo Plakett-Burman (8), el cual permite evaluar el efecto de una gran cantidad de variables mediante la realización de pocos ensayos experimentales (n+1). Como se mencionó en la metodología, se evaluó la influencia de siete variables a dos niveles, sobre tres variables respuesta, como son: rendimiento del proceso, fármaco liberado después de 2 horas en un tampón pH 7,4 (efecto Burst) y eficiencia de encapsulación.
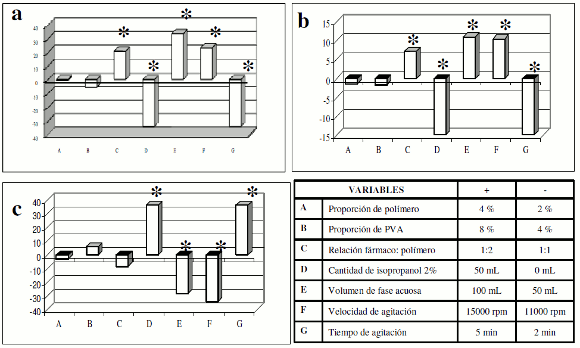
En la figura 2 se muestra el efecto medio de las variables en estudio, sobre las características de las micropartículas obtenidas. Un proceso de microencapsulación óptimo debe permitir la obtención de micropartículas con bajo efecto Burst y una elevada eficiencia de encapsulación y rendimiento. De manera general, las barras sin asterisco indican que la variable no afecta de manera significativa la respuesta evaluada; las barras con valores positivos sugieren que la presencia de dicha variable en el nivel mayor de los dos evaluados aumenta la magnitud de la respuesta evaluada; y los valores negativos, que dicha variable en el nivel mayor disminuye la magnitud de la respuesta evaluada. El tamaño de las barras es reflejo de la magnitud del efecto presentado.
Figura 2. Efecto de las variables en estudio sobre a) Eficiencia de encapsulación, b) Rendimiento del proceso y c) Efecto Burst, en la elaboración de micropartículas de NPX. "t" de Student, *p<0,05.
Adicionalmente se observa que, en los dos niveles estudiados, las variables A y B (cantidad de polímero y cantidad de PVA) no afectan significativamente ninguna de las tres respuestas evaluadas. Esto indica que el proceso es robusto frente a pequeños cambios de estas dos variables. Respecto a las variables C, E y F, los resultados indican que la utilización de éstas en el nivel superior aumenta la eficiencia de encapsulación y el rendimiento del proceso (figuras 2a y 2b), al mismo tiempo que disminuyen la cantidad de NPX liberado a las 2 horas (figura 2c). Antes de analizar estos resultados es importante aclarar que la cantidad de fármaco liberado después de 2 horas es un reflejo de la cantidad de NPX adsorbida en la superficie de la partícula y cuya liberación no depende de la degradación del polímero, pues no hace parte del complejo matricial formado. Esta cantidad liberada de manera inmediata puede constituirse en una dosis de carga y es denominada en inglés como efecto Burst (liberación rápida o explosiva). Esta cantidad adsorbida o efecto Burst puede ser deseable mientras no supere el 20% de la cantidad total del fármaco encapsulado. De lo contrario la liberación no sería controlada. En muchos casos se busca que el efecto Burst sea nulo, pues la dosis de carga puede ser suministrada de otra manera, por ejemplo, con fármaco libre, con partículas de menor tamaño, o con polímeros diferentes o de menor masa molar que se degraden más rápido (13). En el presente caso se consideró como deseable que el efecto Burst fuera el menor posible.
De esta manera se encontró que para el proceso de microencapsulación de NPX era favorable la utilización de las variables C, E y F en el nivel superior, pues aumentan el rendimiento y la eficiencia de encapsulación mientras disminuyen el efecto Burst. En otras palabras, se sugiere la utilización de fármaco:polímero en relación 1:2 (C); 100 mL de fase acuosa (E) y una agitación en el Ultraturrax® a 15000 rpm (F).
En cuanto a las variables D y G, se observa un comportamiento totalmente opuesto. Su presencia en el nivel superior disminuye la eficiencia de encapsulación y el rendimiento del proceso mientras aumenta el efecto Burst. Análogo a lo expresado anteriormente, en este caso se consideró favorable la presencia de estas variables, pero esta vez en su nivel inferior, es decir ausencia de isopropanol (D) y 2 minutos de agitación con el Ultraturrax® (G).
Una vez definidas estas condiciones experimentales, se elaboraron las micropartículas de PLGA cargadas con NPX, utilizando acetona como solvente orgánico. En la tabla 2 se presenta la caracterización de estas micropartículas. Como se observa, se obtienen rendimientos y eficiencias de encapsulación altos; además, un tamaño de partícula de alrededor de 10 μm, gracias a la previa selección experimental de las condiciones de elaboración. En la figura 3 se muestra una imagen tomada por microscopía electrónica de barrido, en la cual se observa la integridad de la superficie de las micropartículas, además del rango de su tamaño.
Tabla 2. Caracterización de las micropartículas de PLGA cargadas con NPX a.
Figura 3. Morfología superficial de las micropartículas de PLGA cargadas con NPX. Fotografía tomada por microscopía electrónica de barrido.
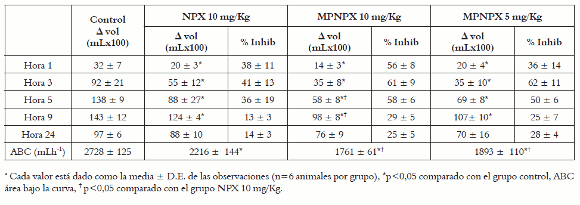
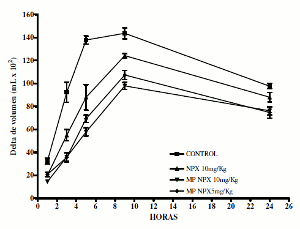
En lo que se refiere a los resultados del ensayo in vivo, es posible observar en la figura 4, que entre la hora 5 y la hora 9 los animales del grupo control (SSN) desarrollan el máximo grado de inflamación, como es usual en este modelo experimental de inflamación aguda (14).
Como era de esperarse, ya que NPX es un fármaco antiinflamatorio reconocido, todos los tratamientos (NPX libre y encapsulado) presentan efecto antiinflamatorio significativo durante las primeras nueve horas del proceso, con mayor intensidad alrededor de las horas 3 y 5, como lo sugieren los resultados detallados en la tabla 3. Es importante destacar que en todos los puntos de observación los grupos tratados con naproxeno microencapsulado (MPNPX5 y MPNPX10) presentan menores deltas de inflamación, es decir, mayor inhibición de la inflamación, que el grupo tratado con naproxeno libre y el grupo control. De manera particular, en las horas 5 y 9 MPNPX10 tiene un delta de inflamación significativamente menor al presentado por el grupo control y por el NPX libre (p<0,05).
Tabla 3. Efecto de naproxeno libre y naproxeno microencapsulado sobre el edema plantar inducido por carragenina en ratas a.
Figura 4. Evolución del efecto de naproxeno libre y microencapsulado con PLGA, sobre el edema plantar inducido por carragenina, en ratas Wistar. Cada valor está dado como la media ± D.E. de las observaciones. n = 6 animales por grupo.
Estos resultados evidencian la influencia de este tipo de sistemas de entrega de fármacos sobre el efecto farmacológico de NPX, lo que está de acuerdo con lo informado por algunos autores sobre otro tipo de fármacos. Como es sabido, la forma y el tamaño de las micropartículas permiten no sólo la administración más homogénea de la dosis correspondiente, sino también una mayor velocidad de disolución in vivo, con la consecuente mayor absorción del fármaco, es decir, una mayor biodisponibilidad (12).
Con respecto a los dos niveles de dosis de MPNPX evaluadas (5 y 10 mg/Kg), es posible observar que en todos los casos, desde la hora 1 hasta la hora 24, se obtienen respuestas antiinflamatorias de magnitud similar. Este efecto también se ve reflejado en los valores del parámetro ABC (área bajo la curva) que en este caso representa el volumen de inflamación durante el tiempo del experimento. Este parámetro, a diferencia de los resultados en las horas puntuales de observación, permite comparar la evolución de la inflamación de manera global. En este caso, gracias al ABC es posible determinar que MPNPX10 y MPNPX5 presentan diferencias estadísticas respecto a NPX libre, pero no entre ellas, es decir, que las MPNPX en dosis de 5 mg/Kg, de manera global, logran disminuir los niveles de inflamación en mayor proporción que NPX libre en dosis de 10 mg/Kg, lo que indica que este sistema de entrega de fármacos permite obtener efectos antiinflamatorios significativos en menores dosis de NPX.
CONCLUSIONES
Con ayuda de un diseño estadístico experimental fraccionado reducido, se establecieron las mejores condiciones para la elaboración de micropartículas de PLGA cargadas con NPX, encontrando que la relación fármaco:polímero, el volumen de solución acuosa de isopropanol 2%, el volumen de fase acuosa, la intensidad de homogenización y el tiempo de homogenización tienen influencia sobre las características de las micropartículas elaboradas.
En el modelo de edema plantar inducido por carragenina, MPNPX en dosis de 10 mg/Kg presenta un efecto antiinflamatorio de mayor magnitud que el de NPX libre en la misma dosis. Según los resultados obtenidos del análisis del parámetro ABC, es posible sugerir que MPNPX en dosis de 5 mg/Kg presenta un efecto antiinflamatorio mayor al de NPX libre en dosis de 10 mg/Kg.
AGRADECIMIENTOS
Al Profesor Alejandro Sosnik, de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires, y a la Farmacéutica Mariana Lagenheim, del Laboratorio Boehringer Ingelheim -filial Argentina, por su colaboración en la realización de los análisis para la determinación de tamaño de partícula. A la División de Investigación de la Universidad Nacional de Colombia, sede Bogotá, por la financiación parcial de este proyecto, y al Departamento de Farmacia de la Universidad Nacional de Colombia, por facilitarnos los equipos y las instalaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Roberts LJ, Morrow JD. En: Hardman JG, Limbird LE, Gilman AG, editores. Goodman & Gilman's: The Pharmacological Basis of Therapeutics. 10ª ed. New York: McGraw-Hill & Co; 2001. p. 703-705. [ Links ]
2. Rosenstein-Ster E. Diccionario de Especialidades Farmacéuticas. 31ª ed. Bogotá: Thompson PLM, S.A; 2003. p. 751-753. [ Links ]
3. Dressman J, Reppas C. In vitro-in vivo correlations for lipophilic, poorly water-soluble drugs. Eur J Pharm Sci. 2000; 11(2): S73-S80. [ Links ]
4. Fernández G, Herrero R, Molina IT, Pastoriza P. Biodegradable ibuprofen-loaded PLGA microspheres for intraarticular administration. Effect of Labrafil addition on release in vitro. Int J Pharm. 2004; 279 (1): 33-41. [ Links ]
5. Calis S, Bozdag S, Süheyla Kas H, Tuncay M, Atilla Hincal A. Influence of irradiation sterilization on poly(lactide-co-glycolide) microspheres containing anti-inflammatory drugs. IL Farmaco. 2002; 57 (1): 55-62. [ Links ]
6. Veronese FM, Marsilio F, Lora S, Caliceti P, Passi P, Orsolini P. Polyphosphazene membranes and microspheres in periodontal diseases and implant surgery. Biomaterials. 1999; 20(1): 91-98. [ Links ]
7. Mrad A, Cardozo CA. Utilización de animales de laboratorio en la experimentación biológica. Bogotá: Instituto de Biotecnología. Universidad Nacional de Colombia, 2000. 277 p. [ Links ]
8. Lewis GA, Mathieu D, Phan-Tan-Luu R. Pharmaceutical Experimental Design. New York: Marcel Dekker; 1999. p. 85-90. [ Links ]
9. Wischke C, Schwendeman S. Principles of encapsulating hydrophobic drugs in PLA/PLGA microparticles. Int J Pharm. 2008; 364 (2): 298-327. [ Links ]
10. Thompson CJ, Hansford D, Higgins S, Rostron C, Hutcheon GA, Munday DL. Evaluation of ibuprofen-loaded microspheres prepared from novel copolyesters. Int J Pharm. 2007; 329 (1): 53-61. [ Links ]
11. El Desoky ES. Pharmacotherapy of Rheumatoid Arthritis: An Overview. Curr Ther Res Clin Exp. 2001; 62 (2): 92-112. [ Links ]
12. Tuncay M, Calis S, Kas HS, Ercan MT, Peksoy I, Hincal AA. Diclofenac sodium incorporated PLGA (50:50) microspheres: formulation considerations and in vitro: in vivo evaluation. Int J Pharm. 2000; 195 (1): 179-188. [ Links ]
13. Rosas JE, Hernández RM, Gascón AR, Igartua M, Guzmán F, Patarroyo ME, et al. Biodegradable PLGA microspheres as a delivery system for malaria synthetic peptide SPf66. Vaccine. 2001; 19 (31): 4445-4451. [ Links ]
14. Ospina LF, Calle J, Arteaga L, Pinzón R, Alcaraz MJ, Payá M. Inhibition of acute and chronic inflammatory responses by the hidroxybenzoquinonic derivative rapanone. Planta Med. 2001; 67 (9): 791-795. [ Links ]
Recibido: Enero 26 de 2010; Aceptado: Febrero 22 de 2010
* Autor a quien debe dirigir la correspondencia: jerosasp@unal.edu.co