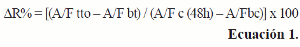Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.1 Medellín Jan./Apr. 2010
FARMACOLOGÍA Y TOXICOLOGÍA
ESTUDIO COMPARATIVO DE LOS MÉTODOS DE RESAZURINA Y MTT EN ESTUDIOS DE CITOTOXICIDAD EN LÍNEAS CELULARES TUMORALES HUMANAS
ESTUDIO COMPARATIVO DE LOS MÉTODOS DE RESAZURINA Y MTT EN ESTUDIOS DE CITOTOXICIDAD EN LÍNEAS CELULARES TUMORALES HUMANAS
Linamaría ESCOBAR M.1; Augusto RIVERA1; Fabio A. ARISTIZÁBAL G.1 *
1 Grupo de Farmacogenética del Cáncer. Departamento de Farmacia. Facultad de Ciencias. Universidad Nacional de Colombia. Sede Bogotá. A.A. 14490. Bogotá, Colombia.
2 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Sede Bogotá. A.A. 14490. Bogotá, Colombia.
RESUMEN
Se realizó un estudio comparativo de los métodos de resazurina y MTT como indicadores de medida indirecta de sobrevivencia celular, aplicables para la estimación de actividad citotóxica, con el fin de establecer la idoneidad de cada uno de los dos sistemas de detección, a través de la valoración de citotoxicidad sobre tres líneas celulares derivadas de tumores humanos: HEp-2, HT-29 y HeLa, evaluando tres compuestos sintéticos durante un periodo de tratamiento de 48 horas, usando como referencia de actividad Doxorrubicina HCl, un agente antineoplásico. Los resultados obtenidos por los dos métodos revelaron comportamientos semejantes en las condiciones estudiadas en las líneas celulares.
Palabras Clave: doxorrubicina, resazurina, viabilidad celular.
ABSTRACT
A study was carried comparing the resazurina and MTT methods as indicators of indirect measure of cellular survival applied to valuated cytotoxic activity in order to assess the suitability of each of the two detection systems. The comparison was made through the valuation of cytotoxicity on three cell lines derived from human tumors: HEp-2, HT-29 and HeLa, evaluating three synthetic compounds during a treatment period of 48 hours using as a reference activity Doxorubicin HCl. The results obtained by the two methods showed a similar performance under the conditions tested in cell lines.
Keywords: Doxorubicin, MTT, resazurine, cellular viability.
INTRODUCCIÓN
Comúnmente, en los estudios de citotoxicidad in vitro sobre líneas celulares, se emplean diferentes métodos de tinción celular con el fin de estimar de manera indirecta el número de células viables presentes después de un tratamiento. La mayoría de éstos son de punto final, al usarse de forma destructiva, lo cual imposibilita seguir el comportamiento de las células después de ser sometidas a un tratamiento traumático. Una prueba in vitro ideal para evaluar la proliferación celular y la citotoxicidad debe tener como características principales: ser simple, rápida, eficiente, económica, reproducible, sensible, segura, efectiva en la medida de la población celular viable y, que no muestre interferencia con el compuesto a evaluar (1). Más aun: si el método es aplicable a técnicas de barrido o tamizaje de alta eficiencia (HTS) y las células pueden ser usadas para más experimentos se habrá adquirido una herramienta excepcional (2). Existen diferentes métodos para realizar ensayos de citotoxicidad in vitro. Primero, el uso de colorantes tales como cristal violeta y sulforrodamina B (3), que colorean componentes específicos de las células y permiten medir residuos celulares después de un tiempo de incubación con el compuesto evaluado. Segundo, los detectores de liberación de componentes constitutivos celulares, que miden la actividad de enzimas tales como lactato deshidrogenasa, y finalmente, aquellos que miden la función metabólica de las células usando las sales de tetrazolio: bromuro de (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio (MTT); (3-[4,5,dimetiltiazol-2-il]-5-[3-carboximetoxi-fenil]-2-[4-sulfofenil]-2H-tetrazolio) (MTS) y (23-bis-(2-metoxy-4-nitro-5-sulfofenil)-2H-tetrazolio-5-carboxanilido) (XTT), los cuales al ser reducidos a formazán producen una intensa coloración (4). El método más empleado es la reducción metabólica de MTT, basado en la reducción de 3-(4.5-dimeltiltiazol-2-yl)-2.5-difeniltetrazolio bromuro (MTT). Este colorante amarillo pálido, soluble en agua, es reducido tempranamente en células viables, por componentes de la cadena respiratoria, a formazán (cristales azul violeta, insoluble en agua), fundamentalmente por la respiración (deshidrogenasas mitocondriales) y su flujo de electrones, lo cual es intrínsecamente tóxico para las células (5, 6).
Dicho método fue desarrollado por Mosmann, 1983 (7) como método colorimétrico cuantitativo de microtitulación para la determinación de la supervivencia y capacidad de proliferación de células mamíferas, y es preciso y rápido (8). Así mismo la resazurina (azul, no fluorescente) es reducida a resofurina (rosado, altamente fluorescente), por oxidoreductasas que se encuentran principalmente en la mitocondria de células viables. La resofurina es excretada al medio permitiendo el continuo monitoreo de la proliferación y/o la citotoxicidad de sustancias sobre células humanas, animales, bacterias e incluso hongos (9-14). Este colorante es poco tóxico para las células (no así otras técnicas descritas), y permite la continuidad de estudios en las mismas células, economizando tiem-po y dinero, especialmente en cultivos primarios donde las células son muy escasas y preciadas. Además, es sensible y altamente reproducible (15, 16). Es posible obtener una medida de absorbancia a una longitud de onda de 570 nm y/o fluorescencia en 530 nmex y 590 nmem, ya que este colorante tiene propiedades tanto cromóforas como fluoróforas (1).
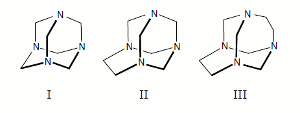
Por ello, comparar las respuestas obtenidas in vitro para los métodos de reducción de resazurina y MTT reconocidos como sistemas de medida indirecta de masa celular, es útil para evaluar la viabilidad y supervivencia en tratamientos de citotoxicidad. Ahora bien, ampliar el ámbito de aplicación de estas técnicas a compuestos poco convencionales pero promisorios, como son los aminales (gem-diaminas) cíclicos tipo caja, nos estimuló a emplear tres de ellos, presentados en la figura 1: el 1,3,5,7-tetrazatriciclo [3.3.1.13,7] decano (urotropina, I), el 1,3,6,8-tetrazatriciclo [4.3.1.13,8] undecano (TATU, II) y el 1,3,6,8-tetrazatriciclo [4.4.1.13,8] dodecano (TATD, III) en estos ensayos. Estos tres aminales difieren en un grupo metileno en sus estructuras, lo que permite, entonces, considerarlos en conjunto como una serie homóloga. En la literatura consultada no se hallaron trabajos relacionados con la actividad citotóxica de estos aminales, pero resulta interesante el hecho de que que el TATD (III) ha sido empleado como carcinostático (17), aumentando la sobrevivencia de ratones inoculados con tumores Ehrlich ascites, de 18 a 149 días, cuando se les suministró entre 1 y 2 milimoles de TATD en soluciones de glucosa.
Figura 1. Aminales cíclicos aplicados en el estudio comparativo de los métodos de resazurina y MTT.
MATERIALES Y MÉTODOS
Líneas celulares
Se emplearon tres líneas celulares: HEp-2 carcinoma epidermoide de laringe contaminada con HeLa, HT-29 adenocarcinoma colorectal, y HeLa adenocarcinoma de cérvix, todas de crecimiento adherente, derivadas de tumores sólidos humanos, obtenidas del banco de células del Laboratorio de Inmunología del Instituto Nacional de Cancerología de Colombia, en Bogotá. Todas fueron cultivadas en Medio Mínimo Esencial (MEM), suplementado con 5% de suero fetal bovino (FBS), gentamicina (50 μg/ml) y bicarbonato de sodio (2,2 g/L), en cajas de cultivo plásticas estériles, de 75 cm2, e incubadas en condiciones estándar (18). Para el mantenimiento de los cultivos se practicó un cambio de medio cada dos días, lavando las células con solución salina con tampón de fosfatos (PBS) de 149,2 mM y pH= 7,3.
Sustancias empleadas para valorar el efecto citotóxico
Se emplearon tres compuestos sintéticos de la serie de aminales cíclicos tipo caja: 1,3,5,7-tetrazatriciclo [3.3.1.13,7] decane (urotropina), 1,3,6,8-tetrazatriciclo [4.3.1.13,8] undecane (TATU), y 1,3,6,8-tetrazatriciclo [4.4.1.13,8] dodecano (TATD), y doxorrubicina HCl (doxo), un antineoplásico reconocido. La urotropina (I) se adquirió en Merck y se tomó directamente del envase del fabricante; el TATU (II) se preparó por reacción entre TATD (III) y amoníaco siguiendo el método descrito en la literatura (19), se purificó por cromatografía en columna (sílica gel), eluyendo con una mezcla de diclorometano-etanol 1:4, y la pureza se verificó por CG-EM; el TATD (III) se sintetizó a partir de etilendiamina y formaldehído, de acuerdo con el método descrito en la literatura (20) y se purificó por recristalización en benceno.
Conteo y comprobación de viabilidad
Los cultivos con 90% de confluencia se trataron con solución de tripsina al 0,025% y EDTA al 0,03%, durante 5 minutos, a 37°C, obteniendo una suspensión celular que se contó en cámara de Neubauer mediante el método de exclusión con azul de tripano.
Inoculación de placas
Las densidades celulares a sembrar en placas de 96 pozos de fondo plano fueron las establecidas para el método de MTT por estudios realizados previamente (21-23). Para HEp-2: 7500 células/pozo, HT-29: 15000 células/pozo, y HeLa: 10000 células/pozo, en un volumen de 100 μL por pozo. Las placas se incubaron 24 horas en condiciones estándar para permitir la adhesión celular a la superficie del pozo.
Comparación entre los dos métodos de tinción celular
Se trataron paralelamente placas semejantes que fueron sometidas a tinción con resazurina o con MTT. Para ello se inocularon por triplicado las densidades celulares establecidas para cada línea celular en 100 μL de MEM suplementado, que fueron incubadas por 24 horas para permitir la adhesión celular. Para valorar el efecto citotóxico se prepararon, de cada uno de los tres compuestos sintéticos: urotropina, TATU y TATD, y del agente antineoplásico doxorrubicina HCl (doxo), tres diluciones seriadas en relación de 1:10, en medio MEM suplementado con 5% de FBS, obteniendo las siguientes concentraciones finales: 10 μM, 1 μM y 0,1 μM (21); como control positivo se empleó doxorrubicina HCl. Después de un tratamiento durante 48 horas, se determinó paralelamente la población celular viable mediante los ensayos con MTT y resazurina. Se compararon los valores de porcentajes de supervivencia calculando el porcentaje de variación de las respuestas en función del método de tinción celular (DR%) definido por la ecuación 1.
Donde (A/F tto) absorbancia o fluorescencia promedio de pozos para cada tratamiento; (A/F bt) absorbancia o fluorescencia promedio de blancos de tratamiento; (A/F c) absorbancia o fluorescencia promedio control de crecimiento y (A/F bc): absorbancia o fluorescencia promedio blanco.
Tinción con resazurina
Para cuantificar el efecto citotóxico de los tratamientos se aplicó la prueba fluorométrica de resazurina. Transcurridas las 48 horas de inoculado el tratamiento sobre las células, se extrajo el medio de cultivo con tratamiento y se lavaron los pozos con PBS de 149,2 mM y pH= 7,3. Posteriormente se adicionaron 100 μL por pozo de medio MEM sin suplementar con resazurina al 10% v/v partiendo de una solución inicial de 44 μM (2, 24), y se incubó durante 4 horas en condiciones estándar. Cumplido el tiempo de incubación las placas fueron leídas a una longitud de onda de excitación 535 nm y 595 nm de emisión en un lector TECAN (1).
Tinción con MTT
Cumplido el tiempo de tratamiento se eliminó el medio de cultivo y las microplacas de cultivo se lavaron con PBS, ya que las proteínas provenientes del suero pueden interferir en la dilución final del formazán (25). Posteriormente se añadieron 100 μL de MTT en concentración 0,25 mg/mL en medio sin suplementar; las placas fueron incubadas durante 4 horas en condiciones estándar. Luego, cuidadosamente se descartó el sobrenadante y se adicionaron 100ml de DMSO con el fin de disolver el formazán, producto del metabolismo de MTT. Las placas de cultivo fueron leídas en un lector de placas BIORAD 550. Los valores resultantes fueron tomados como medida indirecta de masa celular viable.
Análisis estadístico
Para establecer la influencia de los factores de tratamiento sobre las líneas celulares empleadas se realizó un análisis de varianza (ANOVA). Así mismo, para determinar si las respuestas de viabilidad celular expresadas por ambos métodos eran comparables, se aplicó una prueba de correlación de Pearson, empleando el programa estadístico SPSS (Statistical Product for Service Solutions), versión 13.0 para Windows.
RESULTADOS
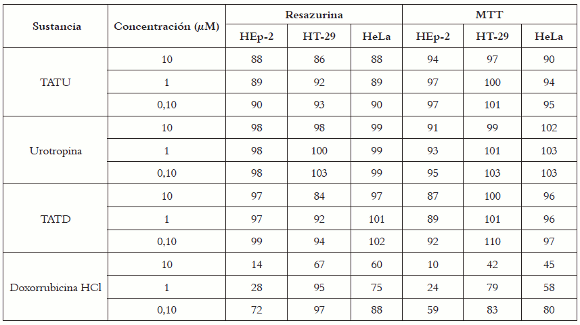
Para evaluar las respuestas obtenidas de ambos métodos, se evaluó el efecto citotóxico de tres compuestos sintéticos y un agente antineoplásico sobre las tres líneas celulares de trabajo. A partir de los valores de fluorescencia obtenidos se calcularon los porcentajes de supervivencia celular después de un periodo de tratamiento de 48 horas, y se halló que los compuestos no habían causado una disminución notoria en la supervivencia celular en ninguna de las líneas celulares evaluadas. Este mismo resultado se obtuvo al valorar las respuestas obtenidas con el MTT. De otro lado, al evaluar doxorrubicina HCl se encontró que las tres líneas en estudio fueron sensibles a la acción de este fármaco en el rango de concentración evaluado como se evidencia en la tabla 1.
Tabla 1. Promedio de porcentajes de supervivencia obtenidos al evaluar los tres compuestos sintéticos y doxorrubicina HCl empleando dos métodos de tinción celular. N = 3.
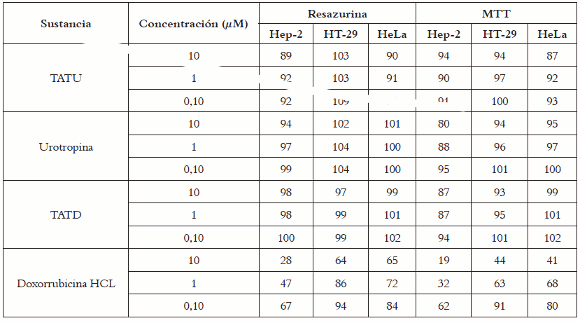
La repetición, realizada dos semanas después, ratificó los valores de supervivencia obtenidos, tanto en la valoración de los compuestos sintéticos evaluados por ambos métodos de tinción celular como en la sensibilidad de las líneas al agente antineoplásico en un periodo de tratamiento de 48 horas, estableciendo la reproducibilidad de los resultados y presentados en la tabla 2.
Tabla 2. Promedio de porcentajes de supervivencia obtenidos al evaluar tres compuestos sintéticos y doxorrubicina HCl, empleando dos métodos de tinción celular. N = 3.
Doxorrubicina HCl
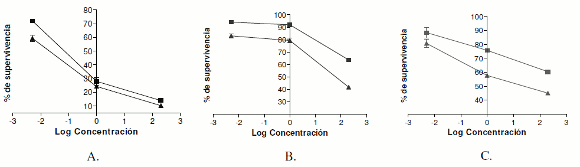
Los resultados expresados en gráficas como curvas de logaritmo de la concentración-porcentaje de supervivencia para cada línea celular, indicados en la figura 2A-C, mostraron que las tres líneas en estudio fueron sensibles a la acción de doxorrubicina en el rango de concentración evaluado, con un tratamiento de 48 horas, empleando ambos métodos de tinción.
Figura 2. Efecto citotóxico de Doxorrubicina HCl empleando el método de resazurina (□) y el método de reducción de MTT (△) sobre cada línea celular. A: HEp-2, B: HT-29 y C: HeLa. Δ = 0,05 y &177; 1 desviación típica.
Al valorar la citotoxicidad de doxorrubicina sobre HEp-2, empleando los métodos MTT y resazurina respectivamente, se obtuvo una viabilidad entre 10% y 20% a la mayor concentración (10 μM); 25%-30% a una concentración de 1 μM, y 60%-70% de supervivencia, evaluando una concentración de 0,1 μM.
En la línea HT-29, sólo a la máxima concentración se observó una reducción importante de este porcentaje empleando el método de MTT (42%); sin embargo, en el caso de resazurina, esta reducción fue del 67% de viabilidad celular. Finalmente, para las tres líneas celulares se observó la misma tendencia al leer por MTT o por resazurina; no obstante, con este último método se obtuvieron porcentajes de viabilidad superiores.
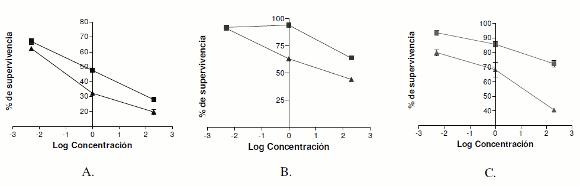
Los resultados obtenidos en el segundo ensayo fueron similares a los anteriormente descritos, la misma tendencia tanto para los compuestos como para doxorrubicina HCl. La tendencia de las dos curvas con relación al ensayo de doxorrubicina HCl es la misma, pero los valores son diferentes y se evidencian en la figura 3 A-C, lo cual demuestra la reproducibilidad de los resultados.
Figura 3. Repetición del efecto citotóxico de doxorrubicina HCl empleando el método de resazurina (□) y el método de reducción de MTT (△) en las tres líneas celulares. A: HEp-2, B: HT-29 y C: HeLa. Δ=0,05 y &177; 1 desviación típica.
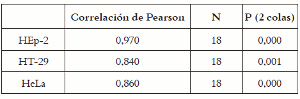
Posteriormente, para comprobar la hipótesis de igualdad de porcentajes de supervivencia obtenida en los dos métodos, se aplicó la prueba de correlación de Pearson, que indica el grado de correlación que existe entre las variables, además de la fuerza con que están asociadas, y si ésta relación es o no significativa. Los valores de correlación de Pearson calculados para cada línea celular mostraron, para las tres líneas celulares un acercamiento a 1. Esto indica que los resultados obtenidos por los dos métodos están asociados en forma positiva, es decir, cuando aumenta el porcentaje de supervivencia en un método, aumenta también en el otro como se observa en la tabla 3.
Tabla 3. Datos obtenidos de la prueba de correlación de Pearson en cada línea celular.
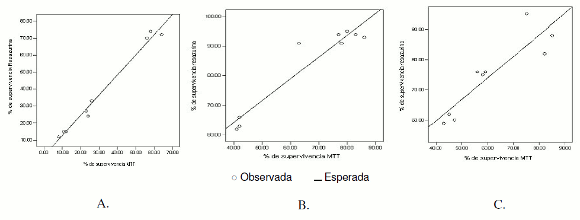
Así mismo, al graficar los porcentajes de supervivencia obtenidos en ambos métodos, se observó que el grado de asociación de las variables para cada línea celular fue cercano a 0,9; lo que expresa un ajuste lineal, con una probabilidad menor de 0,001 en los tres modelos. Por lo tanto, las regresiones son significativas y se evidencian en la figura 4 A-C.
Figura 4. Correlación entre MTT y resazurina en la valoración de citotoxicidad de doxorrubicina HCl en cada línea celular. A: HEp-2, B: HT-29 y C: HeLa.
DISCUSIÓN
Cabe notar que la mayoría de los métodos comúnmente empleados en ensayos de citotoxicidad suelen ser de punto final, mediante sistemas de tinción destructivos. Por esa razón, la implementación del método de resazurina es crucial para valorar detalladamente, no sólo el efecto citotóxico de productos con potencial actividad anticancerígena sobre células tumorales, sino el comportamiento de las células después de ser sometidas a un tratamiento traumático, y permite complementar los modelos disponibles para la evaluación de la actividad citotóxica mediante la determinación de la capacidad proliferativa de las células después de un tratamiento citotóxico.
Después del periodo de tratamiento de 48 horas, los resultados indican que en ninguna de las líneas celulares evaluadas, los compuestos causaron disminución significativa en la supervivencia celular, ni empleando el método de MTT ni el de resazurina; sin embargo, se halló que las respuestas de porcentaje de supervivencia obtenidas a partir de los dos métodos de valoración de citotoxicidad fueron semejantes al evaluar los diferentes compuestos sintéticos. En algunos pozos de tratamiento se dio un efecto citotóxico muy bajo, y en otros se midieron porcentaje de supervivencias superiores al 100%. Esto puede ser obedecer a que, al sembrar las placas, puede existir una mínima diferencia en la cantidad de células dispuestas en cada pozo, y después de 48 horas de incubación de las células proliferan magnificando estas diferencias.
Se debe destacar que en varios de los pozos tratados con los compuestos sintéticos TATU, urotropina y TATD, se observaron intensidades de fluorescencia mayores que en los pozos control de crecimiento. Esto puede relacionarse con el denominado fenómeno de hórmesis (26), que si bien se ha descrito para compuestos considerados como activos y que en muy bajas concentraciones inducen respuesta de inducción aparente de mayor proliferación para diferentes líneas celulares, también podría estar ocurriendo en el caso de moléculas muy poco activas a las concentraciones consideradas como apropiadas (cercanas a 10 μM), como sucede en este caso. Sin embargo, como estas diferencias son menores al 10% no se consideran como un efecto proliferativo significativo y de igual forma se concluye que bajo las condiciones experimentales usadas para los compuestos TATU, urotropina y TATD, éstos no muestran potencial como anticancerígenos.
Por otro lado, el efecto citotóxico observado para doxorrubicina HCl en las tres líneas celulares tuvo el mismo comportamiento empleando ambos métodos; sin embargo, los porcentajes de supervivencia derivados del método de resazurina fueron notablemente superiores a los obtenidos con el método de MTT. De igual forma, Hamid y colaboradores (15), al evaluar doxorrubicina sobre la línea celular HepG2 empleando ambos métodos, encontraron que al valorar el efecto del tratamiento por 24 horas a 10 μM de doxorrubicina, se observó un porcentaje de supervivencia menor con el método de resazurina.
Aunque en este trabajo el tiempo de tratamiento fue de 48 horas, diferente al que establecieron Hamid y colaboradores (15), las respuestas obtenidas al emplear los dos métodos son contrarias al evaluar la misma concentración de fármaco, lo que determina que las respuestas de supervivencia derivadas de ambos métodos, aunque se asocian de manera positiva, no son comparables al valorar el efecto citotóxico de este fármaco, posiblemente por diferentes mecanismos de acción del agente antineoplásico sobre las enzimas responsables de la transformación de resazurina y del MTT, que pueden modificar los resultados.
En el presente estudio, los efectos observados por este medicamento fueron desprendimiento celular y extensivo daño celular. Por consiguiente, se reafirma que para este tipo de estudios existe un potencial riesgo de sesgar los resultados al usar un solo método de tinción celular de punto final cuando se realizan valoraciones de citotoxicidad, lo cual ha sido anteriormente descrito (27).
Así mismo, el descenso gradual en la supervivencia celular que mostró HEp-2 demuestra que esta línea es más sensible a este fármaco usado en tratamientos para cáncer, que otras líneas celulares evaluadas establecidas previamente (21).
Por otra parte, la reducción de resazurina se ha descrito como un método variable según la línea celular valorada. Así OBrien y colaboradores (2) identificaron cómo esto ocurre evaluando CuSO4 a diferentes concentraciones en tres líneas celulares (hepatocitos de ratón, HepG2, y HeLa), donde el método de resazurina detectó una citotoxicidad más rápida en las primeras líneas; sin embargo, usando la línea celular HeLa, el resultado fue contrario. Esto puede indicar una sensibilidad diferente de esta línea. Por esta razón, Nakayama y colaboradores (28) exponen la importancia de valorar individualmente las líneas celulares, ya que cada una posee propiedades metabólicas únicas que deben ser caracterizadas para determinar parámetros experimentales tales como tiempo de incubación, densidad celular y concentración de compuesto a evaluar para la óptima conversión de formas oxidadas a reducidas de los métodos a evaluar, como es el caso de la reducción de tetrazolio a formazán en el método de MTT, y la reducción de resazurina a un producto fluorescente como la resofurina.
Los resultados obtenidos en este ensayo muestran que ambos métodos, empleados bajo las condiciones establecidas, permiten evaluar la citotoxicidad de compuestos sobre líneas tumorales de origen humano, actividad que, según la literatura, puede ser empleada en tamizajes preliminares de sustancias promisorias con potencial citotóxico (2, 15).
REFERENCIAS BIBLIOGRÁFICAS
1. Anoopkumar-Dukie S, Carey JB, Conere T, OSullivan E, Van Pelt FN, Allshire A. Resazurin assay of radiation response in cultured cells. Br J Radiol. 2005; 78 (934): 945-947. [ Links ]
2. OBrien J, Wilson I, Orton T, Pognan F. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. Eur J Biochem. 2000; 267 (17): 5421-5426. [ Links ]
3. Skehan P, Storeng R, Scudiero D, Monks A, McMahon J, Vistica D, et al. New Colorimetric Cytotoxicity Assay for Anticancer-Drug Screening. J Natl Cancer Inst. 1990; 82 (13): 1107-1112. [ Links ]
4. Slater K. Cytotoxicity tests for high-throughput drug discovery. Curr Opin Biotech. 2001; 12 (1): 70-74. [ Links ]
5. Putnam KP, Bombick DW, Doolittle DJ. Evaluation of eight in vitro assays for assessing the cytotoxicity of cigarette smoke condensate. Toxicol In Vitro. 2002; 16 (5): 599-607. [ Links ]
6. Bernas T, Dobrucki J. Mitochondrial a Nonmitochondrial Reduction of MTT: Interaction of MTT with TMRE, JC-1 and NAO Mitochondrial Fluorescent Probes. Cytometry. 2002; 47 (4): 236-242. [ Links ]
7. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983; 65 (1-2): 55-63. [ Links ]
8. Bellamy WT. Prediction of response to drugs therapy of cancer: a review of in vitro assay. Drugs. 1992; 44 (5): 690-708. [ Links ]
9. Rolón M, Vega C, Escario JA, Gómez-Barrio A. Development of resazurin microtiter assay for drug sensibility testing of Tripanosoma cruzi epimastigotes. Parasitol Res. 2006; 99 (2): 103-107. [ Links ]
10. Zhang H, Du G, Zhang J. Assay of mitochondrial functions by resazurin in vitro. Acta Pharmacol Sin. 2004; 25 (3): 385-389. [ Links ]
11. Palomino JC, Martin A, Camacho M, Guerra H, Swings, J, Portaels F. Resazurin Microtiter Assay Plate: Simple and Inexpensive Method for Detection of Drug Resistance in Mycobacterium tuberculosis. Antimicrob Agents Chemother. 2002; 46 (8): 2720-2722. [ Links ]
12. González RJ, Tarloff JB. Evaluation of hepatic subcellular fractions for Alamar blue and MTT reductase activity. Toxicol in Vitro. 2001; 15 (3): 257-259. [ Links ]
13. Rasmussen ES. Use of fluorescent redox indicators to evaluate cell proliferation and viability. In Vitro Mol Toxicol. 1999; 12 (1): 47-58. [ Links ]
14. Rasmussen ES, Nicolaisen GM. Stability of resazurin in buffers and mammal cell culture media. In Vitro Mol Toxicol. 1999; 12 (4): 195-202. [ Links ]
15. Hamid R, Rotshteyn Y, Rabadi L, Parikh R, Bullock P. Comparison of Alamar blue and MTT assays for high throught-put screening. Toxicol InVitro. 2004; 18 (5): 703-710. [ Links ]
16. Lieberman M, Patterson G, Moore R. In vitro bioassays for anticancer drug screening: effects of cell concentration and other assays parameters on growth inhibitory activity. Cancer Lett. 2001; 173 (1): 21-29. [ Links ]
17. Stevens CD, Mosteller RC. Enhancement by Glucose of the Inhibition of an Ehrlich Ascites Tumor by Tetraazatricyclododecane. Cancer Res. 1969; 29 (5): 1132-1136. [ Links ]
18. Freshney I. Culture of animal cells: a manual of basic technique. 4a Ed. New York: John Wiley & Sons Inc; 2000. [ Links ]
19. Rivera A, Nuñez ME, Morales MS, Joseph-Nathan P. Preparation of cage amine 1,3,6,8-tetraazatricyclo[4.3.1.13,8]undecane. Tetrahedron Lett. 2004; 45 (41): 7563-7565. [ Links ]
20. Simkins R, Wright G. Nitrolysis of 1,3-6,8-Diendomethylene-1,3,6,8-tetrazacyclodecane. J Am Chem Soc. 1955; 77 (11): 3157-3159. [ Links ]
21. León CJ, Gómez SM, Morantes SJ, Cordero CP, Aristizábal FA. Caracterización del perfil de sensibilidad de un panel de líneas celulares para valoración de citotoxicidad in vitro. Biomédica Revista del Instituto Nacional de Salud de Colombia. 2006; 26 (1): 161-168. [ Links ]
22. Cordero CP, Gómez-González S, León-Acosta CJ, Morantes-Medina SJ, Aristizábal FA. Cytotoxic activity of five compounds isolated from Colombian plants. Fitoterapia. 2004; 75 (2): 225-227. [ Links ]
23. Cordero CP, Aristizábal FA. Evaluación preliminar in vitro de citotoxicidad de extractos vegetales sobre líneas derivadas de tumores humanos, empleando dos métodos colorimétricos. Rev Colomb Biotecnol. 2002; 4: 100-106. [ Links ]
24. Magnani E, Bettini E. Resazurin detection of energy metabolism changes in serum-starved PC12 cells and of neuroprotective agent effect. Brain Res Protoc. 2000; 5 (3): 266-272. [ Links ]
25. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival: Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods. 1986; 89 (2): 271-277. [ Links ]
26. Kinoshita A, Wanibushi H, Wei M, Fukushima S. Hormesis in Carcinogenicity of Non-genotoxic Carcinogens. J Toxicol Pathol. 2006; 19 (3): 111-122. [ Links ]
27. Holst M, Oredsson S. Comparison of three cytotoxicity tests in the evaluation of the cytotoxicity of a spermine analogue on human breast cancer cell lines. Toxicol In Vitro. 2005; 19 (3): 379-387. [ Links ]
28. Nakayama GR, Caton MC, Nova MP, Parandoosh Z. Assessment of the Alarmar Blue assay for cellular growth and viability in Vitro. J Immunol Methods. 1997; 204(2):205-208. [ Links ]
Recibido: Diciembre 11 de 2008; Aceptado: Febrero 25 de 2010
* Autor a quien debe dirigir la correspondencia: faaristizabalg@unal.edu.co