Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.1 Medellín Jan./Apr. 2010
FARMACOLOGÍA Y TOXICOLOGÍA
EVALUACIÓN DE LAS PROPIEDADES ANTIOFÍDICAS DEL EXTRACTO ETANÓLICO Y FRACCIONES OBTENIDAS DE Renealmia alpinia (Rottb) Mass (Zingiberaceae) CULTIVADA IN VITRO
ANTIOPHIDIAN PROPERTIES EVALUATION OF ETHANOL EXTRACT AND FRACTIONS OBTAINED FROM Renealmia alpinia (Rottb) Mass (Zingiberaceae)CULTIVATED IN VITRO.
Maritza FERNÁNDEZ C.1,2*; William F. ORTIZ C.1,2; Jaime A. PEREÁÑEZ J.1; Diego MARTÍNEZ R.1
1 Programa de Ofidismo/Escorpionismo. Universidad de Antioquia. AA1226. Medellín, Colombia.
2 Facultad de Química Farmacéutica. Universidad de Antioquia. AA1226. Medellín, Colombia
RESUMEN
Los extractos vegetales constituyen una fuente rica de moléculas farmacológicamente activas, cuya aplicación en medicina tradicional permite un acercamiento a potenciales actividades biológicas. En este trabajo se evalúa la capacidad inhibitoria de extractos etanólicos de hojas, raicillas y fracciones obtenidas por cromatografía en columna de Renealmia alpinia (Rottb) Mass, cultivada in vitro, sobre los efectos hemolítico indirecto, proteolítico y coagulante inducidos por el veneno de Bothrops asper. La actividad hemolítica indirecta es inhibida en mayor medida por la fracción 7-8 (47,3 ± 2,20%), seguida en su orden por los extractos de raicillas (32,6 #177; 6,90%) y hojas (24,2 ± 4,43%) de origen in vitro y hojas ex vitro (16,2 ± 3,88%). La actividad proteolítica se inhibe ampliamente por los extractos de hojas tanto in vitro como ex vitro sin diferencias significativas. Contra la actividad coagulante se registra una mayor neutralización por parte de las raicillas in vitro (81,73 ± 9,94s). Se descarta un potencial mecanismo de acción proteolítico de Renealmia alpinia sobre el veneno de Bothrops asper dado que no se producen cambios en los patrones electroforéticos del veneno. Los resultados viabilizan la aplicación de Renealmia alpinia como coadyuvante en el tratamiento del accidente ofídico y sustentan la utilidad de la micropropagación para la producción masiva de componentes activos.
Palabras Clave: Renealmia alpinia, cultivos in vitro, fracciones, Bothrops asper, propiedades antiofídicas.
ABSTRACT
Plant extracts are a rich source of pharmacologically active molecules. Their application allows a tradicional medicine approach to potential biological acitivities. This paper evaluates the inhibitory capacity of ethanolic extracts of leaves and little roots and also fractions chromatographically fractions obtained from Renealmia alpinia (Rottb) Mass, cultured in vitro, on the indirect hemolytic activity, proteolytic activity and coagulant activity induced by the Bothrops asper venom. Indirect hemolytic activity is inhibited to a greater extent by the fraction 7-8 (47.3 ± 2.20%) followed in order by the extracts from little roots (32.6 ± 6.90%) and leaves (24.2 ± 4.43%). They came from in vitro and ex vitro leaves (16.2 ± 3.88%). The proteolytic activity is largely inhibited by the leaves extracts in vitro and ex vitro without significant differences between them. Little roots in vitro showed the highest neutralization effect on coagulant activity (81.73 ± 9.949s). Proteolytic activity from Renealmia alpinia extracts on Bothrops asper venom is ruled out since there are not changes in the electrophoretic pattern of the venom. The results make possible the implementation of Renealmia alpinia as adjuvant for the treatment of ophidic accidents and sustain the value of micropropagation for mass production of active components.
Keywords: Renealmia alpinia, cultures in vitro, fractions, Bothrops asper, antiophidian properties.
INTRODUCCIÓN
El envenenamiento por mordedura de serpiente constituye un problema de salud pública en los países tropicales, con un estimado mundial de 2,5 millones de personas afectadas cada año (1). En América Latina el 90% de tales casos son ocasionados por especies del género Bothrops, siendo en Colombia Bothrops asper la especie causante del 70% de las mordeduras (2, 3).
El veneno de serpiente constituye una compleja mezcla de toxinas con actividad enzimática que incluye hemorraginas, proteasas, fosfolipasas A2 (PLA2), neurotoxinas, citotoxinas, cardiotoxinas y miotoxinas. Estas proteínas actúan por diferentes mecanismos (4), ocasionando una variedad de manifestaciones fisiopatológicas con fuertes efectos locales como mionecrosis, hemorragia, edema, dermonecrosis y ampollas, así como alteraciones sistémicas entre las que se destacan coagulopatías, hemorragias, shock cardiovascular y falla renal aguda (5-9).
Aunque el antiveneno es el único tratamiento disponible, no provee suficiente protección contra el daño local producido por el veneno y con frecuencia produce reacciones adversas de hipersensibilidad (8), haciéndose necesario investigar diferentes inhibidores del veneno que puedan complementar la terapia frente a un accidente ofídico (10-11).
El uso de extractos de plantas como antídoto contra el veneno de serpientes es una práctica ancestral en muchas comunidades rurales que carecen de acceso a la terapia con antiveneno debido a los pocos recursos médicos y las difíciles condiciones geográficas (12-15). Resulta interesante su investigación, porque muchas plantas aún no han sido estudiadas para verificar y validar sus acciones neutralizantes (6, 16, 17).
Particularmente, en la medicina tradicional colombiana de la región nordeste del país, los chamanes disponen de cerca de 100 plantas diferentes, reportadas etnobotánicamente, para administrarlas en forma de extractos acuosos y etanólicos como medida de atención primaria en el 60% de los casos de accidente ofídico (18-19).
Renealmia alpinia (Rottb) Mass, de la familia Zingiberaceae, es una planta típica de bosques tropicales húmedos de tierras bajas, popularmente conocida como matandrea o achira de monte, utilizada tradicionalmente por sus propiedades medicinales como febrífugo, antiemético y estomáquico (20). Además, ha sido comprobado científicamente que posee actividad antiedematizante, antihemorrágica y neutralizante del veneno de Bothrops asper (18).
Con base en técnicas de micropropagación vegetal sobre Renealmia alpinia reportadas por Alarcón et al (20), este trabajo estudia el efecto inhibitorio de extractos etanólicos de hojas y raicillas de esta planta sobre los efectos enzimáticos del veneno de Bothrops asper, así como el aislamiento de fracciones con posibles cumarinas con propiedad neutralizante de la actividad PLA2 del mismo veneno, abriendo la posibilidad, con base en técnicas de cultivo de tejidos vegetales, a nuevos trabajos encaminados al estudio, producción, aislamiento e identificación de los metabolitos responsables de tales actividades y capaces de intervenir como coadyuvantes en el tratamiento convencional del accidente ofídico.
MATERIALES Y MÉTODOS
Venenos
El veneno colectado (centrifugado, liofilizado y almacenado a -20°C) está constituido por una mezcla homogénea obtenida de 40 especímenes adultos de Bothrops asper de diferentes zonas geográficas de los departamentos de Antioquia y Chocó (Colombia), mantenidos en cautiverio en el serpentario de la Universidad de Antioquia.
Material vegetal
Las hojas y raicillas de Renealmia alpinia se obtuvieron de plantas propagadas in vitro, después de un mes de crecimiento en medio de cultivo enriquecido con bencilaminopurina a una concentración de 1 ppm, según Alarcón et al (20).
Las hojas de Renealmia alpinia ex vitro se colectaron a partir de plantas cultivadas en los predios de la Universidad de Antioquia durante el periodo enero-febrero de 2008 (Medellín, Colombia), y su identificación se hizo en el Herbario de la Universidad de Antioquia, según Voucher 107316, número de registro 6456 RF.
El material vegetal in vitro fue separado en hojas (15,2 g) y raicillas (9,2 g); secado por dos días a 38°C, para luego ser molido y percolado en etanol al 96% durante 48 horas. Los extractos se concentraron al vacío hasta sequedad, luego se liofilizaron y se obtuvieron rendimientos del 28,3% (4,3 g) y 23,9% (2,2 g) a partir de hojas y raicillas, respectivamente. Finalmente, se conservaron en congelación hasta su uso. Este mismo tratamiento fue realizado sobre las hojas ex vitro, obteniendo un rendimiento del 26,8% (5,1 g) a partir de 19,0 g de muestra seca y molida de este material.
Los extractos fueron sometidos periódicamente a un análisis por cromatografía en capa fina para monitorear y confrontar el contenido de metabolitos secundarios encontrados en las hojas de origen in vitro frente a los ejemplares ex vitro de Renealmia alpinia (20).
Separación por cromatografía en columna (CC)
El extracto etanólico seco de la planta completa (hojas y raicillas) de Renealmia alpinia in vitro fue fraccionado por cromatografía en columna usando sílica gel como fase estacionaria y un sistema eluente tolueno:éter 1:1 saturado con ácido acético al 10% con el fin de detectar las posibles cumarinas (21). La última fracción fue eluida con etanol al 96%.
Una parte de las fracciones obtenidas se sometió a la prueba cualitativa de determinación de cumarinas mediante la impregnación de un papel de filtro con solución de NaOH diluida. La fracción se calentó a 38°C en baño termostatizado y se adicionó al papel de filtro, posteriormente éste se observó bajo luz ultravioleta a 365 nm. La presencia de una fluorescencia verde, amarilla o roja evidencia cumarinas en la muestra.
Para monitorear el fraccionamiento se llevó a cabo un seguimiento por cromatografía en capa fina utilizando placas de sílica gel 60 F-254 y un sistema eluente tolueno:éter 1:1 saturado con ácido acético al 10% con el fin de detectar las posibles cumarinas (21). Las huellas cromatográficas fueron observadas por medio de una lámpara UV a 365 nm. Las bandas con fluorescencia semejante a la observada en la prueba rápida con solución de NaOH diluida se retiraron de la placa, se procesaron y se realizó la lectura del espectro de absorción UV-visible en un espectrofotómetro UV-1700 Pharmaspec (Shimadzu).
Adicionalmente, cada fracción fue empleada en la exploración del potencial efecto inhibitorio de la actividad hemolítica indirecta inducida por el veneno de Bothrops asper.
Inhibición de la actividad hemolítica indirecta
Se utilizó el método agarosa-yema de huevo-glóbulos rojos descrito por Gutiérrez et al (22). Se definió como Dosis Hemolítica Mínina Indirecta (DHMI) aquella cantidad de veneno capaz de generar un halo de hemólisis de 20 mm de diámetro después de 20 horas de incubación, que para el veneno de Bothrops asper es de 2,2 μg.
Los ensayos de inhibición se realizaron por triplicado con 1 DHMI del veneno mezclada con diferentes cantidades de extracto de hojas y raicillas de plantas in vitro, como también en combinación con cada una de las fracciones obtenidas y con el extracto de hojas ex vitro, siendo todas estas valoradas en una relación fija de 1:20 (veneno/extracto w/w). Cada mezcla fue preincubada durante 30 minutos a 37°C. Posteriormente fueron sembradas y el halo de hemólisis fue determinado después de 20 horas de incubación a 37°C. Los resultados se expresaron como porcentaje de inhibición y los ensayos se hicieron por triplicado.
Inhibición del efecto coagulante
Se siguió el método descrito por Theakston y Reid (23). Diferentes concentraciones de los extractos se mezclaron con una dosis fija de 1,0 μg de veneno disuelto en 50 μL de solución buffer de fosfatos (PBS), pH 7,2; se incubaron a 37°C por 30 minutos y luego se adicionaron a 300 μL de plasma humano procedente de donantes sanos, con el fin de registrar el tiempo de formación del coágulo y determinar el tiempo de prolongación de la coagulación con base en el efecto producido por el control positivo (veneno Bothrops asper). Los experimentos se realizaron por triplicado.
Inhibición del efecto proteolítico sobre la caseína
Con base en la técnica descrita por Lomonte y Gutiérrez (24), se analizaron 0,02 mg/mL de veneno en PBS frente a los extractos en una relación 1:20 (veneno/extracto w/w), la cual se preincubó a 37°C por 30 minutos. Posteriormente, esta mezcla se adicionó a 2 mL de caseína al 1% en PBS, pH 7,2 y se incubó nuevamente en las condiciones descritas. La reacción se detuvo con la adición de ácido tricloroacético al 5% y tras 30 minutos de reposo se realizó la centrifugación a 690 g por 10 minutos, se extrajo el sobrenadante y se leyó su absorbancia a 280nm contra un blanco de reactivos. Los resultados se expresaron como porcentaje de inhibición, tomando como 100% de actividad proteolítica la generada por el veneno, siendo este el control positivo. Los experimentos fueron realizados por triplicado.
Electroforesis SDA-PAGE
La electroforesis se realizó sobre geles de poliacrilamida al 12% en condiciones no reducidas, como lo describe Laemmli (25). Se tomaron 40 μg de veneno y se incubaron con 400 μg de cada extracto, durante 30 minutos a 37°C, para luego correrlos en una cámara mini Protean-II® de BioRad durante 60 minutos a 150 voltios. Las proteínas fueron coloreadas empleando azul de Coomasie R 250.
Análisis estadístico
En la neutralización del efecto coagulante se hizo un análisis de varianza de una vía (ANOVA) seguido por un test de Dunnet, con el fin de determinar diferencias significativas entre el control positivo y las diferentes mezclas de neutralización. Para los ensayos de inhibición de las actividades hemolítica indirecta y proteolítica, respectivamente, se realizó un ANOVA de una vía, seguido por un test de Bonferroni, con el fin de determinar diferencias significativas entre las dosis utilizadas de cada extracto. Los resultados son expresados como la media ± SE y las diferencias fueron consideradas estadísticamente significativas cuando p<0,05.
RESULTADOS
Neutralización de la actividad coagulante inducida por el veneno de B. asper.
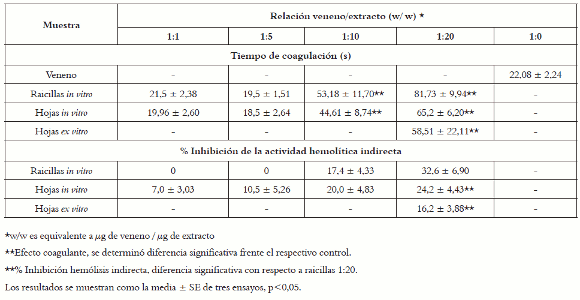
Los extractos etanólicos de Renealmia alpinia in vitro muestran una importante inhibición del efecto coagulante inducido por 1,0 μg de veneno correspondiente a un tiempo de coagulación de 22,08 ± 2,24 s. Inicialmente, la actividad coagulante es inalterada a bajas proporciones de 1:1 y 1:5 (veneno:extracto w/w); no obstante, la prolongación del tiempo de coagulación se hace apreciable cuando se emplea una combinación de extracto de hojas y raicillas superior a 10 veces la cantidad de veneno, obteniéndose tiempos de retardo máximo del período de inicio de la coagulación de 44,61 ± 8,74 s y 53,18 ± 11,70 s respectivamente, y se evidencia que a partir de esta relación el efecto inhibitorio depende de la concentración de extracto. Cabe resaltar que en la relación 1:20 (veneno:extracto w/w), no existen diferencias significativas entre el efecto neutralizante inducido por los extractos de hojas in vitro vs ex vitro, pero se hace evidente que el extracto de raicillas presenta el mayor efecto inhibitorio frente a tal actividad. De igual forma se pudo comprobar, tras media hora de incubación, que los extractos usados para éste ensayo no generan acción coagulante por si solos, como se aprecia en la tabla 1.
Tabla 1. Neutralización de las actividades coagulante y hemolítica indirecta del veneno de Bothrops asper por extractos etanólicos de Renealmia alpinia (Rottb) Mass.
Neutralización de la actividad hemolítica indirecta inducida por el veneno de B. asper.
Para los ensayos de neutralización se utilizó una DHMI 2,2 μg, observándose que los extractos valorados ocasionan una neutralización parcial de tal efecto sobre el veneno y que ninguno de ellos generaba hemólisis por sí mismo tras 20 horas de incubación.
A bajas proporciones, 1:1 y 1:5 veneno/extracto w/w, el extracto de hojas in vitro arroja un efecto protector significativo contra la hemólisis indirecta ocasionada por el veneno, que se incrementa conforme se emplea mayor cantidad de extracto, ofreciendo un máximo de inhibición de 24,2 ± 4,43%. Por el contrario, el extracto de raicillas in vitro en relaciones 1:1 y 1:5 veneno/extracto w/w, no presenta efecto inhibitorio apreciable; sin embargo, se hace evidente una mayor neutralización cuando se emplea el extracto de raicillas in vitro en relación 1:20 veneno/extracto w/w, mostrando el más alto porcentaje de inhibición conseguido por la planta in vitro, 32,6 ± 6,90%.
No obstante, en el ensayo de inhibición realizado con extractos etanólicos de hojas ex vitro (1:20 veneno/extracto w/w) se demostró un efecto protector significativo del 16,2 ± 3,88%, aunque con diferencia significativa con respecto al extracto de hojas obtenido a partir de medios controlados y enriquecidos, resultado presentado en la tabla 1.
Neutralización de la actividad proteolítica inducida por el veneno de B. asper.
Para la determinación del efecto inhibitorio de los extractos de hojas in vitro y ex vitro sobre la actividad proteolítica se optó por evaluar la relación más alta de veneno: extracto, 1:20 w/w, y al realizar el control del extracto, éste no presentó acción proteolítica sobre la caseína No se evaluó la actividad inhibitoria de las raicillas debido a la gran cantidad de extracto que exige esta prueba.
Los porcentajes de inhibición determinados demuestran alta efectividad neutralizante sobre la actividad proteolítica del veneno, pero no son estadísticamente diferentes entre sí, lo que sugiere que los extractos etanólicos de hojas de Renealmia alpinia in vitro (75,5 ± 4,95%) vs ex vitro (65 ± 4,24 %) tienen actividad neutralizante comparable sobre este efecto.
Fraccionamiento por CC y neutralización de la actividad hemolítica indirecta de las fracciones.
Se obtuvieron 12 fracciones, que posteriormente fueron corridas en CCF y reveladas en busca de bandas con fluorescencia correspondiente a cumarinas, que con base en la prueba cualitativa, exhiben el rojo como color característico. La presencia de estos compuestos metabólicos fue reportada por Alarcón et al (20).
Algunas fracciones se combinaron teniendo como parámetro de selección la similitud de sus perfiles cromatográficos en capa fina, resultando en definitiva las fracciones 1, 2, 3-4, 7-8, 9-10, 11 y 12, como se aprecia en las figuras 1A y 1B.
Figura 1. Identificación por CCF de bandas fluorescentes correspondientes a posibles cumarinas a partir del extracto etanólico de planta completa de Renealmia alpinia (Rottb) Mass in vitro. (A) Perfiles cromatográficos similares entre las fracciones 7-8. (B). Perfiles cromatográficos similares entre las fracciones 3-4. (C) Picos de absorción comunes para las posibles cumarinas aisladas por fraccionamiento en CC.
Del análisis espectrofotométrico de las posibles cumarinas aisladas, se obtiene un espectro con tres máximos de absorción comunes para este tipo de sustancias, a longitudes de onda de 250, 420 y 660 nm, correspondiente a la figura 1C.
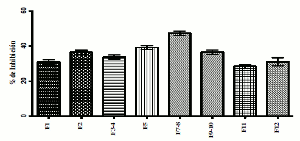
Todas las fracciones aisladas demostraron apreciable efecto inhibitorio sobre la actividad hemolítica indirecta del veneno, como se muestra en la figura 2, con porcentajes de inhibición fluctuantes entre 31,07 ± 2,34% y 39,1 ± 2,10%, siendo la fracción 11 la que demuestra menor efecto inhibitorio (28,36 ± 2,25%), y la fracción 7-8 la que sobresale por su mayor capacidad inhibitoria (47,3 ± 2,20%). De igual manera se evidencia que dos de las fracciones (F1 y F12) registran el mismo porcentaje de inhibición. Ninguna de las fracciones estudiadas presentó hemólisis indirecta al evaluarlas como control negativo.
Figura 2. Porcentaje de inhibición de la actividad hemolítica indirecta de las fracciones obtenidas de planta completa de Renealmia alpinia (Rottb) Mass, obtenida en medios de micropropagación.
Electroforesis
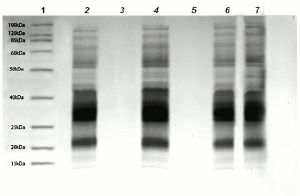
La electroforesis de proteínas en geles de poliacrilamida mostró que el extracto de hojas de Renealmia alpinia, tanto in vitro como de origen ex vitro, no inducen degradación, precipitación o disminución en la intensidad de las bandas de proteínas del veneno. Adicionalmente se observa que dichos extractos no contienen proteínas y/o compuestos que interfirieren con la tinción, de acuerdo a la figura 3.
Figura 3. SDS-PAGE. Interacción del veneno de Bothrops asper con extractos etanólicos de planta completa de Renealmia alpinia (Rottb) Mass in vitro y ex vitro (1:20 w/w). 1. Marcadores de peso molecular; 2. y 4. Renealmia alpinia in vitro con veneno de Bothrops asper; 3. Renealmia alpinia in vitro; 5. Renealmia alpinia ex vitro; 6. Renealmia alpinia ex vitro con veneno de Bothrops asper; 7. Veneno de Bothrops asper.
DISCUSIÓN
En muchos países, las plantas han sido utilizadas tradicionalmente en el tratamiento del envenenamiento provocado por serpientes, porque constituyen una excelente fuente de metabolitos farmacológicamente activos, capaces de antagonizar los lesivos efectos del veneno (15), convirtiéndose en una promisoria alternativa terapéutica para mejorar el pronóstico y evolución de los pacientes tratados con antiveneno, cuya utilización acarrea problemas de hipersensibilidad y limitada protección contra los efectos locales de rápida instalación, y cuyo almacenamiento y administración requiere exigentes condiciones (26-29).
Se ha informado sobre un gran número de plantas con significativas propiedades antiofídicas de uso tradicional en Colombia. En uno de estos estudios (20) se demostró la capacidad neutralizante de Renealmia alpinia sobre el veneno de serpiente (18), hecho que llevó a estudiarla mediante propagación in vitro en condiciones controladas, para la producción uniforme de metabolitos.
Renealmia alpinia (Rottb) Mass se caracteriza por su abundante contenido de cumarinas, cuya producción se mantiene aun en medio in vitro, lo cual se ha demostrado mediante el seguimiento realizado por comparación en CCF frente el material ex vitro, que ha permitido observar que no existen diferencias en estos compuestos, que presentan los mismos perfiles cromatográficos (datos no presentados).
Efectivamente, las fracciones obtenidas muestran una predominante presencia de cumarinas, con notable fluorescencia nativa dentro del extracto etanólico, donde al determinar los espectros de absorción de cada una mediante espectroscopia UV, se observa un patrón común de señales consistente en tres longitudes de onda predominantes, dependientes de la polaridad del entorno (disolvente) (30), lo cual deja entrever que este grupo de compuestos separados tiene un núcleo común de cromóforos que difiere en la posición de sus sustituyentes, hecho responsable de las diferentes afinidades presentadas por los compuestos frente a la sílica gel y al eluente empleado, lo que da lugar a valores de Rf característicos para cada cumarina presente. Así mismo, todas las fracciones demuestran un considerable efecto neutralizante sobre la actividad hemolítica indirecta, siendo más prominente la fracción 7-8, e incluso de mayor actividad que los extractos completos de raicillas in vitro y de hojas, tanto in vitro como ex vitro de Renealmia alpinia, con la peculiaridad de que esta fracción presenta una banda definida, que posiblemente sea de una cumarina.
Varios compuestos aislados de extractos vegetales han exhibido una gran actividad inhibitoria contra el veneno de serpientes, entre ellos taninos, flavonoides, esteroides y triterpenos (6, 13). Concretamente se ha informado sobre propiedades antiofídicas de varias cumarinas como la umbeliferona, que interacciona con la PLA2 del veneno de Crotalus durissus collilineatus, ocasionándole fuertes modificaciones estructurales que se traducen en la supresión del fenómeno inflamatorio producido por la toxina (31). Aunque no se conoce el mecanismo de acción, muchos autores sugieren que tal efecto inhibitorio es promovido por unión de estos compuestos a iones divalentes como el Ca2+ y el Zn2+, importantes para la actividad enzimática de PLA2 y metaloproteinasas, o a interacciones entre los compuestos y las toxinas, que pueden promover pérdida de la actividad biológica de éstas (28, 32). Sin embargo, es necesario un nuevo estudio que permita caracterizar cada una de las posibles cumarinas aisladas y comprobar si su posible efecto quelante, capaz de inhibir la actividad de PLA2, es reversible o irreversible cuando se adiciona un exceso de iones de Ca2+, como ocurre con los extractos acuosos de Musa paradisiaca y hojas de Schizolobium parahyba (28, 33).
Los resultados muestran que no existen diferencias significativas entre el poder protector de la hojas de Renealmia alpinia ex vitro e in vitro contra los efectos coagulante y proteolítico, pero sí la hay frente a la hemólisis indirecta inducida por el veneno de Bothrops asper, donde las hojas in vitro muestran mejor porcentaje de inhibición. Por otro lado, al comparar el efecto neutralizante de las raicillas de Renealmia alpinia in vitro con los rizomas de la planta ex vitro sobre la actividad coagulante inducida por el veneno de Bothrops asper (1), se puede determinar que a la misma proporción de veneno:extracto (1:20 w/w) ocurre prolongación del tiempo de coagulación en 81,73 ± 9,949 s y 23 s, respectivamente.
De forma similar a lo informado sobre otras plantas como Bauhinia forficata, se puede considerar que la prolongación del tiempo de coagulación originada por los extractos de Renealmia alpinia se debe, posiblemente, a que sus componentes actúan como inhibidores sobre enzimas o proteínas como las trombine-like, serinproteasas o metaloproteasas presentes en el veneno de Bothrops asper, que producen alteraciones en la coagulación debido a la degradación del fibrinógeno y/o de otros factores de la coagulación (12).
Además, al comparar el poder inhibitorio de la hemólisis indirecta de la parte terrestre, tanto in vitro como ex vitro, determinamos que las raicillas de Renealmia alpinia in vitro son neutralizantes más potentes, ya que se necesitan 44 μg del extracto para obtener un porcentaje de inhibición cercano al 30%, mientras que los rizomas ex vitro requieren aproximadamente 600 μg para obtener una inhibición comparable (18).
Aunque se desconoce el mecanismo de acción, se atribuye la actividad neutralizante de los extractos de plantas sobre el veneno de serpiente, a la presencia de enzimas inhibidoras, inactivadores químicos o principios inmunomoduladores (28). Nuestro estudio excluye la acción proteolítica de los extractos como posible mecanismo, ya que no se produce degradación de las proteínas presentes en el veneno, ni tampoco se evidencia un cambio en la intensidad de las bandas del perfil electroforético cuando se incuban conjuntamente veneno y extracto, lo que lleva a pensar que los componentes del extracto pueden actuar ocupando los sitios activos u otros sitios de las toxinas para, de esta forma, inducir cambios conformacionales en las proteínas, que puedan prevenir de forma competitiva o no competitiva la unión del sustrato a las enzimas, tal y como ocurre con la BthTX-II (PLA2 aislada del veneno de B. jararacussu) cuando es expuesta al ácido elágico y derivados del mismo, compuestos aislados de Casearia sylvestris (34).
CONCLUSIONES
Finalmente, este estudio proporciona pruebas científicas para el uso tradicional de plantas, especialmente de aquellas que han sido cultivadas in vitro. Estimula el desarrollo de nuevos trabajos encaminados al estudio y la producción de metabolitos con interés farmacéutico, usando técnicas de cultivo de tejidos vegetales, capaces de ayudar directamente como suplementos de la seroterapia convencional, contribuyendo al desarrollo de productos fitoterapéuticos de bajo costo, accesibles a toda la población.
AGRADECIMIENTOS
Al Comité para el Desarrollo de la Investigación (CODI), de la Universidad de Antioquia, por el soporte financiero.
REFERENCIAS BIBLIOGRÁFICAS
1. Núñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R, et al. Neutralization of the edema-forming, defibrinating and coagulant effects of Bothrops asper venom by extracts of plants used by healers in Colombia. Braz J Med Biol Res. 2004; 37 (7): 969-977. [ Links ]
2. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez SL, Osorio RG, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000; 73 (1-2): 233-241. [ Links ]
3. Pereáñez JA, Jiménez SL, Quintana JC, Núñez V, Fernández M, Restrepo Y. Inhibición de las actividades proteolítica, coagulante y hemolítica indirecta inducidas por el veneno de Bothrops asper por extractos etanólicos de tres especies de heliconias. Vitae. 2008; 15 (1): 157-164. [ Links ]
4. Chipaux JP, Goyffon M. Venoms, antivenoms and immunotherapy. Toxicon. 1998; 36 (6): 823-846. [ Links ]
5. Maiorano VA, Marcussi S, Daher MA, Oliveira CZ, Couto LB, Gomes OA, et al. Antiophidian properties of the aqueous extract of Mikania glomerata. J Ethnopharmacol. 2005; 102 (3): 364-370. [ Links ]
6. Borges MH, Soares AM, Rodrigues VM, Oliveira F, Fransheschi AM, Rucavado A, et al. Neutralization of proteases from Bothrops snake venoms by the aqueous extract from Casearia sylvestris (Flacourtiaceae). Toxicon. 2001; 39 (12): 1863-1869. [ Links ]
7. Villar JA, Lima FT, Veber CL, Oliveira AR, Calgarotto AK, Marangoni S, et al. Synthesis and evaluation of nitrostyrene derivative compounds, new snake venom phospholipase A2 inhibitors. Toxicon. 2008; 51 (8): 1467-1478. [ Links ]
8. Da Silva JO, Fernandes RS, Ticli FK, Oliveira CZ, Mazzi MV, Franco JJ, et al. Triterpenoid saponins, new metalloprotease snake venom inhibitors isolated from Pentaclethra macroloba. Toxicon. 2007; 50(2): 283-291. [ Links ]
9. Gutiérrez JM, Lomonte B. Local tissue damage induced by Bothrops snake venoms. Mem Inst Butantan. 1989; 51 (4): 211-223. [ Links ]
10. Gomes A, Saha A, Chatterjee I, Chakravarty AK. Viper and cobra venom neutralization by β-sitosterol and stigmasterol isolated from the root extract of Pluchea indica Less. (Asteraceae)This article is not included in your organizations subscription. However, you may be able to .access this article under your organizations agreement with Elsevier. Phytomedicine. 2007; 14 (9): 637-643.
11. Cavalcante WL, Campos TO, Dal Pai-Silva M, Pereira PS, Oliveira CZ, Soares AM, et al. Neutralization of snake venom phospholipase A2 toxins by aqueous extract of Casearia sylvestris (Flacourtiaceae) in mouse neuromuscular preparation. J Ethnopharmacol. 2007; 112 (3): 490-497. [ Links ]
12. Oliveira CZ, Maiorano VA, Marcussi S, SantAna CD, Januário AH, Lourenzo MV, et al. Anticoagulant and antifibrinogenolytic properties of the aqueous extract from Bauhinia forficata against snake venoms. J Ethnopharmacol. 2005; 98 (1-2): 213-216. [ Links ]
13. Soares AM, Ticli FK, Marcussi S, Lourenço MV, Januário AH, Sampaio SV, et al. Medicinal plants with inhibitory properties against snake venoms. Curr Med Chem. 2005; 12 (22): 2625-2641. [ Links ]
14. Theakston RD, Warrell DA, Griffiths E. Report of a WHO workshop on the standardization and control of antivenoms. Toxicon. 2003; 41 (5): 541-557. [ Links ]
15. Mors WB, Nascimento MC, Pereira BM, Pereira NA. Plant natural products active against snake bite - the molecular approach. Phytochemistry. 2000; 55 (6): 627-642. [ Links ]
16. Martz W. Plants with a reputation against snakebite. Toxicon. 1992; 30 (10): 1131-1142. [ Links ]
17. Samy RP, Thwin MM, Gopalakrishnakone P, Ignacimuthu S. Ethnobotanical survey of folk plants for the treatment of snakebites in Southern part of Tamilnadu, India. J Ethnopharmacol. 2008; 115 (2): 302-312. [ Links ]
18. Otero R, Núñez V, Jiménez SL, Fonnegra R, Osorio R, García ME, et al. Snakebites and ethnobotany in the northwest region of Colombia, Part II: Neutralization of lethal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacol. 2000; 71 (3): 505-511. [ Links ]
19. Otero R, Fonnegra R, Jiménez SL, Núñez V, Evans N, Alzate SP, et al. Snakebites and ethnobotany in the northwest region of Colombia. Part I: Traditional use of plants. J Ethnopharmacol. 2000; 71 (3): 493-504. [ Links ]
20. Alarcón J, Martínez D, Quintana J, Jiménez SL, Díaz A, Jiménez I. Propagación in vitro de Renealmia alpinia (ROTTB), planta con actividad antiofídica. Vitae. 2008; 15 (1): 61-69. [ Links ]
21. Wagner H, Bladt S, Zgainski EM. Plant drug analysis: A thin layer chromatography atlas. 2 ed. Berlín: Springer; 1996. [ Links ]
22. Gutiérrez JM, Ávila C, Rojas E, Cerdas L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon. 1988; 26 (4): 411-413. [ Links ]
23. Theakston RD, Reid HA. Development of simple standard assay procedures for the characterization of snake venoms. Bull World Health Organ. 1983; 61 (6): 949-956. [ Links ]
24. Lomonte B, Gutiérrez JM. La actividad proteolítica de los venenos de serpientes de Costa Rica sobre la caseína. Rev Biol Trop. 1983; 31 (1): 37-40. [ Links ]
25. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227 (5259): 680-685. [ Links ]
26. Otero R, Osorio RG, Valderrama R, Giraldo CA. Efectos farmacológicos y enzimáticos de los venenos de serpientes de Antioquia y Chocó (Colombia). Toxicon. 1992; 30 (5-6): 611-620. [ Links ]
27. Mukherjee AK, Doley R, Saikia D. Isolation of a snake venom phospholipase A2 (PLA2) inhibitor (AIPLAI) from leaves of Azadirachta indica (Neem): Mechanism of PLA2 inhibition by AIPLAI in vitro condition. Toxicon. 2008; 51 (8): 1548-1553. [ Links ]
28. Mendes MM, Oliveira CF, Lopes DS, Vale LH, Alcântara TM, Izidoro LF, et al. Anti-snake venom properties of Schizolobium parahyba (Caesalpinoideae) aqueous leaves extract. Phytother Res. 2008; 22 (7): 859-866. [ Links ]
29. Núñez, V. Plantas con actividad inhibitoria del veneno de serpientes. En: Memorias Segundo Simposio Colombiano de Toxicología. Medellín: Universidad de Antioquia; 2008. pp. 51-53. [ Links ]
30. Romero AE, Olives AI, Martín L, Martín MA, del Castillo B, Agnese AM, et al. Estudio del efecto solvatocrómico en derivados fenólicos naturales. Ars Pharmaceutica. 2002; 43 (1-2): 57-71. [ Links ]
31. Toyama DO, Marangoni S, Diz-Filho EBS, Oliveira SC, Toyama MH. Effect of umbelliferone (7-hydroxycoumarin, 7-HOC) on the enzymatic, edematogenic and necrotic activities of secretory phospholipase A2 (sPLA2) isolated from Crotalus durissus collilineatus venom. Toxicon. 2009; 53 (4): 417-426. [ Links ]
32. Kini RM. Exciment ahead: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon. 2003; 42 (8): 827-840. [ Links ]
33. Borges MH, Alves DL, Raslan DS, Piló-Veloso D, Rodrigues VM, Homsi-Brandeburgo MI, et al. Neutralizing properties of Musa paradisiaca L. (Musaceae) juice on phospholipase A2, myotoxic, hemorrhagic and lethal activities of crotalidae venoms. J Ethnopharmacol. 2005; 98 (1-2): 21-29. [ Links ]
34. Da Silva SL, Calgarotto AK, Chaar SJ, Marangoni S. Isolation and characterization of ellagic acid derivatives isolated from Casearia Sylvestris SW aqueous extract with anti-PLA2 activity. Toxicon. 2008; 52 (6): 655-666. [ Links ]
Recibido: Agosto 6 de 2009; Aceptado: Febrero 25 de 2010
* Autor a quien debe dirigir la correspondencia: mfernandez@farmacia.udea.edu.co