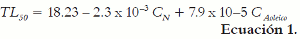Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.1 Medellín Jan./Apr. 2010
PRODUCTOS NATURALES
EVALUACIÓN DE LA ACTIVIDAD BIOLÓGICA DE EMULSIONES ACEITE/AGUA DE ÁCIDO OLEICO-NICOTINA SOBRE Drosophila melanogaster
BIOLOGICAL ACTIVITY EVALUATION OF OLEIC ACID-NICOTINE EMULSIONS OIL/WATER AGAINST Drosophila melanogaster
Pedronel ARAQUE M.1; Carlos A. PELÁEZ J.1*
1 Grupo Interdisciplinario de Estudios Moleculares (GIEM). Facultad de Ciencias Exactas y Naturales, Instituto de Química, Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
RESUMEN
En este trabajo se estudia el efecto de las emulsiones O/W de ácido oleico-nicotina estabilizadas con Tween 80® sobre su actividad insecticida aguda y crónica en Drosophila melanogaster. La bioactividad aguda de las emulsiones de ácido oleico-nicotina registró un tiempo letal medio (TL50 = 13 ± 3 minutos) significativamente mayor que el obtenido con la nicotina en solución acuosa (TL50 = 7 ± 1 minutos). La baja bioactividad de la emulsión de ácido oleico-nicotina presenta una alta correlación con el porcentaje de nicotina encapsulada en las gotas de emulsión. La bioactividad crónica se evaluó en el ciclo de vida de D. melanogaster, donde se observó repelencia, evidenciada por la disminución en la oviposición.
Palabras Clave: Drosophila melanogaster, repelencia, emulsión O/W, ácido oleico-nicotina, actividad insecticida.
ABSTRACT
This paper studies the effect of the O/W emulsion of oleic acid-nicotine stabilized with Tween 80® on its acute and chronic insecticidal activity in Drosophila melanogaster. The oleic acid-nicotine emulsions acute bioactivity show a median lethal time (LT50 = 13 ± 3 minutes) significantly higher compared with that obtained with nicotine in aqueous solution (LT50 = 7 ± 1 minutes). Oleic acid-nicotine emulsion low bioactivity present high correlation with the percentage of nicotine encapsulated in emulsion droplets. The chronic bioactivity is assessed in the life cycle of D. melanogaster where diminution in oviposition is taken as evidence of repellency.
Keywords: Drosophila melanogaster, repellents, O/W emulsion, oleic acid-nicotine, insecticidal activity.
INTRODUCCIÓN
La actividad insecticida de la molécula de nicotina ha sido empleada desde la época precolombina por los aborígenes americanos y reportada por primera vez en 1690 (1). A partir del siglo XIX y hasta mediados del XX, soluciones acuosas de nicotina en forma de sulfato eran incorporadas en una variedad de formulaciones contra insectos de cuerpo blando como pulgones y orugas (2). Sin embargo, su alta toxicidad en mamíferos (DL50 entre 50 y 60 mg/kg para ratas y 3 mg/kg para ratones), ha sido su principal desventaja, dado que entre 40-60 mg (0,5-1,0 mg/kg) puede ser letal para humanos (3), lo que significó su erradicación como herramienta agronómica.
Se ha planteado que los emulsificantes y los estabilizadores son adsorbidos en la interfaz del aceite-agua actuando como barrera de protección; así, las formulaciones tipo emulsión constituyen una alternativa para reducir los efectos adversos ocasionados por la nicotina como pesticida (4). La expansión en las aplicaciones de emulsiones insecticidas de ácido oleico-nicotina como alternativa a los plaguicidas de síntesis hace necesario profundizar en el estudio de los fenómenos asociados a la actividad de las emulsiones de ácido oleico-nicotina y sus implicaciones bioactivas, fundamentalmente en términos de la toxicidad.
Algunos estudios han postulado que la actividad insecticida de la molécula de nicotina es potenciada cuando se encuentra en fase oleosa (5), y que la adición de un ácido carboxílico saturado (entre C10:0 y C18:0) e insaturado (C18:1), lleva a la formación de carboxilatos de nicotina, que influyen en la actividad insecticida (6). Por dicha razón, en este trabajo se evalúa la actividad biológica de emulsiones de ácido oleico-nicotina utilizando el modelo biológico Drosophila melanogaster y la caracterización estructural de la mezcla ácido oleico-nicotina y su efecto en la actividad biológica.
MATERIALES Y MÉTODOS
ReactivosSe obtuvieron Tween 80® (T80), ácido oleico y nicotina grado HPLC de Sigma Chemical Co, el aceite de girasol fue adquirido en un supermercado local, refinado mediante cromatografía en columna (1,5 cm de ancho x 75 cm de alto) y empacado con sílica gel 60 (MERCK®. Kieselgel 60G, Art. 7731).
PARTE EXPERIMENTAL
Cuantificación de alcaloides
El contenido de nicotina presente en la fase acuosa de la emulsión fue determinado por cromatografía líquida de alto rendimiento (HPLC), con un procesador de muestra Gilson 170, con detector de arreglo de diodos, en las siguientes condiciones: columna Phenomenex luna C18 150 x 4,60 mm x 5 μm, con un volumen de inyección de 20 μL a un flujo de 1 mL/min; como fase móvil se utilizó Buffer (K2HPO3/ H3PO3)/acetonitrilo (70:30) a una longitud de onda de 260 nm (7).
Preparación de nicotina en solución acuosa
La nicotina fue adicionada lentamente con agitación continua en agua desionizada a 25°C, hasta disolución completa. El contenido de nicotina en solución acuosa corresponde al 0,67% g/g.
Preparación de fases oleosas
Fase oleosa ácido oleico
El ácido oleico fue adicionado lentamente con agitación continua en aceite de girasol a 25°C, hasta la disolución completa, luego se adicionó lentamente Tween 80®. El contenido de ácido oleico y Tween 80® en la fase oleosa corresponde a 6,84% g/g y 10,89% g/g, respectivamente (8).
Fase oleosa ácido oleico-nicotina
La nicotina fue adicionada lentamente con agitación continua en aceite de girasol a 25°C, hasta la disolución completa, luego se agregó lentamente, con agitación continua, ácido oleico hasta obtener una relación estequimétrica ácido-base 1:1, posteriormente se adicionó Tween 80®. Los contenidos de aceite de girasol, nicotina, ácido oleico y Tween 80® en la fase oleosa corresponden al 78,66 % g/g; 3,61% g/g; 6,84% g/g y 10,89% g/g, respectivamente (8).
Preparación y caracterización de las emulsiónes
La emulsión de aceite de girasol (18,66% g/g de fase oleosa, 16,63% g/g de aceite de girasol; 2,03% g/g de Tween 80®), la emulsión de aceite de girasol-ácido oleico (18,66% g/g de fase oleosa; 15,35% g/g de aceite de girasol; 1,28% g/g de ácido oleico; 2,03% g/g de Tween 80®), la emulsión de aceite de girasol-nicotina (18,66% g/g de fase oleosa; 15,96% g/g de aceite de girasol; 0,67% g/g de nicotina; 2,03% g/g de Tween 80®), y la emulsión de aceite girasol–ácido oleico-nicotina (18,66% g/g de fase oleosa; 14,68% g/g de aceite de girasol; 0,67% g/g de nicotina; 1,28% g/g de ácido oleico; 2,03 % g/g de Tween 80®), fueron preparadas a 25°C, usando como emulsificador un sistema con llave de tres vías acoplada a un filtro (ester de cellulosa 0,2μm) con un límite de presión de 0,51 MPa. Para la caracterización de las emulsiones se determinó el tamaño promedio de partícula (d32) mediante la técnica de dispersión de luz, usando Mastersizer Malvern 2000 (8). Todas las emulsiones fueron preparada por triplicado.
Bioensayos de actividad aguda y crónica
Los bioensayos de bioactividad aguda para la nicotina en solución acuosa y las emulsiones de ácido oleico-nicotina sobre adultos de D. melanogaster se efectuaron en discos de papel filtro (diámetro = 4 cm) impregnados con 0,20 mL de emulsión (después de preparada la emulsión), que fueron puestos en un vial de vidrio (5 cm de ancho x 6 cm de alto). Un total de 30 individuos adultos (cuatro días de nacidos) fueron introducidos al vial y la mortalidad fue monitorizada, dependiendo de la actividad de la emulsión, cada uno o cinco minutos durante 60 minutos (9). Esta evaluación se hizo por cuadruplicado y los valores de tiempo letal medio (TL50) y el análisis de regresión fueron calculados utilizando el software STATGRAPHICS Centurion XV, versión 15.1.02.
La bioactividad crónica de la nicotina en solución acuosa y de las emulsiónes sobre D. melanogaster fue determinada a partir de viales con 15 mL de alimento (mezcla semisólida de proteína, grasa y carbohidratos biodisponibles), que fue mezclado con 0,5 mL de nicotina en solución acuosa o de emulsión después de preparada hasta la completa homogenización. Un total de 6 individuos (3 machos y 3 hembras) se introdujeron al vial: transcurridas 24 horas y a una temperatura de 25°C, se retiraron los adultos y se procedió al recuento de huevos. Posteriormente se realizó el recuento de pupas y adultos con el propósito de evaluar el efecto de la emulsión sobre el ciclo de vida (9).
Estabilidad insecticida
Las pruebas de estabilidad insecticida se determinaron mediante monitorización progresiva de TL50 en las emulsiones durante 30 días.
Biodegradabilidad de las emulsiones
La biodegradabilidad se determinó mediante monitorización progresiva de unidades formadoras de colonia por mililitro (ufc/mL) de microorganismos mesoaerobios en las emulsiones, utilizando la técnica de placa vertida.
Análisis microbiológico
El recuento de mesófilos, expresado como unidades formadoras de colonias, se efectuó en las muestras diluidas en relaciones de volumen 1:10, 1:100, 1:1000, de acuerdo con el método APHA 9610 (10).
Análisis estructural de la mezcla ácido oleico-nicotina
Los espectros infrarrojos fueron obtenidos con un espectrofotómetro infrarrojo Perkin-Elmer FTIRX. El espectro de resonancia magnética nuclear protónico (HNMR) fue obtenido en el espectrofotómetro Bruker 300, y los espectros fueron corridos en CDCl3 a temperatura ambiente, y editados con el software MestReNova para Windows, versión 5.2.3-3833.
Análisis estadístico
Los resultados fueron expresados como promedio y su respectiva desviación estándar. Se realizó la comparación estadística utilizando análisis de varianza de una vía (ANOVA), seguida por el test de comparación múltiple para las diferencias entre las medias con un nivel de confianza del 95%, utilizando el software STATGRAPHICS Centurion XV, versión 15.1.02.
RESULTADOS Y DISCUSIÓN
Bioactividad aguda
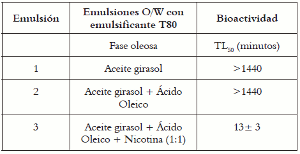
La actividad insecticida por contacto sobre D. melanogaster se llevó a cabo para la emulsión de ácido oleico-nicotina. En la tabla 1 se observa que las emulsiones 1 y 2 no demostraron actividad insecticida en un periodo de 24 horas. Para la emulsión 3, se observa un valor de TL50 de 13 ± 3 minutos, significativamente mayor, comparado con el obtenido para la nicotina en solución acuosa (TL50 = 7 ± 1), dada la pérdida de actividad insecticida en el proceso de emulsificación, comparada con la actividad de la nicotina en solución acuosa, condujo a la necesidad de evaluar el efecto de la fase oleosa. Para la emulsión se realizó extracción de la fase acuosa y se procedió a determinar su actividad. En la tabla 2 se observa que la actividad insecticida de la emulsión está dada por la fase acuosa. El contenido de nicotina en la fase acuosa corresponde al 66% de la nicotina total. A partir de esta información se preparó una solución acuosa en las mismas condiciones, obteniéndose un TL50 de 12 ± 1 minutos, que corrobora la actividad insecticida de la molécula de nicotina en la fase acuosa y que ésta no es potenciada en emulsiones, como se ha planteado en estudios anteriores.
Tabla 1. Bioactividad aguda de ácido oleico-nicotina en emulsión sobre D. melanogaster.
Tabla 2. Bioactividad aguda de ácido oleico-nicotina en emulsión sobre D. melanogaster.
La pérdida de actividad insecticida en el proceso de emulsificación se puede correlacionar con la encapsulación de nicotina en las gotas de fase oleosa de la emulsión, dado que los resultados anteriores muestran que en el proceso de emulsificación se tiene nicotina tanto en la fase oleosa como en la fase acuosa, debido a la solubilidad de la molécula en las dos fases. Predomina la solubilidad en la fase acuosa, pero al momento de adicionar ácido oleico, el contenido de nicotina aumenta en la fase oleosa. Esto puede obedecer a factores como aumento de la polaridad de la fase oleosa o la posible formación de un nuevo compuesto del tipo oleato de nicotina, tal y como se había planteado en algunos trabajos previos (5,6).
Con el fin de elucidar la formación del nuevo compuesto se llevó a cabo el análisis espectroscópico de la mezcla ácido oleico-nicotina.
Análisis espectroscópico
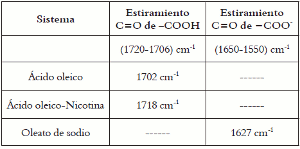
En cuanto a la posible formación de un carboxilato de nicotina se efectuó un análisis de espectroscopia infrarroja con el fin de realizar seguimiento de la banda de absorción del grupo -COOH del ácido oleico. En la tabla 3 se puede observar que la señal del estiramiento carboxílico C=O para el ácido oleico se encuentra en 1702cm-1(11), para la mezcla ácido oleico-nicotina, se observa una señal de estiramiento de grupo carboxílico a 1718 cm-1, lo cual indica que no hay una formación de oleato, ya que para la formación de oleato la banda de absorción se encuentra entre (1650-1550) cm-1, como se observa en el oleato de sodio cuya señal COO- se encuentra a 1627 cm-1(11).
Tabla 3. Bandas de absorción de infrarrojo.
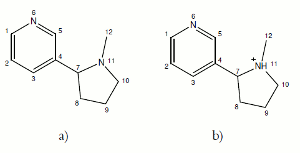
Otra forma de evidenciar la posible formación de oleato de nicotina es observando el efecto en los protones adyacentes al nitrógeno pirrolidínico por espectroscopia de resonancia magnética nuclear protónica (HNMR) en el momento de la protonación. En las figuras 1a y 1b se representan la molécula de nicotina no protonada y monoprotonada, empleando la numeración basada en el Chemical Abstracts Method (12).
Figura 1. Estructuras bi-dimensionales de la molécula de nicotina (N); (a) no protonada,(b) monoprotonada (NH+).
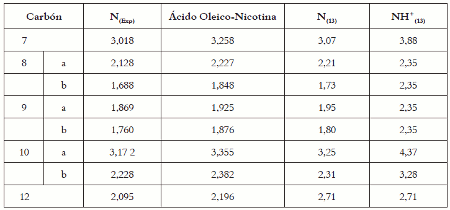
En la tabla 4 puede verse el análisis de los protones del ciclo pirrolidínico de la molécula de nicotina.
A partir de estos resultados se puede inferir que no hay formación de oleato de nicotina y que el desplazamiento a campo bajo de los protones puede ser atribuido a la formación de enlace de hidrógeno entre el grupo carboxílico del ácido oleico y el nitrógeno pirrolidínico de la nicotina. En la figura 2 se representa la estructura bidimensional de ácido oleico-nicotina.
Tabla 4. Desplazamiento químico de los protones del ciclo pirrolidínico δ (ppm)
Figura 2. Estructura bidimensional de ácido oleico-nicotina. La interacción de enlace de hidrógeno entre el grupo carboxílico de la molécula de ácido oleico y el grupo pirrolidínico de la molécula de nicotina está indicada con la línea punteada.
Efecto de la encapsulación de nicotina en la actividad insecticida
En la figura 3 se observa la disminución del TL50 y la concentración de nicotina en la fase acuosa de la emulsión, las cuales están correlacionadas con el aumento de la concentración de ácido oleico en la fase oleosa de la emulsión, dada por el encapsulamiento de la nicotina en las gotas de emulsión. Esto confirma que el aumento en la polaridad de la fase oleosa aumenta la migración de la molécula de nicotina de la fase acuosa a la fase oleosa, y posteriormente la pérdida de actividad en la emulsión.
Figura 3. Efecto de la encapsulación de nicotina en la actividad insecticida de la emulsión.
La evaluación de la concentración de ácido oleico en emulsión y del contenido de nicotina en la fase acuosa, presentó una correlación estadísticamente significativa (p<0,05) entre el TL50, CA. oleico y CN, con un nivel de confianza del 95%, describiendo para este comportamiento un modelo de regresión múltiple lineal, expresado por la ecuación 1:
Estabilidad insecticida
Para la determinación de la estabilidad coloidal y la actividad insecticida de la emulsión ácido oleico-nicotina se monitorizó el tamaño de partícula y actividad insecticida de las emulsiones el día de preparación y 30 días después, como se observa en la tabla 6, encontrándose que el cambio en el diámetro promedio de partícula no es significativo (p>0,05); pero sí se observó diferencia estadísticamente significativa en la actividad insecticida (p<0,05).
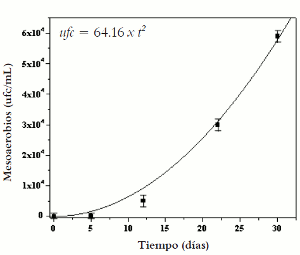
a la estabilidad de la emulsión, pero la pérdida de actividad insecticida de la fase acuosa de la emulsión en un periodo de 30 días puede atribuirse mas a volatilidad o a degradación microbiana que a encapsulación, dado que la fase oleosa de la emulsión es una fuente de alimento para microorganismos. Esta última hipótesis fue sustentada en el hecho de que en el tiempo de monitorización se presentó un aumento progresivo de unidades formadoras de colonia por mililitro (UFC/mL).
En la figura 4 se observa la evaluación de microorganismos mesoaerobios en la emulsión, que presentó una correlación estadísticamente significativa (p<0.05) entre las unidades formadoras de colonia y el tiempo de elaboración, con un nivel de confianza del 95%, y un coeficiente de correlación de 0,9976.
Figura 4. Efecto del tiempo de elaboración en el número de microorganismos.
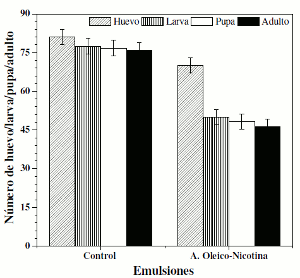
Bioactividad crónica
Para la bioactividad crónica se trabajaron dosis subletales a nivel del ciclo de vida de D. melanogaster. En la figura 5 se muestra que no hay diferencias estadísticamente significativas (p> 0,05) entre las emulsiones blanco (emulsión de aceite girasol), nicotina (emulsión de aceite girasol-nicotina) y ácido oleico (emulsión de aceite girasol-ácido oleico) y el control (agua). Para la emulsión de ácido oleico-nicotina se presentó efecto en el paso huevo-pupa, posiblemente correlacionado con el 34% de nicotina que se encuentra encapsulada en la gota de emulsión, lo que explica un posible efecto ovicida o larvicida.
Figura 5. Efecto de ácido oleico-nicotina en emulsión sobre el ciclo vital de D. melanogaster.
Los resultados de la bioactividad crónica de emulsiones de ácido oleico-nicotina sobre el paso huevo-larva, en el ciclo vital de D. melanogaster, se muestran en la figura 6. No se puede atribuir este efecto a una actividad ovicida, ya que se observó eclosión total del número de huevos. El efecto sobre la larva es selectivo, pues el 50% pasa al estadío de pupa y no se presentó diferencia estadísticamente significativa (p> 0,05) entre los paso larvas-pupas y pupa-adultos.
Figura 6. Efecto de ácido oleico-nicotina en emulsión sobre el ciclo vital de D. melanogaster.
CONCLUSIONES
Los resultados de este estudio mostraron que la actividad insecticida de la molécula de nicotina no es potenciada cuando se encuentra mezclada con ácido oleico y en emulsiones O/W, la actividad insecticida de las emulsiones está dada por la fase acuosa y la pérdida de actividad es atribuida a la encapsulación de nicotina en la fase oleosa debido al aumento de la polaridad de la fase oleosa y la formación de enlace de hidrógeno entre el grupo carboxílico del ácido oleico y el nitrógeno pirrolidínico de la nicotina, y no por formación de un oleato de nicotina. La inestabilidad en la actividad insecticida de la emulsión fue correlacionada con aumento progresivo de microorganismos mesófilos durante el tiempo de monitorización y se atribuye a la fase oleosa de la emulsión.
La emulsión de ácido oleico-nicotina presentó efecto en el paso huevo-pupa sobre el modelo biológico, lo cual fue correlacionado con el contenido de nicotina encapsulada (34%) en la gota de emulsión, lo que explica un posible efecto larvicida, ya que se observó eclosión total del número de huevos.
AGRADECIMIENTOS
Los autores agradecen a la Universidad de Antioquia y al Grupo Interdisciplinario de Estudios Moleculares (GIEM), por el financiamiento de esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Dev S, Koul O. Insecticides of Natural Origin. Australia: Horwood Academic Publishers; 1997. [ Links ]
2. George W, David W. The Pesticide Book. 6 ed. Willoughby, Ohio: Meister Media Worldwide; 2004. [ Links ]
3. Okamoto M, Kita T, Okuda H, Tanaka T, Nakashima T. Effects of aging on acute toxicity of nicotine in rats. Pharmacol Toxicol. 1994; 75 (1): 1-6. [ Links ]
4. Casanova H, Ortiz C, Vallejo A, Araque P. Nicotine oleate dispersión as botanical insecticides. Progr Colloid Polym Sci. 2004; 128 (6): 187-192. [ Links ]
5. Casanova H, Ortiz C, Peláez C, Vallejo A, Moreno M, Acevedo M. Insecticide formulations based on nicotine oleate stabilized by sodium caseinate. J Agric Food Chem. 2002; 50 (22): 6389-6394. [ Links ]
6. Casanova H, Araque P, Ortiz C. Nicotine carboxylate insecticide emulsions: effect of the fatty acid chain length. J Agric Food Chem. 2005; 53 (26): 9949-9953. [ Links ]
7. Grupo de investigación GIEM. Protocolo para determinación de alcaloides. Medellín: Instructivos Universidad de Antioquia; 2005. [ Links ]
8. Araque P, Casanova H, Ortiz C, Peláez C, Henao B. Insecticidal activity of caffeine aqueous solutions and caffeine oleate emulsions against Drosophila melanogaster and Hypothenemus hampei. J Agric Food Chem. 2007; 55 (17): 6918-6922. [ Links ]
9. Granados H, Sáez J, Saldarriaga N, Moreno M, Peláez C, Brun N, et al. In vitro insecticidal activity of the Annona aff. spraguei seeds (Annonaceae) on two biological model of Diptera order: Drosophila melanogaster and Aedes aegyti. Afinidad 2001; 58 (11): 44-48. [ Links ]
10. APHA, AWWA, WFE. Método 9610, detección de hongos. En: Clesceri LS, Greenberg AE, Trussel RR (Editores). Métodos normalizados para el análisis de aguas potables y residuales. 17 ed. Madrid: Diaz de Santos; 1992. 9-212-9-216. [ Links ]
11. Silverstein R, Webster F, Kiemle D. Spectrometric identification of organic compounds. 7 ed. New York: John Wiley & Sons; 2005. [ Links ]
12. Segall JH, Dallas LJ. 1H NMR spectroscopy of pyrrolizidine alkaloids; Phytochem. 1983; 22 (5): 1271-1273. [ Links ]
13. Perfetti TA. Structural study of nicotine salts. Beitr Tabakforsch Int. 1983; 12 (2): 43-54. [ Links ]
Recibido: Julio 17 de 2009; Aceptado: Noviembre 12 de 2009
* Autor a quien debe dirigir la correspondencia: cpelaez@matematicas.udea.edu.co