Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.2 Medellín May/Aug. 2010
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
OBTENCIÓN DE MONOGLICÉRIDOS DE ACEITE DE RICINO EMPLEANDO GLICERINA REFINADA Y CRUDA. ESTUDIO DE LAS PRINCIPALES VARIABLES DEL PROCESO
PRODUCTION OF MONOGLYCERIDES FROM CASTOR OIL USING CRUDE AND REFINED GLYCERIN. STUDY OF THE MAIN VARIABLES OF THE PROCESS
Sandra M. CARDONA V.1; Rodrigo GONZÁLEZ C.1; Alexander FRANCO C.1; Fernando CARDEÑO L.1; Luis A. RÍOS1; *
1 Grupo Procesos Fisicoquímicos Aplicados. Sede de Investigación Universitaria, Universidad de Antioquia. Lab. 329. Medellín, Colombia.
RESUMEN
Los monoglicéridos son ampliamente usados como emulsionantes en las industrias alimentaria, farmacéutica y cosmética. En este estudio se reportó la producción de monoglicéridos de aceite de ricino por reacciones de glicerólisis usando glicerina USP y la glicerina cruda, subproducto del proceso de producción del biodiesel de palma. Se emplearon catalizadores básicos como hidróxidos metálicos y óxido de plomo, y ácidos como acetato de plomo. Los resultados señalan que los catalizadores basados en plomo proporcionaron mayores conversiones hacia los monoglicéridos que los basados en sodio, potasio y calcio. Se encontró que una alta relación molar de aceite/glicerina fue una variable determinante que favorece altas concentraciones de monoglicéridos. Finalmente, se demostró que el uso de glicerina cruda para la producción de monoglicéridos es factible, aunque en este caso la concentración de monoglicéridos obtenidos se disminuye aproximadamente en un 20% debido, probablemente, al envenenamiento de los catalizadores.
Palabras Clave:monoglicéridos, emulsionantes, glicerina, aceite de ricino.
ABSTRACTMonoglycerides are widely used as emulsifiers in food, pharmaceutical and cosmetic industries. In this article was reported the production of monoglycerides from castor oil, by glicerolysis reactions, using USP glycerine and crude glycerol derived from a palm-biodiesel production process. Metalic hydroxides and lead oxide were used as basic catalysts, while lead acetate was used as acid catalyst. Results showed that the lead-based catalysts exhibited higher conversions to monoglycerides respect to those based on sodium, potassium and calcium. We found that a high molar ratio oil/glycerol was a determinant variable that favors high concentrations of monoglycerides. Ultimatelly, it was shown that it is feasible to use crude glycerol for the production of monoglycerides, although in this case the concentration of monoglycerides is reduced 20% due to the poisoning of the catalysts.
Key words:Monoglycerides, emulsifying agent, glycerin, castor oil.
INTRODUCCIÓN
En la última década, las materias primas renovables han alcanzado gran importancia en la búsqueda de una química sostenible. Los aceites y grasas vegetales son fuente de materias primas renovables empleadas en las industrias química y farmacéutica para la producción de productos con mejor biodegradabilidad y menor toxicidad. Entre estos productos están los tensoactivos de origen oleoquímico, más concretamente los monoésteres de ácidos grasos y glicerol (monoglicéridos), ampliamente usados como emulsionantes en las industrias alimentaria, farmacéutica y cosmética (1, 2). Los monoglicéridos (MG) son ésteres parciales del glicerol con ácidos grasos de elevada masa molar que se caracterizan por poseer una fracción hidrofílica y otra lipofílica en su estructura química, que los hace buenos agentes emulsionantes, surfactantes no iónicos, estabilizantes, plastificantes y espesantes (3). También se emplean como agentes modificantes en la fabricación de resinas alquídicas, donde son donadores de hidrógeno, y en la producción de polioles para la industria de los poliuretanos (4).
Los MG se obtienen principalmente por cuatro procesos (5): i) transesterificación de triglicéridos o glicerólisis de grasas con glicerol, ii) esterificación directa por reacción del glicerol con ácidos grasos, iii) hidrólisis de los triglicéridos, y iv) transesterificación del glicerol con metil ésteres de ácidos grasos. Otros procesos en menor escala y que permiten la síntesis selectiva de MG utilizan rutas a partir de: i) apertura nucleofílica del anillo de glicidol (reacción de glicidol y ácido graso) (6), ii) reacción de cetales y ácido graso (7), y iii) reacción de glicerol carbonato y ácido graso (8-10).
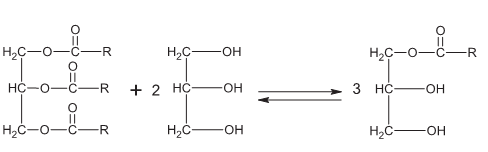
El proceso más empleado para la síntesis de MG es la glicerólisis de grasas o aceites vegetales a temperaturas entre 220ºC y 260ºC, en presencia de catalizadores básicos como NaOH o KOH, el cual se indica en la figura 1. Cuando los MG van a ser empleados en la industria alimenticia, se prefiere emplear hidróxido de calcio, Ca(OH)2, porque éste causa un bajo desarrollo del color en el producto final (2). Sin embargo, hay entre 15 y 20 catalizadores probados y ya aceptados en la alcohólisis de aceites, entre ellos los hidróxidos de plomo, zinc, y magnesio, así como el hierro, cobalto y estaño, especialmente en sus formas de óxido y en un rango de temperaturas entre 170ºC y 280ºC, los naftenatos de calcio y cerio, los acetatos de plomo, estroncio y cadmio, y una serie de mezclas complejas, como las de la marca Fascat® (mezclas de catalizadores de estaño IV), producidas por la compañía norteamericana Arquema Inc. (11, 12). Se reportan también catalizadores biológicos, como enzimas (lipasas inmovilizadas) (13, 14), sólidos ácidos mesoporosos (MCM-41) (15-17), ácidos de Lewis (17), zeolitas (faujasita, mordenita y beta), (16, 17) resinas sólidas (17) y heteropoliácidos (17, 18).
Figura 1. Ecuación general de la reacción de glicerólisis.
Cuando se emplean catalizadores básicos homogéneos, estos deben ser neutralizados al terminar la reacción para impedir su reversión, la cual puede ocurrir en aproximadamente un 30%, y también para evitar características indeseables en los productos finales, tales como sabor a jabón, color inestable y formación de espuma debida al catalizador. Así, al final de la reacción suele añadirse ácido fosfórico al sistema para neutralizar el catalizador; posteriormente, los productos se filtran sobre arcillas para retirar las sales formadas (10). Entre los aceites más empleados para la reacción de glicerólisis con aplicación industrial se destacan los insaturados, como el de soya y el de linaza, y también algunos saturados, como el de coco y el de palmiste (19, 20).
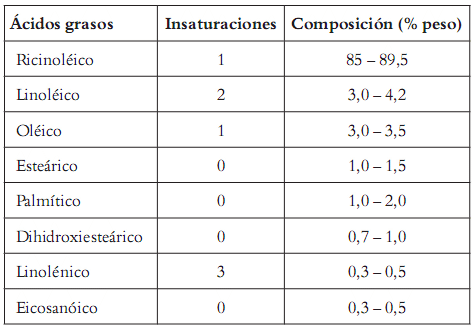
En cuanto al aceite de ricino, es una de las pocas fuentes de glicéridos naturales, en el cual aproximadamente un 90% del contenido de ácidos grasos está constituido por ácido ricinoléico, con la peculiaridad de ser un ácido graso de 18 carbonos con un doble enlace en los carbonos 9 y 10 y un grupo hidroxilo en el carbono 12. Es un aceite de color amarillo pálido, viscoso, casi inodoro, soluble en etanol, sin presencia de sedimentos y su uso es exclusivamente industrial. El grupo hidroxilo del ácido ricinoléico le confiere al aceite de ricino unas propiedades especiales tales como: mayor solubilidad en alcoholes, limitada solubilidad en disolventes alifáticos de petróleo, viscosidad y gravedad específica relativamente altas (21, 22). Actualmente, el Ministerio de Agricultura y Desarrollo Rural y Corpoica adelantan estudios que buscan fomentar y desarrollar su cultivo y sus aplicaciones industriales en Colombia. Por esta razón impulsar investigaciones que usen este aceite, como la fabricación de MG, aprovechando la gran disponibilidad de glicerina cruda proveniente de procesos de fabricación de biodiesel, es de suma importancia (23).
Respecto a la glicerina cruda, es aquella que se obtiene después de retirar el metanol y el catalizador de la fase glicerina, obtenida en la transesterificación de aceites; su contenido en masa de glicerol es del 98,2% (m/m) aproximadamente.
En este trabajo se determinaron las mejores condiciones de reacción para las materias primas empleadas (aceite de ricino, glicerina USP y glicerina cruda), que permitieran alcanzar altos rendimientos de MG empleando condiciones de reacción moderadas y catalizadores básicos homogéneos y heterogéneos.
MATERIALES Y MÉTODOS
Materiales
Catalizadores: se emplearon como catalizadores los hidróxidos de sodio, potasio y calcio (Merck, Alemania), y el acetato y el óxido de plomo (Merck, Alemania).
Reactivos: se utilizaron aceite de ricino (su composición en ácidos grasos se indica en la tabla 1 ), glicerina grado USP (99,8% glicerol) y glicerina cruda procedente del proceso de producción de biodiesel de aceite de palma (cuya composición aproximada fue: 98,2% de glicerol; 0,2% de metanol; 0,4% de agua; 0,5% de cenizas y poligliceroles, los cuales no fueron cuantificados).
Tabla 1. Distribución de ácidos grasos en el aceite de ricino.
Caracterización cromatográfica: para determinar la composición de los productos se empleó el N,N-bis (trimetilsilil) trif luoroacetamida (BSTFA, Sigma Aldrich) y el trimetil cloro silano (TMCS, Merck) como agentes derivatizantes; piridina grado analítico como solvente (Merck), tetradecano grado analítico como estándar interno (Merck), y gliceril palmitato, gliceril estearato, gliceril oleato y glicerol monoricinoleato como patrones de referencia grado analítico (Supelco). Se empleó un cromatógrafo de gases AGILENT 7890A con detector FID y una columna DB 5Ht de 15 metros.
Metodología
Para la reacción de glicerólisis se emplearon reactores de vidrio de 500 mL de capacidad, acoplados a un sistema de reflujo, agitación mecánica (500 rpm) y alimentación de nitrógeno como gas inerte, para evitar la oxidación de los productos de reacción; el calentamiento se llevó a cabo con mantas de calentamiento con control de temperatura.
Las mejores condiciones de reacción para la glicerólisis se determinaron usando un diseño factorial 2k. Una etapa inicial de cribado permitió determinar los mejores catalizadores cuando se empleó glicerina USP, variando el tipo y la concentración del catalizador (NaOH, KOH, Ca(OH)2, óxido de plomo y acetato de plomo). Para los hidróxidos se emplearon cantidades de 0,05%; 0,5% y 1% (12), con base en el peso del aceite. En cuanto a los catalizadores de plomo, debido a su alta toxicidad, la cantidad máxima que se empleó según la literatura y reglamentaciones ambientales, fue de 0,046%; por tanto se usaron 0,015%; 0,025% y 0,046% de catalizador (24). Los productos de reacción fueron cuantificados por cromatografía gaseosa, previa silanización con N,N-bis (trimetilsilil) trifluoroacetamida.
Una vez realizado el tamizado de la variable tipo de catalizador, se encontró que los dos catalizadores de plomo presentaron mayor actividad que los hidróxidos, por lo que se eligieron éstos para evaluar y buscar las mejores condiciones de reacción, mediante el diseño factorial de 23. Las variables evaluadas para cada catalizador fueron: la relación molar aceite/ glicerina USP, la temperatura de trabajo, y el tiempo de reacción. Con los mejores resultados para cada catalizador, se evaluó el empleo de la glicerina cruda procedente del proceso de producción de biodiesel.
RESULTADOS Y DISCUSIÓN
Selección del mejor catalizador para la reacción de glicerólisis
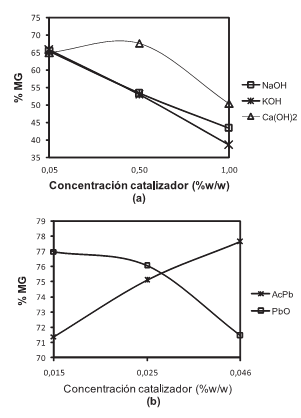
Por medio de análisis cromatográfico se determinó la concentración de MG alcanzada con cada tipo y cantidad de catalizador empleado, como se indica en la figura 2. Al terminar la reacción, el catalizador básico se neutralizó con una cantidad equivalente de ácido fosfórico.
Figura 2. Concentración de MG obtenido a partir de aceite de ricino en función del tipo de catalizador y su concentración, empleando glicerina USP. Condiciones de reacción: relación molar aceite/glicerina=1:2.1, T=220°C, (a) t=4 horas para la reacción catalizada con hidróxidos y (b) t=1 horas para la reacción catalizada con plomo.
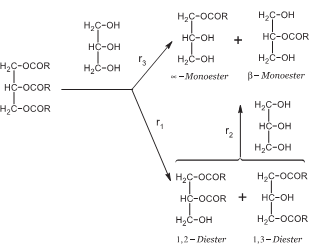
En los resultados representados en las figuras 2a y 2b puede observarse que los hidróxidos de Na, K, Ca y el óxido de plomo presentaron un comportamiento decreciente en la conversión hacia MG, a medida que se aumentó la cantidad de catalizador empleada; el óxido de plomo, en presencia de aire húmedo, se convirtió en hidróxido de plomo (Pb(OH)2), por eso se comporta como los demás hidróxidos. El acetato de plomo mostró una tendencia opuesta, por su naturaleza ácida del tipo Lewis. Estos resultados probablemente se puedan explicar considerando el esquema de la reacción de glicerólisis catalizada por bases, indicado en la figura 3, la cual ocurre en dos etapas representadas por dos ecuaciones consecutivas con diferente velocidad de reacción (10). En la primera etapa, la glicerina reaccionó con el triglicérido produciendo los isómeros 1,3- y 1,2-diglicéridos, y estos en una segunda etapa produjeron el α y β (ó 1- y 2-) monoglicéridos (r1-3 representan las velocidades de reacción de cada etapa). Probablemente, cuando se adicionaron pequeñas cantidades de catalizador, la reacción procedió lentamente favoreciendo la formación de MG (r2 ,r3 > r1). Cuando se aumentó la cantidad de catalizador, se favoreció la formación del diglicérido, y el tiempo que se dejó al sistema reaccionar posiblemente no fue suficiente para que predominara la etapa de formación de los MG (r1> r2, r3). Además, el carácter básico que le impartieron estos catalizadores a la mezcla reaccionante favoreció la reversión de la reacción (25). A más catalizador básico presente, mayor posibilidad de reversión. Esto explicaría por qué al aumentar la cantidad de catalizador básico se disminuyó la concentración de MG.
Figura 3. Esquema de reacción de glicerólisis catalizada por bases. ri: velocidad de reacción de la etapa.
Los catalizadores que presentaron el catión plomo en su estructura fueron más efectivos para la producción de MG que los cationes sodio, potasio y calcio en menores tiempos de reacción, debido principalmente a su mayor electronegatividad y radio atómico que les impartieron una mayor acidez Lewis en el caso del acetato de plomo, y mayor alcalinidad en el caso del óxido de plomo (26); sin embargo, a diferencia del óxido de plomo, el acetato de plomo permitió una mayor conversión a MG, a medida que se aumentó la cantidad empleada de éste. Comportamiento que se funda en el informe de M.diSerio et al., 2005 (26) para la reacción de transesterificación, donde se mostró que la conversión se incrementó con la acidez del catalizador; particularmente el acetato de plomo exhibió una altísima acidez, medida en términos de las constantes de estabilidad en la formación de complejos con dibenzoilmetano (log βDBM=9.8)(27, 28). Además, el acetato de plomo presentó mayor solubilidad en la mezcla de reacción que los otros catalizadores, los cuales pudieron sufrir envenenamiento debido a la formación de jabones metálicos en presencia de los ácidos grasos libres y el agua contenidos en el aceite.
Según los resultados, los mejores catalizadores para la reacción de glicerólisis con aceite de ricino fueron el acetato y el óxido de plomo. De esta manera, los criterios para seleccionar el catalizador fueron: i) mayores % de MG producidos, ii) menor tiempo de reacción empleado, iii) los que no requirieron ser neutralizados al terminar la reacción, iv) recomendación de la literatura para las reacciones de alcohólisis.
Determinación de las mejores condiciones para la reacción de glicerólisis
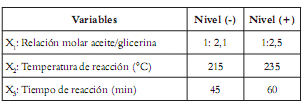
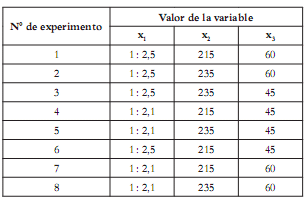
A partir de los resultados se desarrolló una segunda etapa experimental, donde se emplearon glicerina USP y los dos catalizadores que produjeron mayores concentraciones de MG: acetato de plomo y óxido de plomo. Como la concentración de MG obtenida al variar la cantidad de los catalizadores de plomo no mostró una tendencia definida ni una gran variación, se decidió trabajar con la concentración media de catalizador (0,025%), que arrojó buenos resultados. Las variables de entrada para esta etapa fueron: la relación molar aceite-glicerina, la temperatura y el tiempo de reacción. Se siguió un diseño factorial 23. Para cada variable se establecieron dos niveles, como se indica en las tablas 2 y 3, que se aplicaron para cada catalizador.
Tabla 2. Rango de variables.
Tabla 3. Matriz de diseño factorial.
Para evitar errores debidos al ruido experimental, las pruebas se realizaron aleatoriamente.
El límite inferior para la relación molar aceite/ glicerina fue la relación estequiométrica para la reacción de glicerólisis (1:2); sin embargo, se trabajó con un ligero exceso de glicerina que permitiera orientar la reacción hacia los productos (1:2,1). El límite superior para esta relación fue de (1:2,5), que garantizó un exceso de glicerina mayor, pero sin llegar a tal magnitud que ocasionara incremento en los costos de la reacción.
Los niveles seleccionados para la temperatura fueron cercanos a los de la primera etapa y cubrieron los rangos recomendados en la literatura para estos catalizadores; se trabajó a 215°C y a 235°C. De igual manera, se trabajó con tiempos de reacción cercanos a los recomendados en la literatura, 45 min y 60 min.
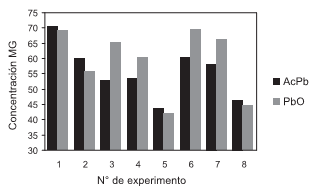
Los efectos analizados y derivados del diseño factorial permitieron establecer cómo afectó cada factor de entrada a la variable de respuesta para los dos catalizadores empleados, y se indican en la figura 4. El factor que causó un mayor cambio en la concentración del MG obtenido fue la variación en la relación aceite/glicerina de 1:2,5 a 1:2,1, manteniendo constantes la temperatura y el tiempo de reacción, lo cual desfavoreció la producción del MG para ambos catalizadores (Exp: 1 y 7, 2 y 8, 3 y 5). Variar el tiempo de reacción, de 45 min a 60 min, manteniendo constantes la relación aceite/glicerina y la temperatura favoreció la producción de MG (Exp: 6 y 1, 4 y 7, 5 y 8). El cambio en la temperatura, de 215ºC a 235ºC, tuvo efecto negativo, disminuyendo la producción de MG (Exp: 1 y 2, 6 y 3, 4 y 5, 7 y 8), debido a la posible formación de poligliceroles.
Figura 4. Concentraciónde MG (%) obtenido a partir de aceite de ricino en función de la relación molar aceite/glicerina, la temperatura y el tiempo de reacción, correspondientes a las condiciones de cada experimento indicadas en la tabla 3
De acuerdo con estos resultados, las mejores condiciones de reacción para la producción de MG fueron: i) catalizador: acetato de plomo u óxido de plomo, ii) relación aceite/glicerina: la más alta, 1:2,5, iii) temperatura: la más baja, 215ºC, iv) tiempo: el más alto, 60 min.
Monoglicéridos procedentes de la glicerina cruda subproducto del proceso de producción de biodiesel
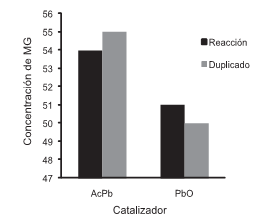
Finalmente, se evaluó la reacción de glicerólisis empleando glicerina cruda procedente del proceso de producción de biodiesel del aceite de palma y usando las mejores condiciones de reacción encontradas en la etapa anterior: relación aceite/glicerina 1:2,5, temperatura: 215°C, tiempo de reacción 60 min, y cantidad media de catalizador (0,025%). Los experimentos se ejecutaron por duplicado, como se indica en la figura 5.
Figura 5. Concentración (%) de MG obtenidos de la reacción de aceite de ricino y glicerina cruda.
Los resultados mostraron que es posible obtener conversiones importantes hacia los MG empleando la glicerina cruda procedente del proceso de producción de biodiesel. La reacción catalizada con acetato de plomo potenció la reacción hasta valores de concentración de MG menores de 55%, en contraste con los resultados empleando glicerina USP, donde se alcanzaron valores alrededor del 70%, tal como se indican en las figuras 4 y 5, probablemente debido a la formación de jabones. En el caso del óxido de plomo, produjo MG con una concentración de alrededor del 50%, debido, tal vez, a la mayor probabilidad de envenenamiento por ser más susceptible a la formación de jabones con los ácidos grasos libres, y a la presencia de agua en la glicerina cruda; además, fue más insoluble que el acetato, por lo que su conversión fue menor.
CONCLUSIONES
Los catalizadores que presentaban el catión plomo en su estructura fueron más activos que los catalizadores con cationes Na+, K+ Y Ca2+, debido principalmente a su mayor electronegatividad. La relación molar aceite/glicerina fue un factor determinante para alcanzar valores altos de MG en tiempos cortos de reacción, y el mejor valor fue la relación de 1:2,5. Se alcanzaron concentraciones medias importantes de MG cuando se empleó la glicerina cruda procedente del proceso de fabricación de biodiesel de palma, usando catalizadores como el acetato y el óxido de plomo. Este resultado es importante porque la glicerina cruda tiene un costo mucho menor que la refinada. Un factor limitante en el proceso de formación de MG fue la presencia de ácidos grasos libres, que envenenaron los catalizadores.
AGRADECIMIENTOS
Este trabajo se realizó gracias al apoyo de la Universidad de Antioquia, del SENA y del Ministerio de Agricultura y Desarrollo Rural a través de los proyectos: Producción de mono y diglicéridos a partir de glicerina obtenida como subproducto en los procesos industriales que usan aceites vegetales. Diseño y evaluación técnica para la producción de tensoactivos y Valoración de la glicerina obtenida en la producción de biodiesel.
REFERENCIAS BIBLIOGRÁFICAS
1. Corma A, Abd Hamid S, Iborra S and Velty A. Lewis and Brönsted basic active sites on solid catalysts and their role in the synthesis of monoglycerides. J Catal. 2005 sep 10; 234 (2): 340–347. [ Links ]
2. Corma A, Iborra S, Miquel S and Primo J. Catalysts for the Production of Fine Chemicals. J Catal. 1998 Jan 25; 173 (2): 315–321. [ Links ]
3. Yang Y, Shaik R and Yi-Hsu J. A Process for Synthesizing High Purity Monoglyceride. J Chin Inst Chem Engrs. 2003; 34 (6): 617-623. [ Links ]
4. Bailey, Alton. Industrial oil and fat products. 2 ed. Estados Unidos: Interscience; 1951. 967 p. [ Links ]
5. Fischer, W. Production of High Concentrated Monoglyceride. En: DGF-Symposium in Magdeburg. Germany: UIC, GmbH; 1998. Pp. 2-14. [ Links ]
6. Katsuki T, Sharpless B. The First Practical Method for Asymmetric Epoxidation. J Am Chem Soc. 1980 Aug; 102 (18): 5974-5976. [ Links ]
7. Ii Yu C, Lee Y, Cheon B, Lee S. Synthesis of Glycerol Monostearate with High Purity. Bull Korean Chem Soc. 2003; 24 (8): 1229-1231. [ Links ]
8. Cardoso R, Gonçal ves V, Rodri gues R, Mot a C. Nova Metodologia de Obtenção do Carbonato de Glicerina [Internet]. Brazil: Universidade Federal do Rio de Janeiro, Instituto de Química. [updated 2010 Apr 22 cited 2010 May 26]; Available from: ht t p: // www.biodiesel. gov.br/docs/congresso2007/ coproduto/15.pdf. [ Links ]
9. Claude S, Mouloungui Z, Yoo J, Gaset A, inventors; Organisation, Nationale Interprofessionnelle Des Oleagineux- Onidol (12, avenue George V, Paris, 75008, FR), assignee. Process for the preparation of glycerol carbonate. European patent EP 0955298. 2001 Nov 14. [ Links ]
10. Garcia R, Besson M, Gallezot P. Chemoselective catalytic oxidation of glycerol with air on platinum metals. Appl Catal A-Gen. 1995 Jun 22; 127 (1-2): 165–176. [ Links ]
11. Norman O, Sonntag V. Glycerolysis of fats and methyl esters Status, review and critique. J Am Oil Chem Soc. 1982 Oct; 59 (10): 795A-802A. [ Links ]
12. Patton TC. Alkyd resin technology, formulating techniques and allied calculations. Manual # 8. New York: Interscience; 1962. 197 p. [ Links ]
13. Cortés A, Mora R, Vargas J. Inmovilización de lipasas: Estudio de la actividad catalítica en la esterificación de ácidos grasos [Internet]. Bogotá: Universidad Nacional de Colombia. [updated 2010 Apr 22 cited 2010 May 26]; Available from: http://www.ciiq. org/varios/peru_2005/Trabajos/I/2/1.2.11.pdf. [ Links ]
14. Dudley SBT, inventor; Boake Roberts and Company Ltd, assignee. Production of fatty acid monoglycerides. United States patent US 2789119. 1957 Apr 16. [ Links ]
15. Corma A, Iborra S, Miguel S, Primo J, inventors; Universidad Politécnica de Valencia, apoderado. Procedimiento y catalizadores para la obtención selectiva de ésteres de ácidos grasos. Patente Española de Invención ES 2124166. 1999 Sept 16. [ Links ]
16. Pérez-Pariente J, Diaz I, Mohino F, Sastre E. Selective synthesis of fatty monoglycerides by using functionalised mesoporous catalysts. Appl Catal A-Gen. 2003; 254 (2): 173–188. [ Links ]
17. Pouilloux Y, Abro S, Vanhove C, Barrault J. Reaction of glycerol with fatty acids in the presence of ion-exchange resins: Preparation of monoglycerides. J Mol Catal A-Chem. 1999 Dec 15; 149 (1-2): 243-254. [ Links ]
18. Dupont P, Lefebvre F. Esterif ication of propanoic acid by butanol and 2-ethylhexanol catalyzed by heteropolyacids pure or supported on carbon. J Mol Catal A-Chem. 1996 Dec 23; 114 (1-3): 299-307. [ Links ]
19. OBrien R. Fats and Oils. Formulating and Processing for Applications. 2 ed. Estados Unidos: CRC Press LLC; 2004. 592 p. [ Links ]
20. Shahidi, F. Baileys industrial oil and fat products: industrial and nonedible products from oils and fats. 6 ed. v.6. Estados Unidos : Wiley Interscience; 2005. 519 p. [ Links ]
21. Ferreira G, de Macedo N, Severino L, de Souza T y Pedrosa M. A Cultura da Mamona no Cerrado: Riscos e Oportunidades. Documentos 149 [Internet]. Brasil: Ministerio da Agricultura, Pecuaria e Abastecimento. [updated 2006 Apr 22 cited 2010 May 26]; Available from: http://www.infoteca.cnptia.embrapa. br/handle/CNPA/18324 [ Links ]
22. Ogunniyi D. Castor oil: a vital industrial raw material. Bioresource Technol. 2006 Jun; 97 (9): 1086-1091. [ Links ]
23. Correa S. Higuerilla alternativa productiva, energética y agroindustrial para Colombia [Internet]. Colombia: Centro de Investigaciones CORPOICA- La Selva. [updated 2010 Apr 22 cited 2010 May 26]; Available from: http://www.biodisol.com/ biocombustibles/higuerilla-alternativa-productiva-energeticay-agroindustrial-para-colombia-biocombustibles-cultivos- energeticos/ [ Links ]
24. Division of Toxicology and Environmental Medicine. Estudios de Caso en Medicina Ambiental (CSEM). La toxicidad del plomo ¿Cuáles son las normas de niveles de plomo en Estados Unidos? [Internet]. Estados Unidos: Agency for Toxic Substances and Disease Registry. [updated 2007 Aug 20 cited 2010 May 13]; Available from: http://www.atsdr.cdc.gov/es/csem/plomo/es_pbnormas.html. [ Links ]
25. Birnbaum H, Lederer J, inventors; Hachmeister Inc, assignee. Process for producing monoglycerides of fatty acids. United States patent US 3102129. 1963 Aug 27. [ Links ]
26. Di Serio M, Tesser R, Dimiccoli M, Cammarota F, Nastasi M, Santacesaria E. Synthesis of biodiesel via homogeneous Lewis acid catalyst. J Mol Catal A-Chem. 2005 Sep 14; 239 (1-2): 111–115. [ Links ]
27. Di Serio M, Apicella B, Grieco G, Iengo P, Fiocca L, R. Po, et al. Kinetic and catalytic aspects of dimethylterephtalate transesterification also through the use of model molecules. J Mol Cat A-Chem. 1998 Apr 3; 130 (3): 233-240. [ Links ]
28. Di Serio M, Cozzolino M, Tesser R, Patrono P, Pinzari F, Bonelli B, et al. Vanadyl phosphate catalysts in biodiesel production. Appl Catal A-Gen. 2007 Mar 22; 320: 1-7. [ Links ]
Recibido: Abril 15 de 2009; Aceptado: Junio 01 de 2010
* Autor a quien debe dirigir la correspondencia: larios@udea.edu.co.