Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.2 Medellín May/Aug. 2010
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
ACTIVIDAD BACTERICIDA DEL EXTRACTO ETANÓLICO Y DEL ACEITE ESENCIAL DE HOJAS DE Rosmarinus officinalis L. SOBRE ALGUNAS BACTERIAS DE INTERÉS ALIMENTARIO
BACTERICIDAL ACTIVITY OF ETHANOLIC LEAF EXTRACT AND LEAF ESSENTIAL OIL OF Rosmarinus officinalis L. ON SOME FOODBORNE BACTERIA
Hader I. CASTAÑO P. 1*; Gelmy CIRO G.2; José E. ZAPATA M.2; Silvia L. JIMÉNEZ R2
1Grupo COINDE. Facultad de Administración. Politécnico Colombiano Jaime Isaza Cadavid. A.A. 4932. Medellín, Colombia. 2Grupo de Ofidismo y Escorpionismo. Universidad de Antioquia. A.A.1226. Medellín, Colombia.
RESUMEN
En este trabajo se evaluó la actividad bactericida y se determinó la Concentración Inhibitoria Mínima (CIM) del extracto etanólico y del aceite esencial de hojas de Rosmarinus officinalis L. sobre microorganismos de interés alimentario: Escherichia coli, Staphylococcus aureus, Salmonella typhimurium, Shigella sonnei, Listeria monocytogenes, Pseudomonas aeruginosa, Bacillus cereus y Lactobacillus plantarum. El aceite esencial exhibió un amplio espectro de acción antimicrobiana tanto para bacterias Gram positivas como Gram negativas con CIM entre 512 – 4096 ppm. El extracto etanólico mostró actividad antimicrobiana contra las bacterias S. sonnei, S. typhimurium y L. monocytogenes con CIM de 1024 ppm. La nisina, utilizada como control positivo, ocasionó una inhibición del crecimiento de todas las bacterias evaluadas con CIMs entre 2 y 1024 ppm, mientras que los conservantes usados comúnmente en la industria de alimentos presentaron una actividad antimicrobiana menor que la encontrada con el aceite esencial de R. officinalis.
Palabras Clave:Rosmarinus officinalis, actividad bactericida, extractos vegetales, aceites volátiles.
ABSTRACTThis work evaluated the bactericidal activity and determinated the Minimum Inhibitory Concentration (MIC) of ethanolic extract and essential oil from Rosmarinus officinalis L. leaves on microorganisms of interest in food industry: Escherichia coli, Staphylococcus aureus, Salmonella typhimurium, Shigella sonnei, Listeria monocytogenes, Pseudomonas aeruginosa, Bacillus cereus and Lactobacillus plantarum. The essential oil showed a broad spectrum of antimicrobial action for both Gram positive and Gram negative bacteria with MICs between 512 - 4096 ppm. The ethanolic extract showed antimicrobial activity against S. sonnei, S. typhimurium and L. monocytogenes with a MIC of 1024 ppm. Nisin was used as positive control and showed a strong growth inhibition of all bacteria tested with MICs between 2 and 1024 ppm. Our result shows that preservatives commonly used in the food industry have lower antimicrobial activity than those found in essential oil from R. officinalis L. leaves.
Keywords:cheese, probiotics, cell survival.
Keywords: Rosmarinus officinalis, bactericidal activity, plant extracts, volatile oils.
INTRODUCCIÓN
La contaminación microbiológica es actualmente un riesgo para la salud debido a la resistencia de algunos microorganismos a los antibióticos convencionales (1) y a los conservantes sintéticos utilizados en la industria alimentaria, que en numerosos informes son considerados como responsables de ser cancerígenos y teratogénicos por su toxicidad residual. Por esta causa, ha aumentando la tendencia al uso de conservantes naturales, que han llegado a constituir una alternativa promisoria como fuente de sustancias con actividad antimicrobiana (2).
La busqueda de mayor conocimiento sobre la actividad antimicrobiana de las plantas en el sector farmacéutico y alimentario, ha despertado el interés para evaluar las propiedades del romero (Rosmarinus officinalis L.) dados los innumerables usos en el ámbito fitoterapéutico(3).
La especie vegetal Rosmarinus officinalis L. perteneciente a la familia Lamiaceae, y conocida popularmente como romero, es una especie originaria de la región mediterránea, rica fuente de metabolitos activos, esta planta es muy usada en la medicina tradicional por sus efectos digestivos, antiespasmódicos y carminativos (4).
El aceite esencial obtenido de sus hojas es considerado como un antimicrobiano natural que puede ser utilizado en la producción de nuevos agentes con actividad antimicrobiana para la industria farmacéutica y alimentaría (5). Su actividad contra algunas cepas patógenas ha sido reportada por varios autores (6-11). Se han realizado estudios in vitro con extractos de R. officinalis en los que se ha evaluado su actividad contra bacterias Gram positivas y Gram negativas. Rota et al., 2004 (12) evaluaron la actividad de R. officinalis contra Salmonella enteritidis, Salmonella typhimurium, Escherichia coli O157:H7, Yersinia enterocolitica, Shigella f lexneri, Listeria monocytogenes serovar 4b, y Staphylococcus aureus. Gutiérrez et al., 2008 (13), usaron el R. officinalis contra Bacillus cereus, Escherichia coli, Listeria monocytogenes y Pseudomonas aeruginosa. Klancnik et al., 2009 (14) evaluaron su actividad contra bacterias Gram positivas (Bacillus aureus y Staphylococcus spp) y Gram negativas (Campylobacter jejuni y Salmonella spp). Lee et al., 2009 (15) probaron el R. officinalis contra S. typhimurium, Enterobacter sakazakii, E. coli O157:H7, S. aureus y L. monocytogenes. En el estudio de Moreira et al., 2005 (11) se identificó la actividad antimicrobiana del aceite esencial de hojas de R. officinalis contra varias cepas de E. coli, y Bozin et al., 2007 (8) encontraron que el aceite esencial de R. officinalis presenta una importante actividad antibacteriana contra cepas de E. coli, S. typhi, S. enteritidis y S. sonnei, además de poseer una notable actividad antifúngica contra Candida albicans, Trichophyton tonsurans, y Trichophyton rubrum. Estudios previos informan que el extracto de hoja de R. officinalis presenta actividad antimicrobiana contra bacterias Gram positivas: Leuconostoc mesenteroides, L. monocytogenes, S. aureus, Streptococcus mutans y B. cereus; y también actividad antifúngica contra Penicillium roqueforti y Botrytis cinerea (14).
Aunque existen estudios sobre actividad antimicrobiana de Rosmarinus officinalis L., son escasos los trabajos publicados sobre la CIM del mismo (11, 12, 14), así como el número de microorganismos evaluados. La determinación de la CIM es fundamental para evaluar la acción de cualquier sustancia como conservante de alimentos, y valorar su efecto sobre la inhibición de los microorganismos sin afectar las características sensoriales del producto que se desea conservar.
Por otra parte, la mayoría de los estudios de actividad antimicrobiana del extracto etanólico y del aceite esencial de romero, realizados a la fecha, han utilizado modelos donde se compara su actividad contra la de los antibióticos convencionales (8-9). Este modelo no es extrapolable a aplicaciones de conservación de alimentos. Por esa razón es de especial importancia adelantar investigaciones que permitan valorar la actividad antimicrobiana específica del romero, comparándola con la de los conservantes aceptados por la legislación vigente en alimentos, y así, participar en la búsqueda de nuevos conservantes de alimentos de origen natural.
En el presente trabajo se ha evaluado la actividad bactericida y se ha determinado la Concentración Inhibitoria Mínima (CIM) del extracto etanólico y del aceite esencial de hojas de Rosmarinus officinalis L. sobre microorganismos de interés alimentario: E. coli, S. aureus, S. typhimurium, S. sonnei, L. monocytogenes, P. aeruginosa, B. cereus y L. plantarum, comparando la actividad antimicrobiana de las dos presentaciones de R. officinalis (aceite y extracto etanólico ) con la de algunos conservantes sintéticos convencionales: nisina, ácido benzoico, ácido sórbico, sorbato de potasio y benzoato de sodio.
MATERIALES Y MÉTODOS
Obtención del material vegetal
El romero fue adquirido en un mercado local de la ciudad de Medellín, identificado y clasificado por el Herbario de la Universidad de Antioquia como Rosmarinus officinalis L. Las hojas se secaron en estufa convencional a temperatura de 37 ± 0,2°C durante 48 h.
El extracto de hojas de romero se obtuvo sometiendo él material vegetal seco a un proceso de extracción con etanol al 95% durante 48 h. Posteriormente fue concentrado en un rotavapor (Büchi R-124) y por último se liofilizó y almacenó a 4 ± 0,2°C.
El aceite esencial de romero se extrajo de las hojas deshidratadas, por destilación de arrastre con vapor de agua. El aceite obtenido se almacenó en refrigeración a una temperatura de 4 ± 0,2°C hasta el momento de su uso.
Cepas bacterianas
Los microorganismos utilizados para los ensayos fueron: Escherichia coli ATCC 8739, Staphylococcus aureus ATCC 6538, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Listeria monocytogenes ATCC 7644, Pseudomonas aeruginosa ATCC 9027, Bacillus cereus ATCC 11778 y Lactobacillus plantarum ATCC 8014.
Curva de crecimiento de los microorganismos
Se realizó curva de crecimiento para los microorganismos en estudio con el objetivo de identificar sus fases y establecer el tiempo para alcanzar la fase de crecimiento exponencial.
Concentración Inhibitoria Mínima (CIM) del extracto y del aceite esencial
Para la evaluación de la CIM del extracto etanólico y del aceite esencial de hoja de R. officinalis fue utilizado el método colorimétrico de microdilución en caldo propuesto por Abate et al., 1998 (6), con algunas modificaciones.
La CIM fue realizada en microplatos de 96 pozos fondo plano marca Falcon (Becton Dickinson Labware® U.S.A.). Inicialmente, se realizaron diluciones seriadas en DMSO (Merck®, U.S.A.) del extracto etanólico y del aceite esencial de hojas de romero, en un rango de concentraciones d 1 hasta 4096 ppm, y se sembraron en los pozos de una fila a los cuales les fue adicionado el medio de cultivo caldo Müeller-Hinton (Merck®, U.S.A.). El inoculo se obtuvo de un cultivo en crecimiento exponencial, se tomó una alícuota y la absorbancia se ajustó a 0,5 McFarland (lo que corresponde a aproximadamente 1,5x108 ufc/mL), y se utilizó para inocular las microplacas. La incubación se realizó a 37°C durante 4 h. Como controles positivos se usaron nisina, ácido benzoico, ácido sórbico, sorbato de potasio y benzoato de sodio, los cuales fueron evaluados a concentraciones desde 1 hasta 1024 ppm y como control negativo DMSO (Merck®, U.S.A.). Cada muestra se evaluó por triplicado.
Después de las 4 h de incubación se adicionó el bromuro de 3-(4,5- dimetiltiazol-2-ilo)-2,5difeniltetrazol (MTT) (Alfa Aesar®, U.S.A.) (0.8 mg/mL) a cada uno de los pozos y la placa se incubó a 37ºC 1/h, permitiendo a los microorganismos viables metabolizar el MTT. Un cambio de color de amarillo a azul intenso indica crecimiento del microorganismo, por consiguiente la CIM es la concentración mínima del extracto donde no se evidencia ningún cambio de color (6,16). Finalmente, los pozos que no presentaron cambio de color se repicaron en agar Müeller-Hinton para corroborar la ausencia de bacterias viables en ellos.
RESULTADOS Y DISCUSIÓN
Curvas de crecimiento de microorganismos
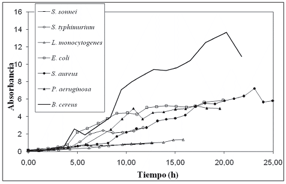
En la figura 1 se pueden observar los resultados de la evaluación del crecimiento de las bacterias usadas en esta investigación. La fase exponencial para las bacterias: E. coli, B. cereus y P. aeruginosa comienza a las 5 h de incubación y concluye a las 8 h, cuando inicia la fase estacionaria. Las bacterias S. typhimurium, S. sonnei y L. monocytogenes exhiben un crecimiento más rápido; a las 2 h se alcanza la fase de crecimiento exponencial y a las 5 h inicia la fase estacionaria, mientras que S. aureus, requiere un tiempo de incubación de 9 h para alcanzar la fase exponencial. Esta información permite establecer el momento oportuno para la evaluación de la actividad antimicrobiana del extracto etanólico y del aceite esencial de hoja de R. officinalis (6).
Figura 1. Curvas de crecimiento de las bacterias utilizadas en este estudio para evaluar la CIM de extractos de R. officinalis
Concentración Inhibitoria Mínima (CIM) de las dos formas de R. officinalis
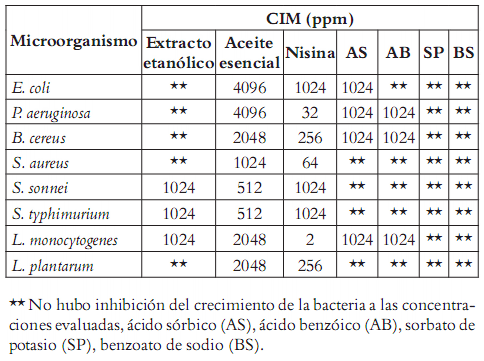
El aceite esencial de hojas de romero (R. officinalis) exhibió un amplio espectro de acción antimicrobiana tanto para bacterias Gram positivas como Gram negativas. En la tabla 1 se puede apreciar que la actividad del aceite esencial es mayor contra las bacterias Gram negativas que contra las Gram positivas evaluadas en este estudio. La inhibición del crecimiento de E. coli se alcanzó a una concentración de 4096 ppm, mientras que para S. sonnei y S. typhimurium fue a 512 ppm. Estos resultados concuerdan con lo encontrado por Moreira et al., 2005 (11), quienes demostraron la actividad antimicrobiana del aceite esencial de hojas de R. officinalis contra varias cepas de E. coli, con halos de inhibición entre 18 y 21 mm; igualmente evaluaron la concentración inhibitoria mínima del aceite esencial sobre la cepa E. coli ATCC 25158 y determinaron una CIM de 0,6 mL/100 mL. El aceite esencial de romero, también mostró una apreciable actividad antibacteriana contra cepas de E. coli, S. typhimurium, S. enteritidis y S. sonnei, con halos de inhibición entre 19,8 y 25 mm para las cepas evaluadas, pero sin haber determinado las correspondientes CIMs (8).
Tabla 1. CIM del extracto y del aceite esencial de hoja de romero en ppm.
Sin embargo, los resultados de este estudio no coinciden con los reportados por Klancnik et al., 2009 (14), quienes observaron que las bacterias Gram positivas (B. cereus y S. aureus) fueron más sensibles que las Gram negativas (C. jejuni y Salmonella infantis) a la acción inhibitoria de extractos de Rosmarinus officinalis officinalis.
El aceite esencial de romero presentó actividad bactericida contra las Gram positivas: B. cereus, S. aureus y L. plantarum con CIM de 2048, 1024 y 2048 ppm, respectivamente. Bozin et al., 2007 (8) determinaron un halo de inhibición del aceite esencial sobre S. aureus de 17 mm. Burt et al., 2004 (17) realizaron la evaluación de la CIM del aceite esencial de romero contra S. typhimurium, B. cereus y S. aureus, obteniendo valores de 20000, 2000 y 8000 ppm, respectivamente.
Se puede apreciar que no existe una actividad selectiva del aceite esencial por algún tipo de bacteria en especial, sino que su acción, frente a los microorganismos evaluados, es de espectro amplio. Estos resultados están de acuerdo con los de Bozin et al., 2007 (8), pero no con los de Klancnik et al., 2009 (14).
El extracto etanólico de hoja de romero mostró actividad antimicrobiana contra las bacterias Gram negativas: S. sonnei y S. typhimurium con CIM de 1024 ppm. Con respecto a las bacterias Gram positivas, solamente fue activo sobre L. monocytogenes con una CIM de 1024 ppm, en contraste con los resultados obtenidos por Campo et al., 2000 (18), que reportaron actividad antimicrobiana contra bacterias Gram positivas del extracto etanólico de R. officinalis con una CIM de: 1% para L. mesenteroides; 0,5% para L. monocytogenes; 0,5% para S. aureus; 0,13% para S. mutans y 0,06% para B. cereus. Celiktas et al., 2007 (9) encontraron actividad antimicrobiana del extracto metanólico de romero sobre S. aureus, pero ninguna sobre P. vulgaris, P. aeruginosa, K. pneumoniae, E. feacalis, E. coli, S. epidermidis, B. subtilis y C. albicans.
La mayor sensibilidad de las bacterias Gram negativas con respecto a las Gram positivas y el mayor espectro de inhibición del aceite esencial de romero frente al extracto etanólico pueden ser explicados por los posibles mecanismos de daño a la membrana celular bacteriana debido el incremento de su permeabilidad y la afectación de su estructura. Este daño se genera por la desestabilización de la capa bilipídica debido a la interacción de los terpenos presentes en el aceite esencial, con las moléculas de la membrana (19).
En la tabla 1 se evidencia como la nisina, usada como control positivo, mostró una fuerte inhibición del crecimiento de todas las bacterias evaluadas mientras que el ácido sórbico inhibió el crecimiento de E. coli, P. aeruginosa, L. monocytogenes y B. cereus a una CIM de 1024 ppm, pero no mostró actividad contra las demás bacterias evaluadas. El ácido benzoico fue activo contra P. aeruginosa, L. monocytogenes y B. cereus a una CIM de 1024 ppm, el sorbato de potasio y el benzoato de sodio no inhibieron el crecimiento de las bacterias en las concentraciones evaluadas (1-1024 ppm). Para los conservantes (nisina, AS, AB, SP, BS) no se utilizaron concentraciones superiores a 1024 ppm, porque la legislación de alimentos no permite su uso a valores mayores a 1000 ppm, en aplicaciones alimentarías según la resolución 4125 de 1991 del Ministerio de Salud, hoy Ministerio de Protección Social (20).
El hecho de que algunos de los conservantes aprobados para alimentos no presenten inhibición a las concentraciones evaluadas, se puede explicar considerando que las condiciones de cultivo in vitro son ideales para el crecimiento microbiano. Por esta razón, estos resultados no deben extrapolarse a una matriz alimentaria específica sin realizar los estudios respectivos. En tal sentido, se ha encontrado que aceites esenciales de romero en concentraciones entre 0,25 ppm y 2,5 ppm, no presentaron efecto sobre Listeria monocytogenes en formulaciones de carne de cerdo picada conservada a 4°C por siete días (21). El efecto antioxidante de oleorresinas de romero es menor comparado con extractos de semillas de uva en patés de carne de cerdo cocida y posteriormente congelada a -18°C (22). El romero molido tiene un efecto inhibitorio sobre bacterias psicrotrofas, coliformes y Clostridium sp, y permite la extensión de vida útil en albóndigas de carne de pavo tratadas térmicamente, empacadas al vacío y mantenidas a 3°C (23). Las oleorresinas de romero permitieron la reducción de la oxidación pero no así la carga microbiana en carne de pollo molida y empacada en atmósfera modificada y de filetes cocidos y ahumados de bagre (24, 25). El efecto de extractos de romero (oleorresina), uva y pino sobre el crecimiento microbiano, los cambios en el color y la oxidación lipidica de carne de res, muestran que el extracto de romero sólo presenta efecto antioxidante, mientras que los extractos de las otras plantas también presentan efecto sobre el crecimiento de los microorganismos (26).
En la tabla 1 se indica la actividad bactericida del aceite esencial de hojas de R. officinalis contra todos los microorganismos evaluados. Los estudios de toxicidad de la planta (extracto) no han demostrado daños orgánicos en el biomodelo, pues la dosis letal (DL50) del extracto es superior a 2.000 mg/Kg de peso del animal (27), razón por la cual, se hace posible, postular su potencial como conservante de alimentos.
Efecto bactericida del extracto y del aceite esencial
Para confirmar el efecto bactericida obtenido en los pozos, donde no se presentó cambio de coloración durante la aplicación del método colorimétrico de microdilución en caldo, se trasladaron muestras a cajas con agar Müeller-Hinton, encontrando que en ningún caso se presentó crecimiento.
CONCLUSIONES
Las hojas de romero (Rosmarinus officinalis L.) contienen compuestos con clara actividad antimicrobiana sobre microorganismos de importancia en contaminaciones alimentarias, con un mayor espectro de acción el aceite esencial, que el extracto etanólico de la hoja.
El potencial de utilidad del aceite esencial de romero se evidencia considerando los bajos valores de CIM encontrados y la alta DL50 reportada para esta planta.
Es notable, además, el mayor efecto antimicrobiano in vitro del aceite esencial y del extracto etanólico de romero, con respecto a los conservantes químicos usados como control positivo, lo que justifica su potencial aplicación en la industria alimentaria. Se sugiere evaluar, en posteriores trabajos, la actividad antimicrobiana con los terpenos mayoritarios aislados del aceite esencial sobre los microorganismos evaluados y desarrollar estudios sobre matrices alimentarías específicas que permitan valorar el comportamiento in situ del aceite esencial y del extracto etanólico de hojas de romero (Rosmarinus officinalis L.), evaluando el efecto sensorial sobre el producto que se desea conservar y el efecto de los procesos de elaboración y de otros aditivos sobre la actividad antimicrobiana.
Con el objetivo de sustituir conservantes de naturaleza química en la industria de alimentos, el romero y en especial su aceite esencial, se convierten en una alternativa natural de conservación que aminora el riesgo toxicológico por el uso de conservantes sintéticos.
AGRADECIMIENTOS
A la Dirección de Investigación y Posgrados del Politécnico Colombiano Jaime Isaza Cadavid y a la Universidad de Antioquia por la financiación del proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Mimica-dukic N, Bozin B, Sokovic M, Mihajlovic B, Matavulj M. Antimicrobial and antioxidant activities of three Mentha species essential oils. Planta Med. 2003 May; 69 (5): 413-419. [ Links ]
2. Skandamis P, Koutsoumanis K, Fasseas K, Nychas G. Inhibition of oregano essential oil and EDTA on E. coli O157:H7. Ital J Food Sci. 2001; 13 (1): 65-75. [ Links ]
3. Tsai P, Tsai T, Hoa S. In vitro inhibitory effects of rosemary extracts on growth and glucosyltransferase activity of Streptococcus sobrinus. Food Chem. 2007;105 (1): 311-316. [ Links ]
4. Abutbul S, Goldhirsh G, Barazani O, Zilberg D. Use of Rosmarinus officinalis L. as a treatment against Streptococcus iniae in tilapia (Oreochromis sp.). Aquaculture. 2004 Sep; 238 (1-4): 97-105. [ Links ]
5. Mounchid K, Bourjilat F, Dersi N, Aboussaouira T, Rachidai A, Tantaoui-Elaraki A, et al.The susceptibility of Escherichia coli strains to essential oils of Rosmarinus officinalis and Eucalyptus globules. Afr J Biotechnol. 2005 Oct; 4 (10): 1175-1176. [ Links ]
6. Abate G, Mshana RN, Miorner H. Evaluation of a colorimetric assay based on 3-(4,5-dimethyl-2-yl)-2,5-diphenyl tetrazolium bromide for rapid detection of rifampin resistance in Mycobacterium tuberculosis. Int J Tuberc Lung D. 1998 Dec; 2 (12): 1011-1016. [ Links ]
7. Angioni A, Barra A, Cereti E, Barile D, Coïsson J, Arlorio M, et al. Chemical composition, plant genetic differences, antimicrobial and antifungal activity investigation of the essential oil of Rosmarinus officinalis L. J Agr Food Chem. 2004 Jun 2;52 (11): 3530 -3535. [ Links ]
8. Bozin B, Mimica-Dukic N, Samojlik I, Jovin E. Antimicrobial and antioxidant properties of rosemary and sage (Rosmarinus officinalis L. and Salvia officinalis L., Lamiaceae) essential oils. J Agr Food Chem. 2007;55 (19): 7879-7885. [ Links ]
9. Celitkas O, Hames E, Bedir E, Vardar F, Ozek T, Baser K. Antimicrobial activities of methanol extracts and essential oils of Rosmarinus officinalisL, depending on locations and seasonal variations. Food Chem. 2007 Sep 19; 100 (2): 553-559. [ Links ]
10. Gachkar L, Yadegari D, Rezaei M, Taghizadeh M, Astaneh S, Rasooli I. Chemical and biological characteristics of Cuminum cyminum and Rosmarinus officinalis essential oils. Food Chem. 2007;102(3): 898-904. [ Links ]
11. Moreira MR, Ponce AG, Del Valle CE, Roura SI. Inhibitory parameters of essential oils to reduce a foodborne pathogen. Food Sci Technol Int. 2005 Aug;38 (5): 565-570. [ Links ]
12. Rot a C, Carramiñana JJ, Buri l lo J, Herrera A. In vitro antimicrobial activity of essential oils from aromatic plants against selected foodborne pathogens. J Food Prot 2004 Jun; 67 (6): 1252-1256. [ Links ]
13. Gutierrez J, Barry-Ryan C, Bourke P. The antimicrobial efficacy of plant essential oil combinations and interactions with food ingredients. Int J of Food Microbiol. 2008 May 10; 124 (1): 91–97. [ Links ]
14. Klancnik A, Guzej B, Kolar M H, Abramovic H Y Moz Ina SS. In vitro Antimicrobial and Antioxidant Activity of Commercial Rosemary Extract Formulations. J Food Protec. 2009 Aug; 72 (8): 1744–1752. [ Links ]
15. Lee SY, Gwon SY, Kim SJ, Moon BK.Inhibitory effect of commercial green tea and rosemary leaf powders on the growth of foodborne pathogens in laboratory media and oriental-style rice cakes. J Food Prot. 2009 May;72 (5): 1107-1111. [ Links ]
16. Foongladda S, Roengsanthia D, Arjrattanakool W. Rapid and simple MTT method for rifampicin and isoniazid susceptibility testing of Mycobacterium tuberculosis. Int J Tuberc Lung D. 2002 Dec; 6 (12): 1118-1122. [ Links ]
17. Burt S. Essential oils: their antibacterial properties and potential applications in foodsa review. Int J Food Microbiol. 2004 Aug 1; 94 (2): 223-253. [ Links ]
18. Campo J, Amiot M, Nguyen-the C. Antimicrobial effect of rosemary extracts. J Food Protect. 2000 Oct; 63 (10):1359-1368. [ Links ]
19. Cox S, Gustafson J, Mann C, Markham J, Liew Y, Hartland R, et al. Tea tree oil causes K+ leakage and inhibition respiration in Escherichia coli. Lett Appl Microbiol. 1998 May; 26 (5): 355-358. [ Links ]
20. Colombia, Ministerio de Salud. Resolución 4125 de 1991, abril 5, por el cual se reglamenta el Título V Alimentos de la Ley 09 de 1979 en lo concerniente a los conservantes utilizados en alimentos. Bogotá: El Ministerio; 1991. [ Links ]
21. Carraminana JJ, Rota C, Burillo J, Herrera A. Antibacterial Efficiency of Spanich Satujera montana Essenial oil against Listeria monocytogenes among flora in Minced Pork. J Food Protec. 2008 Mar; 71 (3): 503-508. [ Links ]
22. Sasse A, Colindres P, Brewer MS. Effect of natural and synthetic antioxidants on the oxidative stability of cooked, frozen pork patties. J food Sci. 2008 Nov 7; 74 (1): S30-S35. [ Links ]
23. Karpinska-Tymoszczyk M. Effect of the addition of ground rosemary on the quality and shlef-life of turkey meatballs during refrigerated storage. Brit Poultry Sci. 2008 Nov; 49 (6): 742-750. [ Links ]
24. Keokamnerd T, Acton, JC, Han I Y, Dawson P. Effect of commercial Rosemary Oleoresin Preparations on Ground Chicken Thigh Meat Quality Packaged in a Oxygen atmosphere. Poultry Sci. 2008; 87 (1): 170-179. [ Links ]
25. Da Silva LV, Prinyawiwatkul W, King JM, No HK, Bankston JD, Ge B. Effect of preservatives on microbial safety and quality of smoked blue catfish (Ictyalurus furcatus) steaks during roomtemperature storage. Food Microbiol. 2008 Dec; 25 (8): 958-963. [ Links ]
26. Ahn J, Grun IU, Mustapha A. Effects of plants extract on microbial growth, color change and lipid oxidation in cooked beef. Food Microbiol. 2007 Feb; 24 (1): 7-14. [ Links ]
27. Anadón A, Martínez-Larrañaga MR, Martínez MA, Ares I, García-Risco MR, Señoráns FJ, et al. Acute oral safety study of rosemary extracts in rats. J Food Protec. 2008 Apr; 71 (4): 790795. [ Links ]
Recibido: Noviembre 26 de 2009; Aceptado: Junio 10 de 2010
* Autor a quien debe dirigir la correspondencia: hicastano@elpoli.edu.co