Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.3 Medellín Sept./Dec. 2010
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
CONSERVACIÓN DE FRESA (Fragaria x ananassa Duch cv. Camarosa) MEDIANTE LA APLICACIÓN DE RECUBRIMIENTOS COMESTIBLES DE GEL MUCILAGINOSO DE PENCA SÁBILA (Aloe barbadensis Miller) Y CERA DE CARNAÚBA
CONSERVATION OF STRAWBERRY (Fragaria x ananassa Duch cv. Camarosa) BY EDIBLE COATING APPLICATION OF SABILA GEL MUCILAGE (Aloe barbadensis Miller) AND CARNAUBA WAX
Jorge I. RESTREPO F.1; Iván D. ARISTIZÁBAL T.2
1 Departamento de Ingeniería Agrícola y de Alimentos. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Sede Medellín. A.A. 568. Medellín, Colombia. jirestrepof@unal.edu.co.
2 Departamento de Ingeniería Agrícola y de Alimentos. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Sede Medellín. A.A. 568. Medellín, Colombia.
RESUMEN
La fresa es un fruto de elevada aceptación entre los consumidores, y como cultivo ofrece una permanencia significativa durante todos los meses del año, con buen posicionamiento en sus precios. El objetivo de este estudio fue aumentar la vida útil de la fresa (Fragaria x ananassa Duch cv. Camarosa), mediante la aplicación de dos recubrimientos comestibles desarrollados a partir del gel mucilaginoso de penca sábila (Aloe barbadensis Miller) y cera de carnaúba. A partir de los resultados obtenidos se concluyó que el recubrimiento comestible de gel mucilaginoso de penca sábila condujo a un aumento en la vida útil de las fresas de por lo menos 10 días, con disminución de la pérdida de humedad, del índice de respiración, y conservación de la firmeza, sin ocasionar cambios perceptibles en el color, en comparación con los frutos utilizados como tratamiento control.
Palabras clave: recubrimiento comestible, fresa, Áloe vera, mucílago de penca sábila, vida útil, cera de carnaúba.
ABSTRACT
The strawberry is a well accepted fruit by consumers. Its culture presents a significant yield in all months of the year and enjoys a good price positioning. The objective of this study was to extend the strawberry (Fragaria x ananassa Duch cv. Camarosa) shelf life by applying two edible coatings developed from the Aloe vera (Aloe barbadensis Miller) mucilaginous gel and carnauba wax. From the results obtained it was concluded that the use of edible coatings from Aloe vera mucilaginous gel and carnauba wax led to an increase of at least ten days in the strawberry shelf life, with reduced moisture loss and respiration rate. Besides, conservation of firmness without showing noticeable changes in color was observed, in comparison to the fruits used as a control.
Keywords: edible coating, strawberry, Aloe vera, sabila mucilage, shelf life, carnauba wax.
INTRODUCCIÓN
La fresa (Fragaria x ananassa Duch cv. Camarosa), es un fruto no climatérico, muy delicado y tiene una vida útil muy corta (1). Por sus condiciones fisiológicas resulta muy susceptible a la pérdida de humedad (2) y al ataque por microorganismos, especialmente al hongo Botrytis cinerea (3, 4), que ocasiona grandes pérdidas durante su transporte y comercialización (5) porque disminuye los atributos de sabor, aroma y textura (6), afectando su calidad comercial y su atractiva frescura para el consumidor.
La conservación en frío es una práctica habitual para prolongar el período de almacenamiento de las frutas (7). En el caso de la fresa, la conservación en frío reduce la tasa de respiración y la pérdida de humedad y retarda el crecimiento microbiano (8-10), permitiendo extender la vida útil y conservar la calidad de la fruta. En Colombia, el empleo de frío está muy limitado por la ausencia de sistemas en cadena que garanticen bajas temperaturas para el producto, y por sus altos costos. Las fresas se cosechan a primeras horas del día, tres veces por semana y completamente maduras, para aprovechar al máximo su sabor y dulzor (11), teniendo cuidado especial de evitar daños mecánicos para su rápida comercialización a temperatura ambiente, con el propósito de obtener una reducción significativa en las pérdidas de manejo en poscosecha, que alcanzan niveles hasta del 50% en regiones tropicales (12, 13).
En la aplicación de tecnologías de empaque para fresa, el uso de atmósferas modificadas combinadas con frío ha contribuido significativamente a su conservación, ya que reduce la respiración debido a la baja presencia de O2 y el aumento de CO2 (14).
Por otro lado, en el mercado de grandes superficies se utilizan cajas termoformadas de poliestireno biorientado (BOPs) y bandejas de poliestireno expandido (EPS) recubiertas con vinilpel (película plástica extensible), almacenadas en refrigeración, con resultados prácticos de hasta tres días en condiciones con apariencia aceptable. Como alternativa a estos métodos de conservación tradicional surge la utilización de recubrimientos comestibles (RC) aplicando bajas temperaturas, como medio que permita reducir la velocidad de deterioro en los atributos de calidad de los frutos durante su almacenamiento (15).
Un recubrimiento comestible (RC) se define como la capa delgada formada por materiales comestibles depositada sobre la superficie del alimento con el propósito de extender su vida útil y proporcionarle una efectiva barrera contra los riesgos que generan las condiciones ambientales existentes (16, 17). Dicho recubrimiento puede estar constituido por materiales poliméricos, como proteínas o polisacáridos en solución hidrocoloide (18), que actúan como sistema mejorador de las propiedades mecánicas y de barrera. La inclusión de lípidos, ácidos grasos de cadena larga, resinas, aceites, ceras como carnaúba (CC), candelilla y cera de abejas (19) en emulsión, por su carácter lipofílico les permite actuar como barrera al vapor de agua, disminuyendo su permeabilidad a niveles intermedios y actuando como sistema regulador de la transpiración en vegetales (20-24). Su aplicación sobre frutos, actúa como sistema protector creando una atmosfera modificada que retrasa la senescencia en frutas climatéricas y no climatéricas, ayuda a conservar la apariencia, disminuye la transpiración, la pérdida de aromas y mejora la textura (25).
La penca de sábila (Aloe barbadensis Miller) se utilizó en civilizaciones antiguas con fines fitoterapéuticos. De ella existen en el mundo aproximadamente 300 especies, la más comercializada es la Barbadensis, que tiene gran acogida en el mercado y se utiliza como antioxidante, antiinflamatorio, estimulante de los procesos digestivos, activador del sistema inmunológico y cicatrizante (26). Concretamente, el gel mucilaginoso de Aloe vera, gracias a la actividad biológica de sus componentes, ha tenido diversas aplicaciones como ingrediente de alimentos funcionales (27), helados, bebidas a base de frutas (28), yogures, también en cosmetología y medicina, como antiviral, desinfectante, vermífugo y fungicida, entre otros (29-31).
El gel mucilaginoso está formado por agua en una proporción de 99,5% y el otro 0,5% corresponde a materia sólida que contiene una serie de compuestos, como vitaminas hidrosolubles y liposolubles, minerales, enzimas, polisacáridos, compuestos fenólicos y ácidos orgánicos (32).
Se ha evaluado la aplicación de Áloe vera como recubrimiento coméstible en cereza dulce y en uva de mesa, con resultados bastante satisfactorios con relación a la conservación de las características sensoriales, el control de la actividad respiratoria, la pérdida de humedad, el pardeamiento enzimático y la reducción en la proliferación de microorganismos a los 16 y 35 días respectivamente (33, 34).
Para el sector agroindustrial colombiano, el cultivo de Áloe vera representa una oportunidad 254 Vitae j. i. restrepo f. et al. bastante interesante como estrategia de desarrollo rural; su empleo en la industria va en aumento, lo que plantea la necesidad urgente de investigaciones que permitan nuevas alternativas de uso para sus componentes (35).
El propósito de esta investigación fue aumentar la vida útil de la fresa (Fragaria x ananassa Duch cv. Camarosa) mediante la aplicación de dos recubrimientos coméstibles desarrollados a partir del gel mucilaginoso de Aloe barbadensis Miller y cera de carnaúba, y empacadas en cajas de poliestireno biorientado (BOPs) termoformadas, perforadas, y conservadas en refrigeración a 5ºC ± 0,5ºC y humedad relativa de 75% ± 0,1 %, buscando así reducir las pérdidas de calidad que se producen durante el almacenamiento y la comercialización, sin afectar los atributos físicos y sensoriales de calidad de esta interesante fruta.
MATERIALES Y MÉTODOS
Materiales
Se utilizaron fresas (Fragaria x ananassa Duch cv. Camarosa) cultivadas en el municipio de Envigado (Antioquia – Colombia), recién cosechadas. Se clasificaron teniendo en cuenta la uniformidad en su grado de madurez, forma y tamaño (36), se transportaron al laboratorio, se desinfectaron en una solución de hipoclorito de sodio a 50 ppm y se almacenaron en condiciones de refrigeración a 5ºC ± 0,5ºC y humedad relativa media de 75% ± 0,1%. El extracto del gel mucilaginoso se obtuvo de hojas de Aloe barbadensis Miller, provenientes del municipio de Guarne (Antioquia-Colombia) y suministradas por el Centro de Acopio Agropaisa, de Marinilla (Antioquia-Colombia), con las siguientes características mínimas: 600 gramos de peso, 60 cm de largo y un espesor de 2 cm. La cera de carnaúba grado alimentario en escamas y el polisorbato 80 (monooleato de sorbitán) fueron adquiridos en la empresa Bell Chem Internacional S.A., el glicerol (99,5 %) fue suministrado por Andercol S.A.
Preparación del Recubrimiento Coméstible
Las hojas libres de abolladuras y cicatrices, se lavaron y desinfectaron en solución de hipoclorito de sodio a 50 ppm, posteriormente se pelaron para retirar mecánicamente el gel mucilaginoso, el cual se enjuagó con abundante agua potable. Se hicieron ensayos preliminares en los que se evaluaron diferentes concentraciones de gel mucilaginoso de en solución con agua destilada, en el rango del 10% P/P al 60% P/P, homogenizando a 18000 rpm por espacio de 5 minutos. Se vertieron las preparaciones sobre bandejas plásticas de superficie lisa y se secaron por convección, con aire caliente a 40°C durante 8 horas. Se seleccionó la concentración en la que la película presentaba mejores características de firmeza relacionadas con la formación de película en forma de escamas y se procedió a evaluar de manera cualitativa su adherencia, color y brillo, aplicándola en fresas almacenadas en refrigeración durante 10 días. A partir de los ensayos preliminares se selecciona la concentración de 50% p/v y se incluye en la formulación glicerol, para proporcionar al recubrimiento coméstible mayor plasticidad. Además, se diseñó un segundo recubrimiento correspondiente a una emulsión de gel mucilaginoso de y cera de carnauba y adición de surfactantes como estabilizantes del sistema. Para ambos recubrimientos coméstibles se practicaron las evaluaciones cualitativas descritas anteriormente. Los recubrimientos se aplicaron sobre fresas en las mismas condiciones de almacenamiento, con resultados muy satisfactorios en cuanto a la adherencia, el color, el brillo y la conservación de los frutos en el tiempo.
Finalmente, fueron formulados dos recubrimientos comestibles: el tratamiento M, gel mucilaginoso de sábila en agua con adición de 0,75% w/w de glicerol como plastificante, sometido a calentamiento a 90ºC durante 5 minutos y enfriamiento hasta alcanzar 25ºC; y el tratamiento C, que consistió en una fase oleosa formada por cera de carnauba al 0,1% w/w y una fase acuosa del recubrimiento M; ambas fases fueron sometidas a calentamiento por encima del punto de fusión de la cera, luego se adicionaron los surfactantes en concentración del 0,01% w/w y se homogenizó el sistema por cizalladura (con un equipo Waring Commercial, modelo WSB60®, durante 5 minutos, a 18.000 rpm). Una vez preparados, los dos recubrimientos se almacenaron en refrigeración a 5 ºC ± 0,5ºC y humedad relativa del 75% ± 0,1% hasta el momento de su aplicación.
Aplicación de recubrimientos coméstibles
Las fresas se sumergieron en los respectivos recubrimientos durante 30 s. Luego se secaron por convección con aire forzado durante 1 hora, a 20ºC. Como tratamiento control (Blanco: B) se utilizaron fresas sumergidas en agua destilada. Después del proceso de recubrimiento, las fresas se envasaron en cajas termoformadas, de poliestireno biorientado (BOPs), con perforaciones (15 frutos/ caja) y se almacenaron en una cava de refrigeración a 5ºC ± 0,5ºC y 75% ± 0,5% de humedad relativa durante 10 días. Se recubrieron frutos para los tres tratamientos (M, C, B) y tiempos de almacenamiento, con siete repeticiones para cada tratamiento y por triplicado. Para la cuantificación del peso y el índice de respiración se analizaron los días 1, 3, 5, 7 y 10, un total de 105 fresas; para los análisis fisicoquímicos de textura y color se utilizaron 63 fresas los días 0, 5 y 10. Finalmente, para el análisis sensorial se empleó un total de 270 frutos, 90 para cada día.
Microestructura
Se analizó la microestructura de la emulsión por microscopia electrónica de barrido (SEM), con un microscopio marca JEOL referencia JSM 5910 LV, en condiciones de vacío a 15 Pa, previo secado parcial de la muestra a temperatura ambiente durante 12 horas. Las micrografías fueron tomadas a 2000 X, con el fin de determinar el tamaño medio de la partícula grasa en la emulsión del recubrimiento.
Pérdida de peso
Las pérdidas de peso se determinaron por gravimetría mediante la diferencia entre pesos. Se tomó el peso inicial (Pi) menos el peso del fruto al final (Pf) del almacenamiento y los resultados se expresaron como porcentaje de pérdida de peso (%PP) mediante la siguiente ecuación:
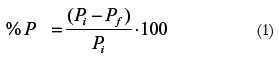
Firmeza
La firmeza se determinó utilizando un analizador de textura TA.XT2 (Stable Micro System®) y el software Texture Expert Excced® v 2.64. Se utilizó una sonda metálica de 5 mm de diámetro, a una velocidad de 5 mm/s y una deformación de 10 mm, sobre una de las caras, en la zona media de cada fruto. Los resultados se expresaron en gramos fuerza, gf.
Análisis fisicoquímicos
Después del análisis de firmeza las fresas se desintegraron. De cada fresa se pesaron 10 g de pulpa que se homogenizaron en 100 mL de agua destilada a 20ºC. Se midió el pH con un potenciómetro marca Schott® modelo CG840B; la cantidad de sólidos solubles expresado en ºBrix, se determinaron con un refractómetro marca ATAGO® modelo HSR500 en una escala de 0 a 42%. El % de acidez se determinó por volumetría, titulando el sobrenadante con NaOH 0,1N y fenoltaleína como indicador. Los resultados se expresaron como % de ácido cítrico (37).
Mediciones de color
Para la determinación del color del epicarpio se practicaron tres mediciones en la zona ecuatorial de cada fruto utilizando un espectrocolorímetro marca X-RITE®, modelo SP64, iluminante D65, y el observador estándar de 10º como sistema de referencia, obteniendo las coordenadas de color L*, que es el indicador de la luminosidad, a* (cromaticidad (-) verde a (+) rojo) y b* (cromaticidad (-) azul a (+) amarillo), con las cuales se calcularon las diferencias de color ΔE* (38, 39):
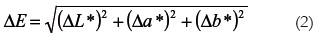
Donde ΔL*, Δa* y Δb* representan las diferencias entre los parámetros de color de los frutos recubiertos y de los frutos control, tomados como referencia el día cero (inicio del almacenamiento).
Índice de respiración
El índice de respiración se determinó a partir del método citado por Márquez et al., 2007 (40) para tomate de árbol, expresado como mg de CO2/h•kg, que se fundamenta en la modificación del método químico de Pettenkoffer, consistente en neutralizar el CO2 producto de la respiración del fruto con NaOH (0,1 N), determinando la cantidad de H2CO3 a partir de la diferencia de concentraciones de la solución de NaOH inicial (0,1 N) y la concentración de NaO H parcialmente neutralizada; obteniendo la cantidad de CO2 por métodos estequiométricos a partir del H2CO3. Para este análisis se pesaron 6 frutos por cada uno de los tratamientos, y se introdujeron 1 hora en la cámara de respiración para cada día (1, 3, 5, 7 y 10), respectivamente.
Análisis sensorial
La valoración sensorial se llevó a cabo con un panel compuesto por 7 jueces entrenados. La prueba utilizada fue un perfil sensorial por aproximación 256 Vitae j. i. restrepo f. et al. multidimensional para tres tratamientos, en el que, por medio de una escala descriptiva se cuantificó, teniendo en cuenta la Norma Técnica Colombiana 3932 (41), donde 0 corresponde a ausente, 1 a leve intensidad, y 5 a muy intenso. Para efectos del estudio se definió 3 como el límite inferior de aceptación de los frutos tratados. Se evaluaron atributos de olor, firmeza, sabor y color para los tiempos 0, 5 y 10 días de almacenamiento.
Análisis estadístico
Se utilizó el análisis de varianza (ANOVA) y el método LSD (mínimas diferencias significativas) de comparaciones múltiples, con un nivel de confianza del 95% (α = 0,05), para evaluar el efecto de los recubrimientos comestibles en las variables de respuesta antes descritas. Para estos análisis estadísticos se utilizó el paquete estadístico STATGRAPHICS PLUS® versión 5.1.
RESULTADOS Y DISCUSIÓN
Micrografía
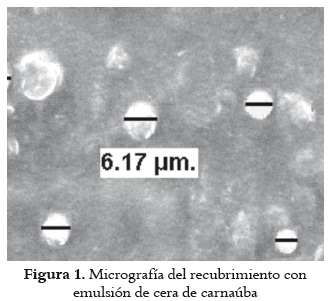
El tamaño de las gotas de cera es de gran importancia para evaluar la estabilidad física de la emulsión, ya que influye directamente en la velocidad de agregación, por fenómenos como la coalescencia, la sedimentación y la floculación (42).
En la figura 1 se presenta la micrografía a 2000 aumentos del recubrimiento en emulsión y un tamaño promedio de gotas de cera de carnaúba de 6,17 μm.
Pérdida de peso
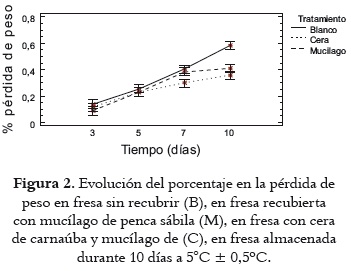
El ANOVA no mostró diferencias estadísticas (P>0,05) en la pérdida de peso %PP de las fresas recubiertas con respecto al tratamiento control B a los 3 y 5 días de almacenamiento, como se puede apreciar en la figura 2. Sin embargo, a los 7 y 10 días de almacenamiento presentaron menor %PP las fresas del tratamiento C (0,35%) y del tratamiento M (0,40%) frente al control (0,58%). Esto podría explicarse por la acción de barrera que ejercen el mucílago y la cera de carnaúba frente a la difusión del vapor de agua (43). Estos resultados están acordes con las comunicaciones de Martínez et al., 2006 (33) para un recubrimiento coméstible de Áloe vera evaluado en cereza.
Firmeza
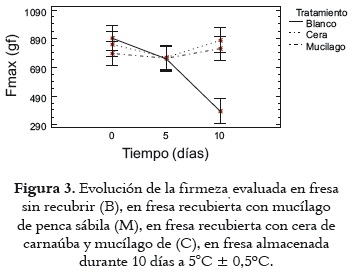
El ANOVA no reveló diferencias significativas (P> 0,05) por efecto del factor tiempo en la firmeza de las fresas recubiertas con mucílago de penca sábila M y con la emulsión de cera de carnaúba C, como se indica en la figura 3. Tanto el ANOVA como la prueba LSD mostraron, la mayor firmeza, a los 10 días de almacenamiento, entre 850 gf y 880 gf, en las fresas recubiertas con tratamiento C y M, respectivamente, mientras que en las fresas no recubiertas (tratamiento B), la firmeza se redujo a niveles de 390 gf, debido, muy probablemente, a la mayor migración de vapor de agua en la superficie del fruto, que favorece el crecimiento de moho gris. Este moho ocasiona daños estructurales a los tejidos y permite su ablandamiento (44, 45). Cabe destacar también que para este caso la disminución de la firmeza se encuentra relacionada con el aumento en el % de pérdida de humedad en los frutos sin recubrimiento. La leve disminución en la firmeza, que se observó durante los primeros 5 días de almacenamiento en los tres tratamientos evaluados podría relacionarse con la degradación del parénquima cortical que forma la pared celular debido a procesos de degradación enzimática (46) y a la misma pérdida de humedad durante el almacenamiento. Los resultados obtenidos para la firmeza coinciden con los que comunican Han et al., 2004 (47) sobre un recubrimiento coméstible a base de quitosano, y con los de Del Valle et al., 2005 (48), que experimentaron con un RC de mucílago de cactus, todos ellos sobre fresa.
Fisicoquímicos
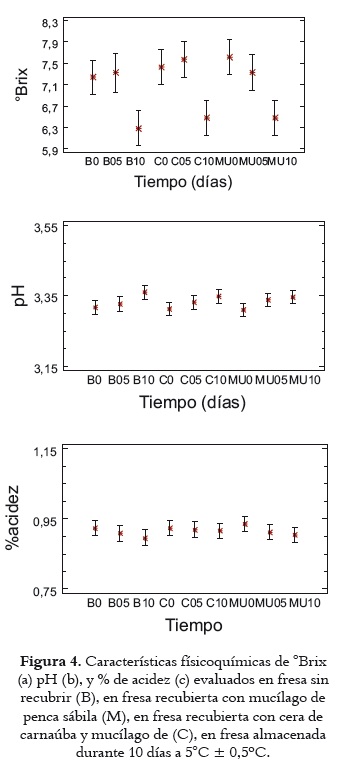
Como se observa en la figura 4a, el ANOVA para los sólidos solubles (°Brix) de las fresas recubiertas con mucílago y con cera de carnaúba, frente al de los frutos control no reveló diferencia estadísticamente significativa (p>0,05) en los días 0 y 5 de almacenamiento, por efecto de los factores tratamiento y tiempo, y halló un rango de valores medios entre 7,22 y 7,80 °Brix. Ahora, el ANOVA y la prueba LSD demuestran que los recubrimientos coméstibles frente al control no mostraron efecto significativo en el contenido de sólidos solubles a los 10 días de almacenamiento; sin embargo, se advierte un descenso importante en los °Brix, que marca una diferencia estadísticamente significativa (p<0,05) con respecto a los 0 y 5 días de almacenamiento, lo que posiblemente encuentre explicación en el proceso normal de senescencia de los frutos (49), porque los azúcares resultantes de la hidrólisis de la sacarosa se utilizan como sustrato en reacciones metabólicas de respiración (50). Estos resultados difieren de los comunicados por Trejo et al., 2007 (51) sobre un recubrimiento coméstible a base de gelatina, aplicado sobre fresas almacenadas en refrigeración 13 días y coinciden con los de Tanada y Grosso, 2005 (52), en revelar una tendencia descendente para un recubrimiento coméstible de doble capa, compuesto por gluten y cera de abejas, aplicado sobre fresas (52).
Ahora, como puede observarse en la figura 4b, para el cambio del pH en función del tiempo de almacenamiento, se observó crecimiento a partir del día 5, y se apreciaron diferencias significativas (p<0,05) entre los tiempos 0 y 10 para la muestra referencia B, aunque los rangos de variación son mínimos. Los tratamientos C y M no exhibieron diferencias estadísticamente significativas (p>0,05), ni en el tiempo, ni entre ellos. Por otro lado, como se indica en la figura 4c, los resultados obtenidos para los tres tratamientos con respecto al % de acidez mostraron decrecimiento en función del tiempo, pero no se advirtieron cambios significativos (p>0,05) y no se observa un efecto del tratamiento en esta variable. En los tres tratamientos se observó la tendencia a la disminución de la acidez con el aumento del pH de los frutos, posiblemente debido a que, en el caso de los recubrimientos coméstibles, éstos ralentizan la frecuencia respiratoria de las fresas y retrasan la utilización de los ácidos orgánicos en la reacciones enzimáticas (53). Los resultados obtenidos sobre pH y acidez coinciden con los de diferentes estudios sobre la aplicación de recubrimientos coméstibles a base de quitosano, gelatina y gluten de trigo en fresas almacenadas en refrigeración (47, 51, 53).
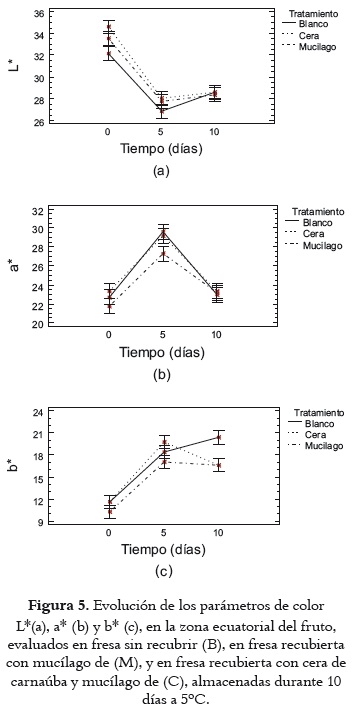
Color
La figura 5 exhibe los valores medios con intervalos LSD (95%) de las variables de color L*, a* y b*, en la zona ecuatorial de los frutos, durante el almacenamiento, evaluados a los 0, 5 y 10 días en fresas control (Blanco) y fresas recubiertas con mucílago y cerade carnaúba. En todos los casos se observan diferencias significativas (p<0,05) por efecto de los factores tiempo y tratamiento.
Como se puede apreciar en la figura 5a, El ANOVA encontró diferencia significativa en L* (p<0,05) por efecto de los tratamientos M y C con respecto al control B al tiempo 0. Por otra parte se hallaron diferencias significativas (p<0,05), por efecto del factor tiempo, entre el día cero y el grupo homogéneo formado por los días 5- 10, entre ellas el oscurecimiento de la piel del fruto (< L*) por oxidación y la pérdida de humedad que sufrieron las fresas durante el almacenamiento (52). Por último se encontró que la aplicación de recubrimiento coméstible no afectó la luminosidad de las fresas con respecto a la muestra control. Los resultados obtenidos coinciden con los de Hernández-Muñoz et al., 2006 (54).
En cuanto a la coordenada cromática a* (tonalidad rojiza de la epidermis de la fresa), el ANOVA no mostró diferencia estadística ni en el inicio ni al final del almacenamiento, cuando las mediciones se comportan como un grupo homogéneo, como puede apreciarse en la figura 5b. Comparando con los datos del día 5 se observa un notable incremento y posterior descenso en los valores de a*, con diferencia estadísticamente significativa (p<0,05) entre ambos. El aumento en la tonalidad de a* obedece a la pérdida de humedad durante el almacenamiento debido a la transpiración; y la disminución en el enrojecimiento probablemente se debe a un aumento de la actividad respiratoria y enzimática que ocasiona pérdida de calidad por pardeamiento oxidativo (48).
Como se observa en la figura 5c, entre el inicio y el día 5 del almacenamiento el ANOVA no mostró diferencia estadística (p>0,05) entre tratamientos en la coordenada cromática b* (tonalidad amarilla de la epidermis en la fresa). El día 10 se observó una notable disminución de b* en los frutos con recubrimeinto coméstible frente a los frutos control, y diferencia significativa (p<0,05) por efecto de los tratamientos con respecto al control, asociada con reacciones de pardeamiento enzimático (50, 55). Los valores obtenidos de a* y b* coinciden con los que registran Sanz et al., 1999 (1) para fresas frescas almacenadas en refrigeración, y con los de Del Valle et al., 2005 (48) para fresas recubiertas con mucílago de cactus y almacenadas en refrigeración.
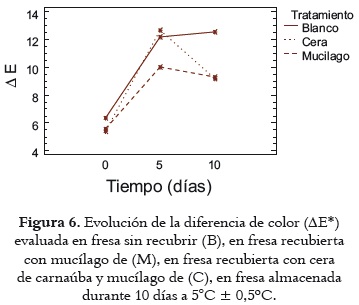
La figura 6 exhibe la diferencia de color (ΔE*) de los tratamientos C y M, en comparación con el tratamiento control B, durante el tiempo de almacenamiento, evaluada a los 0, 5 y 10 días.
Para el día 0, el ANOVA no reveló diferencia significativa (p>0,05) por efecto de los tratamientos M y C con respecto al control B, para el tiempo. Ahora, para el día 5, se registró un marcado incremento en los valores ΔE del control y del tratamiento C con respecto a M, con diferencias significativas (p<0,05) que pueden atribuirse a que el recubrimiento C presenta menor transparencia por tener cera de carnaúba en su composición (56), lo que aumenta las diferencias de color. Para el día 10 no se evidenció diferencia estadística (p>0,05) entre los tratamientos, que observan un comportamiento muy similar, pero comparándolos con los frutos control, se encuentra que estadísticamente son diferentes (p<0,05), probablemente debido a que los recubrimientos coméstibles actúan como una barrera selectiva que impide la exposición del fruto al oxígeno ambiental (54), inhibiendo las posibles reacciones de oxidación (57), mientras que en los frutos control, el oscurecimiento de la piel (mayor ΔE*) aumentó de manera progresiva, seguramente debido a la disminución del ácido ascórbico por su degradación en el tiempo, que propicia las reacciones de pardeamiento enzimático (58, 59). De manera general, tanto los frutos recubiertos como los frutos control presentaron diferencias estadísticas (p<0,05) a los días 5 y 10 con respecto al inicio (día 0), por efecto del factor tiempo, diferencias que se atribuyen a la pérdida de humedad a lo largo del periodo de almacenamiento ocasionada, probablemente, por fenómenos biológicos propios de los tejidos vegetales, como la transpiración (48).
Finalmente se halló que, a nivel instrumental, las mediciones de las variaciones de color ΔE* son apreciables y cuantificables, mientras que, en el análisis sensorial, el ojo humano no alcanza a percibir las variaciones que se producen en el tiempo en el color de los frutos recubiertos, como se observa en la figura 8D.
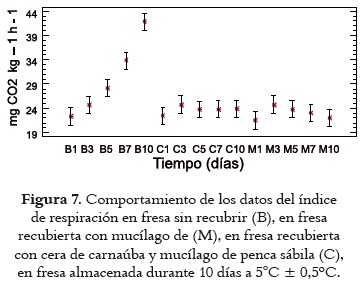
Índice de respiración
La figura 7 exhibe los valores medios con intervalos LSD (95%) del índice de respiración, expresado como mg CO2 kg-1h-1, y cuantificado los días 1, 3, 5, 7, 10 en las fresas control (B) y en las fresas recubiertas con mucílago (M) y cera de carnaúba (C). Se observan diferencias significativas (p<0,05) por efecto del factor tratamiento.
Al inicio y a los 3 días de almacenamiento el ANOVA no reveló diferencia significativa (P>0,05) entre los frutos control B y los recubiertos M y C; sin embargo, a partir del día 5, las fresas con recubrimiento coméstible muestran un leve descenso en su actividad respiratoria, con valores que se mantuvieron entre 23,72 y 22,05 mg CO2/kg-h hasta el día 10 de almacenamiento, y forman un grupo homogéneo de comportamiento similar, en comparación con los frutos control, que marcaron una curva ascendente en términos de actividad respiratoria hasta registrar, en promedio, 41,88 mg CO2/kg-h al final en el día 10, lo que pone de manifiesto las significativas diferencias (P<0,05) por efecto de los tratamientos. Dicho incremento presenta un comportamiento aparentemente similar al de un fruto climatérico en el tiempo, muy probablemente por el evidente crecimiento del moho gris en los frutos control, que ocasiona daños estructurales en los tejidos, permite su ablandamiento y favorece procesos fermentativos que aportan CO2, que fue retenido en la cámara de respiración (44, 46). En cambio, los recubrimientos coméstibles lograron reducir la actividad respiratoria de los frutos actuando como barrera para los gases producto del intercambio gaseoso del fruto con su ambiente.
De otra parte también se observó que, aunque no existe diferencia significativa entre los tratamientos (P>0,05), el recubrimiento a base de mucílago reveló una leve tendencia a disminuir la actividad respiratoria, mientras que el recubrimiento con adición de cera de carnaúba demostró la tendencia a mantener constante el índice de respiración, posiblemente por la influencia del desarrollo de la microestructura en el tamaño de los glóbulos grasos y por su distribución en el RC frente a los efectos de permeabilidad a gases (60). Los resultados obtenidos sobre la actividad respiratoria tienen similitud con los registrados por Trejo et al., 2007 (51) en fresa cv. Camarosa.
Sensorial
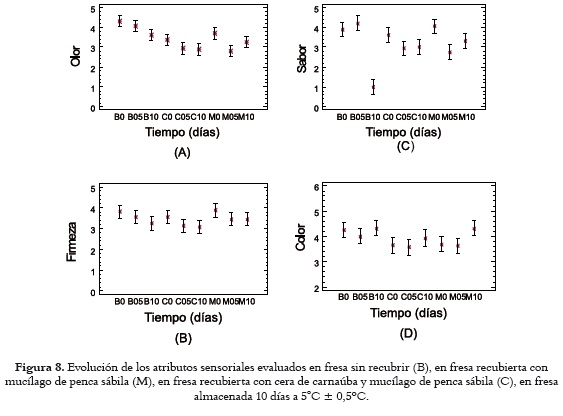
Con el propósito de garantizar el estado de salud de los panelistas, se determinó la calidad microbiológica de las muestras en los tiempos 0, 5 y 10 días de almacenamiento, evaluando el recuento de coliformes totales, mohos, levaduras y la presencia o ausencia de Salmonella. Los resultados obtenidos (no mostrados), se ajustan a los estándares microbiológicos legales para frutas frescas de consumo.
Como se aprecia en la figura 8A, en cuanto al descriptor olor las muestras analizadas revelaron una tendencia individual decreciente en el tiempo, así: los frutos de control (4,31 a 3,62), frutos con RC a base de mucílago (3,60 a 3,12) y los frutos con RC a base de cera de carnaúba (3,13 a 2,80). Ahora, realizando un análisis comparativo entre el control y los tratamientos con RC, se apreció diferencia significativa (P< 0,05) en el inicio y el día 5, porque los RC se comportan como barrera semipermeable que reduce el paso de compuestos aromáticos desprendidos por el fruto (47) y menguaron en los analistas la percepción del olor a fresa.
En cuanto al descriptor firmeza, en el blanco y en cada tratamiento M y C, el ANOVA no reveló, diferencias significativas (p>0,05) por efecto de los factores tiempo y tratamiento, como se puede observar en la figura 8B. Sin embargo, los resultados muestran cómo en el tiempo, para cada tratamiento, los analistas percibieron la pérdida progresiva de textura, así: para el tratamiento B disminuyó 14,7%; para el tratamiento C, 12,6%; y para M, 11,3%. Este comportamiento obedece, quizás, a la degradación gradual de la pectina de la pared celular por la actividad enzimática propia del fruto después de su proceso de recolección (44) y a la misma senescencia del fruto.
Para el descriptor sabor, en el Blanco el ANOVA muestra diferencias significativas (p<0,05) en el tiempo, con dos grupos homogéneos: uno, conformado por 0 y 5 días, con una leve tendencia al aumento en la percepción relacionada con la pérdida de humedad; y otro, conformado por el día 10, en el que decrece la apreciación hasta una valoración de 1,00 en el tratamiento control (B), como puede observarse en la figura 8C. La causa de ello fue el gran deterioro que sufre el fruto por la actividad enzimática y la considerable invasión de moho gris (44, 46), que imposibilitaron a algunos analistas la degustación de los frutos. Para el tratamiento C, el rango de valores medios obtenidos (3,31) no descubrió diferencias significativas (p>0,05) con respecto al tiempo, resultado afín con los datos exhibidos en la figura 4c, para fresa recubierta con cera de carnaúba y mucílago de penca sábila en los tiempos 0 – 5 y 10 días, en la que se observa claramente que no decreció en el tiempo. El comportamiento de M señala que la percepción decreció de 4,06 a 3,31, y evidencia una diferencia significativa (p<0,05) entre dos grupos homogéneos, el tiempo 0 y entre 5 - 10 días, lo que encuentra explicación en el deterioro normal del fruto durante un periodo de almacenamiento prolongado.
Pasando a otro aspecto, el factor tratamiento ocasionó diferencias significativas (p<0,05) entre B y los dos recubrimientos coméstibles (M y C), porque con el paso de los días las fresas sin recubrimiento perdieron sus atributos de sabor. Se marca así una gran diferencia entre éstas y las recubiertas (a partir del análisis sensorial resultaron ser similares con ambos tratamientos), haciendo manifiesto el efecto positivo de los RC en la conservación del sabor de los frutos en su vida de anaquel. Los resultados respecto al sabor coinciden con los de Del Valle (48) para fresas recubiertas con mucílago de cactus.
El ANOVA para el color en las muestras M y C y en las muestras B en los tiempos 0 y 5 días no registró diferencias significativas (p>0,05) por efecto de los factores tiempo y tratamiento, como puede apreciarse en la figura 8D; sin embargo, se observa una leve tendencia al descenso de las percepciones del color en los tres casos. Por otro lado, entre los tiempos 5 y 10 se produjo un leve aumento: del 7,75% en la valoración del color de manera individual para el Blanco, y para los recubrimientos, del 10,08% en C y del 19,06% en M, presentándose diferencia estadísticamente significativa (p< 0,05) para B y M en el tiempo 10 con respecto a C, posiblemente debido a la actividad enzimática y a variaciones propias del fruto en sus características sensoriales producto del metabolismo normal (60).
CONCLUSIONES
Se recomienda la utilización de recubrimiento a partir del gel mucilaginoso de penca sábila en dilución acuosa, a partir de concentraciones del 30% P/P para la formación de películas que sirvan como recubrimientos comestibles (RC).
Este estudio muestra que los RC a base de mucílago de penca sábila aplicados sobre fresas frescas logran aumentar su vida útil en 10 días, disminuyendo las pérdidas de humedad, el índice de respiración, manteniendo la firmeza y produciendo mínimas variaciones perceptibles de color, en comparación con los frutos sin recubrimiento utilizados como tratamiento control. En el análisis sensorial, la aplicación de ambos recubrimientos satisfizo la percepción de los jueces en lo relativo a los parámetros de color, olor, textura y sabor hasta el décimo día de almacenamiento, en comparación con los frutos control.
La adición de cera de carnaúba al RC de mucílago demuestra un efecto favorable frente a las pérdidas de humedad a los 7 y 10 días, y un significativo mantenimiento de la firmeza del fruto a los 10 días de almacenamiento. La evaluación sensorial permite establecer que las fresas recubiertas con ambos tratamientos, mucílago y cera, mantuvieron el atributo de sabor hasta el día 10, mientras las fresas control suscitan rechazo a los 5 días de almacenamiento.
Es conveniente adelantar nuevos estudios para evaluar el efecto de la en el crecimiento del moho Botritis cinerea en la fresa.
AGRADECIMIENTOS
Los autores agradecen al Laboratorio de Análisis Microbiológico y Fisicoquímico de la Corporación Interactuar, al laboratorio de Análisis Sensorial de la Universidad de Antioquia y al Laboratorio de Control y Calidad de Alimentos de la Universidad Nacional de Colombia, sede Medellín, por su apreciable aporte en el desarrollo experimental.
REFERENCIAS BIBLIOGRAFIAS
1. Sanz C, Pérez AG, Olías R, Olías JM. Quality of strawberries packed with perforated polypropylene. J. Food Sci. 1999 Jul; 64 (4): 748–752. [ Links ]
2. USDA, ARS. The commercial storage of fruits, vegetables, and florist and nursery stocks. [Internet]. Beltsville, EEUU: USDA, ARS. 2004 [Updated 2004 Apr 1; cited 2010 Jul 22]. Available from: http://www.ba.ars.usda.gov/hb66/index.html. [ Links ]
3. Mertely JC, MacKenzie SJ, Legard DE. Timing of fungicide applications for Botrytis cinerea based on development stage of strawberry flowers and fruit. Plant Dis. 2002 Sep; 86 (9): 1019-1024. [ Links ]
4. Shafir S, Dag A, Bilu A, Abu Toamy M, Elad Y. Honey bee dispersal of the biocontrol agent Trichoderma harzianum T39: effectiveness in suppressing Botrytis cinerea on strawberry under field conditions. J Plant Pathol. 2006 Jul; 116 (2): 119–128. [ Links ]
5. Ceponis MJ, Cappellini RA, Lightner GW. Disorders in sweet cherry and strawberry shipments in the New York market, 1972–1984. Plant Dis. 1987 May; 71 (5): 472–475. [ Links ]
6. Azodanlou R, Darbellay C, Luisier JL, Villettaz JC, Amado R. Quality assessment of strawberries (Fragaria species). J Agric Food Chem. 2003; 51 (3): 715–721. [ Links ]
7. Zhang H, Lei Wang Ying Dong, Song Jiang, Jian Cao, Rujie Meng. Postharvest biological control of gray mold decay of strawberry with Rhodotorula glutinis. Biol Control. 2007 Feb; 40 (2): 287-292. [ Links ]
8. Robertson GL. Food packaging principles and practice. 2 ed. New York, EEUU: Marcel Dekker; 1993. p. 484-499. [ Links ]
9. Cordenunsi BR, Nascimento JRO, Lajolo FM. Physicochemical changes related to quality of five strawberry fruit cultivars during cool-storage. Food Chem. 2003 Nov; 83 (2): 167-173. [ Links ]
10. Mitcham EJ. 2004. Strawberry. In: The commercial storage of fruits, vegetables, and florist and nursery stocks. [Internet]. Beltsville, EEUU: USDA, ARS. 2004 [Updated 2004 Apr 1; cited 2010 Jul 22]. Available from: http://www.ba.ars.usda.gov/hb66/130strawberry.pdf. [ Links ]
11. Nagata M, Tallada JG, Kobayashi T. Bruise detection using nir hyperspectral imaging for strawberry (Fragaria * ananassa Duch). Environ Control Biol. 2006; 44 (2): 133-142. [ Links ]
12. Wilson CL, Wisniewski ME. Biological control of postharvest diseases of fruits and vegetables an emerging technology. Annu Rev Phytopath. 1989 Sep; 27 (9): 425-441. [ Links ]
13. Oficina Regional de la FAO para América Latina y el Caribe. 1987. Improvement of post-harvest fresh fruits and vegetables handling-a. [Internet]. Santiago, Chile: FAO. 1987 [Updated 1987 Apr 1; cited 2010 Jul 22]. Available from: http://www.fastonline.org/CD3WD_40/INPHO/VLIBRARY/X0055S/ES/X0055S00.HTM. [ Links ]
14. Nielsen T, Leufve'n A. The effect of modified atmosphere packaging on the quality of Honeoye and Korona strawberries. Food Chem. 2008 Apr 1; 107 (3): 1053–1063. [ Links ]
15. Xu S, Chen X, Sun DW. Preservation of kiwi fruit with an edible film at ambient temperature. J Food Eng. 2001 Dec; 50 (4): 211–216. [ Links ]
16. McHugh TH, Senesi E. Apple wraps: a novel method to improve the quality and extend the shelf life of fresh-cut apples. J Food Sci. 2000 Apr; 65 (3):480-485. [ Links ]
17. Del Nobile MA, Conte A, Scrocco C, Brescia I. New strategies for minimally processed cactus pear packaging M.A. Innovative Food Sci Emerging Technol. 2009 Jul; 10 (3): 356–362. [ Links ]
18. Uquiche E, Villarroel M, Cisneros-Cevallos L. Efecto de recubrimientos comestibles sobre la calidad sensorial de pimentones verdes (Capsicum annuum L.) durante el almacenamiento. ALAN. 2002 Mar; 52 (1): 84-90. [ Links ]
19. Krochta JM, Baldwin EA, Nísperos-Carriedo M (Eds.). Edible coatings and films to improve food quality. Lancaster, PA: Technomic Publishing Company; 1994. Chapter 10, Edible coatings from lipids and resins; p. 279–303. [ Links ]
20. Morillon V, Debeaufort F, Blond G, Capelle M, Voilley A. Factors affecting the moisture permeability of lipid edible films: a review. Crit RevFood Sci Nutri. 2002 Jan; 42 (1): 67–89. [ Links ]
21. Bai J, Hagenmaier RD, Baldwin E. Coating selection for 'Delicious' and other apples. Postharvest Biol Tec. 2003 Jun; 28 (3): 381-390. [ Links ]
22. Karbowiak T, Debeaufort F, Voilley A. Influence of thermal process on structure and functional properties of emulsion-based edible films. Food Hydrocolloid. 2007 Jul-Aug; 21 (5): 879-888. [ Links ]
23. Ozdemir M, Floros J. Optimization of edible whey protein films containing preservatives for water vapor permeability, water solubility and sensory characteristics. J Food Eng. 2008 May; 86 (2): 215-224. [ Links ]
24. Rojas-Argudo C, del Río MA, Pérez-Gago MB. Development and optimization of locust bean gum (LBG)-based edible coatings for postharvest storage of 'Fortune' mandarins. Postharvest Biol Tec. 2009 May; 52 (2): 227–234. [ Links ]
25. Olivas GI, Barbosa-Cánovas GV. Edible coating for fresh-cut fruits. Crit Rev Food Sci Nutri. 2005; 45 (7-8): 657-670. [ Links ]
26. Rodríguez I, Santana O, Recio O, Fuentes M. Beneficios del Aloe vera l (sábila) en las afecciones de la piel. Rev Cubana de Enfermer. 2006; 22 (3): 52–55. [ Links ]
27. Vega A, Ampuero N,Díaz Lemus R. El Aloe vera (Aloe barbadensis Miller) como componente de alimentos funcionales. Rev Chil Nutr. 2005 Dic; 32 (3): 208-214. [ Links ]
28. He Q, Changhong L, Kojo E, Tian Z. Quality and safety assurance in the processing of Aloe vera gel juice. Food Control. 2005 Feb; 16 (2): 95-104. [ Links ]
29. García MA, Martino MN, Zaritzky NE. Plasticized starch-based coatings to improve strawberry (Fragaria Ananassa) quality and stability. J Agric Food Chem. 1998 Aug 13; 46 (9): 3758–3767. [ Links ]
30. De Rodríguez JD, Hernández Castillo D, Rodríguez García R, Angulo Sánchez JL. Antifungal activity in vitro of Aloe vera pulp and liquid fraction against plant pathogenic fungi. Industrial Crops and Products. 2005 Jan; 21 (1): 81-87. [ Links ]
31. Rosca Casian J, Parvu M, Vlase L, Tamas M. Antifungal activity of Aloe vera leaves. Fitoterapia. 2007 Apr; 78 (3): 219-222. [ Links ]
32. Boudreau MD, Beland FA. An evaluation of the biological and toxicological properties of Aloe Barbadensis (Miller), Aloe vera. J Environ Sci Health C. 2006 Jul; 24 (1): 103-154. [ Links ]
33. Martínez L, Romero N, Alburquerque JM, Valverde F, Guillén S, Castillo D, et al. Postharvest sweet cherry quality and safety maintenance by Aloe vera treatment: A new edible coating. Postharvest Biol Tec. 2006 Jan; 39 (1): 93–100. [ Links ]
34. Serrano M, Valvere JM, Quillén F, Castillo S, Martínez D, Valero D. Use of Aloe vera gel coating preserves the functional properties of table grapes. J Agric Food Chem. 2006 May 31; 54 (11): 3882-3886. [ Links ]
35. Ramírez A. Sábila = salud = vida. Producción y comercialización de penca sábila. [Monografía]. [Rionegro (Ant.), Colombia]: Universidad Católica de Oriente; 2002. 77 p. [ Links ]
36. Instituto Colombiano de Normas Técnicas y Certificación. Norma Técnica Colombiana. NTC 4103. Frutas frescas. Fresa variedad Chandler. Especificaciones. Santafé de Bogotá, Colombia: ICONTEC; 1997. 14 p. [ Links ]
37. AOAC. Official Methods of Analysis of the Association of Official Analytical Chemists. Method 942.15 Arlington, USA. 1997. 37 p. [ Links ]
38. Gennadios A, Weller CL, Hanna MA, Froning GW. Mechanical and barrier properties of egg albumen films. J Food Sci. 1996 Aug: 61 (3): 585–589. [ Links ]
39. Robson MG, Ferreira Soares N de F, Alvarenga Botrel D, de Almeida Gonçalves L. Characterization and effect of edible coatings on minimally processed garlic quality. Carbohyd Polym. 2008 May 16: 72 (3): 403-409. [ Links ]
40. Márquez C, Otero C, Cortés M. Cambios fisiológicos, texturales, fisicoquímicos y microestructurales del tomate de árbol (Cyphomandra betacea S.) en poscosecha. [Tesis de Maestría] [Medellín, Colombia]: Universidad Nacional de Colombia; 2007. 171 p. [ Links ]
41. Instituto Colombiano de Normas Técnicas y Certificación. Norma Técnica Colombiana. NTC 3932. Análisis sensorial. Identificación y selección de descriptores para establecer un perfil sensorial por una aproximación multidimensional. Santa Fé de Bogotá, Colombia: ICONTEC; 1996. 31 p. [ Links ]
42. Fennema O. Química de los alimentos. Zaragoza, España: Acribia; 1993. 1095 p. [ Links ]
43. Pérez-Gago MB, Krochta JM. Drying temperature effect on water vapor permeability and mechanical properties of whey protein–lipid emulsion films. J Agric Food Chem. 2000 Jun 9; 48 (7):2687–2692. [ Links ]
44. Almenar R. Envasado activo de fresas silvestres, [Tesis Doctoral] [Valencia, España]: Universidad de Valencia; 2005. 225 p. [ Links ]
45. Wszelaki AL, Mitcham EJ. Effect of combinations of hot water dips biological control and controlled atmospheres for control of gray mold on harvested strawberries. Postharvest Biol Tec. 2003 Mar; 27 (3): 255–264. [ Links ]
46. Redondo-Nevado J, Moyano E, Medina-Escobar N, Caballero JL, Muñoz-Blanco J. A Fruit- specific and developmentally regulated endopolygalacturonase gene from strawberry (Fragaria x ananassa cv. Chandler). J Exp Bot. 2001 Jun 8; 52 (362): 1941–1945. [ Links ]
47. Han C, Zhao Y, Leonard SW, Traber MG. Edible coatings to improve storability and enhance nutritional value of fresh and frozen strawberries (Fragaria × ananassa) and raspberries (Rubus ideaus). Postharvest Biol Tec. 2004 Jul; 33 (1): 67–78. [ Links ]
48. Del Valle V, Hernández P, Guarda A, Galotto MJ. Development of a cactus-mucilage edible coating (Opuntia ficus indica) and its application to extend strawberry (Fragaria ananassa) shelf-life. Food Chem. 2005 Aug; 91 (4): 751–756. [ Links ]
49. Ferreira da Mota W, Chamhum-Salomão LC, Cecon RP, Finger FL. Waxes and plastic film in relation to the shelf life of yellow passion fruit. Scientia Agricola. 2003 Jan-Feb: 60 (1): 51-57. [ Links ]
50. García C, Zafrilla P, Romero F, Abellán P, Artés F, Tomás-Barberán FA. Color stability of strawberry jam is affected by cultivar and storage temperature. J Food Sci. 1999 Mar: 64 (2): 243-247. [ Links ]
51. Trejo-Márquez A, Ramos-López KA, Pérez-Guillén C. Efecto de la aplicación de un recubrimiento comestible a base de gelatina sobre la calidad de fresa (Fragaria Vesca L.) almacenada en refrigeración. V Congreso Iberoamericano de Tecnología Postcosecha y Agroexportaciones. Cartagena, España: Grupo Postrecolección y Refrigeración UPCT; 2007. p. 978-984. [ Links ]
52. Tanada PS, Grosso CRF. Effect of edible wheat gluten-based films and coatings on refrigerated strawberry (Fragaria ananassa) quality. Postharvest Biol Tec. 2005 May; 36 (2): 199–208. [ Links ]
53. Pelayo C, Ebeler SE, Kader AA. Postharvest life and flavour quality of three strawberry cultivars kept at 5 ºC in air or air + 20 KPa CO2. Postharvest Biol Tec. 2003 Feb; 27 (2): 171-183. [ Links ]
54. Hernández-Muñoz P, Almenar E, Ocio MC, Gavara R. Effect of calcium dips and chitosan coatings on postharvest life of strawberries (Fragaria x ananassa) Postharvest. Postharvest Biol Technol. 2006 Mar; 39 (3): 247–253. [ Links ]
55. Hutchings JB. Food color and appearance. 2° ed. Gaithersburg, MD: Aspen; 1999. p. 453–461. [ Links ]
56. Quezada J, Debeaufort F, Callegarin F, Voilley A. Lipid hydrophobicity, physical state and distribution effects on the properties of emulsion-based edible films. J Membr Sci. 2000 Dec 1; 180 (1): 37–46. [ Links ]
57. Nunes MCN, Brecht JF, Morais AMMB, Sargent SA. Possible influences of water loss and polyphenol oxidase activity on anthocyanin content and discolouration in fresh ripe strawberry (cv. Oso Grande) during storage at 1°C. J Food Sci. 2005; 70 (8): 79–84. [ Links ]
58. Vámos-Vigyázó L. Polyphenol oxidase and peroxidase in frutsand vegetables. Crit Rev Food Sci Nutr. 1981; 15 (1): 49-127. [ Links ]
59. García Viguera C, Zafrilla P, Romero F, Abellán P, Artés F, Tomás-Barberán FA. Color stability of strawberry jam is affected by cultivar and storage temperature. J Food Sci. 1999; 64 (2): 243-247. [ Links ]
60. Bosquez -Molina E, Guerrero-Legarreta I, Vernon-Carter EJ. Moisture barrier properties and morphology of mesquite gum–candelilla wax based edible emulsion coatings. Food Research Intern. 2003; 36 (9-10): 885–893. [ Links ]
Recibido: Septiembre 01 de 2009
Aceptado: Agosto 19 de 2010.