Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.3 Medellín Sept./Dec. 2010
BIOTECNOLOGÍA
BIOTRANSFORMACIÓN DE trans-CINAMALDEHÍDO CON EL HONGO FILAMENTOSO Aspergillus sp.
BIOTRANSFORMATION OF trans-CINNAMALDEHYDE BY THE FILAMENTOUS FUNGUS Aspergillus sp.
Rodrigo VELASCO B.1; Diego A. ARISTIZABAL1; Carlos M. GARCÍA P.1, Jesús H. GIL G.1,2, Diego L. DURANGO R.3
1 Grupo de Química de los Productos Naturales y los Alimentos, Facultad de Ciencias, Escuela de Química. Universidad Nacional de Colombia. Calle 59A 63-020 Autopista Norte. A.A. 3840. Medellín, Colombia.
2 Facultad de Ciencias Agropecuarias. Departamento de Ingeniería Agrícola y Alimentos. Universidad Nacional de Colombia. Calle 59A 63-020. Medellín, Colombia.
3 Grupo de Química de los Productos Naturales y los Alimentos, Facultad de Ciencias, Escuela de Química. Universidad Nacional de Colombia. Calle 59A 63-020 Autopista Norte. A.A. 3840. Medellín, Colombia. dldurango@unal.edu.co.
RESUMEN
El desarrollo de métodos biocatalíticos ha permitido la preparación de una amplia variedad de productos con alto valor agregado a través de procesos simples, selectivos, económicos y respetuosos con el medio ambiente. En este trabajo se evaluó la transformación microbiana causada por el hongo Aspergillus sp. sobre el sustrato arilpropanoide trans-cinamaldehído. El proceso se llevó a cabo empleando los medios de cultivo líquido Sabouraud y Czapeck-Dox, a temperatura promedio de 24oC, humedad relativa entre 45 y 60% y agitación orbital a 120 rpm. El sustrato se transformó principalmente a los productos metabólicos: 3-fenil-1-propanol, alcohol cinamílico, 3-fenilpropanal, acetato 3-fenilpropílico, acetato de cinamilo, alcohol bencílico, 1-fenilpropanol y 2-fenilpropanol. A partir de los resultados se concluyó que el hongo Aspergillus sp. convirtió inicialmente el trans-cinamaldehído mediante reacciones de reducción, y posteriormente modificó los productos resultantes por esterificación y descarboxilación, generando varios compuestos que se emplean como materias primas en diferentes industrias. Se discute una posible ruta metabólica y el efecto del medio de cultivo en la transformación del sustrato.
Palabras clave: Aspergillus sp., actividad antifúngica, reducción, acetilación, ruta metabólica.
ABSTRACT
The development of biocatalytic methods has allowed the preparation of a wide variety of products with high added value through simple, selective, economical and environmentally friendly processes. In this work, the microbial transformation of arylpropanoide substrate trans-cinnamaldehyde using the fungus Aspergillus sp. was investigated. The process is carried out in liquid media culture Sabouraud y Czapeck-Dox to an average temperature 24oC, relative humidity between 45 and 60%, and with agitation at 120 rpm on a orbital shaker. The biotransformation of the substrate generated mainly the metabolic products 3-phenyl-1-propanol, cinnamyl alcohol, 3-phenylpropanal, 3-phenylpropyl acetate, cinnamyl acetate, benzylic alcohol, 1-phenylethanol, and 2-phenylethanol. From the results it is concluded that the fungus Aspergillus sp. initially converted the trans-cinnamaldehyde by reduction reactions, and later modified the products resulting through esterification and decarboxylation. In the process, several compounds used as raw materials in different industries were generated. The metabolic pathway and culture medium effect on substrate transformation are discussed.
Key words: Aspergillus sp., antifungal activity, reduction, acetylation, metabolic pathway.
INTRODUCCIÓN
Las biotransformaciones son un campo emergente de la ciencia que emplea catalizadores biológicos, por ejemplo, células completas y enzimas, para realizar reacciones químicas (1). En la última década, este campo ha despertado gran interés y actualmente es una de las áreas más promisorias para la investigación científica, debido a su aplicabilidad en la obtención de materias primas y productos útiles en diferentes procesos industriales y en sectores tan trascendentales como el farmacéutico, el químico y el agrícola (2-5). Los productos obtenidos mediante procesos de biotransformación se consideran naturales, lo que les aporta un valor agregado con respecto a sus contrapartes sintéticas, especialmente cuando son empleados como materias primas para la alimentación o el cuidado de la salud (6).
Aunque el principal uso de los sistemas biológicos para la síntesis de sustancias orgánicas reside en la preparación de compuestos ópticamente activos (enantiopuros), estos procesos también se han empleado para modificar grupos funcionales aquirales; en esta aproximación se aprovecha el hecho de que las biotransformaciones se pueden llevar a cabo en condiciones suaves, como temperatura ambiente, presión atmosférica y pH neutro, evitando así las condiciones de reacción extremas que pueden conducir a la formación de productos secundarios indeseables (7). Además, se puede obtener en un único proceso de biotransformación algunos productos que requieren varias etapas sintéticas, si se utilizan para su producción las metodologías de síntesis clásica. Otra característica importante de las biotransformaciones lo constituye el hecho de que son un método que no tiene un impacto negativo en el ambiente (8, 9); debido a que el medio de reacción utilizado puede ser acuoso y es posible biodegradar o reutilizar los subproductos.
El uso de microorganismos (por ejemplo hongos filamentosos) como biocatalizadores ha suscitado particular interés, en parte como consecuencia de su habilidad para generar grandes cantidades de biomasa y una amplia variedad de enzimas diferentes en corto tiempo. Adicionalmente, los microorganismos son hábiles para realizar diversas reacciones, incluso algunas casi inaccesibles por medios químicos (10). Entre los hongos filamentosos más empleados para llevar a cabo biotransformaciones están las especies del género Aspergillus. En el presente trabajo se informa sobre los productos resultantes de la biotransformación del trans-cinamaldehído (I) con el hongo Aspergillus sp. Además, se evalúa el comportamiento de la concentración del sustrato y los productos metabólicos en función del tiempo y del medio de cultivo empleado en la biotransformación.
MATERIALES Y MÉTODOS
Reactivos
Se emplearon solventes (AcOEt, MeOH, nhexano, CHCl3) de la marca Merck, grado analítico. Las muestras estándares de alcohol cinamílico, 3-fenil-1-propanol y (I) se adquirieron en la casa comercial Sigma-Aldrich. El acetato de 3-fenil- 1-propanol se obtuvo por acetilación habitual del 3-fenil-1-propanol, empleando anhídrido acético y piridina, y posterior extracción con éter etílico (11). Se utilizaron sílica gel 60 (0,040-0,063 mm) y Sephadex® LH-20 de Merck y Sigma-Aldrich, respectivamente. Para los medios de cultivo se utilizaron peptona de caseína (Merck KGaA, Darmstadt, Germany), alfa-D(+)-glucosa anhídra (Acros Organics, New Jersey, USA), extracto de levadura (Oxoid, Hampshire, England), K2HPO4 (Mallinckrodt Chemical, Xalostoc, México), NaNO3 (Merck, Darmstadt, Germany); MgSO4.7H2O (Protokimica, Medellín, Colombia), y FeSO4.7H2O (Carlos Erba Reagents, Chaussée du Vexin – BP).
Métodos de separación y analíticos
Los análisis por cromatografía de capa fina (CCF) se llevaron a cabo empleando cromatoplacas de sílica gel 60 F254, de 0,25 mm (Merck), y como fase móvil, la mezcla de n-hexano-AcOEt (8:2). Los compuestos se visualizaron bajo radiación UV a 254 y 365 nm, y mediante aspersión con la mezcla AcOH:H2SO4:H2O (143:28:30), seguido de calentamiento (~100°C, 1 min). Para la cromatografía de columna (CC) se emplearon como fases estacionarias sílica gel 60 y Sephadex® LH-20. Los análisis mediante cromatografía de gases (CG) se efectuaron en un cromatógrafo Hewlett-Packard 6890 (Agilent Technologies), equipado con un detector selectivo de masas Agilent MSD 5973, en el modo de ionización electrónica. La columna empleada fue una DB-35MS (30 m x 0,25 mm x 0,25 μm, Agilent Technologies). Las condiciones cromatográficas fueron las siguientes: temperatura de la columna, 50-250°C a 10°C/min; temperatura del inyector, 230°C; temperatura del detector, 280°C; gas de arrastre, N2 a 1 mL/min. La composición relativa de los constituyentes individuales se determinó a partir del área promedio de los picos. Los espectros de masas se obtuvieron por ionización electrónica (IE), mediante CG-EM, en las condiciones citadas previamente. Los espectros infrarrojo (IR) se determinaron en un Perkin Elmer Paragon 1000, empleando como solvente cloroformo. Los espectros de resonancia magnética nuclear (RMN) de 1H y 13C se obtuvieron empleando como solvente cloroformo deuterado, en un equipo Bruker AMX 300. Las multiplicidades se establecieron por la secuencia de pulso JMOD. Los desplazamientos químicos se expresan en valores de δ (ppm) y las constantes de acoplamiento J en hertz (Hz).
Evaluación de la toxicidad del sustrato (I)
Las evaluaciones de toxicidad, referida como actividad antifúngica de (I) frente al hongo filamentoso Aspergillus sp. (cepa aislada y caracterizada morfológicamente por el Laboratorio de Sanidad Vegetal de la Universidad Nacional de Colombia, sede Medellín), se llevaron a cabo con la metodología descrita por Bustillo et al., 2003 (12), con algunas modificaciones. Para las evaluaciones se utilizaron frotis del microorganismo realizados en agar papa-dextrosa (PDA) e incubados durante 48 horas. La toxicidad se determinó empleando diferentes concentraciones (100, 250, 500 y 1000 mg/L) de (I), y midiendo los diámetros de crecimiento micelial del hongo cada 24 horas durante 288 horas. Las mediciones se efectuaron por triplicado y cada ensayo se respaldó con los respectivos controles (blanco absoluto y blanco de solvente: etanol). La toxicidad de (I) se expresó como porcentaje de inhibición del crecimiento micelial, el cual se calculó de acuerdo con la expresión: 100 x (diámetro promedio de crecimiento radial del micelio en el medio de control – diámetro promedio de crecimiento radial del micelio en el medio del ensayo)/diámetro promedio de crecimiento radial del micelio en el medio de control. Para (I) se construyeron las correspondientes curvas de toxicidad frente al microorganismo, a partir de las cuales se buscó determinar una concentración aproximada que inhibiera el crecimiento micelial del hongo entre el 40 y 50% a la mitad del tiempo de evaluación; este valor se utiliza como concentración inicial del sustrato en los procesos de biotransformación. La selección de dicha concentración pretende evitar el uso de niveles del sustrato demasiado elevados como para inhibir completamente el crecimiento del microorganismo, o demasiado bajos y tolerables para el hongo y que conducen a la formación en baja proporción de los productos de biotransformación; esto último, además, promueve la generación indeseable de metabolitos propios del microorganismo, que dificultan la separación y el análisis.
Preparación del preinóculo de Aspergillus sp.
La preparación del preinóculo se realizó de acuerdo con la metodología empleada por Miyazawa et al., 1997 (13), con algunas modificaciones. En dos matraces Erlenmeyer de 500,0 mL cada uno, con 250,0 mL de medio de cultivo líquido Sabouraud (peptona de caseína, 10 g/L; alfa-D(+)-glucosa anhidra, 40 g/L), se inocularon esporas de Aspergillus sp., conservadas en un medio de cultivo sólido de agar PDA a 24oC. Los matraces Erlenmeyer con el inóculo se cubrieron con trozos de algodón estéril y se preincubaron durante 3 días en un agitador orbital (Centricol serie 0239 con cámara de incubación) a 120 rpm y 24°C.
Biotransformación a escala preparativa y aislamiento de los metabolitos
Una vez terminado el periodo de preincubación, se retiró la biomasa mediante filtración con un lienzo de nylon estéril y se transfirió a 6 matraces Erlenmeyers, de 1,0 L cada uno, con 500,0 mL de medio de cultivo Sabouraud fresco y el sustrato (I). La biotransformación se produjo a una temperatura de 24°C, con agitación a 120 rpm, durante un periodo de 288 horas. Posteriormente, el medio de cultivo y el micelio se separaron mediante filtración con una malla de nylon; el filtrado obtenido se saturó con NaCl y se extrajo con AcOEt (4 x 400 mL). La fase orgánica resultante se secó con sulfato de sodio anhidro, se filtró y se evaporó a presión reducida en un rotoevaporador. El residuo obtenido se fraccionó mediante sucesivas CC, empleando como fases estacionarías sílica gel (fase móvil: sistemas de polaridad creciente de n-hexano-AcOEt), y Sephadex® LH-20 (sistema de elusión: la mezcla n-hexano-CH2Cl2-MeOH, 2:1:1 v/v), permitiendo el aislamiento y purificación de 4 productos metabólicos, denominados (III), (IV), (V) y (VI). Un análisis por CG-EM de las fracciones obtenidas en los muestreos también reveló la presencia de los compuestos designados como (II), (VII), (VIII) y (IX). Los metabolitos se identificaron por métodos espectroscópicos y espectrométricos y mediante comparación de sus espectros con los obtenidos para muestras estándares y/o con los datos reportados en la base de datos NIST Mass Spectral Library, NIST'02 (versión 2.0).
Experimentos en el curso del tiempo y efecto del medio de cultivo
El material resultante del preinóculo se filtró y la biomasa se distribuyó en 4 matraces Erlenmeyer de 500,0 mL cada uno, con 250,0 mL de medio de cultivo Sabouraud fresco y el sustrato (I), a la concentración de 300 mg/L. Las condiciones de temperatura, agitación y tiempo corresponden a las citadas para la biotransformación preparativa. Cada 24 horas se retiraron, a través de una sonda estéril, 50,0 mL de medio de cultivo que incluía parte del micelio. Este material se combinó con 50,0 mL de etanol al 95% con la finalidad de detener la biotransformación. Cada una de las muestras se extrajo con AcOEt (3 x 50 mL), de acuerdo con el procedimiento descrito para el aislamiento de metabolitos. El residuo obtenido se redisolvió con 5,0 mL de CHCl3 grado analítico, se filtró a través de un microfiltro Whatman (0,45 μm) y se analizó por CCF y CG-EM. La relación entre el sustrato y los productos se determinó con base en el área de los picos en CG.
Además, y con el objeto de evaluar el efecto del medio de cultivo en la biotransformación del compuesto (I) por el hongo Aspergillus sp., se hizo un estudio en el curso del tiempo del proceso usando el medio de líquido Czapeck-Dox (solución A: glucosa 5%, extracto de levadura 0,1%; solución B: K2HPO4 0,5%; NaNO3 0,2%; MgSO4.7H2O 0,05%; FeSO4.7H2O 0,001%).
RESULTADOS Y DISCUSIÓN
Toxicidad de (I) sobre Aspergillus sp.
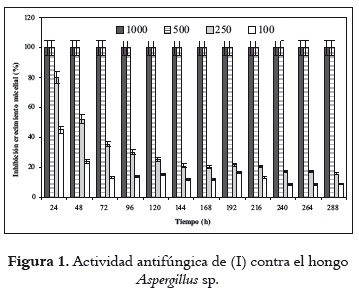
En la figura 1 se observa que el crecimiento micelial de Aspergillus sp. se inhibió completamente a concentraciones de 500 y 1000 mg/L del compuesto (I), durante todo el tiempo de evaluación (24 a 288 h). En este mismo intervalo de tiempo, a niveles de 250 y 100 mg/L, la inhibición del crecimiento varió en el rango de 80,0-20,1% y 45,0-11,8%, respectivamente. A estas concentraciones se aprecia decrecimiento en la inhibición del microorganismo a medida que aumenta el tiempo de evaluación, lo cual puede atribuirse a una disminución de la toxicidad de (I) por parte del microorganismo. En general, los resultados muestran un relativo buen control del crecimiento radial de Aspergillus sp. por parte de (I). Este hecho concuerda con diferentes estudios en los que se demuestra que este arilpropanoide posee una elevada actividad antifúngica (14, 15), razón por la cual se ha planteado la posibilidad de emplearlo en el control de enfermedades de la poscosecha (16). Sin embargo, un inconveniente posible en su uso directo como antifúngico es la generación de resistencia microbiana a mediano plazo, como resultado de la capacidad del microorganismo para metabolizar el compuesto (I) a sustancias inócuas. Lo anterior refuerza la necesidad de estudios de biotransformación que permitan determinar las posibles rutas metabólicas empleadas por los hongos filamentosos.
La concentración de (I) elegida para la biotransformación se determinó a partir de la información suministrada en la figura 1. Se seleccionó una concentración de sustrato de 300 mg/L, inferior a la de 500 mg/L (que no permite el crecimiento del hongo), y ligeramente superior a la de 250 mg/L (que presentó la más alta inhibición, pero inferior al rango 40-50%, a la mitad del tiempo de evaluación). A este nivel se pretende obtener una actividad enzimática que redunde en un proceso de conversión adecuado del arilpropanoide por parte del microorganismo.
Productos de biotransformación
Los datos espectroscópicos de los productos metabólicos detectados, aislados e identificados se presentan a continuación:
Compuesto (II). En el análisis por CG-EM presentó un tiempo de retención, tR = 13,38 min. EM-IE, m/z [% intensidad relativa]: 134 (M+) [56], 105 [63], 103 (C8H7+) [14], 92 (M-C2H2O+) [30], 91 (C7H7+) [100], 78 (M-CO-C2H4+) [24], 77 (C6H5+) [24], 45 [14].
Compuesto (III). Se aisló como un semisólido de olor agradable. Mediante análisis por CG-EM presentó un tiempo de retención, tR = 10,87 min. EM-IE, m/z [% intensidad relativa]: 134 (M+) [66], 115 (M-H2O-H+) [69], 105 [56], 103 (C8H7+) [35], 92 [85], 91 (C7H7+) [100], 78 [97], 77 (C6H5+) [63], 89 [27]; IR vmax (CHCl3, cm-1): 3300 (-OH), 3020 (=C-H), 2950, 1620 (C=C), 1500 (C=C), 1480, 1050 (C-O), 910, 750; RMN 1H (300 MHz, CDCl3): 7,20-7,40 (m, 5H); 6,60 (d, 1H, J = 16,0); 6,38 (dt, 1H, J = 16,0; 6,0); 4,30 (d, 2H, J = 6,0); RMN 13C (75 MHz, CDCl3): δ 63,2 (C-1); 126,4 (C-2'); 128,2 (C-2); 129,1 (C-3'); 130,3 (C-4'); 132,0 (C-3); 137,5 (C-1').
Compuesto (IV). Se aisló como un líquido incoloro y viscoso. Mediante análisis CG-EM presentó un tiempo de retención, tR = 9,21 min. EM-IE, m/z [% int. rel.] 136 (M+) [20], 118 (M-H2O+) [55], 117 [100], 92 [39], 91 (C7H7+) [90], 78 [18], 77 (C6H5+) [22], 65 [18]; IR vmax (CHCl3, cm-1): 3350 (-OH), 3030 (=C-H), 2980, 1550 (C=C), 1500 (C=C), 1430, 1390, 1100 (C-O), 950; RMN 1H (300 MHz, CDCl3): δ 7,20-7,30 (m, 5H); 3,69 (t, 2H, J = 6,4); 2,70 (t, 2H, J = 7,7); 1,85-1,95 (dt, 2H, J = 7,7; 6,4); RMN 13C (75 MHz, CDCl3): δ 32,0 (C-3); 34,5 (C-2); 62,4 (C-1); 125,5 (C-4'); 128,2 (C-2', 3' ,5' y 6'); 142,0 (C-1').
Compuesto (V). Se aisló como un líquido incoloro de olor balsámico. Mediante análisis por CG-EM presentó un tiempo de retención, tR = 11,69 min. EM-IE, m/z [% int. rel.]: 118 [71], 117 [100], 91 (C7H7+) [57], 77 (C6H5+) [10], 65 [13], 43 [19]; IR vmax (CHCl3, cm-1): 3074-3026 (=C-H), 1729 (C=O), 1601 (C=C), 1495, 1227 (C-O), 1031; RMN 1H (300 MHz, CDCl3): δ 7,20-7,60 (m, 5H); 4,12 (t, 2H, J = 6,6); 2,72 (t, 2H, J = 7,4); 2,07 (s, 3H); 1,99 (dt, 2H, J = 7,4; 6.6); RMN 13C (75 MHz, CDCl3): δ 21,3 (CH3); 30,7 (C-2); 32,6 (C-1); 64,2 (C-3); 126,5 (C-4'); 128,8 (C-3' y 5'); 128,9 (C-2' y 6'); 141,7 (C-1'); 171,4 (C=O).
Compuesto (VI). Mediante análisis por CG-EM presentó un tiempo de retención, tR = 13,07 min. EM-IE, m/z [% int. rel.]: 176 (M+) [33], 134 [30], 133 [28], 117 [35], 116 [37], 115 [100], 105 [43], 91 (C7H7+) [27], 77 (C6H5+) [8], 43 [30]; IR vmax (CHCl3, cm-1): 3047 (=C-H), 1734 (C=O), 1614 (C=C), 1257 (C-O), 1028; RMN 1H (300 MHz, CDCl3): δ 7,20-7,60 (m, 5H); 6,67 (d, 1H, J = 15,9); 6,30 (dt, 1H, J = 15,9; 6,4); 4,73 (d, 2H, J = 6,4); 2,10 (s, 3H); RMN 13C (75 MHz, CDCl3): δ 18,9 (CH3); 63,0 (C-1); 121,1 (C-2); 124,5 (C-2' y 6'); 126,0 (C-4'); 126,5 (C-3' y 5'); 132,1 (C-3); 134,1 (C-1'); 168,7 (C=O).
Compuesto (VII). Presentó un tiempo de retención, tR = 5,48 min en el análisis por CG-EM. EM-IE, m/z [% int. rel.]: 108 (M+) [76], 107 [51], 91 (C7H7+) [18], 80 [11], 79 [100], 78 [16], 77 (C6H5+) [71], 51 [14], 50 [12].
Compuesto (VIII). Tiempo de retención, tR = 5,94 min. EM-IE, m/z [% int. rel.]: 122 (M+) [24], 107 [80], 79 [100], 78 [26], 77 (C6H5+) [64], 51 [13], 50 [8].
Compuesto (IX). Tiempo de retención, tR = 6,95 min. EM-IE, m/z [% int. rel.]: 122 (M+) [23], 92 [47], 91 (C7H7+) [100], 65 (C5H5+) [21], 63 [9].
La información espectroscópica para los compuestos (III), (IV) y (V) coincide con los valores encontrados para muestras estándar de los compuestos alcohol cinamílico, 3-fenil-1-propanol y acetato 3-fenilpropílico, respectivamente. La identificación de los compuestos (II), (VI), (VII), (VIII) y (IX) se logró mediante comparación de los espectros con aquellos registrados en bases de datos; corresponde a los productos 3-fenilpropanal, acetato de cinamilo, alcohol bencílico, 2-feniletanol y 1-feniletanol, correspondientemente.
Algunos de estos productos de biotransformación han sido empleados como materias primas en diferentes industrias, especialmente en la composición de sabores y aromas. El compuesto (III) posee un olor a jacinto, perdurable y agradable, y el metabolito (IV), junto con su éster (V), encuentran uso en compuestos de perfumería (17). Del mismo modo, las propiedades aromáticas de los ésteres del cinamato, como por ejemplo el compuesto (VI), son bien reconocidas por su aplicación como fragancias en jabones y cosméticos (18). Además de sus usos en perfumería, por su olor agradable y como agentes de sabor, estos productos metabólicos han demostrado ser efectivos para prevenir el oscurecimiento de la piel (19) causado por la irradiación de los rayos ultravioleta del sol, y para reducir la caída del cabello y favorecer su crecimiento (20). Asimismo son útiles como intermedios para la síntesis de varios productos farmacéuticos como los antivirales, particularmente inhibidores de la VIH proteasa (21), y para la producción de colorantes, agroquímicos y alcaloides, entre otros (22). Entre los productos obtenidos, los compuestos (III) y (VIII) tienen la mayor demanda como sabores y fragancias.
Experimentos en el curso del tiempo
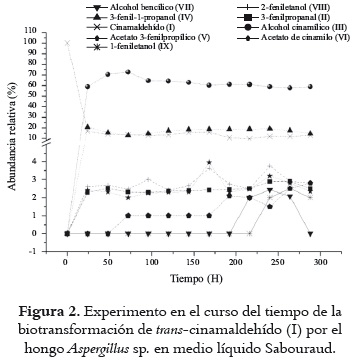
En la figura 2 se aprecia que el sustrato es transformado principalmente en dos metabolitos mayoritarios [(III) y (IV)], y algunos productos minoritarios [(II), (V), (VI), (VII), (VIII) y (IX)]. Estos compuestos no fueron detectados por análisis mediante CCF o CG a partir de un cultivo de Aspergillus sp. carente del sustrato. En este sistema, el sustrato de partida (I) se consumió en un ~85% durante las primeras 48 horas del proceso; a partir de este momento, la concentración de (I) permaneció aproximadamente constante. El metabolito (III) presentó, durante todo el tiempo del análisis una abundancia relativa superior al 50%, alcanzando un valor máximo al cabo de 72 h (~70%). De otro lado, el compuesto (IV) mantuvo una abundancia relativa, cercana al 15%, entre 24 y 288 h de evaluación. La formación mayoritaria de (III) muestra la alta eficiencia de Aspergillus sp. en la reducción del grupo carbonilo. Además se observó que durante todo el proceso de biotransformación, los productos (II), (V), (VI), (VII), (VIII) y (IX) alcanzaron abundancias inferiores al 5%. Es muy interesante anotar que el 1-fenil-1,3-propanodiol, producto metabólico de la biotransformación de (I) con Colletotrichum acutatum (23), no fue detectado en el presente estudio.
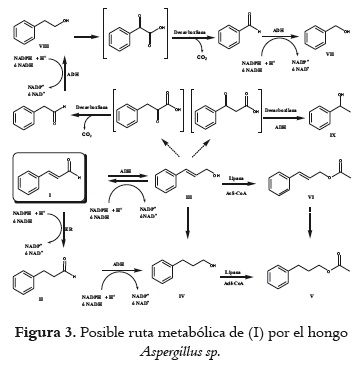
A partir de la estructura de los productos obtenidos y los experimentos en el curso del tiempo, en la figura 3 se plantea una posible ruta metabólica para la biotransformación de (I) por el hongo Aspergillus sp. En la transformación se aprecia que el microorganismo posee una gran capacidad de reducir el grupo aldehído a alcohol, que puede atribuirse a la acción de enzimas del tipo alcohol dehidrogenasa (ADH) y las coenzimas NADH y NADPH, a partir de las cuales un ión hidruro es transferido al grupo carbonilo de (I) para producir (III) (24). Otra posibilidad es que se reduzca el doble enlace activado mediante la acción de la enzima enoato reductasa (ER), generando el compuesto (II), el cual es seguidamente reducido por enzimas ADH para la formación de (IV). Sin embargo, la producción mayoritaria de (III) podría indicar que Aspergillus sp. presenta quimioselectividad hacia la reducción del grupo carbonilo, o que la velocidad de transformación de un grupo aldehído a alcohol es mayor en comparación con la reducción del doble enlace. Otros autores han encontrado que la quimioselectividad de las bioreducciones que se llevan a cabo empleando células completas, de los enlaces C=C versus C=O es frecuentemente pobre, debido a la competencia de la enzima ER con relación a enzimas ADH (25, 26), ya que ambas dependen del mismo cofactor nicotinamida.
La obtención de (III) a partir del trans-cinamaldehído mediante el uso de catalizadores convencionales y especializados es considerada un reto, debido a que la hidrogenación del doble enlace C-C es cinética y termodinámicamente más favorable que la reducción del grupo C=O; este hecho disminuye ostensiblemente el rendimiento para la obtención del producto deseado, el alcohol cinamílico (27). Por tanto, la utilización de un biocatalizador como el hongo Aspergillus sp. puede ser una alternativa razonable para la hidrogenación selectiva de (I) y la consecuente producción del compuesto (III), una vez se lleve a cabo un proceso adicional de purificación que permita eliminar algunos productos minoritarios.
Se considera al compuesto (IV) proveniente potencialmente de las rutas [(I) (III)
(III) (IV)] ó [(I)
(IV)] ó [(I) (II)
(II) (IV)]. Es posible pensar que la etapa [(III)
(IV)]. Es posible pensar que la etapa [(III) (IV)] o no se cumplió debido a que las abundancias de (III) y (IV) permanecieron constantes entre 24 y 288 h, o se presentó rápidamente y durante las primeras 24 h del proceso, después de lo cual la biotransformación se estabiliza y las abundancias relativas de (III) y (IV) permanecen casi invariables, lo que involucraría probablemente un proceso de inhibición enzimático; sin embargo, son necesarios estudios complementarios para llegar a esta conclusión. De otro lado, la sucesión [(I)
(IV)] o no se cumplió debido a que las abundancias de (III) y (IV) permanecieron constantes entre 24 y 288 h, o se presentó rápidamente y durante las primeras 24 h del proceso, después de lo cual la biotransformación se estabiliza y las abundancias relativas de (III) y (IV) permanecen casi invariables, lo que involucraría probablemente un proceso de inhibición enzimático; sin embargo, son necesarios estudios complementarios para llegar a esta conclusión. De otro lado, la sucesión [(I) (II)
(II) (IV)] transcurriría durante las primeras 24 horas del bioproceso; hipotéticamente, esta ruta involucraría que la conversión [(II)
(IV)] transcurriría durante las primeras 24 horas del bioproceso; hipotéticamente, esta ruta involucraría que la conversión [(II) (IV)] es rápida, y no permite que el aldehído (II) se acumule en gran proporción. Es interesante anotar que para esta clase de sistemas, Stuermer et al., 2007 (26) han planteado que el aldehido α, b-insaturado no sólo se consume como resultado de una rápida reducción del grupo aldehído al alcohol alílico correspondiente (el cual no es un sustrato para las enzimas ER), sino también por una sobrerreducción del aldehído saturado (formado por la acción de la ER), para dar el alcohol saturado como producto final. Además, proponen que la reversibilidad de la interconversión de aldehído-alcohol permitiría asimismo usar el alcohol cinamílico como sustrato (para la obtención del alcohol saturado) el cual es, por supuesto, reducido por la ER cuando se encuentra como aldehído. Así, la secuencia [(III)
(IV)] es rápida, y no permite que el aldehído (II) se acumule en gran proporción. Es interesante anotar que para esta clase de sistemas, Stuermer et al., 2007 (26) han planteado que el aldehido α, b-insaturado no sólo se consume como resultado de una rápida reducción del grupo aldehído al alcohol alílico correspondiente (el cual no es un sustrato para las enzimas ER), sino también por una sobrerreducción del aldehído saturado (formado por la acción de la ER), para dar el alcohol saturado como producto final. Además, proponen que la reversibilidad de la interconversión de aldehído-alcohol permitiría asimismo usar el alcohol cinamílico como sustrato (para la obtención del alcohol saturado) el cual es, por supuesto, reducido por la ER cuando se encuentra como aldehído. Así, la secuencia [(III) (IV)] se daría por la ruta [(III)
(IV)] se daría por la ruta [(III) (I)
(I) (II
(II (IV)].
(IV)].
Los ésteres (V) y (VI), empleados para la fabricación de bases aromáticas, presentaron una baja abundancia relativa (<10%) durante todo el proceso; ambos compuestos provienen de la acetilación, debida a la acción de lipasas, de los alcoholes 3-fenil-1-propanol y cinamílico, respectivamente. Por otra parte, los productos (VII), (VIII) y (IX) resultan posiblemente de la acción de cetoácidodescarboxilasas sobre precursores de naturaleza ácido α- ó b-oxo-carboxílicos y la subsiguiente reducción del aldehído por enzimas ADH. Esta clase de transformaciones ha sido propuesta en la ruta de Ehrlich de levaduras, para convertir L-fenilalanina en 2-feniletanol (28). No obstante, estos precursores ácido oxo-carboxílicos no se detectaron en el presente estudio.
Efecto del medio de cultivo en la biotransformación
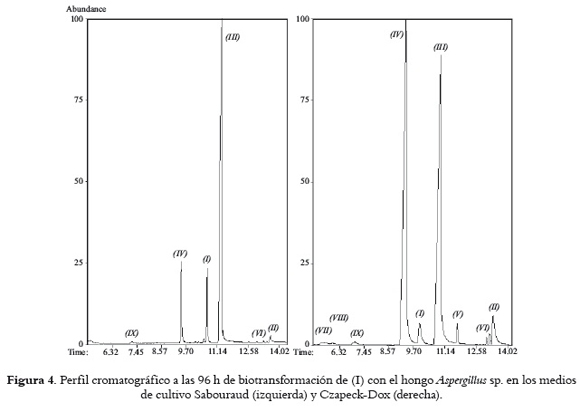
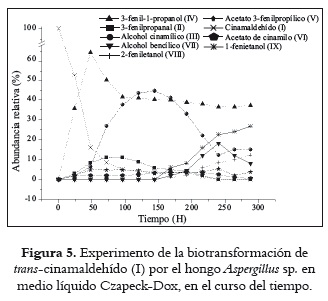
En la figura 4 se observa que un cambio del medio de cultivo afecta las abundancias relativas de los metabolitos; en particular, se aprecia que a las 96 h de biotransformación hay un cambio en la selectividad hacia la formación de (III) cuando se utiliza el medio Czapeck-Dox. En consecuencia, se llevó a cabo un estudio en el curso del tiempo para la biotransformación de (I) con Aspergillus sp. empleando este medio.
Las abundancias relativas de los metabolitos durante las 288 horas de evaluación se representan en la figura 5. En este medio, (I) se consumió rápidamente (~80% durante las primeras 48 h), transformándose mayoritariamente en (III) y (IV). El producto (IV) alcanzó cerca del 70% de la abundancia relativa al cabo de 48 horas, mientras que el alcohol insaturado (III), en este mismo lapso de tiempo sólo se acumuló en un 8%. El hecho de que (IV) alcance su concentración máxima a las 48 horas, tiempo en el cual el alcohol cinamílico apenas se está comenzando a formar, indica que éste se debe estar formando preferentemente mediante la secuencia [(I) (II)
(II) (IV)], en donde juega un papel determinante la enzima ER. Por su parte, el metabolito (III) alcanzó la mayor abundancia relativa a las 144 h de biotransformación; sin embargo, la concentración disminuyó a niveles del 15% al cabo de 240 horas. Adicionalmente, los ésteres (V) y (VI) presentaron una baja abundancia relativa (<10%) durante todo el proceso.
(IV)], en donde juega un papel determinante la enzima ER. Por su parte, el metabolito (III) alcanzó la mayor abundancia relativa a las 144 h de biotransformación; sin embargo, la concentración disminuyó a niveles del 15% al cabo de 240 horas. Adicionalmente, los ésteres (V) y (VI) presentaron una baja abundancia relativa (<10%) durante todo el proceso.
Al comparar las abundancias de los metabolitos obtenidos en ambos medios se observa que en Sabouraud el compuesto (III) alcanza en corto tiempo niveles 4 veces superiores a los obtenidos para (IV), diferente de lo que se encuentra en el medio Czapeck-Dox. Adicionalmente, en éste último medio, (III) se comporta como un metabolito intermediario, disminuyendo su concentración a expensas de su conversión a los compuestos (VII), (VIII) y (IX), los cuales incrementaron su abundancia a partir de 172 h. Este comportamiento no se observó en el medio Sabouraud. Así, el medio de cultivo Czapeck-Dox, rico en minerales, podría estar aportando iones metálicos necesarios para algunos procesos catalíticos (por ejemplo, como cofactores o ácidos Lewis), favoreciendo procesos que involucran la ER y descarboxilasas. En este sentido, Caldeira et al., 1996 (29) sugieren la participación de un centro azufre-hierro en el mecanismo de la enzima ER. Además, el medio de cultivo, posiblemente está influyendo en el estado fisiológico del hongo, lo cual, a su vez, podría inducir diferencias en la eficiencia hacia la formación de determinados productos. Algunos autores han encontrado que el estado fisiológico del microorganismo y el medio de cultivo afectan tanto el rendimiento como la selectividad de los productos, y por tanto ambos son considerados parámetros críticos en la optimización de los procesos (30-32).
CONCLUSIONES
De la biotransformación del sustrato trans-cinamaldehído (I) con el hongo filamentoso Aspergillus sp., se identifican los metabolitos 3-fenil-1-propanol, alcohol cinamílico, 3-fenilpropanal, acetato 3-fenilpropílico, acetato de cinamilo, alcohol bencílico, 1-fenilpropanol y 2-fenilpropanol, mediante una combinación de RMN 1H y 13C, EM-IE, y por comparación con los datos cromatográficos y espectrales obtenidos para muestras auténticas. Los resultados sugieren que el microorganismo tiene la capacidad de: i.) Transformar el sustrato mediante reacciones de hidrogenación del grupo carbonilo [(I) (III), (II)
(III), (II) (IV)], mediante enzimas ADH y el doble enlace C-C [(I)
(IV)], mediante enzimas ADH y el doble enlace C-C [(I) (II), (III)
(II), (III) (IV)], a través de ER, ii.) Efectuar reacciones de esterificación [acetilación; (III)
(IV)], a través de ER, ii.) Efectuar reacciones de esterificación [acetilación; (III) (VI), (IV)
(VI), (IV) (V)], por acción de lipasas, y iii.) Reducir la extensión de la cadena del sustituyente, posiblemente mediante descarboxilación [(III)
(V)], por acción de lipasas, y iii.) Reducir la extensión de la cadena del sustituyente, posiblemente mediante descarboxilación [(III) (VIII), (III)
(VIII), (III) (IX), (VIII)
(IX), (VIII) (VII)]. La transformación de trans-cinamaldehído por Aspergillus sp. estuvo influenciada por el medio de cultivo; el hongo transformó rápidamente el sustrato en medio Czapeck-Dox y su acción fue un poco más limitada en medio Sabouraud. En éste último, el producto metabólico mayoritario fue (III) (~75%), seguido por (IV) (~20%). En Czapeck-Dox, (IV) fue el producto que se formó en mayor proporción, excepto entre 120 y 168 h, intervalo en el cual (III) fue el metabolito mayoritario. La biotransformación de (I) usando Aspergillus sp. puede ser una alternativa simple y eficiente para obtener agentes de sabor y fragancias congéneres del trans-cinamaldehído. Sin embargo, para la optimización del proceso y para determinar con certeza las enzimas y los mecanismos de regulación involucrados en la biotransformación, son necesarios otros estudios.
(VII)]. La transformación de trans-cinamaldehído por Aspergillus sp. estuvo influenciada por el medio de cultivo; el hongo transformó rápidamente el sustrato en medio Czapeck-Dox y su acción fue un poco más limitada en medio Sabouraud. En éste último, el producto metabólico mayoritario fue (III) (~75%), seguido por (IV) (~20%). En Czapeck-Dox, (IV) fue el producto que se formó en mayor proporción, excepto entre 120 y 168 h, intervalo en el cual (III) fue el metabolito mayoritario. La biotransformación de (I) usando Aspergillus sp. puede ser una alternativa simple y eficiente para obtener agentes de sabor y fragancias congéneres del trans-cinamaldehído. Sin embargo, para la optimización del proceso y para determinar con certeza las enzimas y los mecanismos de regulación involucrados en la biotransformación, son necesarios otros estudios.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de Colombia, sede Medellín, y a la Dirección Nacional de Investigación, por el apoyo en la ejecución de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Durán N, de Conti R, Rodrígues JAR. Biotransformations by microorganisms, organisms and enzymes: state of art. Bol Soc Chil Quím. 2000 Abr; 45 (1): 109-121. [ Links ]
2. Vandamme EJ, Soetaert W. Bioflavours and fragrances via fermentation and biocatalysis. J Chem Technol Biot. 2002 Dec; 77 (12): 1323-1332. [ Links ]
3. Serra S, Fuganti C, Brenna E. Biocatalytic preparation of natural flavours and fragrances. Trends Biotechnol. 2005 Apr; 23 (4): 193–198. [ Links ]
4. Straathof AJJ, Panke S, Schmid A. The production of fine chemicals by biotransformation. Curr Opin Biotechnol. 2002 Dec; 13 (6): 548–556. [ Links ]
5. Pollard DJ, Woodley JM. Biocatalysis for pharmaceutical intermediates: the future is now. Trends Biotechnol. 2007 Feb; 25 (2): 66-73. [ Links ]
6. Xu P, Hua D, Ma C. Microbial transformation of propenylbenzenes for natural flavour production. Trends Biotechnol. 2007 Dec; 25 (12): 571-576. [ Links ]
7. Luna H. Aplicación de la biocatálisis a la preparación de intermediarios para la síntesis de fármacos. J Mex Chem Soc. 2004 Jul-Sep; 48 (3): 211-219. [ Links ]
8. Ran N, Zhao L, Chen Z, Tao J. Recent applications of biocatalysis in developing green chemistry for chemical synthesis at the industrial scale. Green Chem. 2008 Apr; 10 (4): 361-372. [ Links ]
9. Etschmann MMW, Sell D, Schrader J. Screening of yeasts for the production of the aroma compound 2-phenylethanol in a molasses-based medium. Biotechnol Lett. 2003 Feb; 25 (7): 531–536. [ Links ]
10. Ishihara K, Hamada H, Hirata T, Nakajima N. Biotransformation using plant cultured cells. J Mol Catal B-Enzym. 2003 Sep; 23 (2-6): 145-170. [ Links ]
11. March J. Advanced Organic Chemistry. 4a ed. New York, EU: John Wiley and Sons; 1992. 1099 p. [ Links ]
12. Bustillo AJ, García-Pajón CM, Aleu J, Hernández-Galán R, Collado IG. Studies on biotransformation of (±)-1-(4'-chlorophenyl)- 2-phenylethanol. Tetrahedron-Asymmetr. 2003 Nov; 14 (23): 3755-3760. [ Links ]
13. Miyazawa M, Nobata M, Hyakumachi M, Kameoka H. Biotransformation of (+)- and (_)-camphorquinones to camphanediols by Glomerella cingulata. Phytochemistry. 1997 Jan; 44 (1): 79-81. [ Links ]
14. Wang SY, Chen PF, Chang ST. Antifungal activities of essential oils and their constituents from indigenous cinnamon (Cinnamomum osmophloeum) leaves against wood decay fungi. Bioresource Technol. 2005 May; 96 (7): 813–818. [ Links ]
15. Cheng SS, Liu JY, Chang EH, Chang ST. Antifungal activity of cinnamaldehyde and eugenol congeners against wood-rot fungi. Bioresource Technol. 2008 Jul; 99 (11): 5145-5149. [ Links ]
16. Tzortzakis NG, Economakis CD. Antifungal activity of lemongrass (Cympopogon citratus L.) essential oil against key postharvest pathogens. Innov Food Sci Emerg Tech. 2007 Jun; 8 (2): 253-258. [ Links ]
17. Muller AJ, Bowers JS, Eubanks JR, Geiger CC, Santobianco JG, inventors; First Chemical Corporation, assignee. Processes for preparing hydrocinnamic acid. US Patente 5,939,581. 1999 Aug 17. [ Links ]
18. Wiegers WJ, Spreker MA, inventors; International Flavors & Fragances, assignee. Perfumery uses of esthers of phenyl alkanols. US Patente 4,524,021. 1985 Jun 18. [ Links ]
19. Joshi BP, Sharma A, Sinha AK. Efficient one-pot, two-step synthesis of (E)-cinnmaldehydes by dehydrogenation–oxidation of arylpropanes using DDQ under ultrasonic irradiation. Tetrahedron. 2006 Mar; 62 (11): 2590-2593. [ Links ]
20. Sinha AK, Joshi BP, Ruchi D, inventors; Council of Scientific and Industrial Research, assignee. Process for the preparation of substituted trans-cinnamaldehyde, a natural yellow dye, from phenylpropane derivatives. US Patente. 6,566,557. 2003 May 20. [ Links ]
21. Castelijns AM, Hogeweg JM, van Nispen SP, inventors; DSM N.V., assignee. Process for the preparation of 3-phenylpropanal. US Patente 5,811,588. 1998 Sep 22. [ Links ]
22. Parmar VS, Jain SC, Bisht KS, Jain R, Taneja P, Jha A, et al. Phytochemistry of the genus Piper. Phytochemistry. 1997 Oct; 46 (4): 597-673. [ Links ]
23. Correa YM, Durango DL, García CM. Transformación microbiana del arilpropanoide cinamaldehído con el hongo fitopatógeno Colletotrichum acutatum. Vitae. 2009 Ene-Abr; 16 (1): 83-91. [ Links ]
24. Carballeira JD, Quezada MA, Hoyos P, Simeó Y, Hernaiz MJ, Alcántara AR, et al. Microbial cells as catalysts for stereoselective red–ox reactions. Biotechnol Adv. 2009 Nov-Dec; 27 (6): 686-714. [ Links ]
25. Hall M, Hauer B, Stuermer R, Kroutil W, Faber K. Asymmetric whole-cell bioreduction of an α,b-unsaturated aldehyde (citral): Competing prim-alcohol dehydrogenase and C–C lyase activities. Tetrahedron-Asymmetr. 2006 Nov; 17 (21): 3058-3062. [ Links ]
26. Stuermer R, Hauer B, Hall M, Faber K. Asymmetric bioreduction of activated C=C bonds using enoate reductases from the old yellow enzyme family. Curr Opin Chem Biol. 2007 Apr; 11 (2): 203-213. [ Links ]
27. Baeza BB, Ramos IR, Ruiz AG. Influence of Mg and Ce addition to ruthenium based catalysts used in the selective hydrogenation of α, b-unsaturated aldehydes. Appl Catal A-Gen. 2001 Jan; 205 (1-2): 227–237. [ Links ]
28. Eshkol N, Sendovski M, Bahalul M, Katz-Ezov T, Kashi Y, Fishman A. Production of 2-phenylethanol from L-phenylalanine by a stress tolerant Saccharomyces cerevisiae strain. J Appl Microbiol. 2009 Jan; 106 (2): 534-542. [ Links ]
29. Caldeira J, Feicht R, White H, Teixeira M, Moura JJ, Simon H, et al. EPR and Mossbauer spectroscopic studies on enoate reductase. J Biol Chem. 1996 Aug; 271 (31): 18743-18748. [ Links ]
30. Gurram SP, Kollu NR, Sivadevuni G, Solipuram MR. Biotransformation of albendazole by Cunninghamella blakesleeana: influence of incubation time, media, vitamins and solvents. Iranian J Biotech. 2009 Oct; 7 (4): 205-215. [ Links ]
31. Hrdlicka PJ, Sørensen AB, Poulsen BR, Ruijter G, Visser J, Iversen JJL. Characterization of nerolidol biotransformation based on indirect on-line estimation of biomass concentration and physiological state in batch cultures of Aspergillus niger. Biotechnol Prog. 2004 Jan-Feb; 20 (1): 368–376. [ Links ]
32. Demir AS, Ayhan P, Demirtas U, Erkýlýc U. Fusarium roseum and Aspergillus oryzae-mediated enantioselective reduction of benzils to benzoins. J Mol Catal B-Enzym. 2008 Nov; 55 (3-4): 164-168. [ Links ]
Recibido: Marzo 23 de 2010
Aceptado: Julio 30 de 2010