Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae v.17 n.3 Medellín set./dez. 2010
FARMACOLOGÍA Y TOXICOLOGÍA
ACTIVIDAD INHIBITORIA DE Murraya paniculata CONTRA FOSFOLIPASAS A2 MIOTÓXICAS
INHIBITORY ACTIVITY OF Murraya paniculata AGAINST MYOTOXIC PHOSPHOLIPASES A2
Tatiana LOBO E.1; Jaime A. PEREAÑEZ2; Karol Zapata A.3; Pablo A. GUTIÉRREZ3; Mónica LONDOÑO2; Vitelbina NÚÑEZ2,4; Benjamín A. ROJANO5
1 Escuela de Química. Universidad Nacional de Colombia, sede Medellín. Medellín, Colombia. tloboech@unal.edu.co.
2 Programa de Ofidismo y Escorpionismo. Universidad de Antioquia. Medellín, Colombia.
3 Escuela de Biociencias. Universidad Nacional de Colombia, sede Medellín. Medellín, Colombia
4 Escuela de Microbiología Universidad de Antioquia. Medellín, Colombia.
5 Escuela de Química. Universidad Nacional de Colombia, sede Medellín. Medellín, Colombia.
RESUMEN
Los envenenamientos causados por serpientes del género Bothrops constituyen un problema de salud en algunos países tropicales, no solamente por la mortalidad sino por el alto porcentaje de incapacidades físicas que ocasionan. Las fosfolipasas A2 (PLA2) son componentes abundantes en los venenos bothrópicos y crotálicos, y se caracterizan por inducir daños irreversibles en el músculo. Considerando el aporte de las plantas en el tratamiento ofídico, este trabajo se enfocó en la búsqueda de inhibidores de las fosfolipasas, bien sea como alternativa terapéutica o como coadyuvante del tratamiento ofídico. De un tamizaje de 37 especies de plantas vasculares y briofitos contra las PLA2, se seleccionó la especie Murraya paniculata por su promisoria actividad preliminar. Se siguió con el fraccionamiento biodirigido por la evaluación de la actividad inhibitoria de la PLA2 y de la fracción con mayor actividad inhibitoria, por medio de cromatografía de gases acoplada a masas se identificaron metabolitos responsables de la actividad, para proponer un modelo de inhibición enzima-sustrato. Los resultados de este proyecto pretenden contribuir en la búsqueda de moléculas inhibitorias de las PLA2 en plantas vasculares, como la especie M. paniculata, que podrían llegar a ser una herramienta en el desarrollo de nuevos productos para mejorar el pronóstico del accidente ofídico.
Palabras clave: fosfolipasas A2, Murraya paniculata, Bothrops, docking molecular.
ABSTRACT
Envenomation by snakes of the genus Bothrops are a health problem in some tropical countries, not only because of the mortality but given the high percentage of physical disabilities it causes. Phospholipases A2 (PLA2) are abundant constituents in bothropic and crotalic venoms, characterized by inducing irreversible muscle damage. Due to the contribution of plants in the snakebite treatment, we focus on the search of phospholipases inhibitors, either as an alternative treatment or as a therapeutic adjuvant of the current treatments. From a screening of 37 vascular plants and bryophytes in the search for such inhibitors, the species Murraya paniculata was selected due to its promising preliminary activity. Starting from this point further work consisting of bioassay-guided fractionation followed by the evaluation of the inhibitory activity of PLA2, the metabolites responsible for the activity were detected through a tandem of gas chromatography - mass spectrometry in the most active fraction, to propose substrate-enzyme inhibition model. The aims of this project was the search of promising compounds with an inhibitory activity of the PLA2 in vascular plants such as M. paniculata, that could become tools for developing new products to improve the prognosis of the snakebite.
KEYWORDS: phospholipase A2, Murraya paniculata, Bothrops, molecular docking.
INTRODUCCIÓN
Los accidentes ofídicos constituyen un problema de salud pública en países tropicales. En América Latina se presentan entre 130.000 y 150.000 casos cada año, que ocasionan aproximadamente 2.300 muertes (1). El 90-95% de las mordeduras son producidas por serpientes de la familia Viperidae, principalmente por especies del género Bothrops, cuyo veneno induce efectos a nivel local y sistémico tales como edema, hemorragia, dermonecrosis, mionecrosis, alteraciones de la coagulación, hipotensión e insuficiencia renal aguda, entre otros (2, 3). Muchos de dichos efectos aparecen muy rápidamente y los antivenenos han demostrado tener ciertas limitaciones para neutralizarlos; tales son los casos del edema y la mionecrosis (2, 4).
Entre los componentes de los venenos, uno de los principales responsables de los efectos son las fosfolipasas A2 (PLA2: EC 3.1.1.4), enzimas que hidrolizan los glicerofosfolípidos en la posición sn-2, liberando lisofosfolípidos y ácidos grasos (5). Estas proteínas, además de los efectos ya mencionados, también acarrean efectos tóxicos como cardiotoxicidad, hemólisis, edema, inhibición y/o agregación plaquetaria (6). Las PLA2 también están presentes en los venenos del género Crotalus, y son responsables del efecto neurotóxico y de la miotoxicidad local y sistémica ocasionados por el veneno. Paralelamente existe un subgrupo de proteínas conocido como ''PLA2 homólogas'', que no ejercen actividad catalítica debido a una mutación en un aminoácido del sitio activo; pero aunque estas toxinas carecen de acción lipolítica, producen efectos biológicos similares a los de sus homólogas catalíticamente activas, entre los cuales se destacan la miotoxicidad y la inflamación (7). Además, las PLA2 enzimáticamente activas tienen alta homología con las PLA2 humanas involucradas en procesos inflamatorios, y son utilizadas frecuentemente como modelo para inducir tal estado fisiopatológico (8-10).
En los últimos años se han intensificado las investigaciones sobre inhibidores de PLA2, con el fin de contribuir al hallazgo de moléculas que apoyen el tratamiento del accidente ofídico, o como coadyuvantes para mejorar el pronóstico y la evolución de sus efectos locales (11). Además, la búsqueda específica de inhibidores permite profundizar en los mecanismos de acción de las PLA2 de venenos, así como en la identificación y caracterización de la interacción de las proteínas con su ligando, lo cual aún no está totalmente claro (12).
Las plantas han sido una de las principales fuentes de compuestos bioactivos frente a los venenos o las toxinas aisladas de los mismos (13 -15). Un grupo de enzimas sobre las cuales se ha enfocado el estudio de los metabolitos activos son las PLA2 (10, 16). Para aproximarse a los mecanismos de inhibición de las fosfolipasas se han propuesto estudios de docking molecular, que han demostrado la interacción selectiva entre compuestos derivados de plantas y el sitio activo de las PLA2 (17).
En la búsqueda de inhibidores de estas enzimas, se realizó un tamizaje de 37 extractos etanólicos de especies de plantas vasculares y briofitos contra la actividad enzimática de PLA2 del veneno completo de Bothrops asper (18). A partir de los resultados preliminares se selecciona Murraya paniculata (L.) Jack (Rutaceae), por su efecto antagónico e inhibidor de tales proteínas. Adicionalmente, existe un informe según el cual el extracto acuoso de las raíces de esta especie es usado en medicina tradicional contra la mordedura de serpiente (19). Por las razones anteriores, este estudio busca determinar la actividad inhibitoria de las fracciones y los compuestos mayoritarios de M. paniculata sobre algunos efectos inducidos por PLA2 purificadas de venenos de serpientes colombianas. Además, mediante estudios de modelamiento molecular se propone un posible mecanismo de inhibición de los metabolitos presentes en esta planta sobre las PLA2.
MATERIALES Y MÉTODOS
Venenos y reactivos
Los venenos de Crotalus durissus cumanensis (Departamento del Meta, 4 especímenes), Bothrops atrox (Departamento del Meta, 4 especímenes) y Bothrops asper (Magdalena Medio antioqueño, 18 especímenes), se obtuvieron por extracción manual, de animales en cautiverio en el Serpentario de la Universidad de Antioquia. Posteriormente fueron centrifugados a 800 g durante 15 minutos, y los sobrenadantes, liofilizados y almacenados a -20°C hasta su uso. Todos los reactivos utilizados fueron grado reactivo o analítico.
Toxinas
La toxina Cdcum6 (PLA2 del complejo crotoxina del veneno de la cascabel colombiana, C. d. cumanensis) fue purificada usando cromatografía de exclusión molecular seguida de HPLC en fase reversa (20). La miotoxina I de B. atrox (PLA2 homologa K49) fue purificada por cromatografía de intercambio catiónico seguida de HPLC en fase reversa (21). Una fracción rica en PLA2 básicas (Fx- V B. asper) y con actividad enzimática fue purificada mediante cromatografía de intercambio catiónico. Con este propósito, se diluyeron 250 mg de veneno en Tris 0,05 M, KCl 0,1 M (pH: 7,0) y se aplicaron a una columna de Carboximetil-Sephadex C-25, la cual fue equilibrada con el mismo buffer; las proteínas fueron eluídas a una velocidad de flujo de 1 mL/min, con un gradiente de 0,1 a 0,75 M KCl. En todos los casos el perfil cromatográfico fue monitorizado a 280 nm, y la pureza de las proteínas, evaluada por electroforesis SDS-PAGE.
Material vegetal
La especie Murraya paniculata (L.) Jack, de la familia Rutaceae, fue seleccionada por su actividad preliminar contra la actividad enzimática de PLA2 del veneno completo de Bothrops asper (18). Para este trabajo en el campus universitario de la Universidad Nacional de Colombia, sede Medellín, fueron colectados 3 kg de esta planta (6º15'41'' N, 75º34'35,5'' W), y se depositó una muestra testigo en el Herbario de la Universidad Nacional, Gabriel Gutiérrez Villegas (Medellín) bajo el código TL-108.
Fraccionamiento biodirigido
El extracto vegetal de la especie vegetal Murraya paniculata, obtenido por medio de percolación con etanol, se fraccionó por cromatografía de columna con sílica gel 60 F254 (70-230 mesh), con un sistema de solventes hexano-diclorometano-metanol a gradiente. Se obtuvieron 15 fracciones y se evaluó su actividad inhibitoria contra PLA2 del veneno completo de B. asper. Para la visualización de los perfiles cromatográficos y el cálculo de los Rf de cada compuesto se utilizaron placas de aluminio de sílica gel 60 F254, eluídas con los sistemas hexanodiclorometano 9,5:0,5 para las fracciones apolares, y hexano-acetona 9:1 para las fracciones polares.
Cromatografía de gases acoplada a espectrometría de masas (GC-MS)
La fracción con mayor actividad inhibitoria contra las PLA2 (F3) fue analizada por GC-MS en un cromatógrafo de gases Agilent 6890 acoplado a un espectrómetro de masas (5973), con una columna capilar ZB-35 (30 m x 0,25 mm x 0,25 μm). Se inyectó 1,0 μL de muestra disuelta en hexano usando helio como fase móvil a un flujo de 1,0 mL/min (velocidad lineal 36 cm/s); la inyección se hizo en modo splitless y la temperatura del inyector fue de 325°C, con una presión de 7,60 psi. La temperatura inicial de la columna fue de 50°C durante 3 minutos, luego se incrementó en 5ºC/min hasta alcanzar 150°C, donde se mantuvo por 5 minutos, y finalmente se elevó 5ºC/min hasta 300°C donde permaneció 12 minutos, para un tiempo de corrida total de 70 minutos. Para adquirir los datos de masas se fijó la temperatura del detector en 350°C; se hizo el barrido en modo SCAN con un retardo de solvente de 3 minutos y un intervalo de masas entre 30 y 800 umas. Para la identificación de los picos se empleó la base de datos NIST 98.
Inhibición de la actividad de la fosfolipasa A2
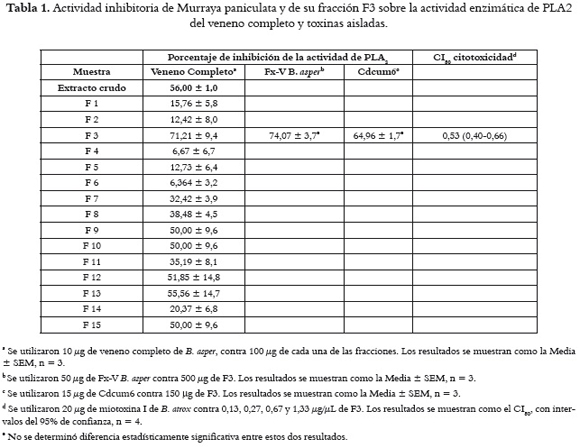
Se examinó la inhibición de la actividad de PLA2 inducida por veneno completo de B. asper, Cdcum6 o Fx-V B. asper, usando como sustrato fosfolípidos de yema de huevo en presencia de 1% de Tritón X-100. Fueron preincubadas concentraciones fijas de veneno completo, Cdcum6 o Fx-V B. asper (10, 15 y 50 μg respectivamente, seleccionadas del segmento lineal de las curvas de actividad), con 100, 150 o 500 μg del extracto completo o de su fracción activa; posteriormente las mezclas se incubaron durante 15 minutos con el sustrato, y por último, los ácidos grasos producidos se extrajeron y titularon con NaOH 0,018 N, siguiendo el método de Dole (22). El porcentaje de inhibición de la actividad de PLA2 se calculó tomando los respectivos controles negativos y positivos (veneno o toxinas) como el 0 y 100% de actividad, respectivamente.
Inhibición de la citotoxicidad inducida por la miotoxina de B. atrox
Los experimentos de inhibición de la actividad citotóxica inducida por la miotoxina I de B. atrox se practicaron sobre células musculares de ratón C2C12 (ATCC CRL-1772) (23), mezclando 25, 50,100 y 200 μg de la fracción activa con 20 mg toxina en 150 μL de medio (Dulbecco's Modified Eagle's Medium suplementado con 1% de suero fetal bovino), e incubando las soluciones a 37°C durante 30 minutos; posteriormente, 150 μL de las mezclas se adicionaron a un plato de 96 pozos y fueron incubados a 37°C durante tres horas. Finalmente se colectó una alícuota del sobrenadante para la determinación de la actividad de la enzima deshidrogenasa láctica (LDH; EC 1.1.1.27) liberada de las células dañadas, en un ensayo cinético (Wiener LDH-P UV). El porcentaje de inhibición se calculó teniendo el medio y la toxina como controles de 0 y 100% citotoxicidad, respectivamente.
Docking
La estructura del compuesto mayoritario, cis octadeca-9-enoato de etilo, se construyó con el programa Ghemical, y su geometría fue optimizada con un algoritmo de gradiente conjugado, utilizando 2.500 pasos de minimización, una tolerancia de 0.001 y el campo de fuerzas Tripos 5.2 (24). Como no se cuenta con la estructura cristalográfica de ninguna de las toxinas utilizadas, para el modelamiento molecular se seleccionaron otras estructuras homólogas, aisladas de venenos de serpientes del mismo género. Se utilizó como molécula receptora la estructura cristalográfica de la miotoxina II de Bothrops asper, depositada en el Protein Data Bank con el código de acceso 1CLP (25), que posee un 89% de identidad con la miotoxina I de B. atrox utilizada en este estudio (21).
Los ligandos fueron encajados en la estructura de la miotoxina mediante un protocolo de docking de cuerpo flexible con el programa AutoDock 4,0 (26). Se reconstruyeron los protones con AutoDock Tools (ADT) y las cargas se calcularon con el método Gasteiger, según el protocolo implementado en el mismo programa. Las aguas se eliminaron del archivo pdb para el proceso de Docking. Los mapas que representan la proteína se calcularon con la opción AutoGrid, utilizando una grilla de 40 x 40 x 40 Å3 con espaciamiento de grilla de 0,375 Å, centrada en el sitio activo de la miotoxina. Para el docking se utilizó un algoritmo genético lamarquiano y se practicaron 100 simulaciones, con una población inicial de 150 moléculas y un máximo de 2.500.000 evaluaciones de energía. Las tasas de mutación y entrecruzamiento fueron de 0,02 y 0,8 respectivamente. Se escogió el modelo con menor valor de energía asignado por AutoDock.
Análisis estadístico
Con el fin de determinar si existía diferencia significativa entre los porcentajes de inhibición de la actividad de PLA2 inducida por Cdcum6 y Fx-V B. asper, se practicó un análisis de t-Student con un límite de confianza del 95%. Como la muestra no se ajustaba a una distribución normal, este resultado se confirmó con la prueba de Mann-Whitney, la cual no mostró diferencia estadísticamente significativa entre la inhibición de Fx-V B. asper y la de Cdcum6. Con el propósito de calcular la concentración inhibitoria 50% (CI50) para la actividad citotóxica inducida por la miotoxina I de B. atrox, se realizó una regresión lineal simple a partir del segmento lineal de la curva mg/ mL fracción activa vs. porcentaje de inhibición. Los resultados se muestran como la media ± SEM (error estándar de la media). El número de repeticiones es aclarado en cada caso.
RESULTADOS Y DISCUSIÓN
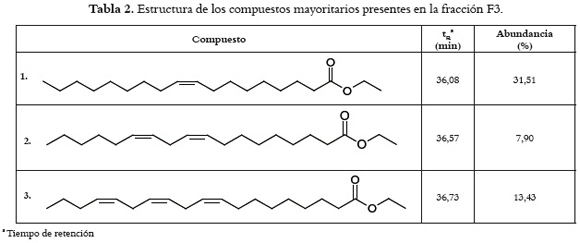
El fraccionamiento biodirigido del extracto etanólico de hojas de M. paniculata arrojó 15 fracciones (F1-F15), con porcentajes de inhibición sobre la actividad de PLA2 del veneno completo de B. asper, que variaron entre 12,42 y 71,21 %, como se ilustra en la tabla 1. Por la alta capacidad inhibitoria de la fracción F3, ésta fue seleccionada para la identificación de sus compuestos por medio de GC-MS. De allí se determinó la presencia de ácidos grasos esterificados con un grupo etilo (compuestos 1-3) como compuestos mayoritarios, como se observa en la tabla 2. Estos compuestos fueron identificados de acuerdo con su patrón de fragmentación en el espectro de masas, por medio de comparaciones con compuestos registrados en la base de datos NIST 98. En la figura 1 se aprecian los espectros de masas del compuesto mayoritario (1), y el espectro comparativo de la base de datos, con el cual tiene un porcentaje de similitud del 99%, corrobora su estructura. Además, en esta fracción se detectaron compuestos minoritarios de tipo sesquiterpénico. Después de la caracterización, se estableció la capacidad inhibitoria de F3 sobre la actividad enzimática de PLA2 purificadas de venenos de serpientes colombianas (Fx-V B. asper y Cdcum6), ensayos donde se estableció que esta fracción neutraliza con potencia similar PLA2 crotálicas y bothrópicas. Por otro lado, F3 también neutralizó la citotoxicidad inducida por una PLA2 homóloga (enzimáticamente inactiva) del veneno de B. atrox con un CI50 de 0,53 μg/μL, como se representa en la tabla 1.
Con los resultados descritos, se realizaron estudios de docking molecular, que se ilustran en la figura 1, con los cuales se demostró que los compuestos identificados en la fracción mencionada interactúan con aminoácidos del canal hidrofóbico y otros residuos de gran importancia para la catálisis.
La miotoxicidad y la inflamación son efectos muy frecuentes en la mayoría de los accidentes ofídicos causados por serpientes de la familia Viperidae (27). Las enzimas responsables de la inducción de los efectos mencionados son las PLA2, que son dependientes de Ca2+ y catalizan la hidrólisis de la posición sn-2 de glicerofosfolípidos, produciendo lisofosfolípidos y ácidos grasos (5). En la figura 2, se puede observar que la estructura de las fosfolipasas está compuesta por tres hélices largas (α1- α3), una hélice corta, un ala beta y un sitio de unión al calcio. Estas proteínas tienen longitud variable, de 119 a 134 aminoácidos, sus dos α-hélices antiparalelas (residuos 37-54 y 90-109, respectivamente) definen, con ayuda de la α-hélice N-terminal (residuos 1-12), el canal hidrofóbico. Dicho canal es el encargado de conducir el sustrato hacia el sitio activo que, a su vez, está conformado por cuatro residuos: H48, D49, Y52 y D99. Otra región altamente conservada en estas proteínas es el dominio de unión al calcio, que compromete Y28, G30 y G32, los cuales, en combinación con D49, son los encargados de unir el Ca2+ requerido para la catálisis. Además, existe una superficie de unión interfacial, que media la adsorción de la enzima en la interfase lípido-agua entre el exterior y la bicapa lipídica de las membranas celulares (28).
Asimismo, el subgrupo conocido como ''PLA2 homólogas'' presenta una sustitución del D49 por K, R, S, Q, o N, entre otras, que conduce a la pérdida de unión al Ca2+ y, subsecuentemente, de la actividad enzimática (29, 30). Aunque estas toxinas carecen de acción lipolítica, tienen efectos biológicos similares a los de las enzimas catalíticamente activas, como la miotoxicidad y la inflamación (7, 30).
En este estudio se logró determinar que una fracción (F3) aislada de M. paniculata, con alto contenido de etil ésteres derivados de ácidos grasos, neutraliza con gran eficacia las PLA2 crotálicas y bothrópicas, así como PLA2 homólogas. Con el fin de determinar el tipo de interacciones responsables de la inhibición de las actividades de las toxinas por parte de los compuestos principales de F3, se hicieron estudios de modelamiento molecular. Los compuestos etil ésteres identificados en la fracción F3 de M. paniculata tienen varias características que explican su actividad inhibitoria. El docking de cuerpo flexible del compuesto mayoritario, cis octadeca-9-enoato de etilo (1), en el sitio análogo al sitio activo de la PLA2 de B. asper, sugiere que los oxígenos de los etil ésteres de ácidos grasos podrían interactuar con los nitrógenos de las cadenas laterales de la H48 y/o K49 de la miotoxina II de B. asper. Sin embargo, como el sitio activo de las PLA2 está enmarcado por una cavidad hidrofóbica delimitada por las cuatro hélices, tiene la profundidad apropiada para acomodar dos cadenas alifáticas, como se observa en la figura 1. Una de estas cadenas alifáticas es estabilizada mediante la formación de puentes de hidrógeno del extremo polar de los fosfolípidos con las cadenas laterales de la hélice α2 y el esqueleto de la proteína. La segunda cadena alifática, a su vez, es estabilizada principalmente mediante interacciones de van der Waals con los aminoácidos hidrofóbicos que delimitan el sitio de unión (L2, L5, I9, P17, A18, Y22, V102 y L106) (31), como puede observarse en la figura 1. En el caso del cis octadeca- 9-enoato de etilo, la presencia de la α-hélice corta en la proteína obliga a la cadena alifática a plegarse sobre sí misma, ocupando la estructura proteica en toda su extensión. La cavidad hidrofóbica tiene una longitud aproximada de 12 Å, que corresponde a un etil éster con nueve carbonos en la cadena alifática. En consecuencia, no es sorprendente que las cadenas alifáticas de los compuestos 1, 2 y 3 de la fracción activa F3, presenten insaturaciones a partir del carbono 9, lo que facilitaría la adopción de una conformación más compatible con el sitio de unión. La restricción de los grados de libertad conformacional mediante la introducción de dobles enlaces también puede tener implicaciones en la constante de disociación, mediante la reducción de la entropía conformacional en el proceso de unión. Al analizar la estructura cristalográfica de otras fosfolipasas en complejos con ácido esteárico (31) y 1-O-octil-2-heptilfosfonil-sn-glicero-3-fosfoetanolamina (32), se observa que estos compuestos también ocupan el canal hidrofóbico utilizando dos cadenas alifáticas. El repliegue del cis octadeca-9-enoato de etilo impediría la unión de una segunda molécula del inhibidor, aunque no se descarta la existencia de un mecanismo de unión que implique dos moléculas por sitio activo a concentraciones mayores del ligando.
A pesar de que los estudios de modelamiento molecular se efectuaron con una PLA2 homóloga, las uniones descritas entre los compuestos de F3 y las PLA2 enzimáticamente activas serían similares, bloqueando el canal hidrofóbico y el subsecuente acceso del sustrato por el mismo, lo que se traduciría en disminución de la actividad enzimática, efecto que se observó en este estudio. Adicionalmente, las interacciones entre los compuestos de etil éster derivados de ácidos grasos y las PLA2 homólogas, ya mencionadas, son de gran importancia para la inhibición de los efectos tóxicos inducidos por dichas proteínas, en correspondencia con estudios previos, donde se ha demostrado que la libre accesibilidad por el canal hidrofóbico hacia el sitio similar al sitio activo de estas proteínas es un proceso necesario para inducir la miotoxicidad, efecto directamente relacionado con la citotoxicidad evaluada en este trabajo (24, 33).
CONCLUSIONES
Los resultados obtenidos en la inhibición de la actividad enzimática de PLA2 y la citotoxicidad se apoyaron en los estudios de modelamiento molecular, donde se demuestra que los compuestos con etil ésteres de ácidos grasos bloquean selectivamente el canal hidrofóbico de estas proteínas. La identificación de las moléculas inhibidoras descritas en este trabajo permitirá profundizar en los mecanismos de acción de PLA2 y posibilita el desarrollo de productos farmacéuticos que mejoren el pronóstico del accidente ofídico.
AGRADECIMIENTOS
Los autores agradecen al Profesor Jair Gaviria y al Laboratorio de Análisis Instrumental de la Universidad Nacional de Colombia por la toma de datos de GS-MS, asimismo, a la Universidad Nacional de Colombia, Dirección de Investigación Medellín Dime (Código 201010 07698) y a Colciencias (Proyecto 393-2006), por la financiación de este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Chippaux JP. Snake venoms and envenomations. Florida, USA: Krieger Publishing Company; 2006. 287 p. [ Links ]
2. Meier J, White J (Eds.) Handbook of clinical toxicology of animal, venoms and poisons. Boca Ratón, United States: CRC Press; 1995. Clinical toxicology of snakebite in South America. p. 667-688. [ Links ]
3. Meier J, White J, editores. Handbook of clinical toxicology of animal, venoms and poisons. Boca Ratón, United States: CRC Press; 1995. Clinical toxicology of snakebite in Central America. p. 645-665. [ Links ]
4. Lomonte B, Lungren J, Johansson B, Bagge U. The dynamics of local tissue damage induced by Bothrops asper snake venom and myotoxin II on the mouse cremaster muscle: an intravital and electron microscopic study. Toxicon. 1994 Jan; 32 (1): 41-55. [ Links ]
5. Six DA, Dennis EA. The expanding superfamily of phospholipase A2 enzymes: classification and characterization. Biochim Biophys Acta. 2000 Oct 31; 1488 (1-2): 1-19. [ Links ]
6. Kini RM. Excitement ahead: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon. 2003 Dec; 42 (8): 827-840. [ Links ]
7. Lomonte B, Angulo Y, Calderon L. An overview of lysine-49 phospholipase A2 myotoxins from crotalid snake venoms and their structural determinants of myotoxic action. Toxicon. 2003 Dec; 42 (8): 885-901. [ Links ]
8. Dennis EA. Diversity of group types, regulation, and function of phospholipase A2. J Biol Chem. 1994 May 6; 269 (18): 13057-13060. [ Links ]
9. Lehr M. Phospholipase A2 inhibitors in inflammation. Expert Opin Ther Pat. 2001 Jul; 11 (7): 1123-1136. [ Links ]
10. da Silva SL, Calgarotto AK, Maso V, Damico DC, Baldasso P, Veber CL, et al. Molecular modeling and inhibition of phospholipase A2 by polyhydroxy phenolic compounds. Eur J Med Chem. 2009 Jan; 44 (1): 312-321. [ Links ]
11. Hage-Melim LI, da Silva CH, Semighini EP, Taft CA, Sampaio SV. Computer-aided drug design of novel PLA2 inhibitor candidates for treatment of snakebite. J Biomol Struct Dyn. 2009 Aug; 27 (1): 27-36. [ Links ]
12. Nirmal N, Praba GO, Velmurugan D. Modeling studies on phospholipase A2-inhibitor complexes. Indian J Biochem Biophys. 2008 Aug; 45 (4): 256-262. [ Links ]
13. Núñez V, Castro V, Murillo R, Ponce-Soto LA, Merfort I, Lomonte B. Inhibitory effects of Piper umbellatum and Piper peltatum extracts towards myotoxic phospholipases A2 from Bothrops snake venoms: isolation of 4-nerolidylcatechol as active principle. Phytochemistry. 2009 May; 66 (9): 1017-1025. [ Links ]
14. Soares AM, Ticli FK, Marcussi S, Lourenço MV, Januario AH, Sampaio SV, et al. Medicinal plants with inhibitory properties against snake venoms. Curr Med Chem. 2005 Oct; 12 (22): 2625-2641. [ Links ]
15. Leanpolchareanchai J, Pithayanukul P, Bavovada R. Antinecrosis potential of polyphenols against snake venoms. Immunopharmacol and Immunotoxicol. 2009 Dec; 31 (4): 556-562. [ Links ]
16. da Silva SL, Calgarotto AK, Chaar JS, Marangoni S. Isolation and characterization of ellagic acid derivatives isolated from Casearia sylvestris SW aqueous extract with anti-PLA2 activity. Toxicon. 2008 Nov; 52 (6): 655-666. [ Links ]
17. Leanpolchareanchai J, Pithayanukul P, Bavovada R, Saparpakorn P. Molecular docking studies and anti-enzymatic activities of Thai mango seed kernel extract against snake venoms. Molecules. 2009 Mar 31; 14 (4): 1404-1422. [ Links ]
18. Pereañez JA, Núñez V, Lobo T, Rojano B, Gaviria CA, Vargas LJ, et al. Actividad inhibitoria plantas contra fosfolipasas A2 de serpientes y su relación con la actividad antioxidante: selección de Swietenia macropylla. Sección de Poster presentado en: X Congreso Colombiano de Fitoquímica; 2009 Jun 9-12; Popayán, Colombia. [ Links ]
19. Kong YC, Ng KG, But PPH, Li Q, Yu SX, Zhang HT, et al. 1986. Sources of the anti-implantation alkaloid yuehchukene in the genus Murraya. J Ethnopharmacol. 1986 Feb; 15 (2): 195-200. [ Links ]
20. Pereañez JA, Núñez V, Huancahuire-Vega S, Marangoni S, Ponce-Soto LA. Biochemical and biological characterization of a PLA2 from crotoxin complex of Crotalus durissus cumanensis. Toxicon. 2009 Apr; 53 (5): 534-542. [ Links ]
21. Núñez V, Arce V, Gutiérrez JM, Lomonte B. Structural and functional characterization of myotoxin I, a Lys49 phospholipase A2 homologue from the venom of the snake Bothrops atrox. Toxicon. 2004 Jul; 44 (1): 91-101. [ Links ]
22. Dole VP. A relation between non-esterified fatty acids in plasma and the metabolism of glucose. J Clin Invest. 1956 Feb; 35 (2): 150-154. [ Links ]
23. Lomonte B, Angulo Y, Rufin S, Cho W, Giglio JR, Ohno M, et al. Comparative study of the cytolytic activity of myotoxic phospholipases A2 on mouse endothelial (tEnd) and skeletal muscle (C2C12) cells in vitro. Toxicon. 1999 Jan; 37 (1): 145-158. [ Links ]
24. Hassinen T, Peräkylä M. New energy terms for reduced protein models implemented in an off-lattice force field. J Comput Chem. 2001 Sep; 22 (12): 1229-1242. [ Links ]
25. Arni RK, Ward RJ, Gutiérrez JM, Tulinsky A. Structure of a calcium-independent phospholipase-like myotoxic protein from Bothrops asper venom. Acta Crystallogr D Biol Crystallog. 1995 May; 51 (Pt 3): 311-317. [ Links ]
26. Goodsell DS, Morris GM, Olson AJ. Automated docking of flexible ligands: applications of AutoDock. J Mol Recognit. 1996 Jan-Feb; 9 (1): 1-5. [ Links ]
27. Gutiérrez JM, Lomonte B, León G, Rucavado A, Cháves F, Angulo Y. Trends in snakebite envenomation therapy: scientific, technological and public health considerations. Curr Pharm Des. 2007; 13 (28): 2935-2950. [ Links ]
28. Manjunatha KR (Ed.) Venom phospholipases A2 enzymes: structure, function and mechanism. Chichester: John Wiley & Sons; 1997. Phospholipase A2: structure and catalytic properties. 528 p. [ Links ]
29. Križaj I, Bieber AL, Ritonja A, Gubenšek F. The primary structure of ammodytin L, a myotoxic phospholipase A2 homologue from Vipera ammodytes venom. Eur J Biochem. 1991 Dec; 202 (3): 1165-1168.
30. Ownby CL, Selistre de Araújo HS, White SP, Fletcher JE. Lysine 49 phospholipase A2 proteins. Toxicon. 1999 Mar; 37 (3): 411-445. [ Links ]
31. Watanabe L, Soares AM, Ward RJ, Fontes MR, Arni RK. Structural insights for fatty acid binding in a Lys 49-phospholipase A2: crystal structure of myotoxin II from Bothrops moojeni complexed with stearic acid. Biochimie. 2005 Feb; 87 (2): 161-167. [ Links ]
32. White SP, Scott DL, Otwinowski Z, Gelb MH, Sigler PB. Crystal structure of cobra-venom phospholipase A2 in a complex with a transition-state analogue. Science. 1990 Dec; 250 (4987): 1541-1546. [ Links ]
33. Murakami MT, Viçoti MM, Abrego JR, Lourenzoni MR, Cintra AC, Arruda EZ, et al. Interfacial surface charge and free accessibility to the PLA2-active site-like region are essential requirements for the activity of Lys49 PLA2 homologues. Toxicon. 2007 Mar 1; 49 (3): 378-387. [ Links ]
Recibido: Febrero 03 de 2009
Aceptado: Agosto 10 de 2010