Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.17 no.3 Medellín Sept./Dec. 2010
PRODUCTOS NATURALES
BOROJÓ (Borojoa patinoi): FUENTE DE POLIFENOLES CON ACTIVIDAD ANTIMICROBIANA
BOROJÓ (Borojoa patinoi): SOURCE OF POLYPHENOLS WITH ANTIMICROBIAL ACTIVITY
Indira SOTELO D.1, Nidia CASAS F.2, Gustavo CAMELO M.2
1 Grupo Procesos Agroindustriales. Maestría en Diseño y Gestión de Procesos. Ingeniería de Producción Agroindustrial. Universidad de La Sabana. Bogotá, Colombia. indira.sotelo@unisabana.edu.co.
2 Grupo Procesos Agroindustriales. Maestría en Diseño y Gestión de Procesos. Ingeniería de Producción Agroindustrial. Universidad de La Sabana. Bogotá, Colombia.
RESUMEN
El fruto del borojó (Borojoa patinoi cuatrec.) es reconocido en la tradición popular por sus propiedades como conservante, posiblemente relacionadas con la presencia en él de compuestos fenólicos. En esta investigación se evaluó el contenido de polifenoles y su actividad antimicrobiana frente a patógenos como Escherichia coli y Staphylococcus aureus. El fruto del borojó tiene un contenido de polifenoles que oscila entre 600 y 800 mg ácido gálico/100gr, y actividad antimicrobiana frente a S. aureus y E. coli, determinada por halos de inhibición entre 12 y 9 mm respec ivamente. Estos resultados muestran el potencial que tiene este fruto de la familia de las Rubiaceae como posible agente antimicrobiano para ser utilizado en la industria agroalimentaria y cosmética.
Palabras clave: actividad antimicrobiana, borojó, polifenoles, E. coli, S. aureus.
ABSTRACT
According to popular belief, borojó (Borojoa patinoi cuatrec.) fruit is recognized for its preservative properties, possibly related to the presence of phenolic compounds. The content of polyphenols and their antimicrobial activity against pathogens as Escherichia coli and Staphylococcus aureus were evaluated in this research. Borojó fruit has polyphenol content between 600 and 800 mg gallic acid/100gr, and antimicrobial activity against S. aureus and E. coli with inhibition halos between 12 and 9 mm respectively. These results showed the advantages that have this fruit from the Rubiaceae family as a potential antimicrobial agent in food and cosmetics industries.
Key words: antimicrobial activity, borojó, polyphenols, E. coli, S. aureus.
INTRODUCCIÓN
El borojó (Borojoa patinoi cuatrecasas) es el nombre dado a una especie arbórea de entre 3 y 5 m de altura, de tallo erecto, leñoso, y hojas decusadas, propia de los climas tropicales y subtropicales, perteneciente a la familia Rubiáceae, originaria del sotobosque selvático del interior del Departamento del Chocó, zona del Pacífico colombiano, y de las selvas amazónicas. Su fruto es una baya carnosa de entre 7 y 12 cm de y diámetro, que en sus primeros estadios es verde clara y al madurar se torna parda rojiza; tiene un mesocarpio carnoso con sabor aromático y muy perfumado (1). Este fruto es comúnmente utilizado en América del Sur, en productos como jugos, pulpas y mermeladas, por su alto contenido de sólidos y bajo pH. Los nativos lo han empleado tradicionalmente como cicatrizante y para embalsamar cadáveres; además, se le han atribuido propiedades como energizante de la actividad sexual. Sin embargo, sobre sus características fitoquímicas y funcionales es poca la literatura científica que se encuentra referenciada; por tanto, hay pocos datos que permitan hoy dilucidar sus propiedades. Investigadores como Giraldo et al., 2004 (1) se han aproximado al conocimiento de este fruto nativo y han determinado su sexo mediante marcadores moleculares. Mosquera et al., 2005, 2010 (2-3), estudiaron algunas características de las propiedades funcionales de la pulpa obtenida mediante el secado por aspersión y evaluaron el efecto de la maltodextrina en la estabilidad de la pulpa de borojó seca por liofilización.
Estudios fitoquímicos realizados en plantas pertenecientes a la familia de las Rubiáceas, como uncaria (4), café (5), Chassalia (6) y noni (7), han hallado que estos frutos presentan contenidos de compuestos fenólicos con propiedades antioxidantes y actividad antimicrobiana y con un gran potencial de aplicación fitoterapéutica, lo cual podría tener relación con las propiedades que el saber popular le atribuye al fruto del borojó.
Los compuestos fenólicos son metabolitos secundarios de las plantas, derivados de complejas rutas metabólicas de origen mixto (shikimico–acetato y acetato–mevalonato), y de reacciones enzimáticas como hidroxilaciones, metilaciones, acetilaciones y glicosilaciones (8), y determinantes en la calidad sensorial y nutricional de las frutas y vegetales (9). Su contenido varía de acuerdo con la especie, la variedad, el tipo de cultivo, el estado de maduración, la estacionalidad y la región geográfica, entre otros factores (10). Están clasificados, de acuerdo con su estructura, como ácidos fenólicos, flavonoides y taninos (11). Dado que se les atribuye una variada actividad farmacológica, en general asociada a la capacidad de actuar como agentes antioxidantes, secuestradores de radicales libres, antimicrobianos y antivirales (12-13), actualmente se desarrollan numerosas investigaciones sobre el tema.
De acuerdo con González et al., 2001 (14), los ensayos preliminares cualitativos permiten determinar la presencia de metabolitos secundarios como: flavonoides, triterpenos, cumarinas, esteroles, quinonas, saponinas, glicósidos y alcaloides, de manera sencilla, específica y rápida, mediante reacciones de coloración, precipitación, y el análisis de propiedades físicas como la sublimación o la fluorescencia. En el proceso de extracción de los metabolitos se pueden emplear diferentes solventes como: éter dietílico, cloroformo, etanol y agua, que modifican el pH del medio con el fin de obtener metabolitos secundarios de acuerdo con su solubilidad (15).
El proceso de extracción de compuestos fenólicos en diferentes plantas y frutas está influenciado por su naturaleza química, por el método empleado y la presencia de substancias interferentes. Contini et al., 2008 (16), establecieron que el rendimiento en la extracción de los compuestos fenólicos y su actividad antioxidante no sólo dependen de la naturaleza del disolvente y del método de extracción, sino también de los compuestos bioactivos y de la estructura de la matriz del producto, porque los extractos de polifenoles presentes en las plantas son una mezcla de diferentes clases de polifenoles, solubles en el sistema de solvente empleado. Según Moure et al., 2001 (17), los solventes más empleados están constituidos por mezclas acuosas de etanol, metanol y acetona; asimismo indican que la selección óptima del solvente para la extracción de los compuestos fenólicos depende del tipo de matriz. Sobre este asunto, Suhaj et al., 2006 (18) afirman que mezclas de metanol en agua son eficaces para la extracción de compuestos polifenólicos de matrices fibrosas, como las frutas, debido a su grado de polaridad, mientras que las mezclas de acetona en agua son útiles para la extracción de polifenoles en matrices proteicas, como las nueces, ya que la acetona degrada el complejo polifenol–proteína.
Gracias a las propiedades de los polifenoles, y a su fuerte actividad biológica como agentes antimicrobianos, superior a la de los antioxidantes obtenidos por síntesis química, que pueden llegar a promover la carcinogénesis (19), en los últimos años ha crecido el interés en la cuantificación y uso de estos antioxidantes, con el propósito de emplearlos en las industrias alimentaria, farmacéutica y cosmética (18), Varios autores han estudiado la relación entre el contenido de polifenoles y la actividad antimicrobiana, encontrando asociación entre ellos en diferentes extractos de plantas y frutas (11, 20 - 28).
Teniendo en cuenta las propiedades que se le han atribuido al fruto del borojó, los objetivos de esta investigación son: a) establecer la presencia de metabolitos secundarios mediante ensayos de identificación cualitativos, y b) cuantificar el contenido de polifenoles totales y evaluar su actividad antimicrobiana sobre microorganismos patógenos como Escherichia coli y Staphylococcus aureus.
MATERIALES Y MÉTODOS
Materiales
Acido gálico (Sigma), reactivo de Folin Ciocalteu (Merck), carbonato de sodio (Merck), etanol (Merck), metanol (Merck), acetona (Merck) y agar Muller Hilton (Scharlau).
Materia prima
El fruto del borojó (Borojoa patinoi cuatrec.), en completo estado de maduración, fue adquirido en el mercado local. Las semillas se apartaron de la fruta de forma manual, para obtener la pulpa, que se almacenó en bolsas de polietileno de baja densidad con banda hermética abre-cierre (Ziploc®) a una temperatura de 4°C hasta su uso.
Caracterización fisicoquímica
El contenido de humedad de la pulpa de borojó se determinó por el método de estufa a 70°C (AOAC 20.013 /80); proteína, por el método de Kjeldahl (AOAC 924.09/90); grasa, por el método de Soxhlet (AOAC 963.15 /90); cenizas, por el método de incineración (AOAC 940.26 /90); actividad de agua (Aw), empleando el método instrumental Novasina a 20°C, y el pH fue medido con potenciómetro Metrohm.
Pruebas preliminares para detección de metabolitos secundarios
La extracción de los metabolitos se efectuó empleando etanol al 95% en una relación 1:9 (pulpa fresca: solvente) durante 2 horas, en agitación constante, a 60°C. Los extractos se filtraron a vacío y se almacenaron en recipientes de vidrio color ámbar a temperatura de refrigeración hasta su uso. A los extractos etanólicos se les practicaron diferentes ensayos con reacciones químicas de identificación, mediante cambios de color o formación de precipitados, para determinar la presencia de los metabolitos secundarios: flavonoides (Shinoda, Pew's, reacción con vapores de amonio y prueba de NaOH); triterpenos (Liebermann-Buchard); lactonas insaturadas (método Legal); glicósidos (Kedde); y polifenoles solubles (cloruro férrico) (29 - 32).
Extracción de polifenoles
Para la extracción de polifenoles a partir de la pulpa se emplearon tres solventes: etanol 30%, metanol 30% y acetona 30%, en una relación 1:9 (pulpa fresca:solvente). Se ensayaron dos métodos de extracción: (a) Centrifugación: la mezcla de pulpa– solvente se homogeneizó en un Ultraturrax® durante dos minutos y se paso a una centrífuga Hettich Universal 32R a 9000 rpm, a 4°C, durante 15 minutos; el sobrenadante se almacenó en ausencia de luz para su posterior análisis. (b) Agitación: la mezcla de pulpa-solvente se homogeneizó en un Ultraturrax® durante dos minutos y se llevó a agitación constante en un shaker a 60°C durante 2 horas, luego se filtró y el extracto se guardó en frascos ámbar. Los extractos obtenidos se almacenaron en refrigeración hasta su cuantificación.
Cuantificación de polifenoles
Se cuantificó el contenido de polifenoles presentes en los extractos por el método espectrofotométrico (33). A un balón aforado de 25 mL se le adicionaron 1 mL del extracto de polifenoles, 5 mL de agua destilada y 1 mL de reactivo de Folin-Ciocalteu. Después de cinco minutos de reacción, se adicionó 1 mL de carbonato de sodio al 7% y se aforó a 25 mL con agua destilada; se dejó reaccionar durante 90 minutos protegido de la luz. Se determinó la absorbancia a una longitud de onda de 750 nm en un espectofotómetro Cary Varian 100 UV-Vis, y el contenido de polifenoles se expresó en mg de ácido gálico (AG)/100 g de muestra.
Actividad antimicrobiana
Para evaluar la actividad antimicrobiana se emplearon extractos de pulpa de borojó fresca y liofilizada (obtenida en un liofilizador Labconco a -35°C, y 6.66 KPa de presión). Los extractos se 332 Vitae i. sotelo d. et al. obtuvieron del proceso de extracción con agua en una relación 1:3 (pulpa:agua), a 50°C, en agitación constante durante 90 min, y se purificaron por microfiltración empleando una membrana de 0,22 micras de tamaño de poro. A estos extractos se les cuantificó el contenido de polifenoles por método espectrofotométrico (33).
La prueba de inhibición se realizó por el método de difusión en pozos, empleando cepas de Staphylococcus aureus ATCC 460716 y Escherichia coli ATCC 25922, activadas en caldo Mueller Hinton durante 24 horas a 37°C. De cada cultivo se tomaron 0.2 mL de inóculo (108 UFC/mL) y se inocularon en 20 mL de agar Mueller Hinton por la técnica de difusión en profundidad. Con sacabocados estériles de 6 mm de diámetro se realizaron 6 pozos por placa, en los cuales se colocaron 70 μL de extracto acuoso de borojó de pulpa fresca y liofilizada, 70 μL de agua, 70 μL de fenol (10% p/v), ácido gálico (0,1% p/v) y ácido láctico (10% v/v), diluidos en agua estéril. Se incubaron en condiciones aerobias a 37ºC durante 24 horas, y luego se hizo la medición del diámetro promedio del halo de inhibición expresado en mm (34).
Análisis estadístico
Los ensayos se evaluaron por triplicado. Los resultados obtenidos fueron expresados por promedio ± desviación estándar. El análisis estadístico se llevó a cabo mediante una comparación por ANOVA, con un nivel de confianza del 95% (P<0,05), utilizando el software Minitab® versión 15.
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica
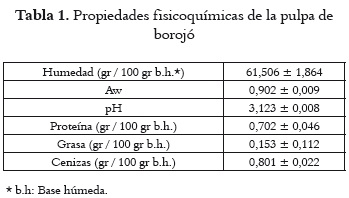
Los parámetros medidos para la caracterización fisicoquímica de la pulpa de borojó se observan en la tabla 1. En cuanto a las propiedades de humedad y pH, se encuentran dentro del rango que definen Mosquera et al., 2010 (3). El valor de actividad de agua hallado es menor al que comunican los mismos autores (0,98). La actividad de agua es una medida del agua disponible para reaccionar química o físicamente en un sistema y está muy relacionada con la composición de un alimento. Esto quiere decir que las posibles variaciones en las condiciones agroecológicas del cultivo influyen en las características fisicoquímicas del fruto.
En relación con el pH, la pulpa de borojó presenta valores inferiores a los hallados en frutos como el noni (7), perteneciente también a la familia de las Rubiáceas (3,72), factor favorable en lo que concierne a su estabilidad a nivel microbiológico, y propicia su posible uso como antimicrobiano, porque los ácidos orgánicos ejercen una reducción en el pH extracelular sobre los microorganismos, aumentando la turgencia celular, que provoca un aumento de la presión mecánica sobre la pared de los microorganismos, que eventualmente hace que la pared colapse (34).
La pulpa de borojó contiene cantidades muy bajas de proteína (0,70%), grasa (0,15%) y cenizas (0,8%), expresadas en relación peso a peso. Algunos valores difieren en los estudios publicados, posiblemente por el estado de maduración o por las condiciones de cultivo y postcosecha. Mosquera et al., 2010. (3), mencionan contenidos de proteína, grasa y cenizas de: 0,69%, 0,15% y 0,76% (p/p); en el mismo orden, Mosquera et al., 2005 (2) publican datos de 1,75%, 0,82%, 2,68% y Arango et al., 1986 (35) valores del 5,51%, 0,00%, 1,49% respectivamente.
Ensayos preliminares para la detección de metabolitos secundarios
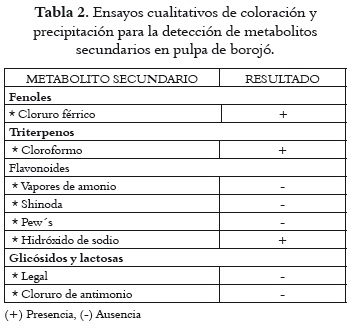
Los resultados obtenidos de los ensayos cualitativos de precipitación y coloración para la detección de metabolitos secundarios presentes en la pulpa de borojó aparecen en la tabla 2.
El análisis preliminar para la identificación cualitativa de los metabolitos secundarios en la pulpa de borojó hizo evidente la presencia de fenoles, como se aprecia en la tabla 2. En cuanto a los triterpenos, este estudio coincide con lo descrito por Mosquera et al., 2005 (2), quienes señalan la prevalencia de estos metabolitos secundarios en pulpa de borojó liofilizada y seca por atomización. En relación con los compuestos tipo flavonoides, la prueba con NaOH resultó positiva, lo que puede indicar presencia de algún flavonoide en la pulpa fresca. En lo referente a las lactonas insaturadas y los glicósidos, los resultados indicaron que estos metabolitos no se encuentran en la pulpa fresca de borojó.
Los metabolitos secundarios, como triterpenos, flavonoides, fenoles, taninos, saponinas y alcaloides, han sido asociados con cualidades que incluyen la actividad antimicrobiana, antiviral y algunas propiedades curativas contra patógenos (36-37). Como la pulpa fresca de borojó presenta tres de estos metabolitos (triterpenos, flavonoides y fenoles), se podría inferir que puede desarrollar algún tipo de actividad antimicrobiana.
Extracción y cuantificación de polifenoles
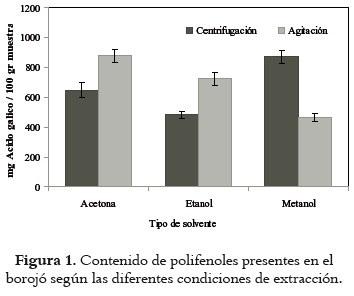
Como se puede apreciar en la figura 1, el contenido total de polifenoles extraídos de la pulpa de borojó varía, dependiendo del tipo de solvente empleado y del método de extracción. Se observa que para el método de extracción por centrifugación, el metanol es el solvente que ofrece la mayor eficiencia (870,56 ± 43,11 mg AG/ 100gr), seguido por la acetona (651,12 ± 52, 4 mg AG/ 100gr). Sin embargo, estadísticamente no se observa diferencia significativa (ANOVA p< 0,05) entre los contenidos de polifenoles extraídos con estos dos solventes. En el caso de la extracción que emplea como método la agitación en shaker, el solvente que atrae una mayor cantidad de polifenoles totales es la acetona (880,32 ± 44,94 mg AG/ 100gr), seguida por el etanol (725,3 ± 24,11 mg AG/ 100gr), y finalmente, el metanol (464,74 ± 30,10 mg AG/ 100gr).
De acuerdo con los resultados de este estudio, la acetona es el solvente que permite una mayor extracción de polifenoles totales, en lo cual coincide con Contini et al., 2008 (16), quienes encontraron que la acetona tiene el mayor rendimiento de extracción de polifenoles con menor arrastre de sustancias extrañas para la cáscara y la semilla de nueces, en comparación con el etanol y el metanol. Asimismo Alothman et al., 2009 (38) encontraron que la acetona y el etanol son los solventes más eficientes en el proceso de extracción de compuestos fenólicos en piña, banano y guayaba. Aunque la acetona exhibe altos valores de eficiencia en el proceso de extracción de compuestos polifenólicos, su aplicación como solvente se ve reducida para aplicaciones alimentarias y cosméticas debido a sus niveles de toxicidad.
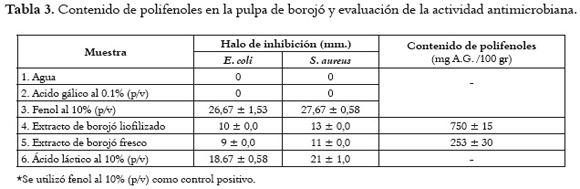
En los extractos obtenidos para la evaluación de la actividad antimicrobiana a partir de pulpa fresca y liofilizada de borojó, utilizando agua como solvente, se encontró que el contenido de polifenoles totales fue de 253 ± 30 mg AG/100gr para pulpa fresca, mientras que para pulpa liofilizada alcanzó valores de 750 ± 15 mg AG/ 100gr.
Comparando el contenido de polifenoles obtenido en el borojó con el de otras especies de la familia de las Rubiáceas, se concluye que éste tiene un contenido mayor de polifenoles que el que comunican Lizcano et al. (4) para Uncaria guianensis (466 mg AG/100g), y menor al reportado por Soobrattee et al., 2008 (6) para Chassalia (1000 mg AG/100g) y para Coffea macrocarpa (2400mg AG/100g). En comparación con otros tipos de fruta, como la manzana Granny Smith - 680 mg AG/100g (11), la manzana royal - 349 mg AG/100g (11), el guaraná - 180 mg AG/100 g (25), la piña - 50.7 mg AG/100 g (38), el banano - 72.2 mg AG/100 g (38) y la guayaba - 191 mg AG/100 g (38), el fruto del borojó tiene un contenido mayor de polifenoles.
Estos resultados hacen evidente que este fruto es indiscutiblemente, una fuente de compuestos polifenólicos con potenciales usos en la industria agroalimentaria, como agentes antioxidantes de origen natural que pueden ayudar a prevenir y retardar el daño oxidativo en lípidos o proteínas y contribuir al estilo de vida saludable, porque el consumo de alimentos ricos en polifenoles está asociado a un menor riesgo de daño cardiovascular, formación de cáncer y envejecimiento prematuro (39 - 42).
Actividad antimicrobiana
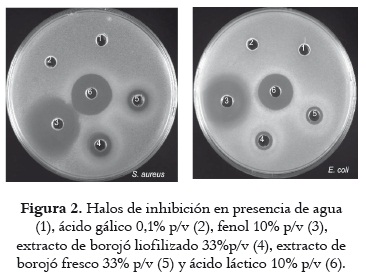
La actividad antimicrobiana in vitro de los extractos acuosos de la pulpa de borojó se evaluó cuantitativamente por la presencia de halos de inhibición y se reportó el valor promedio ± desviación de cada diámetro. En la figura 2 pueden observarse los halos de inhibición de los extractos de polifenoles en comparación con agua, ácido gálico, fenol y ácido láctico, frente a dos bacterias patógenas humanas: S. aureus y E. coli. Las muestras control, agua y ácido gálico solubilizado en agua (0,1p/v) no presentaron halos de inhibición para ambas bacterias.
En la tabla 3, los resultados obtenidos sobre el contenido de polifenoles en los extractos acuosos del borojó se contrastan con las medidas de los halos de inhibición. Esta inhibición puede atribuirse a los metabolitos presentes en el fruto y está directamente relacionada con los polifenoles presentes en el fitocomplejo. El análisis estadístico de los resultados muestra que existe diferencia significativa (ANOVA p<0,05) entre los halos de inhibición de los extractos de Borojó frente a los controles positivo fenol 10% p/v y ácido láctico 10% p/v. Sin embargo, estos resultados son promisorios para el Borojó, tal como se hace evidente en estudios realizados por Al-Fatimi et al., 2007 (34) quienes refieren que un halo de inhibición desde 8 mm de diámetro es indicativo de prueba positiva de inhibición microbiana; Albayrak et al., 2007 (19) comunican resultados de halos de inhibición significativa, mayores de 6 mm. En este estudio se obtuvieron halos de inhibición de 9 mm frente a E. coli para los extractos de borojó, valor superior a los registrados por Alberto et al., 2006 (11) en cáscara de manzana Granny Smith (7 mm) y manzana royal (4 mm), e inferior a lo informado por Wang et al., 2008 (43) para hojas de tabaco (20,23 mm), y por Estevinho et al., 2008 (24) en extractos de miel (9 mm, considerada como fuerte actividad antimicrobiana). Con respecto al S. aureus, los resultados de los halos de inhibición para los extractos de borojó muestran valores entre 11 y 13 mm, superiores a los informados por Alberto et al., 2006 (11) en cáscara de manzana granny Smith (10 mm) y manzana royal (4 mm), y por Estevinho et al., 2008 (24) en extractos de miel (9 mm); pero inferiores a los que daclaran Wang et al., 2008 (43) en hojas de tabaco (17,66 mm) y Mayachiew et al., 2008 (23) en extractos de grosella (21,8 mm). Estas diferencias obedecen, probablemente, a que los extractos que presentan mayores halos de inhibición pueden tener un mayor contenido de compuestos fenólicos, lo que indicaría una relación directa entre el contenido de polifenoles y el efecto antimicrobiano de los extractos.
Los extractos de borojó exhibieron halos de inhibición mayores para S. aureus (Gram positiva) que para E. coli (Gram negativa), resultado que coincide con los obtenidos por Albayrak et al., 2007 (19), Shan et al., 2007 (28), Estevinho et al., 2008 (24), Al-Fatimi et al., 2007 (34) y Alberto et al., 2006 (11), quienes hacen evidente una mayor inhibición de los extractos con polifenoles en bacterias Gram positivas que en bacterias Gram negativas, debido a la sensibilidad de las bacterias Gram positivas frente a especias y extractos de hierbas, plantas y frutos. La mayor sensibilidad al efecto antimicrobiano puede ser atribuída, en el caso del S. aureus, a la estructura de su membrana citoplasmática, la cual permite a las sustancias antibacterianas destruir fácilmente la membrana de la célula ocasionando una salida del citoplasma (44). La resistencia de E. coli frente a las sustancias antibacterianas está relacionada con la superficie hidrofílica de su membrana externa. Esta membrana,rica en moléculas de lipopolisacáridos, despliega una barrera contra la penetración de numerosas moléculas antibióticas y está también asociada con las enzimas en el espacio periplasmático, las cuales son capaces de romper las moléculas introducidas desde el exterior (45 - 46).
Varios autores han estudiado la relación entre el contenido de polifenoles y la actividad antibacteriana. Entre los más importantes se puede citar a Alberto et al., 2006 (11), quienes investigaron el efecto antimicrobiano de los componentes fenólicos de la piel de dos variedades de manzana sobre patógenos humanos, y encontraron relación directa entre el contenido de polifenoles y el efecto antibacteriano, en lo que coinciden con Rodríguez et al., 2007 (27), quienes afirman que las propiedades antimicrobianas se incrementan con el aumento en la concentración de los polifenoles en muestras de vino y clasifican la actividad antimicrobiana como: moderada, cuando sus zonas de inhibición están entre 4 y 5 mm; alta, cuando exhibe zonas de inhibición entre 6 y 9 mm; y fuerte, cuando sus zonas de inhibición son mayores de 9 mm. También Shan et al., 2007 (28) encontraron una relación altamente positiva (r2 = 0,70-0,93) entre la actividad antibacteriana y el contenido de fenoles de 46 extractos de hierbas y especias medicinales evaluadas frente a diferentes bacterias Gram positivas y Gram negativas.
En cuanto a la liofilización del borojó fue claro que el tratamiento de secado favorece la actividad antibacteriana; así, se presentó un aumento entre 10 y 15% en la inhibición de E. coli y S. aureus, lo que puede explicarse por el incremento en la concentración de polifenoles en el extracto de pulpa seca.
CONCLUSIONES
Los resultados obtenidos sobre el extracto del fruto del borojó exponen un contenido de polifenoles con valores entre 600 y 800 mg AG/100gr, y significativa actividad antimicrobiana frente a las bacterias patógenas humanas S. aureus y E. coli. Esta actividad no puede atribuirse a la presencia de una sola molécula del fruto, sino a la acción de los compuestos de carácter fenólico que ejercen efectos sinérgicos, formando un fitocomplejo activo en la inhibición microbiana.
El estudio deja abierta la posibilidad de continuar la investigación sobre este fruto y sobre su uso potencial como preservante y antioxidante natural para las industrias alimentaria, farmacéutica y cosmética.
AGRADECIMIENTOS
Los autores agradecen al Fondo Patrimonial Especial de la Universidad de La Sabana por su apoyo financiero en la ejecución del Proyecto ING-34-2007.
REFERENCIAS BIBLIOGRÁFICAS
1. Giraldo C, Rengifo L, Aguilar E, Gaviria D, Alegría A. Determinación del sexo en borojó (Borojoa patinoi Cuatrecasas) mediante marcadores moleculares. Rev Col Biotecnol. 2004 Dic; 6 (2): 9-14. [ Links ]
2. Mosquera LH, Ríos HA, Zapata PS. Obtención de una materia prima con valor agregado mediante secado por aspersión a partir del fruto fresco de borojó (Borojoa patinoi Cuatrec.). Rev Inst Univ Tecnológica Chocó. 2005; 11 (23): 5–10. [ Links ]
3. Mosquera LH, Moraga G, Martínez-Navarrete N. Effect of maltodextrin on the stability of freeze-dried borojó (borojoa patinoi cuatrec.) powder. J Food Eng. 2010 Mar; 97 (1): 72–78. [ Links ]
4. Lizcano L, Bakkali F, Ruiz-Larrea M, Ruiz-Sanz J. Antioxidant activity and polyphenol content of aqueous extracts from Colombian Amazonian plants with medicinal use. Food Chem. 2010 Apr 15; 119 (4): 1566–1570. [ Links ]
5. Ferrazzano G, Amato I, Ingenito A, de Natale A, Pollio A. Anticariogenic effects of polyphenols from plant stimulant beverages (cocoa, coffee, tea). Fitoterapia. 2009 Jul; 80 (5): 255–262. [ Links ]
6. Soobrattee M, Bahorun T, Neergheen V, Googoolye K, Aruoma O. Assessment of the content of phenolics and antioxidant actions of the Rubiaceae, Ebenaceae, Celastraceae, Erythroxylaceae and Sterculaceae families of Mauritian endemic plants. Toxicol in Vitro. 2008 Feb; 22(1): 45–56. [ Links ]
7. Chan-Blanco Y, Vaillant F, Pérez A, Reynesc M, Brillouet J, Brat P. The noni fruit (Morinda citrifolia L.): A review of agricultural research, nutritional and therapeutic properties. J Food Compos Analysis. 2006 Sep-Nov; 19 (6-7): 645–654. [ Links ]
8. Palacios N, Burtin D, Leech M. Biología molecular, una herramienta para la bioprospección del metabolismo secundario de plantas en Colombia. Rev Col Biotecnol. 2004; 6 (2): 67–77. [ Links ]
9. Lapornik B, Prosek M, Golc A. Comparison of extracts prepared from plant by-products using different solvents and extraction time. J Food Eng. 2005 Nov; 71 (2): 214–222. [ Links ]
10. Naczk M, Shahidi F. Phenolics in cereals, fruits and vegetables: Occurrence, extraction and analysis. J Pharm Biomed Anal. 2006 Aug 28; 41(5): 1523–1542. [ Links ]
11. Alberto M, Rinsdahl M, Manca M. Antimicrobial effect of polyphenols from Apple skins on human bacterial pathogens. Electronic Journal of Biotechnology. 2006; 9 (3): 1–5. [ Links ]
12. González M, Hernández M, Kite G, Martínez M. Actividad antioxidante de flavonoides del tallo de orégano mexicano. Revista Fitotecnia Mexicana. 2007 Ene-Mar; 30 (1): 43–49. [ Links ]
13. Castañeda C, Ramos Ll, Ibáñez V. Evaluación de la capacidad antioxidante de siete plantas medicinales peruanas. Rev Horizonte Médico. 2008 Jul; 8 (1): 56-72. [ Links ]
14. González J, Lechuga A, Serrano C. Estudio fitoquímico comparativo de Oenothera rosea y Oenothera multicaulis (Yawar chonqa). SITUA. 2001 Sep-Feb; 9 (17): 67–72. [ Links ]
15. Enríquez A, Prieto E, de los Ríos E, Ruiz S. Estudio farmacognóstico y fitoquímico del rizoma de Zingiber officinale Roscoe ''jengibre'' de la ciudad de Chanchamayo - Región Junín - Perú. Rev Med Vallejiana. 2008; 5 (1): 50–64. [ Links ]
16. Contini M, Baccelloni S, Massantini R, Anelli G. Extraction of natural antioxidants from hazelnut (Corylus avellana L.) shell and skin wastes by long maceration at room temperature. Food Chem. 2008 Oct 1; 110 (3): 659–669. [ Links ]
17. Moure A, Cruz J, Franco D, Domínguez J, Sineiro J, Domínguez H, et al. Natural antioxidants from residual sources. Food Chem. 2001 Feb; 72 (2): 145–171. [ Links ]
18. Suhaj M. Spice antioxidants isolation and their antiradical activity: a review. J Food Compos Analysis. 2006 Sep-Nov; 19 (6-7): 531–537. [ Links ]
19. Tripoli E, La Guardia M, Giammanco S, di Majo D, Giammanco M. Citrus flavonoids: Molecular structure, biological activity and nutritional properties: A review. Food Chem. 2007 Jan 31; 104 (2): 466–479. [ Links ]
20. Albayrak S, Aksoy A, Sagdic O, Hamzaoglu E. Compositions, antioxidant and antimicrobial activities of Helichrysum (Asteraceae) species collected from Turkey. Food Chem. 2010 Mar 1; 119 (1): 114–122. [ Links ]
21. Viswanath V, Urooj A, Malleshi N. Evaluation of antioxidant and antimicrobial properties of finger Millet polyphenols (Eleusine coracana). Food Chem. 2009 May 1; 114 (1): 340–346. [ Links ]
22. Rodríguez M, Tomassini L, Manca M, Strasser A. 2009. Antioxidant capacity and antibacterial activity of phenolic compounds from argentinean herbs infusions. Food Control. 2010 May; 21 (5): 779–785. [ Links ]
23. Mayachiew P, Devahastin S. Antimicrobial and antioxidant activities of Indian gooseberry and galangal extracts. LWT. 2008 Sep; 41 (7): 1153 – 1159. [ Links ]
24. Estevinho L, Pereira A, Moreira L, Dias L, Pereira E. Antioxidant and antimicrobial effects of phenolic compounds extracts of Northeast Portugal honey. Food Chem Toxicol. 2008 Dec; 46 (12): 3774 – 3779. [ Links ]
25. Ao C, Li A, Elzaawely A, Xuan T, Tawata S. Evaluation of antioxidant and antibacterial activities of Ficus microcarpa L. fil. extract. Food Control. 2008 Oct; 19 (10): 940 – 948. [ Links ]
26. Majhenic L, Skerget M, Knez Z. Antioxidant and antimicrobial activity of guarana seed extracts. Food Chem. 2007; 104 (3): 1258–1268. [ Links ]
27. Rodríguez MJ, Alberto MR, Manca de Nadra MC. Antibacterial effect of phenolic compounds from different wines. Food Control. 2007 Feb; 18 (2): 91–101. [ Links ]
28. Shan B, Cai Y, Brooks J, Corke H. The in vitro antibacterial activity of dietary spice and medicinal herb extracts. Int J Food Microbiol. 2007 Jun 10; 117 (1): 112–119. [ Links ]
29. Fernández L. Fitoquímica del Agave salmiana. [Trabajo de pregrado] [Puebla, México]: Universidad de las Américas: 2005. 60 p. [ Links ]
30. Pérez L. Estudio fitoquímico biodirigido de las plantas con potencial actividad insecticida trichilia havanensis y croton ciliatoglanduliferus. [Trabajo de pregrado]. [Puebla, México]: Universidad de las Américas: 2006. 70 p. [ Links ]
31. Mallikharjuna P, Rajanna L, Seetharam Y, Sharanabasappa G. Phytochemical studies of Strychnos potatorum L.f.- A medicinal plant. E-J Chem. 2007 Mar 30; 4 (4): 510–518. [ Links ]
32. Neira A, Ramírez M, Sánchez N. Estudio fitoquímico y actividad antibacterial de Psidium guineense Sw (choba) frente a Streptococcus mutans, agente causal de caries dentales. Rev Cubana Plant Med. 2005; 10 (3-4). [ Links ]
33. Singleton V, Rossi J. Colorimetry of total phenolics with phosphomolybdic- phosphotungstenic acid reagents. Am J Enol Vitic. 1965; 16 (3): 144–158. [ Links ]
34. Al-Fatimi M, Wurster M, Schröder G, Lindequist U. Antioxidant, antimicrobial and cytotoxic activities of selected medicinal plants from Yemen. J Ethnopharmacol. 2007 May 22; 111 (3): 657–666. [ Links ]
35. Arango A, Quijano T. Estudio de los frutos de Boroja Patinoi (Cuatrec.). Rev Latin Química. 1986; 17 (3): 167-169. [ Links ]
36. Naranjo J, Guiamet P, Gómez S. Evaluación fitoquímica de extractos naturales de Eucalyptus citriodora y Pinus caribaea con actividad biocida. BLACPMA. 2009; 8 (5): 445–448. [ Links ]
37. Reuben KD, Abdulrahman F, Akan J, Usman H, Sodipo O, Egwu G. Phytochemical screening and in vitro antimicrobial investigation of the methanolic extract of croton zambesicus Müell. Arg stem bark. Eur J Sci Res. 2008; 23 (1): 134–140. [ Links ]
38. Alothman M, Bhata R, Karim A. Antioxidant capacity and phenolic content of selected tropical fruits from Malaysia, extracted with different solvents. Food Chem. 2009 Aug 1; 115 (3): 785–788. [ Links ]
39. Watson R, Preedy V (Eds.). Bioactive foods promoting health. New York: Academic Press; 2010. Fruit, vegetables and bone health; p. 173–194. [ Links ]
40. Petti S, Scully C. Polyphenols, oral health and disease: A review. J Dent. 2009 Jun; 37 (6): 413–423. [ Links ]
41. Ferrari C. Functional foods and physical activities in health promotion of aging people. Maturitas. 2007 Dec 20; 58 (4): 327–339. [ Links ]
42. Speisky H. Antioxidantes en alimentos: cultivando salud. Indualimentos. 2006; 42: 28-31. [ Links ]
43. Wang H, Zhao M, Yang B, Jiang Y, Rao G. Identification of polyphenols in tobacco leaf and their antioxidant and antimicrobial activities. Food Chem. 2008 Apr 15; 107 (4): 1399–1406. [ Links ]
44. Kalemba D, Kunicka A. Antibacterial and antifungal properties of essential oils. Curr Med Chem. 2003 May; 10 (10): 813–829. [ Links ]
45. Kuwano K, Tanxaka N, Shimizu T, Nagatoshi K, Nou S, Sonomoto K. Dual antibacterial mechanisms of nisin Z against Gram-positive and Gram-negative bacteria. Int J Antimicrob Ag. 2005 Nov; 26 (5): 396–402. [ Links ]
46. Gao Y, van Belkum M, Stiles M. The outer membrane of Gramnegative bacteria inhibits antibacterial activity of brochocin-C. Appl Environ Microb. 1999 Oct; 65 (10): 4329–4333. [ Links ]
Recibido: Febrero 16 de 2010
Aceptado: Agosto 19 de 2010