Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.18 no.1 Medellín Jan./Apr. 2011
ARTÍCULOS CORTOS
AISLAMIENTO E IDENTIFICACIÓN DE DOS ESTEROLES Y UN TRITERPENOIDE DEL CUERPO FRUCTÍFERO DE Ganoderma lucidum CULTIVADO EN COLOMBIA
ISOLATION AND IDENTIFICATION OF TWO STEROLS AND A TRITERPENE FROM DRY FRUITING BODIES OF Ganoderma lucidum CULTIVATED IN COLOMBIA
Henry MORENO P.1; Alejandro MARTÍNEZ M.2; Yoshinori FUJIMOTO3
1 Grupo de Investigación Productos Naturales Marinos. Facultad de Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín, Colombia. hmoreno@farmacia.udea.edu.co.
2 Grupo de Investigación Productos Naturales Marinos. Facultad de Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
3 Departamento de Química y Ciencia de los Materiales. Instituto Tecnológico de Tokio Ookayama 2-12-1, Meguro, Tokio 152-8551, Japón Tel / Fax +81-3-5734-2241
Recibido: Enero 25 de 2010
Aceptado: Octubre 19 de 2010
RESUMEN
Ganoderma lucidum es un hongo medicinal que pertenece a la familia Ganodermataceae, conocido hace mucho tiempo en Japón como ''reishi'', y usado ampliamente en la medicina tradicional china. Los metabolitos que se han reportado en él son principalmente polisacáridos y triterpenoides con diferentes actividades biológicas. En el presente artículo se describe el aislamiento y la identificación efectuados de los compuestos ergosterol, 5,6-dihidroergosterol y lucidumol-B, a partir del extracto metanólico del cuerpo fructífero seco del Ganoderma lucidum cultivado en Colombia.
Palabras clave: reishi, ergosterol, 5,6-dihidroergosterol, lucidumol-B.
ABSTRACT
Ganoderma lucidum is a medicinal mushroom belonging to Ganodermataceae family. It is known as ''reishi'' in Japan and is widely used in traditional Chinese medicine. Reported metabolites include polysaccharides and triterpenoids with different biological activities. In this paper isolation and identification of ergosterol, 5,6-dihydroergosterol and lucidumol-B, are described. These compounds were isolated from methanolic extract of fruiting bodies of Ganoderma lucidum cultivated in Colombia.
Key words: Reishi, ergosterol, 5,6-dihydroergosterol, lucidumol-B.
INTRODUCCIÓN
El hongo Ganoderma lucidum (Fam. Ganodermataceae) ha sido utilizado en Japón, China y otros países desde hace cientos de años como alimento y como materia prima para el desarrollo de productos nutracéuticos que preservan la vitalidad y promueven la longevidad. En dichos países se conoce con nombres triviales como ''lingzhi'', ''reishi'' y ''youngzhi'' (1). Es un hongo frágil, cuyo color varía del blanco al negro, pasando por tonalidades amarillas, doradas, azules y violáceas, y crece en todas las latitudes cálidas, en el tronco de los árboles dañados o muertos. Entre sus componentes químicos más estudiados están los triterpenoides, que desarrollan actividades biológicas que los hacen potencialmente útiles para la prevención y el tratamiento de enfermedades como: hipertensión, diabetes, cáncer, hepatitis, artritis, hipercolesterolemia, bronquitis, asma, gastritis, VIH-1(2-4). En el caso particular del cáncer, se ha demostrado que nueve especies del género Ganoderma, incluido G. lucidum, pueden ser útiles en el tratamiento del cáncer de pulmón (SCLC), particularmente en las terapias con mezclas de medicamentos, cuando se desarrolla resistencia que hace ineficaz el tratamiento (5). Otros posibles usos suyos están en el tratamiento de la diabetes tipo 2 (6) y en el envejecimiento asociado a enfermedades neurodegenerativas (7).
En el caso de los compuestos identificados en especies del género Ganoderma, se ha informado el aislamiento de más de 130 compuestos triterpenoides, entre ellos el lucidumol-B, que han recibido una considerable atención por sus actividades biológicas, entre las cuales se destacan la acción anti VIH-1 (4) y antitumoral (8).
En Colombia se han efectuado estudios similares a partir de los cuerpos fructíferos frescos de G. lucidum recolectado en el departamento del valle del Cauca, del cual se aislaron e identificaron cinco triterpenoides tipo lanostano, dos de ellos nuevos, el lucidadiol y el lucidal, además de seis compuestos esteroidales (9).
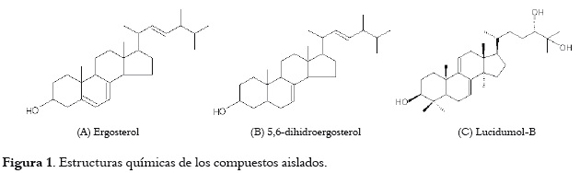
En este trabajo se describe el aislamiento y la identificación de tres compuestos: dos esteroles: ergosterol y 5,6-dihidroergosterol, y un triterpenoide: lucidumol-B, a partir de los cuerpos fructíferos de Ganoderma lucidum cultivado en Colombia.
MATERIALES Y MÉTODOS
Equipos y condiciones de análisis
Los análisis por cromatografía de gases acoplada a espectrometría de masas (CG-EM) se realizaron en un cromatógrafo de gases Agilent 6890N, acoplado a un espectrómetro de masas Agilent 5973N. Se utilizó una columna Zebron Zb-35 (0,25 mm x 30 m x 0,25 um), con la siguiente programación del horno: se inició con una temperatura de 150ºC (1 min) – 200°C (5°C/min - 3 min) – 250°C (3°C/ min -4 min) – 300°C (5°C/min – 5,33 min). Retardo: 5 minutos. La temperatura del inyector fue de 250ºC, la fuente de ionización se mantuvo a 70 eV. El gas de arrastre usado fue helio, a un flujo de 1 mL/min. El rango de masas utilizado fue de 30 uma – 600 uma. Los análisis por espectroscopia Uv-visible se efectuaron en un espectrofotómetro SPECTRONIC Genesys® 2PC, usando metanol grado reactivo como solvente.
Al triterpenoide aislado se le determinaron los espectros de RMN-1H y RMN-13C (CDCl3+ CD3OD) en un espectrómetro JEOL® 500 MHz.
Preparación de la muestra
La muestra de Ganoderma lucidum se cultivó en el sector de San Javier, en la ciudad de Medellín (Departamento de Antioquia, Colombia) y la facilitó la empresa Hongos y Nutracéuticos S. A.
Los cuerpos fructíferos de Ganoderma lucidum se secaron y trituraron en un molino de cuchillas. De la muestra molida se pesaron 100 g y se extrajeron con 1,6 litros de metanol grado reactivo, con agitación continua, en ausencia de luz, durante 12 horas. Luego se hizo un reflujo abierto con calentamiento suave durante 30 minutos. El extracto se filtró y el residuo se extrajo 2 veces más, con porciones de 800 y 200 mL de metanol, durante 12 horas. Todos los extractos se juntaron y llevaron a sequedad en un rotaevaporador a una temperatura menor a 45°C, a presión reducida y agitación constante. Posteriormente se hizo una partición líquido-líquido con cloroformo/agua (3:2), por duplicado. La fase clorofórmica se secó con sulfato de sodio anhidro y se llevó a sequedad obteniéndose un residuo de 1,75 g.
Fraccionamiento cromatográfico
El residuo clorofórmico se fraccionó por cromatografía en columna, usando sílica gel 40 como fase estacionaria y n-hexano/acetato de etilo (3:7 v/v) como fase móvil. Las fracciones obtenidas se sometieron a fraccionamientos repetidos por cromatografía en capa fina preparativa (CCFP), con sílica gel 60 F254 (Merck®), eluyendo las menos polares con la mezcla n-hexano/acetato de etilo 7:3 (v/v), y las más polares con n-hexano/acetato de etilo 3:7 (v/v). Al eluir con la mezcla n-hexano/acetato de etilo 7:3 (v/v) se obtuvieron 6,8 mg del compuesto A (Rf = 0,5), 16,3 mg del compuesto b (Rf = 0,29). Al eluir otras fracciones más polares con la mezcla n-hexano/acetato de etilo 3:7 (v/v), se obtuvieron 27 mg del compuesto C (Rf = 0,7).
RESULTADOS Y DISCUSIÓN
El espectro de masas de impacto electrónico del compuesto aislado A muestra el ión molecular m/z 396, que corresponde a la fórmula molecular C28H44O. Los fragmentos generales en m/z: 381(M+-CH3, 1.26), 378(M+-H2O, 0.9) y 363[M+(CH3+H2O, 38.3)], son característicos de un esterol. Además, están presentes los fragmentos intensos a m/z: 337(M+-59, 15.6), 271(M+-Cadena lateral, 35.9), 253(M+-Cadena lateral-H2O, 14.6), 229(Fisión del anillo D, 7.2), 211(Fisión del anillo D-H2O, 14.2), 158(M+-H2O y fisión del anillo C, 7.3), 143(M+-H2O-fisión del anillo C-CH3, 25.8) y 128(M+-H2O-fisión del anillo C-2CH3, 13.5), que indican que el núcleo esteroidal está insaturado en los carbonos C5 y C7 (núcleo Δ5,7-3-hidroxiandrosteno) (10). Estos datos coinciden con los reportados en la literatura (11-13) y son consistentes con la estructura del ergosterol mostrada en la figura 1, un esterol característico de los hongos y que a juicio de algunos autores puede utilizarse para el control de calidad de productos a base de G. lucidum (14).
El espectro de masas de impacto electrónico del compuesto aislado B muestra el ión molecular m/z 398, correspondiente a la fórmula molecular C28H46O. Algunos fragmentos característicos son: 398(M+, 6.0), 383(M+-Metilo, 4.4), 273(M+-Cadena lateral, 7.6), 271(M+-Cadena lateral-2H, 28.3), 255(M+-Cadena lateral-H2O, 11.7), 246(Fisión anillo D, 5.9), 213(Fisión anillo D-H2O, 5.9) y 43 (M+-Isopropilo, 100). Por medio este análisis y los datos reportados en la literatura se pudo establecer que el espectro corresponde al del esterol: 5,6-dihidroergosterol (13,15), cuya estructura se muestra en la figura 1. Este compuesto reportado en la especie G. aplannatum, es activo contra bacterias Gram-positivas (16) y presenta una actividad potente contra el virus del herpes simple (17). Algunos compuestos análogos de este esterol han mostrado diversas propiedades biológicas, entre las que se incluyen, una actividad inhibidora in vitro potente contra líneas celulares de cáncer PLC/PRF/5 y Kb (18), e inhibición del ciclo celular (19).
El espectro de masas de impacto electrónico del compuesto aislado C muestra el ión molecular m/z 458, correspondiente con la fórmula molecular C30H50O3. El espectro muestra el fragmento m/z 311, el cual ha sido reportado para varios triterpenoides tipo lanostano insaturados en 7 y 9 (20). El espectro ultravioleta en metanol muestra máximos de absorción en 237, 245 y 254 nm. Estos datos son consistentes con los mostrados por triterpenoides tipo lanostano con insaturación Δ7,9(11), como los reportados previamente en otros compuestos aislados de G. lucidum y especies relacionadas (21). El espectro RMN-1H muestra señales particulares de un compuesto triterpenoide: δ 5,31 (d, J = 6.1Hz) y δ 5,48 (d, J = 5.8), característicos de un triterpenoide tipo lanostano con insaturación Δ7,9. Lo anterior confirma lo observado en el espectro UV. El análisis del espectro de RMN-13C muestra 30 señales: δ 116,19 (C-11), 120,21 (C-7), 142,60 (C-8) y 145,90 (C-9). Este análisis y la comparación de los datos obtenidos de los espectros RMN-1H y RMN-13C, muestran muy buena correlación con los datos reportados para el compuesto lucidumol-B, aislado de G. lucidum (22), cuya estructura se muestra en la figura 1.
Este compuesto ha sido reportado previamente en muestras de G. lucidum cultivadas en China, vietnam y Japón, y ha mostrado significativa actividad inhibitoria contra la proteasa del virus VIH-1 (22).
Varios trabajos de investigación demuestran que la composición química del hongo G. lucidum presenta gran variabilidad, dependiendo de factores como: origen geográfico, las condiciones climáticas y las condiciones ambientales, lo cual dificulta el control de calidad de esta materia prima y de los productos terminados elaborados a partir de ella (23-25). Lo anterior ha llevado a que se desarrollen métodos de análisis cada vez más confiables (24). Adicionalmente, estos autores han demostrado que a pesar de la complejidad y variabilidad de la composición química de las fracciones provenientes de G. lucidum, es posible establecer una huella dactilar o perfil cromatográfico de referencia, con el cual se pueden comparar las muestras de diferentes orígenes e identificar su procedencia. Aunque se puede establecer un perfil cromatográfico representativo para el análisis de estos productos naturales, seguramente se requerirá modificarlo a través de la obtención de nuevas evidencias (23).
La presencia de una sustancia, de distribución restringida, como el lucidumol-B en la muestra analizada de G. lucidum, permite sugerir que este compuesto puede servir como marcador para el control de calidad de los productos que se elaboren a partir de los cuerpos fructíferos del hongo cultivado en la ciudad de Medellín, y para diferenciarlo de los obtenidos en otras localizaciones geográficas.
CONCLUSIONES
A partir del extracto metanólico de los cuerpos fructíferos de Ganoderma lucidum cultivado en Colombia se aislaron e identificaron dos esteroles, ergosterol y 5,6-dihidroergosterol, y un triterpenoide tipo lanostano: lucidumol-B.
AGRADECIMIENTOS
A la empresa Hongos y Nutracéuticos S. A. y la señora María Elena Arango, por proporcionar las muestras de hongo. Al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, por la financiación del proyecto de sostenibilidad 2007-2008. A las estudiantes Diana M. Zuluaga y Marleny Puerta, del programa de Química Farmacéutica de la Universidad de Antioquia.
REFERENCIAS BIBlIOGRÁFICAS
1. Huie CM, Di X. Chromatographic and electrophoretic methods for Lingzhi pharmacologically active components. J Chromatogr B. 2004 Dec; 812 (1-2): 241-257. [ Links ]
2. Arisawa M, Fujita A, Saga M, Fukumura H, Hayasi T, Shimizu M, et al. Three new lanostanoids from Ganoderma lucidum. J Nat Prod. 1986; 49 (4): 621-625. [ Links ]
3. Paterson RRM. Ganoderma -A therapeutic fungal biofactory. Phytochemistry. 2006 Sep; 67 (18): 1985-2001. [ Links ]
4. El-Mekkawy S, Meselhy M, Nakamura N, Tezuka Y, Hattori M, Kakiuchi N, et al. Anti-HIV-1 and anti-HIV-1-protease susbstances from Ganoderma lucidum. Phytochemistry. 1998; 49 (6): 1651-1657. [ Links ]
5. Sadava D, Still D, Mudry R, Kane S. Effect of Ganoderma on drug-sensitive and multidrug-resistant small-cell lung carcinoma cells. Cancer Lett. 2009 May; 277 (2): 182-189. [ Links ]
6. Seto SW, Lam TY, Tam HL, Au ALS, Chan SW, Wu JH, et al. Novel hypoglycemic effects of Ganoderma lucidum water-extract in obese/diabetic (+db/+db) mice. Phytomedicine. 2009 May; 16 (5): 426-436. [ Links ]
7. Ajith TA, Sudheesh NP, Roshny D, Abishek G, Janardhanan KK. Effect of Ganoderma lucidum on the activities of mitochondrial dehydrogenases and complex I and II of electron transport chain in the brain of aged rats. Exp Geront. 2009 Mar; 44 (3): 219-223. [ Links ]
8. Min B-S, Gao J-J, Nakamura N, Hattori M. Triterpenes from the spores of Ganoderma lucidum and their cytotoxicity against meth-A and LLC tumor cells. Chem Pharm bull. 2000 Jul; 48 (7): 1026-1033. [ Links ]
9. González AG, León F, Rivera A, Muñoz CM, Bermejo J. Lanostanoid triterpenes from Ganoderma lucidum. J Nat Prod. 1999 Dec; 62 (12): 1700-1701. [ Links ]
10. Galli G, Maroni S. Mass spectrometric investigations of some unsaturated sterols biosynthetically related to cholesterol. Steroids. 1967 Sep; 10 (3): 189-197. [ Links ]
11. León JF. Química y síntesis de los principios activos aislados de hongos superiores. Sus posibles aplicaciones farmacológicas. [Tesis doctoral]. [Tenerife, España]: Universidad de la Laguna: 2005. 325 p. [ Links ]
12. Seo HW, Hung TM, Na M, Jung HJ, Kim JC, Choi JS, et al. Steroids and triterpenes from the fruit bodies of Ganoderma lucidum and their anti-complement activity. Arch Pharm Res. 2009; 32 (11): 1573-1579. [ Links ]
13. Kac D, barbieri G, Falco MR, Seldes AM, Gros EG. The major sterols from three species of polyporaceae. Phytochemistry. 1984; 23 (11): 2686-2687. [ Links ]
14. Yuan JP, Wang JH, Liu X, Kuang HC, Huang XN. Determination of ergosterol in Ganoderma spore lipid from the germinating spores of Ganoderma lucidum by high-performance liquid chromatography. J Agric Food Chem. 2006 Aug 23; 54 (17): 6172-6176. [ Links ]
15. Martínez A. Esteroles. Medellín, Colombia: Universidad de Antioquia; 2002. 37 p. [ Links ]
16. Zjawiony JK. biologically active compounds from Aphyllophorales (Polypore) Fungi. J Nat Prod. 2004 Feb; 67 (2): 300-310. [ Links ]
17. Niedermeyer THJ, Lindequist U, Mentel R, Gördes D, Schmidt E, Thurow K, et al. Antiviral terpenoid constituents of Ganoderma pfeifferi. J Nat Prod. 2005 Dic; 68 (12): 1728-1731. [ Links ]
18. Lin CN, Tome WP, Won SJ. Novel cytotoxic principles of Formosan Ganoderma lucidum. J Nat Prod. 1991 Jul; 54 (4): 998-1002. [ Links ]
19. Gan K-H, Fan Y-F, Hsu S-H, Kuo K-W, Lin C-N. Mediation of the cytotoxicity of lanostanoids and steroids of Ganoderma tsugae through apoptosis and cell cycle. J Nat Prod. 1998 Apr; 61 (4): 485-487. [ Links ]
20. Lin L-J, Shiao M-S, Yeh S-F. Seven New Triterpenes from Ganoderma lucidum. J Nat Prod. 1988 Sep; 51 (5): 918-924. [ Links ]
21. de Silva ED, Van der Sar SA, Santha L, Wijesundera RLC, Cole ALJ, blunt JW, et al. Lanostane triterpenoids from the Sri Lankan basidiomycete Ganoderma applanatum. J Nat Prod. 2006 Aug; 69 (8): 1245-1248. [ Links ]
22. Min BS, Nakamura N, Miyashiro H, Bae KW, Hattori M.Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 proteasa. Chem Pharm bull. 1998 Oct; 46 (10): 1607-1612. [ Links ]
23. Chen Y, Yan Y, Xie M-Y, Nie S-P, Liu W, Gong X-F, et al. Development of a chromatographic fingerprint for the chloroform extracts of Ganoderma lucidum by HPLC and LC-MS. J Pharm biomed Anal. 2008 Jul; 47 (3): 469-477. [ Links ]
24. Chen Y, Xie M-Y, Yan Y, Zhu S-B, Nie S-P, Li S, et al. Discrimination of Ganoderma lucidum according to geographical origin with near infrared diffuse reflectan spectroscopy and pattern recognition techniques. Anal Chim Acta. 2008 Jun; 618 (2): 121-130. [ Links ]
25. Chen Y, Zhu S-B, Xie M-Y , Nie S-P, Li W , Li C, et al. Quality control and original discrimination of Ganoderma lucidum based on high-performance liquid chromatographic fingerprints and combined chemometrics methods. Anal Chim Acta. 2008 Aug; 623 (2): 146-156. [ Links ]