Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.18 no.1 Medellín Jan./Apr. 2011
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
CONTENIDO FENÓLICO E IDENTIFICACIÓN DE LEVADURAS DE IMPORTANCIA VÍNICA DE LA UVA ISABELLA (Vitis labrusca) PROCEDENTE DE VILLA DEL ROSARIO (Norte de Santander)
PHENOLIC POTENTIAL DETERMINATION AND YEASTS IDENTIFICATION WITH SIGNIFICANT LEAVENS IN ISABELLA GRAPE (Vitis labrusca) FROM VILLA DEL ROSARIO (Norte de Santander) FOR WINE MAKING
José D. HERNÁNDEZ C.2; Yanine Y. TRUJILLO N.1; Daniel S. DURÁN O.1*
1 Grupo de investigación en Ingeniería y Tecnología de Alimentos (GINTAL). Universidad de Pamplona, Km 1 Vía a Bucaramanga, Pamplona, Norte de Santander, Colombia.
2 Maestría en Ciencia y Tecnología de Alimentos. Universidad de Pamplona, Km 1 Vía a Bucaramanga, Pamplona, Norte de Santander, Colombia.
* Autor a quien se debe dirigir la correspondencia: danielduran@unipamplona.edu.co
Recibido: Octubre 16 de 2009
Aceptado: Febrero 21 de 2011
RESUMEN
La uva Isabella (Vitis labrusca) es una variedad tinta que se ha adaptado óptimamente a las condiciones edafoclimáticas de la región de Villa del Rosario (Norte de Santander), y ha tenido buena aceptación en los mercados locales. Actualmente la uva se consume en fresco y se desconoce su contenido fenólico para la elaboración de vinos. El objetivo de este trabajo fue establecer el contenido fenólico e identificar las levaduras de importancia vínica de esta variedad. Para ello, se tomaron bayas de dos vendimias consecutivas. Se analizaron parámetros como densidad, sólidos solubles, pH, acidez y el contenido fenólico total y extraíble. Asimismo, se identificaron las levaduras morfológica y bioquímicamente. Los resultados de los parámetros fisicoquímicos de las dos vendimias se promediaron y compararon con las uvas procedentes del Valle del Cauca. Se concluyó que las bayas de las dos regiones fueron similares en sus características físicas, y diferentes significativamente en cuanto a su composición química. El contenido fenólico total fue mayor en las uvas del Valle del Cauca, mientras que el extraíble fue similar en las dos regiones. El examen microbiológico identificó cinco especies de levaduras: Kloeckera apiculata, Criptococcus laurentii, Candida guillermondii, Candida novergensis y Rhodotorula glutinis.
Palabras clave: Isabella, antocianinas, taninos, levaduras, contenido fenólico.
ABSTRACT
The Isabella grape (Vitis labrusca) is a red variety that has been optimally adapted to the edafoclimatic conditions in the region of Villa del Rosario (Norte de Santander) and has been accepted also in local markets. Currently, the grape is eaten fresh and its potential for winemaking is unknown. Therefore, the purpose of this study was to establish the phenolic potential and identify important yeasts of this kind of grape for winemaking. To this end, berries taken from two consecutive vintages were analyzed. Parameters analyzed were density, soluble solids, pH, acidity and total and removable phenolic potential. The yeasts were identified morphologically and biochemically. The results of the physicochemical parameters of the two vintages were averaged and compared with results for grapes from Valle del Cauca. The results indicated that the berries of the two regions were similar in physical characteristics but significantly different in terms of chemical composition. The total phenolic potential was higher in grapes from Valle del Cauca, while removable was similar in the two regions. Five yeast species: Kloeckera apiculata, Criptococcus laurentii, Candida guillermondii, Candida novergensis and Rhodotorula glutinis were microbiologically isolated and identified.
Key words: Isabella, anthocyanins, tannins, yeasts, phenolic potential.
INTRODUCCIÓN
La uva es el mayor cultivo de frutas del mundo. Se reporta una producción anual mayor de 42 millones de toneladas (1). Los productores más importantes de vid son Francia, España, Italia y Estados Unidos. Cerca del 80% de la uva producida es utilizada en la elaboración de vinos (2). La uva también es orientada para su consumo en fresco y en la producción de zumos, mermeladas, colorantes naturales y pasas (3). Dada su importancia económica y cultural, se han hecho muchas investigaciones concernientes a problemas básicos en el manejo de los viñedos, su adaptación a los diferentes climas y su aptitud para la industrialización (4).
Las principales regiones de producción de uva en el mundo están distribuidas tanto en el hemisferio Norte como en el Sur, donde se recoge una cosecha al año. En el trópico, las regiones para la producción de uva son muy específicas en relación con los parámetros de humedad, temperatura, precipitación y suelos, principalmente. En Colombia, por su condición de país tropical unida a un adecuado manejo de la plantación, el viñedo produce en promedio 2,2 cosechas al año. De otra parte, según estudios realizados por CENIUVA (5), en nuestro país existen muy pocas regiones con las condiciones favorables para su cultivo, localizadas principalmente en los departamentos de Valle del Cauca, Boyacá y los Santanderes. El Valle del Cauca es el principal productor nacional de uva Isabella con unas 1.551 hectáreas cultivadas, y se ha encontrado que la producción de uva es competitiva gracias a las condiciones edafoclimáticas de la zona, y al desarrollo de paquetes tecnológicos para este cultivo en el trópico (5). En el departamento de Boyacá, la producción de uva está encaminada a la elaboración de vinos, ya que las condiciones de clima, suelos y luminosidad de la región han permitido el cultivo de variedades como Riesling blanca del Rhin, Pinot negra y cruzamientos de Riesling por Silvaner, con los cuales se han elaborado vinos de excelente calidad (6). Los municipios Villa del Rosario y Ocaña en Norte de Santander, son productores de uva de la variedad Isabella.
La uva Isabella, originaria del sur de los Estados Unidos es una de las principales variedades de Vitis labrusca. En la década de 1850, despertó el interés de los viticultores europeos debido a su resistencia a la enfermedad del oidio (6). El cultivo de la uva Isabella es de fácil expansión, por su buena adaptación a condiciones edafoclimáticas variables, elevada productividad, longevidad y relativa rusticidad (7, 8). El vino producido a partir de esta uva tiene aromas y gusto fuerte y su consumo está asociado a los beneficios de sus pigmentos y taninos, razón por la cual es uno de los más consumidos en Brasil (9).
En la uva madura, factores como su composición físico-química, conformación y número de la microbiota presente en la periferia de la baya, son de vital importancia para el proceso de vinificación. Por su parte, los parámetros físico-químicos en uvas tintas, como el peso de la baya, la densidad del mosto (10) y la relación entre los azúcares y la acidez, han sido utilizados tradicionalmente como indicadores para determinar el tiempo de vendimia y la calidad de la uva (11). Igual importancia tiene el contenido polifenólico de la baya, uno de los parámetros con mayor significación tecnológica. Los compuestos fenólicos de los hollejos y semillas determinan el color, sabor, cuerpo y estructura en los vinos tintos (3) y entre ellos, los antocianos y los taninos son los que mayor influencia tienen sobre el color del vino tinto (12, 13). Muchas investigaciones enológicas estudian los compuestos fenólicos con el propósito de mejorar la calidad del vino y conocer propiedades suyas de interés nutricional y farmacológico (13). Durán et al., 2008 (24) comparó el contenido fenólico de vinos tintos colombianos e importados y encontró que el índice de polifenoles totales y las características cromáticas son similares en todos ellos y que los colombianos revelan bajos contenidos de antocianos y taninos.
Las uvas son la fuente principal de microorganismos para la producción del vino (15) principalmente levaduras, mohos y varias especies de bacterias ácido lácticas y acéticas (16). Las levaduras son las de mayor importancia puesto que dirigen la fermentación alcohólica, contribuyendo a la estructura química básica y a la individualidad del sabor y aroma del vino. De allí la importancia del conocimiento sobre su ecología (17).
Por lo general, muy pocas levaduras (103 ufc/g) se detectan en la uva inmadura, pero aumentan las poblaciones de 104 a 106 ufc/g cuando madura porque durante la maduración los azúcares se lixivian o difunden de los tejidos internos a la superficie de la baya, facilitando el crecimiento de las levaduras (18). Otros factores como la lluvia, la temperatura, el daño físico y la aplicación de agroquímicos como fungicidas e insecticidas afectan el crecimiento o la carencia de levaduras en la superficie de la uva (19, 20). Por tal razón, cada región tiene una microflora característica de acuerdo con el área en la que se localizan las viñas y sus labores culturales (21). Normalmente, las especies de levaduras que es posible encontrar en las uvas y en el mosto son la Hanseniaspora uvarum (Kloeckera apiculata), Metsnichnikowia pulcherrima, especies de Pichia (Pichia membranifaciens, Pichia fermentans), especies de Candida (Candida stellata y Candida aghi raghiraghi), Issatchenkia orientalis, Cryptoccocus spp. y Rhodotorula spp. (15, 20).
El propósito del presente trabajo es establecer el contenido fenólico e identificar las levaduras de importancia vínica de la uva variedad Isabella producida en la región de Villa del Rosario y comparar sus propiedades físico-químicas con las de la uva producida en la región del Valle del Cauca, con el fin de establecer el contenido de esta variedad para la producción de vino tinto en la región.
MATERIALES Y MÉTODOS
Muestras de uva Isabella
Se tomaron in situ muestras de uvas provenientes de dos fincas (A y B) de Villa del Rosario de dos vendimias consecutivas (mayo y octubre). Como control se adquirieron uvas de dos fincas (C y D) del Valle del Cauca por medio de una empresa distribuidora, en el año 2007. De cada finca se tomaron muestras de 3 kg de bayas de dos lotes siguiendo la técnica descrita por Ough, 1996 (22). Las muestras fueron refrigeradas y analizadas 24 horas después de la recolección.
Características físico-químicas de la uva
Determinación físico-química de la baya
Se eligieron bayas localizadas en el centro de los racimos por su mayor uniformidad en el tamaño. La densidad se determinó tomando 10 bayas al azar. Se midió la masa a cada baya por pesada directa y el volumen por desplazamiento del agua en una probeta. Posteriormente, con los resultados se calculó la densidad (ρ = m/v). La composición macro de baya (hollejo, pulpa y semilla) se obtuvo congelando 10 bayas durante 24 horas previas al análisis. Luego fueron pesadas y con un bisturí se separaron cuidadosamente el hollejo, las semillas y la pulpa. Seguidamente, se pesó cada una de estas partes por separado, para lo cual se utilizó una balanza de precisión marca OHAUS con una sensibilidad de ± 0,0001g. Luego, por maceración se obtuvieron 100 mL de mosto, al cual se le determinaron los sólidos solubles (refractómetro digital Reichert AR200), pH (pHmetro HANNA HI 221), y acidez total (valoración volumétrica, expresada en g de ácido tartárico/L de mosto). Estos análisis se realizaron por triplicado y siguiendo el Reglamento CEE Nº 2676/90 (23).
Determinación del contenido polifenólico de la uva
Preparación de los extractos de hollejos de uva
Para la extracción de los polifenoles se siguió la metodología utilizada por Glories et al., 1994 (24). Se prepararon dos soluciones alcohólicas de diferentes pH (12% etanol, 5 g/L ácido tartárico, ajustada a pH 1,0 o 3,2). A cada solución (pH 1,0 y 3,2) se le adicionaron hollejos provenientes de 25 bayas de la parte media del racimo. Los hollejos fueron macerados en cada solución durante 24 horas a 25ºC. De esta manera, a pH =1,0 se asimilan los polifenoles totales de la uva y a pH =3,2 los que serían extraídos durante el proceso de vinificación. El volumen de solución alcohólica fue calculado de acuerdo con el peso de las uvas, con el fin de obtener una dilución similar a las que tenían las uvas originalmente.
Parámetros polifenólicos medidos a los extractos de hollejo de uva
A los extractos se les midió el índice de polifenoles totales (IPT), antocianos totales, taninos y la intensidad del colorante (IC), según Ribéreau-Gayon et al., 1998 (25), calculada como la suma de las absorbancias a 420, 520 y 620nm. El contenido fenólico de las uvas se determinó utilizando los métodos de Glories et al., (24) y Saint-Criq et al., 1998 (26), y la extractabilidad antociánica, mediante la ecuación:
%EA=[(ApH1-ApH3.2)/ApH1)]*100 Ecuación 1.
Las medidas de estos parámetros se obtuvieron por duplicado en un espectrofotómetro UV-Visible Hach DR/4000U, utilizando cubetas de 1 cm de recorrido óptico.
Identificación de levaduras de la uva Isabella
Tratamiento de pre-aislamiento
Dos racimos de uvas fueron transferidos asépticamente a una bolsa plástica estéril y macerados a mano durante 2 minutos, de acuerdo con lo estimado por Combina et al., 2005 (15). Para la enumeración y aislamiento se utilizó el método de diluciones (agua de peptona micológica al 0,1%) seriadas hasta 10-6. Posteriormente, las diluciones fueron inoculadas en alícuotas de 0,1 mL en placas de agar extracto de malta (MEA), suplementado con rosa de bengala (30 mg L-1), cloranfenicol (50 μg L-1) y eritromicina (70 μg L-1), ajustando el pH del medio a 4,5. Las placas de Petri inoculadas se incubaron a 25ºC y se examinaron a diario hasta que las colonias tuvieron un tamaño que permitiera la diferenciación entre los diferentes tipos. Más tarde se recuperaron números representativos de cada tipo de colonia y se estimó su porcentaje. El recuento de colonias se efectuó por triplicado. Los aislamientos se purificaron en placas de agar glucosa, peptona, levadura (YPD), para la siguiente identificación según Combina et al., (15).
Identificación morfológica y bioquímica de levadura
A las levaduras aisladas en el agar YPD se les examinó la morfología celular por microscopía. Se utilizó agar adicionado con Tween 80 en placas Dalmau, para determinar la habilidad de formar hifas y pseudohifas. Para la identificación bioquímica, las levaduras se sometieron a pruebas de asimilación de hidratos de carbono, utilizando el sistema API 20C AUX (Bio-Merieux), según las instrucciones del fabricante.
Tratamiento estadístico de los datos
Los resultados se analizaron mediante el paquete de software estadístico SPSS versión 13.0 con análisis de varianza (ANOVA un factor).
RESULTADOS Y DISCUSIÓN
Características físico-químicas de la uva
Características físicas de la uva
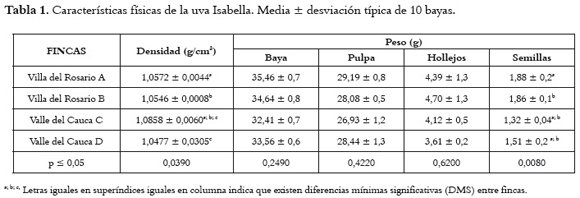
En la tabla 1 aparecen los valores promedio de las características físicas de la uva de las regiones de Villa del Rosario y Valle del Cauca que, en general, son muy similares. En el caso de la densidad de la baya, la proveniente de la finca C del Valle del Cauca es la que registra mayor densidad. Al hacer el análisis de la varianza se encontraron diferencias significativas y se determinó que es posible establecer dos grupos, cada uno conformado por las fincas de la misma región.
En cuanto a la composición macro de la uva: peso de la baya entera, peso de la pulpa, peso del hollejo, son similares en las diferentes fincas muestreadas y en las regiones, salvo en el peso de las semillas, ya que las uvas provenientes de Villa del Rosario tuvieron mayor peso. En este mismo sentido, los pesos de la uva entera, pulpa y hollejo, no registraron diferencias estadísticamente significativas a diferencia del peso de las semillas.
Estas características son de importancia, ya que el tamaño de la baya es conocido como factor determinante en la calidad de la uva para vinificación, porque se relaciona directa o inversamente con la proporción de pulpa, hollejos y semillas, y con la concentración de los compuestos fenólicos en la uva (27, 28).
Al estimar los resultados como porcentajes de las diferentes partes de la composición macro de la uva Isabella de las dos regiones, se obtienen estas cifras: 81% de pulpa, 14% de hollejo y 5% de semillas, que comparadas con las obtenidas por Roby y Matthews (29), en uvas Cabernet Sauvignon (80% de pulpa, 15% de piel y 5% de semillas), demuestra que las proporciones en la uva Isabella son similares a las de la Cabernet Sauvignon, con la diferencia de que la primera registra más peso (3,33 g promedio) que la Cabernet Sauvignon (1,24 g promedio), según Muñoz et al., 2002 (30).
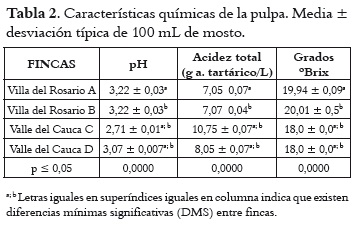
Características químicas
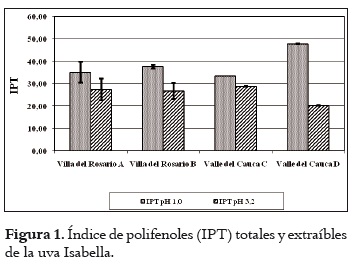
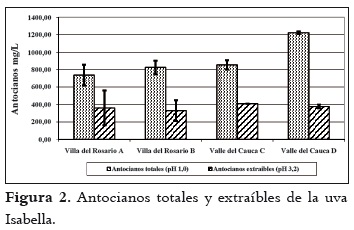
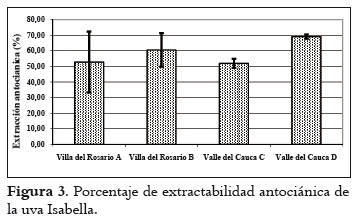
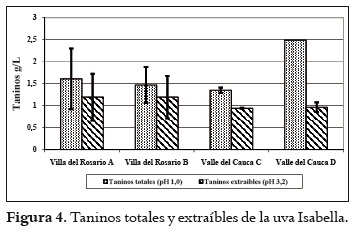
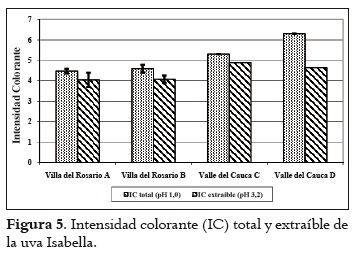
Los resultados sobre el pH, la acidez total y los sólidos solubles se aprecian en la tabla 2. Estos valores son similares para las fincas de cada región. El pH y los sólidos solubles son superiores en las uvas de Villa del Rosario, al tiempo que la acidez es menor. Con respecto a los valores de pH se puede indicar que el mosto obtenido de la uva de Villa del Rosario se encuentra en el rango apto para realizar una fermentación (3,2 a 3,9), en tanto que al obtenido con las uvas del Valle del Cauca se le debe hacer una corrección si se desea vinificar. De igual forma sucede con la acidez. En este caso, al efectuar la corrección se correría el riesgo de la formación de tartratos en los mostos obtenidos con las uvas del Valle del Cauca. Por otra parte, el contenido de azúcares es de importancia en la vinificación, ya que de ellos depende la formación de alcohol. Por tanto, con contenidos de azúcares superiores a 18ºBrix se podrían obtener vinos con promedios de alcohol entre 10 y 12% respectivamente (31). El análisis de la varianza indicó diferencias estadísticamente significativas entre las uvas provenientes de las dos regiones para cada característica química medida. Asimismo, la prueba post hoc definió dos grupos homogéneos de fincas: uno, conformado por las fincas de Villa del Rosario, y el otro, por las del Valle del Cauca. Contenido polifenólico de la uva Índice de polifenoles totales (IPT) En la figura 1 se muestran los resultados del índice de polifenoles totales y extraíbles (pH 1,0 y 3,2 respectivamente) de las uvas provenientes de las regiones de Villa del Rosario y Valle del Cauca. Estos valores son similares, exceptuando la finca D del Valle del Cauca, en donde el IPT total es más alto y el extraíble más bajo. Generalizando, el porcentaje de IPT que pasaría de las uvas al vino en una eventual vinificación sería en promedio del 78% para las uvas de las fincas A, B y C, mientras que para la finca D sería del 42,5%. El análisis estadístico mostró que existen diferencias entre el IPT de las uvas a pH 1,0, mientras que a pH 3,2 no se apreció ninguna diferencia en las uvas de las diferentes regiones. El IPT se relaciona inversamente con el tamaño de la baya, por la relación superficie/volumen de la baya; así, aumenta a medida que el diámetro disminuye, es decir que a menor volumen de las bayas, mayor es la proporción de hollejos, o viceversa (32). Asimismo, los compuestos fenólicos de la uva se concentran mayormente en los hollejos, de lo que se puede deducir que, a mayor proporción de hollejo, más alta es la concentración de polifenoles en mostos y vinos tintos, como se puede observar en la tabla 1. Contenido de antocianos La cantidad promedio de antocianos totales (pH 1,0) es alta con respecto a los antocianos extraíbles (pH 3,2) de las bayas de las dos regiones, tal como se aprecia en la figura 2. Por otro lado, la finca D del Valle del Cauca exhibió un mayor contenido de antocianos totales y un menor contenido en los extraíbles que las otras fincas, mientras que estas últimas demostraron similaridad en los totales y extraíbles. Al igual que con el IPT, las uvas a pH 1,0 indicaron diferencias estadísticas significativas pero a pH 3,2 no se apreciaron tales diferencias. Al comparar los antocianos totales obtenidos en Isabella con los obtenidos por Reyero et al., 2005 (33) en uvas Cabernet Sauvignon y Merlot (800 mg/L en promedio), y los extraíbles con los obtenidos en Merlot y Cabernet Sauvignon (475 y 430 mg/L respectivamente) por González-Nevez et al., 2004 (34) y Reyero et al., 2005 (33), es posible afirmar que la uva Isabella obtuvo promedios similares a los de estas variedades importantes internacionalmente. Porcentaje de extracción antociánica (%EA) En la figura 3 se pueden ver los resultados de la extractabilidad antociánica (%EA), parámetro que proporciona información sobre la cantidad de antocianos que pasan de la uva al vino durante la etapa de maceración, de manera que cuanto mayor sea su valor, mayor será la dificultad para su extracción. El %EA de las uvas de las dos regiones es similar. El análisis de varianza no indicó diferencias significativas para este parámetro entre fincas y regiones. El %EA de la uva Isabella en promedio fue del 58%, más alto que el registrado por las variedades Merlot y Monastrell (30% promedio), y las variedades Cabernet Sauvignon, Tempranillo y Syrah (48% en promedio) (33). Esta comparación indica que los antocianos de la uva Isabella ofrecen mayor dificultad para su extracción que los de las uvas internacionales, quizá por su menor proporción de hollejos por kilogramo de fruta. Estas diferencias pueden deberse a que la uva Isabella, por su tamaño, contiene menor proporción de hollejos por kilogramo de fruta que las otras variedades. La extractabilidad antociánica en la variedad Isabella puede mejorar si se opta por utilizar enzimas pectolíticas que contribuyan a incrementar la composición fenólica del vino, al permitir la disgregación de las paredes celulares durante el proceso de maceración (35). Contenido de taninos Los resultados promedios del contenido de taninos totales (pH 1,0) y taninos extraíbles (pH 3,2) de las uvas provenientes de Villa del Rosario y del Valle del Cauca aparecen en la figura 4, donde se observa que todos son similares, exceptuando los correspondientes a la finca D del Valle del Cauca, que obtuvo el valor más alto. Es necesario advertir, sin embargo, que el análisis estadístico señaló que la uva de esta finca difiere significativamente del resto en los taninos totales, pero no en los extraíbles. Intensidad colorante (IC) La IC es la suma de las absorbancias a 420nm, 520nm y 620nm de los colores amarillo, rojo y azul respectivamente. Los resultados obtenidos de la IC se indican en la figura 5, donde se observa que la mayor IC total y extraíble se da en la uvas de la finca D de Valle del Cauca; la sigue la finca C de la misma región, mientras que para las fincas de Villa Es posible que las condiciones medioambientales del Rosario los valores fueron similares. El análisis de la varianza (ANOVA) del IC total y extraíble señaló diferencias significativas entre las bayas de las dos regiones. Asimismo, la prueba post hoc mostró dos grupos homogéneos, conformados por las uvas de las fincas de cada región. Identificación de levaduras de la uva Isabella
Esta identificación se practicó en las bayas de Villa del Rosario, ya que no se puede comparar con la de otras uvas porque la microbiota depende de las condiciones edafoclimáticas y de las labores en el cultivo.
Las poblaciones de levaduras de las uvas de las diferentes regiones aparecen en la tabla 3. Los conteos de levaduras de la primera vendimia en las uvas de las fincas A y B obtuvieron valores menores que en la segunda. De otro lado, entre las fincas tuvieron conteos de levaduras similares para cada vendimia. El análisis estadístico no indicódiferencias significativas entre las uvas de cada finca para cada vendimia, en tanto que sí se dieron entre vendimias.
Es posible que las condiciones medioambientales de cada época del año hayan influido en estos resultados. Varios autores han indicado que los factores del clima ejercen una gran influencia, y entre ellos la lluvia es uno de los más importantes (16, 36). Los datos pluviométricos de Villa del Rosario durante los meses de vendimia (mayo y octubre) fueron de 68 mm y 150 mm respectivamente. Así pues, las poblaciones de levaduras que se hallaron en el presente trabajo parecen relacionadas con las diferencias en las condiciones climáticas cercanas al tiempo de cosecha. Por una parte, la lluvia induce un aumento en el volumen de la uva, permitiendo la liberación de jugos endulzados a través de pequeñas rasgaduras y separaciones en las áreas de conexión, como entre el pedicelo y la baya (15). Y por otra se puede producir la exosmosis, fenómeno por el cual migran nutrientes del interior al exterior de la fruta proporcionando sustancias nutritivas a la microbiota periférica de la baya (37).
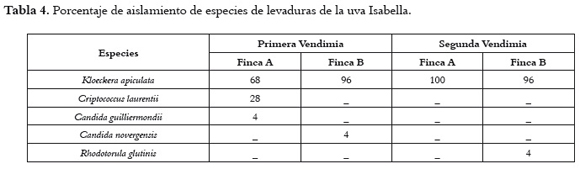
Composición de la microbiota de levaduras: en las dos vendimias se aislaron cinco especies de levaduras de las uvas de las fincas A y B, tal como se muestra en la tabla 4, representadas en orden decreciente por Kloeckera apiculata, Criptococcus laurentii, especies del genero Candida guilliermondii y Candida novergensis y Rhodotorula glutinis.
El género mayormente aislado en las uvas de las dos vendimias fue la levadura apiculada Kloeckera apiculata. El porcentaje de recuperación en esta especie fue similar para las uvas de la finca B en las dos vendimias. El Criptococcus laurentii, especie que se encontró únicamente en las uvas de la finca A durante la primera vendimia, fue la segunda. No se hallaron levaduras altamente fermentativas.
El informe sobre las especies de levaduras que se hallaron en las uvas de Villa del Rosario concuerda parcialmente con reportes de diferentes países. Es habitual encontrar Kloeckera spp., Criptococcus laurentii y Rhotorula glutinis en las bayas y mostos (20, 21, 38, 39). La frecuencia de levaduras apiculadas en la superficie de la uva, que pueden representar entre el 50 y 90% de la población total de levaduras en uvas maduras saludables, se ha estudiado ampliamente (21, 38, 40). En otros estudios, sin embargo, las levaduras apiculadas son especies escasas, y otras como Criptococcus, Rhodotorula y algunas especies de Candida, conforman los géneros más frecuentes de levaduras (17, 20, 41).
La Kloeckera apiculata (especie fermentativa) actúa durante las primeras fases de fermentación del mosto, donde es responsable de la síntesis de algunos de los componentes del aroma (42), por tanto, es conveniente para la producción del vino, al que aporta parte del bouquet. Las demás especies aisladas, tales como Criptococcus laurentii, Candida guilliermondii, C. novergensis y Rhodotorula glutinis, normalmente crecen sobre la superficie del vino, tienen bajo poder fermentativo, oxidando el etanol, produciendo diversos productos finales, algunos de los cuales perjudican la calidad del vino (ácido acético, acetato de etilo, entre otros).
CONCLUSIONES
La composición física de la baya procedente de Villa del Rosario tiene similitud con la uva del Valle del Cauca; solamente difieren en el peso de las semillas. De otra parte, según los resultados de acidez, pH y sólidos solubles, la uva de Villa del Rosario es más apta para la vinificación, porque estos parámetros se encuentran dentro del rango tecnológico que una uva debe tener para ello.
Las características del contenido polifenólico total fueron siempre superiores en las uvas de la finca D del Valle del Cauca, pero en los extraíbles presentaron el nivel más bajo. De otra parte, las uvas procedentes de Villa del Rosario exhibieron uniformidad entre las fincas de origen. La uva Isabella demostró una extractabilidad antociánica alta, comparada con algunas variedades internacionales, por lo que sería interesante utilizar enzimas pectolíticas en la maceración, con el fin de acrecentar su aporte polifenólico al vino durante su proceso de vinificación.
Las poblaciones de levaduras fueron mayores en la segunda vendimia que la primera. Se aislaron e identificaron cinco especies de levaduras: Kloeckera apiculata, Criptococcus laurentii, Candida guillermondii, Candida novergensis y Rhodotorula glutinis, siendo el género Kloeckera apiculata el que presenta el metabolismo fermentativo que contribuye al bouquet de los mostos de uva fermentados. Sin embargo, los mostos que procedan de estas uvas deberán ser inoculados con cultivos comerciales de levaduras para lograr un proceso de fermentación óptimo.
REFERENCIAS BIBLIOGRÁFICAS
1. FAOSTAT-FAO. Producción de uva en el mundo [Internet]. Estados Unidos de América: 2007 [Citado 2009 Nov 21]. Disponible en: http://faostat.fao.org/site/339/default.aspx. [ Links ]
2. Kammerer D, Claus A, Carle R, Schieber A. Polyphenol screening of pomace from red and white grape varieties (Vitis vinifera L.) by HPLC-DAD-MS/MS. J Agri Food Chem. 2004 Jul 14; 52 (14): 4360-4367. [ Links ]
3. Pinelo M, Arnous A, Meyer AS. Upgrading of grape skins: Significance of plant cell-wallstructural componentsand extraction techniques for phenol release. Trends Food Sci Technol. 2006 Nov; 17 (11): 579-590. [ Links ]
4. Luo S, He P. The inheritances of fruit skin and must colors in a series of interspecificandintraspecific crosses between V. vinifera and the wild grape species native to China. Sci Hortic. 2004 Jan 2; 99 (1): 29–40. [ Links ]
5. CENIUVA. Estudio de factibilidad para la producción de uva en el municipio de Villa del Rosario, Norte de Santander. Cali, Colombia: Centro de Investigación Vitícola Tropical CENIUVA, Corporación Autónoma Regional de Norte de Santander (CORPONOR). 2002. p 97-99. [ Links ]
6. Quijano RM. El viñedo y la cava de la loma de Punta Larga [Internet]. Vía Duitama Nobsa; 2008 [Citado 2009 Jun 3]. Disponible en: http://boyaca.homestead.com/historiavinos.html. [ Links ]
7. Grigoletti A, Sônego OR. Principais doenças fúngicas da videira no Brasil. 1ª rev. ed. Brasialia, DF, Brasil: EMBRAPA; 1993. 36 p. [ Links ]
8. Zanuz MC. Efeito da maturação sobre a composição do mosto e qualidade do suco de uva [Tesis magistral]. [Porto Alegre]: Faculdade do Agronomia, Universidade Federal do Rio Grande do Sul; 1991. [ Links ]
9. Rombaldi C, Bergamasqui M, Lucchetta L, Zanuzo M, Silva J. Produtividade e qualidade de uva, cv. Isabel, em dois sistemas de produção. Rev Bras Frutic. 2004 Apr; 26 (1): 89-91. [ Links ]
10. Coombe BG. Distribution of solutes within the developing grape berry in relation to its morphology. Am J Enol Vitic. 1987 Jun; 38 (2): 120–127. [ Links ]
11. González–Sanjosé ML, Díez C. Compuestos fenólicos en el hollejo de uva tinta durante la maduración. Agrochimica xxxvi. 1992; 1 (1): 63–70. [ Links ]
12. Bautista AB. Técnicas enológicas para la obtención de vinos de Monastrell de alto contenido polifenólico [Tesis doctoral]. [Murcia]: Universidad de Murcia; 2005. 9-10p. [ Links ]
13. Llaudy MC. Contribución al estudio de los factores que afectan la astringencia del vino tinto [Tesis doctoral]. [Tarragona]: Universidad Rovira i Virgili; 2006. p. 3-12. [ Links ]
14. Duran D, Trujillo Y. Estudio comparativo del contenido fenólico de vinos tintos Colombianos e importados. Vitae. 2008 Jan-Jun; 15 (1): 17-24. [ Links ]
15. Combina M, Mercado L, Borgo P, Elia A, Jofré V, Ganga A, et al. Yeasts associated to Malbec grape berries from Mendoza, Argentina. J Appl Microbiol. 2005 Nov; 98 (5): 1055–1061. [ Links ]
16. Fleet GH. Microorganisms in food ecosystems. Int J Food Microbiol. 1999 Sep 15; 50 (1-2): 101–117. [ Links ]
17. Fleet GH, Prakitchaiwattana C, Beh AL, Heard G. The yeast ecology of wine grapes. Biodiversity and biotechnology of wine yeast. Ciani M, editor. Trivandrum, India: Research Signpost; 2002. p. 1-17. [ Links ]
18. Fleet GH. Yeast interactions and wine flavour. Int J Food Microbiol. 2003 Sep 1; 86 (1-2): 11–22. [ Links ]
19. Longo E, Cansado J, Agrelo D, Villa TG. Effect of climatic conditions on yeast diversity in grape musts from northwest Spain. Am. J Enol Vitic. 1991 Jun; 42 (2): 141–144. [ Links ]
20. Rementeria A, Rodríguez JA, Cadaval A, Amenabar R, Muguruza JR, Hernando FL, et al. Yeast associated with spontaneous fermentations of white wines from the Txakoli de Bizkaia region (Basque Country, North Spain). Int J Food Microbiol. 2003 Sep 1; 86 (1-2): 201–207. [ Links ]
21. Ribéreau-Gayon P, Dubourdieu D, Doneche B, Lonvaud A. Handbook of Enology. The microbiology of wine and vinifications. 2nd rev ed. New York, US: Wiley; 2000. p. 1– 49. [ Links ]
22. Ough CS. Tratado básico de enología. 1ra rev ed. Zaragoza, España: Acribia; 1996. 16p. [ Links ]
23. Comunidad Económica Europea. Reglamento (CEE) No 2676/90). Comisión de 17 de septiembre de 1990 por el que se determinan los métodos de análisis comunitarios aplicables en el sector del vino [Internet]. 1990 [Citado 2011 Feb 03]. Disponible en: http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:1990R2676:20050813:ES:PDF. [ Links ]
24. Glories Y, Augustin M. La maturité phenolique des raisins Rouges. Les polyphenols Facteurs de la Qualité. Bordeaux, Francia: Sitevinite; 1994. 117p. [ Links ]
25. Ribéreau-Gayon P, Glories Y, Maujean A, Dubourdieu D. Traité d'oenologie: chemie du vin. Stabilisatión et traitements. Tome II. 1a rev ed. París, Francia: Dunod; 1998. p. 185-219. [ Links ]
26. Saint-Criq N, Vivas N, Glories Y. Maduritè phènolique: définition et contrôle. Rev Fr Oenol. 1998; 173: 22-25. [ Links ]
27. Esteban MA, Villanueva MJ, Lissarrague JR. Effect of irrigation on changes in berry composition of Tempranillo during maturation. Sugars, organic acids and mineral elements. Am J Enol Vitic. 1999 Dec; 50 (4): 418-434. [ Links ]
28. Reyero JR, Garijo J, Pardo F, Salinas MR. Influencia del riego excesivo en la producción y en el contenido polifenólico de diferentes variedades viníferas. Enólogos. 1999 Sep-Dic; 3: 17-21. [ Links ]
29. Roby G, Matthews MA. Relative proportions of seed, skin and flesh, in ripe berries from Cabernet Sauvignon grapevines grown in a vineyard either well irrigated or under water deficit. Aust J Grape Wine Res. 2004 Apr; 10 (1): 74–82. [ Links ]
30. Muñoz R, Pérez J, Pszczolkowski Ph, Bordeu E. Influencia del nivel de carga y microclima sobre la composición de bayas, mosto y vino de Cabernet-Sauvignon. Cien Inv Agr. 2002; 29 (2): 115-125. [ Links ]
31. Rizzon LA, Miele A, Meneguzzo J. Avaliação da uva cv. Isabel para a elaboração de vinho tinto. Ciênc Tecnol Aliment. 2000 Apr; 20 (1): 115-121. [ Links ]
32. Roby G, Harbertson JF, Adams DA, Matthews MA. Berry size and vine water deficits as factors in winegrape composition: Anthocyanins and tannins. Aust J Grape Wine Res. 2004 Jul; 10 (2): 100–107. [ Links ]
33. Reyero JR, Lorenzo C, Pardo F, Alonso GL, Salinas MR. Comparación del contenido fenólico de uvas en el momento óptimo de vendimia y características de sus vinos [Internet]. (Revista Enólogos). Madrid, España: Federación Española de Asociaciones de Enólogos; 2005 [Citado 2009 Ene 16]. Disponible en: http://www.enologo.com/tecnicos/eno37/ined37_2.html. [ Links ]
34. González-Neves G, Charamelo D, Balado J, Barreiro L, Bochicchio R, Gatto G, et al. Phenolic potential of Tannat, Cabernet-Sauvignon and Merlot grapes and their correspondence with wine composition. Anal Chim Acta. 2004 Jun 18; 513 (1): 191-196. [ Links ]
35. Pardo F, Salinas MR, Alonso GL, Navarro G, Huerta MD. Effect of diverse enzyme preparations on the extraction and evolution of phenolic compounds in red wines. Food Chem. 1999 Nov; 67 (2): 135-142. [ Links ]
36. Rousseau S, Doneche B. Effect of water activity (aw) on the growth of some epiphytic microorganisms isolated from grape berry. Vitis. 2001; 40 (2): 75–78. [ Links ]
37. Padgett M, Morrison JC. Changes in grape berry exudates during fruit development and their effect on mycelial growth of Botrytis cinerea. J Am Soc Hortic Sci. 1990 Mar; 115 (2): 269–273. [ Links ]
38. Fleet GH, Heard GH. Wine microbiology and biotechnology. Graham H. Fleet (Ed). New York, USA: Harwood Academic Publisher; 1993. p 27-54. [ Links ]
39. De La Torre MJ, Millán MC, Pérez-Juan PM, Morales J, Ortega JM. Changes in the microbiota during ripening of two Vitis vinifera grape varieties grown in southern Spain. Microbios. 1998; 96 (385): 165–176. [ Links ]
40. Jolly N, Augustyn O, Pretorius I. The occurrence of non-Saccharomyces cerevisae yeast species over three vintages in four vineyards and grape musts from four production regions of the Western Cape, South Africa. S. Afr. J Enol Vitic. 2003; 24 (2): 35–42. [ Links ]
41. Sánchez de Cos P, González S,Cristellys E. Isolation and identification of the yeast biota in the D.O. Valle de La Orotava (1st part). Vitic Enol Sci. 1999; 54 (1): 21–25. [ Links ]
42. Romano P, Suzzi G, Comi G, Zironi R, Maifreni M. Glycerol and other fermentation products of apiculate wine yeasts. J Appl Microbiol. 1997 May; 82 (5): 615– 618. [ Links ]