Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.18 no.1 Medellín Jan./Apr. 2011
BIOTECNOLOGÍA
RESOLUCIÓN CINÉTICA DE (R,S)-MANDELATO DE METILO POR PREPARACIONES INMOVILIZADAS DE LIPASA DE Candida antarctica B
KINETIC RESOLUTION OF (R,S)-METHYL MANDELATE BY IMMOBILIZED LIPASE PREPARATIONS FROM Candida antarctica B
Andrés ESCORCIA1; Jenniffer CRUZ1; Rodrigo TORRES1; Claudia ORTIZ1*
1 Grupo de Investigación en Bioquímica y Microbiología (GIBM). Universidad Industrial de Santander. Carrera 27 Calle 9ª, Edificio Camilo Torres 210. Bucaramanga, Colombia.
* Autor a quien se debe dirigir la correspondencia: ortizc@uis.edu.co.
Recibido: Febrero 17 de 2010
Aceptado: Noviembre 24 de 2010
RESUMEN
El desarrollo de métodos para la obtención de compuestos quirales constituye uno de los grandes desafíos de la química actual. En este contexto, la resolución cinética catalizada por lipasas representa una excelente alternativa. En medios homogéneos, estas enzimas presentan equilibrio entre dos conformaciones (abierta y cerrada), el cual es posible desplazar hacia la conformación abierta (forma activa) en presencia de soportes hidrofóbicos. En este trabajo, la lipasa de Candida antarctica B (CAL-B) se purificó e inmovilizó covalentemente en soportes epóxido Eupergit C (EC), Eupergit C activados con otros grupos funcionales y soportes de octil-agarosa. Estas preparaciones de enzima inmovilizada se utilizaron bajo diferentes condiciones de pH en la resolución cinética del (R,S)-mandelato de metilo. Se destacó el derivado inmovilizado EC-amino-CAL-B, por ser altamente enantioselectivo a pH 8 (razón enantiomérica (E) de 52), permitiendo obtener el enantiómero R del ácido mandélico con un exceso enantiomérico (ee) del 96%.
Palabras clave: Lipasas, biotransformación, ingeniería de proteínas, enzimas inmovilizadas.
ABSTRACT
The development of methodologies for obtaining chiral compounds constitutes a major challenge on current chemistry. In this context, kinetic resolution catalyzed by lipases represents an excellent alternative. In homogeneous media, these enzymes display an equilibrium between two conformations (open and closed form), that can be displaced towards an open conformation (active form) in presence of hydrophobic supports. In this article lipase from Candida antarctica B (CAL-B) was purified and covalently immobilized onto Eupergit C epoxy supports (EC), Eupergit C activated with other functional groups and octyl-agarose supports. These preparations of immobilized enzymes were used under different pH conditions in the kinetic resolution of (R,S)-methyl mandelate. In this study, EC-amino-CAL-B immobilized derivative was highlighted because it is highly enantioselective at pH 8 (enantiomeric ratio (E) of 52), allowing to obtain an R-enantiomer from mandelic acid with an enantiomeric excess (ee) of 96%.
Key words: Lipases, biotransformation, protein engineering, immobilized enzymes.
INTRODUCCIÓN
Las lipasas son enzimas hidrolíticas (triacilglicerol hidrolasas, EC 3.1.1.3) que actúan sobre triglicéridos insolubles y otros ésteres insolubles de ácidos grasos de cadena larga. Puesto que la reacción de hidrólisis es reversible, estos biocatalizadores pueden también catalizar la formación de ésteres a partir de donadores acilo y alcoholes en sistemas no acuosos. Estas enzimas son muy estudiadas en biocatálisis, ya que presentan una amplia especificidad por sustratos no naturales, lo cual contrasta, en algunos casos, con su elevada regio y enantioselectividad. De ahí que las lipasas sean utilizadas para efectuar diferentes tipos de reacciones en síntesis orgánica (por ejemplo, resolución de mezclas racémicas) (1-4).
Las lipasas tienen un complejo mecanismo catalítico de reacción, de acuerdo con el cual, en medios acuosos homogéneos se encuentran en un cierto equilibrio entre dos conformaciones estructurales: una lipasa con el sitio activo abierto y uno cerrado, con el equilibrio desplazado mayoritariamente hacia la conformación cerrada. Sin embargo, en presencia de una interfase hidrofóbica, sufren lo que se conoce como fenómeno de activación interfacial, proceso mediante el cual se desplaza el equilibrio conformacional dando lugar a la fijación de la conformación abierta de la lipasa sobre dicha interfase (5, 6).
El complejo mecanismo catalítico de las lipasas hace posible pensar que la alteración de este mecanismo de apertura y cierre o de la forma exacta de la conformación abierta de la lipasa, podría dar lugar a una modificación en sus propiedades catalíticas. De esta forma, la posibilidad de controlar y modular este equilibrio constituye una poderosa herramienta para mejorar sus propiedades como enzimas de interés industrial. La alteración de su equilibrio conformacional se puede lograr mediante diferentes técnicas de inmovilización en las cuales se involucren distintas áreas de la enzima, en donde sea posible controlar: primero, la orientación de la lipasa sobre el soporte, segundo, la rigidez de las lipasas inmovilizadas, y tercero, los micro-ambientes que rodean las moléculas de lipasas inmovilizadas. Todo esto podría provocar una modificación en el mecanismo de apertura y cierre de la lipasa, dando lugar a una alteración en la forma exacta de la conformación abierta (activa) final, que se vería reflejada en una modificación de sus propiedades de actividad y especificidad (enantio o regioselectividad) (7-14).
Por otro lado, un cambio en las condiciones de reacción podría llegar a tener un gran efecto en las propiedades catalíticas de las lipasas, debido probablemente a la modificación que se produciría sobre las interacciones globales de las conformaciones presentes en el equilibrio (abierta y cerrada), alterándose, de nuevo, la forma exacta de la conformación abierta de la enzima.
La modulación de las propiedades catalíticas de las lipasas es lo que se denomina ''ingeniería conformacional'', que ha sido empleada para modular el comportamiento de diferentes enzimas que sufren grandes cambios conformacionales durante la catálisis (15-17).
En esta investigación se estudió la ingeniería conformacional de la lipasa de Candida antarctica B, utilizando diferentes estrategias de inmovilización en soportes de Eupergit modificados parcialmente con etilendiamina y ácido iminodiacético, soportes epóxido funcionales y soportes octil-agarosa.
MATERIALES Y MÉTODOS
Materiales
La lipasa de Candida antarctica B (CAL-B) se obtuvo en Novozymes. El gel octil-agarosa y los marcadores de peso molecular, en Fermentas. El Eupergit C fue donado por Röhm Pharma. El Tritón X-100, p-nitrofenilbutirato, (RS)-mandelato de metilo, (R)-mandelato de metilo y (S)-mandelato de metilo se adquirieron en Sigma®. Todos los reactivos utilizados fueron grado analítico.
La solución del extracto comercial de CAL-B se preparó en una solución 5 mM de fosfato de potasio a pH 7. La concentración de proteína se estimó mediante el método de Bradford (18).
Métodos
Todos los ensayos y procedimientos de esta investigación se realizaron por triplicado. De esta manera, los resultados que aparecen en las diferentes tablas y figuras son el promedio de tres mediciones. El error relativo fue estimado dentro del 0,1 al 3%.
Hidrólisis enzimática de p-nitrofenilbutirato (pNPB)
El ensayo se hizo midiendo el aumento en el valor de absorbancia a 348 nm, producido por la formación de p-nitrofenol en la hidrólisis de 0,4 mM de pNPB disuelto en una solución 25 mM de buffer fosfato de potasio a pH 7 y 25ºC (19). Para iniciar la reacción, se añadieron 0,02 mL de solución lipásica o suspensión a 2,5 mL del sustrato. Se definió una unidad internacional (IU) de actividad sobre pNPB como la cantidad de enzima necesaria para hidrolizar 1 μmol de pNPB por minuto bajo las condiciones descritas anteriormente. El coeficiente extinción molar usado para el producto de reacción fue de 3100 M-1cm-1.
Purificación de la CAL-B
La purificación de la lipasa comercial se efectuó por adsorción interfacial en geles octil-agarosa a muy baja fuerza iónica (5 mM) y pH 7 (10 mL de solución 1mg/mL de lipasa fueron incubados con 2 g de octil-agarosa) (20-22). Periódicamente se recolectaron las muestras de sobrenadante y suspensión, para ser analizadas posteriormente por el ensayo de actividad pNPB.
La lipasa fue desorbida del soporte octil-agarosa, utilizando 20 mL de una solución de Tritón X-100 al 1% v/v en una solución 5 mM de fosfato de potasio a pH 7. La mezcla enzima/detergente se utilizó directamente para la inmovilización de CAL-B sobre soportes epóxido modificados parcialmente.
Modificación parcial del soporte Eupergit C
Los grupos epóxido del soporte Eupergit C fueron parcialmente modificados con diferentes compuestos (7).
Soporte aminado
Se incubaron 10 g de Eupergit C en 60 mL de etilendiamina al 2% v/v a pH 8,5 durante 15 minutos con agitación suave. Posteriormente, el soporte fue lavado abundantemente con agua destilada y almacenado a 4°C.
Soporte iminodiacético
Se incubaron 10 g de Eupergit C en 18 mL de una solución 2M de ácido iminodiacético a pH 9 y 25°C durante 15 minutos con agitación suave (7, 23). El soporte se lavó abundantemente con agua destilada y se almacenó a 4°C.
Soporte IDA-Cu
Se incubaron 10 g de soporte Eupergit C-IDA en 60mL de agua destilada con un contenido de 2 g de sulfato de cobre con agitación suave. Después de 2 horas, el soporte se lavó con un exceso de agua destilada. El tratamiento debería modificar en un 100% los grupos IDA del soporte (7).
Inmovilización de CAL-B sobre soportes epóxido multifuncionales
Fueron incubados 5 mL de la solución enzimática pura con 0,5 g de cada soporte (Eupergit C, Eupergit C-IDA, Eupergit C-IDA-Cu y Eupergit C-aminado), monitoreando el proceso de inmovilización de CAL-B en los diferentes soportes mediante la determinación periódica de la actividad del sobrenadante en el ensayo de pNPB. Adicionalmente, dicho proceso se verificó por electroforesis SDS-PAGE (19).
Electroforesis en geles de poliacrilamida-SDS PAGE
Las muestras fueron tratadas durante 5-10 minutos a 100ºC en presencia de tampón de ruptura (Tris-HCl 62,5 mM pH 6,8 – SDS 2% -β-mercaptoetanol 5% -glicerol 10% y azul de bromofenol al 0,005%). La electroforesis se realizó a temperatura ambiente y 150 mV de corriente constante, utilizando como electrolito Tris-HCl 25 mM-glicina 192 mM y SDS 1% (24). La visualización de las proteínas se logró mediante tinción con azul brillante de Coomassie R-25072. Se utilizaron marcadores de bajo peso molecular: fosforilasa b (94 KD), BSA (66,2 KD), ovoalbúmina (45 KD), anhidrasa carbónica (30 KD) e inhibidor de tripsina (20,1 KD).
Inactivación térmica
Para estudiar la estabilidad térmica de los diferentes derivados inmovilizados, se incubó una suspensión de 10 mg/mL (en una solución 25 mM de buffer fosfato de potasio a pH 7) de cada uno a diferentes temperaturas (60°C, 70°C y 80°C) y pH 7, durante 1 hora. Cada 15 minutos se tomó una alicuota para determinar la actividad mediante el ensayo de pNPB.
Actividad enzimática y determinación de enantioselectividad
La actividad y la enantioselectividad de la lipasa de C. antarctica B se determinó utilizando el sustrato mandelato de metilo [(±),(-),(+)], el cual fue preparado de la concentración de interés en una solución 25 mM de buffer fosfato de potasio a distintas condiciones de pH (6, 7 y 8) y 25°C. Para llevar a cabo las diferentes reacciones, se añadieron 10 mg de biocatalizador a 10 mL de solución 1mM de sustrato en el caso de los enantiómeros puros –determinación de actividad y enantioselectividad– y la mezcla racémica –efecto de la cantidad de biocatalizador–, y 0,2 g de biocatalizador a soluciones que contenían 0,05 mmol, 0,01 mmol, 0,1 mmol del sustrato racémico – efecto de la concentración de sustrato. Para cuantificarla hidrólisisquímica seefectuaron las reacciones bajo las mismas condiciones sin adicionar la enzima.
Análisis en HPLC
El grado de hidrólisis se analizó por HPLC en fase reversa, utilizando como columna una Zorbax XDB-C18 (4,6 mm x 250 mm), suministrada por Agilent Technologies. La fase móvil consistió en una mezcla isocrática de acetonitrilo y una solución 10 mM de buffer fosfato de amonio a pH 3 en proporción 35:65 v/v. El flujo utilizado fue 1 mL/min y la detección UV se desarrolló a 225 nm (19). Los tiempos de retención fueron los siguientes: ácido mandélico (3,300 min), y mandelato de metilo (5,646 min).
La actividad específica (AE) se definió como μmol de sustrato hidrolizado por minuto y por miligramo de biocatalizador. A diferentes grados de conversión (entre 10-20%) se analizó el exceso enantiomérico (ee) del ácido formado. La enantioselectividad se calculó como la relación de la velocidad inicial de hidrólisis de ambos isómeros puros (hidrólisis alrededor del 10-20% del éster).
RESULTADOS Y DISCUSIÓN
Inmovilización y purificación de CAL-B en el soporte hidrofóbico octil-agarosa
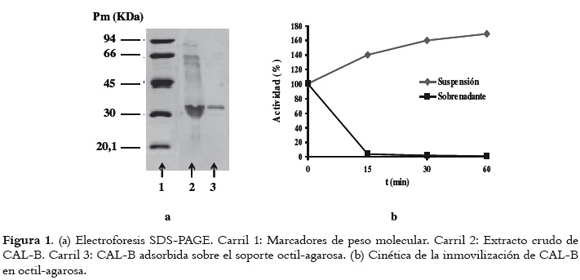
La inmovilización de CAL-B sobre el soporte octil-agarosa fue selectiva y rápida, tal como se describe en la literatura (21, 22). De esta manera se confirmó la adsorción específica de la lipasa sobre el soporte. En la figura 1a puede verse la electroforesis SDS-PAGE correspondiente al proceso de inmovilización de la lipasa. En la figura 1b se observa la adsorción del 99% de la actividad de la enzima sobre el soporte; el 1% restante de actividad se atribuye generalmente a esterasas o lipasas presentes en el extracto de CAL-B que no pueden ser adsorbidas por el soporte. En términos de actividad específica se alcanzó una carga enzimática del derivado de 4,082 mg CAL-B/g octil-agarosa.
Durante el proceso de inmovilización se observó un aumento de la actividad enzimática por un factor hasta de 1,7 aproximadamente. Este efecto se ha advertido cuando las lipasas son inmovilizadas interfacialmente sobre soportes hidrofóbicos, y se explica por el hecho de que se fija su forma abierta (21, 25).
Efecto de la concentración de sustrato ((RS)mandelato de metilo) y biocatalizador
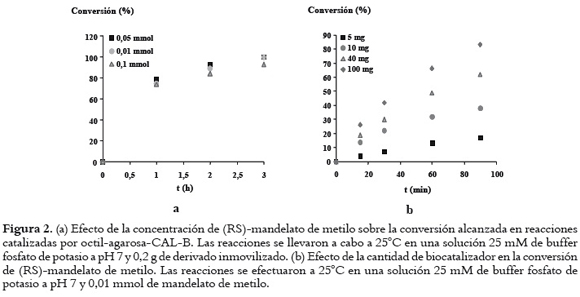
En la figura 2a se observan los resultados correspondientes al estudio del efecto de la concentración de (RS)-mandelato de metilo (rango 0,005-0,1 mmol), utilizando la CAL-B inmovilizada en octilagarosa en las condiciones ya descritas. Además, se estudió el efecto de la cantidad de derivado inmovilizado octil-agarosa-CAL-B (5, 10, 40 y 50 mg de biocatalizador) en el medio de reacción. Al aumentar la cantidad de biocatalizador se incrementó la velocidad de reacción y se obtuvo una conversión máxima de 17, 38, 62 y 83% de (RS)-mandelato de metilo respectivamente, a los 90 minutos. En la figura 2b se puede apreciar que el aumento de biocatalizador incrementó la conversión hasta valores cercanos al 90% cuando se usaron 100 mg de catalizador.
De acuerdo con los resultados obtenidos, al aumentar la concentración de mandelato de metilo en el medio de reacción, disminuye la velocidad de hidrólisis del éster por el derivado octil-agarosa-CAL-B. Esto podría obedecer a la inhibición de la enzima por el ácido mandélico y el metanol formado durante la reacción de hidrólisis del mandelato de metilo. En todo caso, la inhibición del derivado de lipasa inmovilizado no fue tan marcada bajo las condiciones de reacción utilizadas. Se han reportado tipos similares de inhibición con otras lipasas, utilizando ácido mandélico y metanol como sustrato (15, 26). El aumento de la velocidad de reacción en relación con la cantidad de catalizador indica que la reacción está cinéticamente controlada. La disminución del porcentaje de conversión a medida que aumenta la cantidad de catalizador nos sugiere que se están produciendo limitaciones de transferencia de masa, las cuales serían ocasionadas al utilizar cantidades de biocatalizador mayores que 10 mg.
Inmovilización de CAL-B en soportes epóxidos multifuncionales
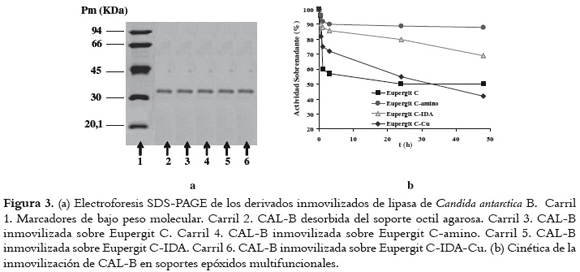
La CAL-B fue inmovilizada sobre soportes epóxidos multifuncionales luego de la desorción de la enzima a partir del derivado de octil-agarosa utilizando 1% (v/v) de Tritón X-100. La presencia del surfactante no-iónico Tritón X-100 evitó la inmovilización de agregados bimoleculares de la lipasa, los cuales pueden tener propiedades diferentes respecto de los monómeros (27). En la figura 3a aparece la evolución del proceso de inmovilización de la lipasa, cuantificando la actividad enzimática con el sustrato p-NPB y verificando su inmovilización por electroforesis SDS-PAGE. En la figura 3b se presenta el porcentaje de actividad enzimática inmovilizada en los diferentes soportes. Los soportes que inmovilizaron una mayor actividad fueron el Eupergit C y el Eupergit C-Cu, 50% y 58% respectivamente. El Eupergit C-IDA inmovilizó un 31% de la actividad enzimática disponible y el Eupergit C-amino inmovilizó sólo un 12% de la enzima.
En todos los soportes epóxido multifuncionales se pudo inmovilizar la enzima CAL-B en las condiciones estándar de inmovilización. Mediante la utilización de los epóxidos multifuncionales como soporte es posible orientar la CAL-B sobre el soporte de formas distintas, cambiando así la geometría del sitio activo de dicha lipasa. Esta modificación podría explicar los diferentes valores de actividad catalítica obtenidos para cada derivado enzimático (7, 11). El hecho de que la enzima haya sido inmovilizada en presencia de Tritón X-100 en el soporte Eupergit C, demuestra que la concentración utilizada (1% v/v) es adecuada para permitir la adsorción hidrofóbica de la CAL-B a dicho soporte.
El bajo porcentaje de actividad enzimática inmovilizada en el soporte EC-amino, puede atribuirse a que la CAL-B presenta poca carga negativa bajo las condiciones utilizadas, o a una cantidad insuficiente de grupos epóxidos modificados del soporte EC. Cuando se usaron estos soportes multifuncionales, la adsorción física de la enzima fue el primer paso de la inmovilización. Por ejemplo, el ECIDA inmovilizó un 31% de la actividad enzimática disponible. Sin embargo, este mismo soporte con cobre adsorbido en los grupos IDA inmovilizó un 58%. En general, la optimización del proceso de inmovilización depende no sólo de las condiciones de éste, sino de la modificación parcial de los grupos epóxidos del soporte EC.
Estabilidad térmica de los derivados inmovilizados de CAL-B
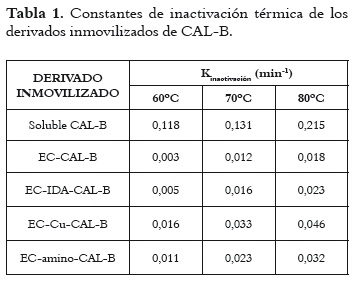
En la tabla 1 se presentan las constantes de inactivación térmica de los diferentes derivados inmovilizados de CAL-B. En este estudio se destaca el derivado de Eupergit C, el cual inmoviliza la enzima de forma covalente y presentó una constante de inactivación menor con todas las temperaturas estudiadas [0,003 (60°C), 0,012 (70°C) y 0,018 (80°C)], y por ende, una mayor estabilidad térmica. Por otro lado, el derivado de Eupergit C-IDA-Cu demostró siempre una mayor constante de inactivación y, en consecuencia, fue el menos estable de los derivados de CAL-B inmovilizados. En todos los tipos de derivados inmovilizados se conservó siempre un mismo orden de estabilidad para cada una de las temperaturas analizadas, siendo todos los derivados inmovilizados más estables que la enzima soluble; así por ejemplo, EC-IDA-CAL-B fue, a 60°C, casi 24 veces más estable que la preparación soluble de CAL-B, y el EC-CAL-B fue 12 veces más estable que la enzima soluble a 80°C, lo cual demuestra la efectividad de la inmovilización covalente en soportes poliméricos como técnica de estabilización de las enzimas.
En la figura 4 se expone la cinética de inactivación de los derivados de CAL-B y de la enzima soluble. Se puede apreciar que la enzima soluble pierde casi toda su actividad a 70°C y que la pérdida de actividad es total a 80°C. La enzima CAL-B inmovilizada conserva su actividad en todos los casos. Se destaca el derivado de Eupergit C, que conserva más del 60% de su actividad, aun a la temperatura más alta a la que fueron sometidos los diferentes derivados inmovilizados. El derivado de octil-agarosa conservó siempre el 100% de su actividad. En general, las formas diméricas de las lipasas (27) son más estables que las formas monoméricas, debido fundamentalmente a las interacciones proteína-proteína y al mayor orden de las moléculas en su conformación abierta (25). El hecho de que el derivado inmovilizado de octil-agarosa no se haya inactivado puede atribuirse a que la enzima se adsorbería a este soporte, generalmente por el sitio activo; así, este último no sería afectado de igual manera que en los otros soportes, en los cuales el sitio activo se encuentra más expuesto.
A pesar de que la inmovilización en los soportes epóxidos multifuncionales se llevó a efecto en presencia de una concentración relativamente alta de detergente, se pudieron obtener derivados inmovilizados de CAL-B con una mayor estabilidad térmica respecto a la enzima nativa. Si se quisiera obtener derivados inmovilizados (a partir de soportes epóxidos) de CAL-B, aun más estables térmicamente, se podría pensar en efectuar una inmovilización a baja concentración de detergente o una inmovilización directa de la enzima nativa, es decir, sin previa purificación en soporte octil-agarosa. De esta forma, no sólo se inmovilizarían los monómeros presentes en la enzima nativa sino los dímeros, los cuales tenderán a ser más estables térmicamente que los respectivos monómeros, como en el caso de la lipasa de Alcaligenes sp (28).
Especificidad de los distintos derivados inmovilizados de CAL-B
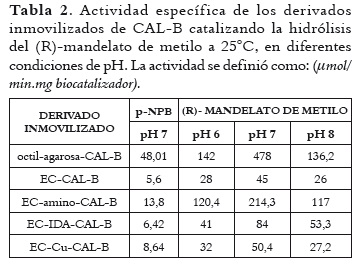
Se estudió la actividad catalítica de derivados inmovilizados de CAL-B, utilizando (R)-mandelato de metilo y pNPB como sustratos. Inicialmente, la reacción de hidrólisis se efectuó a pH 7, con el objetivo de estudiar dos efectos sobre la actividad catalítica de esta lipasa: i) la inmovilización sobre distintos soportes y ii) la naturaleza del sustrato. En la tabla 2 se observa que, a pH 7, el derivado octilagarosa-CAL-B demostró la actividad específica más alta para los dos sustratos utilizados, seguido del derivado EC-amino-CAL-B. Se observa también que cuando se utilizó el isómero R del mandelato de metilo, se registró un aumento significativo de la actividad enzimática de todos los derivados inmovilizados, respecto a la obtenida con pNPB, destacándose el derivado EC-amino-CAL-B, que tuvo una actividad 16 veces mayor. De esta forma, podemos decir que la metodología de inmovilización empleada promovió una afinidad de la enzima por sustratos menos hidrofóbicos en relación al pNPB. Por su parte, la disminución o aumento del pH (desde pH 7) condujo a una pérdida de la actividad catalítica de los diferentes derivados inmovilizados frente al R-mandelato de metilo. Todos los derivados mostraron mayor actividad a pH 6 que a pH 8, exceptuando EC-IDA-CAL-B, con una actividad de 41 U/mg a pH 6 y 53,3 a pH 8. El efecto anterior podría atribuirse al hecho de que en estos valores de pH no se favorece la ionización de los aminoácidos del centro activo de la lipasa Candida antarctica B, dificultando la entrada del sustrato al sitio activo de la lipasa; es decir, tales valores de pH debilitan las interacciones del lid con la superficie de la proteína en la conformación abierta (29, 30).
Enantioselectividad de los derivados inmovilizados de CAL-B catalizando la hidrólisis de mandelato de metilo
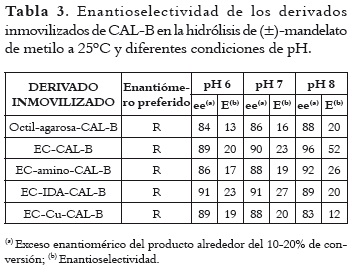
Se analizó el efecto de la inmovilización sobre la enantioselectividad de la CAL-B en la hidrólisis de (±)-mandelato de metilo a temperatura constante y diferentes valores de pH. En la tabla 3 se pueden apreciar los resultados obtenidos. Todos los derivados inmovilizados manifestaron una preferencia estereoquímica similar, hidrolizando el isómero R. A pH 7, el derivado EC-IDA-CAL-B fue el más enantioselectivo (E=27), seguido del derivado ECCAL-B (E=23), mientras el valor de E más bajo se obtuvo con el derivado octil-agarosa-CAL-B (E=16). Las enantioselectividades encontradas para los demás derivados inmovilizados fueron muy similares (E=19-20). Además, se pudo modificar la enantioselectividad de los diferentes derivados inmovilizados mediante cambios de pH, destacándose el derivado EC-CAL-B con una E=52 a pH 8.
Una de las propiedades catalíticas más interesantes de las lipasas es la enantioselectividad frente a sustratos quirales. En general, la inmovilización de CAL-B en los diferentes soportes utilizados permitió la obtención de derivados con una enantioselectividad mayor de la aceptable para una resolución cinética, destacándose el derivado ECCAL-B frente al mandelato de metilo, con una enantioselectividad de 52 y un exceso enantiomérico del producto de 96% a pH 8.
CONCLUSIONES
La metodología que se empleó en este trabajo para la inmovilización de la lipasa de Candida antarctica B sobre soportes epóxidos multifuncionales, permitió la obtención de derivados inmovilizados con una considerable enantioselectividad (E>20), al catalizar la hidrólisis del (RS)-mandelato de metilo, destacándose el derivado de EC-amino-CAL-B (E=52). Además, los derivados obtenidos desplegaron actividad alta, comparada con la que exhibieron derivados inmovilizados de CAL-B, valores publicados por otros autores, que oscilan entre 1 y 60 U/mg de lipasa (ej: derivados Eupergit-Cu, octadecilo, PEI, glutaraldehído, entre otros), y derivados inmovilizados de otras lipasas catalizando la misma reacción (ej: derivados octil, PEI y glutaraldehído de lipasa de Candida rugosa, entre otros). Los resultados obtenidos se atribuyen a la concentración de Tritón X-100 utilizada durante el proceso de inmovilización y a los cambios conformacionales de la enzima como consecuencia de la interacción con los distintos soportes.
En general, se comprobó que la utilización de diferentes técnicas de inmovilización constituye una herramienta efectiva y versátil para la modificación de las propiedades catalíticas de una misma enzima.
AGRADECIMIENTOS
Las investigaciones sobre inmovilización de lipasas se pudieron llevar a efecto gracias a la financiación otorgada por la Vicerrectoría de Investigación y Extensión (VIE), de la Universidad Industrial de Santander.
REFERENCIAS BIBLIOGRÁFICAS
1. Ghanem A, Aboul-Enein MN, El-Azzouny A, El-Behairy MF. Lipase-mediated enantioselective kinetic resolution of racemic acidic drugs in non-standard organic solvents: Direct chiral liquid chromatography monitoring and accurate determination of the enantiomeric excesses. J Cromatogr A. 2010 Feb 12; 1217 (7): 1063-1074. [ Links ]
2. Kawasaki M, Toyooka N,Saka T, Goto M, Matsuya Y,Kometani T. Lipase-mediated preparation of optically active isomers of Rosaphen. J Mol Catal B-Enzym. 2010 Nov; 67 (1-2): 135-142. [ Links ]
3. Ghanem A, Aboul-Enein HY. Lipase-mediated chiral resolution of racemates in organic solvents. Tetrahedron-Asymmetr. 2004 Nov 1; 15 (21): 3331-3351. [ Links ]
4. Maciejewski M, Póltorak K, Kaminska JE. Lipase resolution of new (±)-3-aryloxy-1-halogenopropan-2-ols: Versatilebuilding blocks for β-adrenergic receptor antagonists. J Mol Catal B-Enzym. 2010 Mar; 62 (3-4): 248-256. [ Links ]
5. Grochulski P, Li Y, Schrag JD, Bouthillier F, Smith P, Harrison D, et al. Insights into interfacial activation from an open structure of Candida rugosa lipase. J Biol Chem. 1993 Jun 15; 268 (17): 12843-12847. [ Links ]
6. Fernández-Lafuente R, Armisén P, Sabuquillo P, Fernández-Lorente G, Guisán JM. Immobilization of lipases by selective adsorption on hydrophobic supports. Chem Phys Lipids. 1998 Jun; 93 (1-2): 185-197. [ Links ]
7. Mateo C, Fernández-Lorente G, Abian O, Fernández-Lafuente R, Guisán JM. Multifunctional epoxy supports: a new tool to improve the covalent immobilization of proteins. The promotion of physical adsorptions of proteins on the supports before their covalent linkage. Biomacromolecules. 2000 Nov 10; 1 (4): 739-745. [ Links ]
8. Fernández-Lorente G, Terreni M, Mateo C, Bastida A, Fernández-Lafuente R, Dalmases P, et al. Modulation of lipase properties in macro-aqueous systems by controlled enzyme immobilization: enantioselective hydrolysis of a chiral ester by immobilized Pseudomonas lipase. Enzyme Microb Tech. 2001 Mar 8; 28 (4-5): 389-396. [ Links ]
9. Fernández-Lorente G, Fernández-Lafuente R, Palomo JM, Mateo C, Bastida A, Coca J, et al. Biocatalyst engineering exerts a dramatic effect on selectivity of hydrolysis catalyzed by immobilized lipases in aqueous medium. J Mol Catal B-Enzym. 2001 Jan 22; 11 (4-6): 649-656. [ Links ]
10. Palomo JM, Segura RL, Fernández-Lorente G, Guisán JM, Fernández-Lafuente R. Enzymatic resolution of (±)-glycidyl butyrate in aqueous media. Strong modulation of the properties of the lipase from Rhizopus oryzae via immobilization techniques. Tetrahedron-Asymmetr. 2004 Apr 5; 15 (7): 1157-1161. [ Links ]
11. Palomo JM, Muñoz G, Fernández-Lorente G, Mateo C, Fuentes M, Guisán JM, et al. Modulation of Mucor miehei lipase properties via directed immobilization on different hetero-functional epoxy resins: Hydrolytic resolution of (RS)-2-butyroyl-2-phenylacetic acid. J Mol Catal B-Enzym. 2003 Feb 17; 21 (4-6): 201-210. [ Links ]
12. Queiroz N, Nascimento MG. Pseudomonas sp. lipase immobilized in polymers versus the use of free enzyme in the resolution of (R,S)-methyl mandelate. Tetrahedron Lett. 2002 Jul 22; 43 (30): 5225-5227. [ Links ]
13. Yang G, Wu J, Xu G, Yang L. Enhancement of the activity and enantioselectivity of lipase in organic systems by immobilization onto low-cost support. J Mol Catal B-Enzym. 2009 May; 57 (14): 96-103. [ Links ]
14. Lee JH, Kim SB, Park Ch, Kim SW. Effect of a buffer mixture system on the activity of lipases during immobilization process. Bioresour Technol. 2010 Jan; 101 (1 Suppl 1): S66-S70. [ Links ]
15. Palomo JM, Fernandez-Lorente G, Mateo C, Ortiz C, Fernández-Lafuente R, Guisan JM. Modulation of the enantioselectivity of lipases via controlled immobilization and medium engineering: hydrolytic resolution of mandelic acid esters. Enzyme Microb Tech. 2002 Nov 1; 31 (6): 775-783. [ Links ]
16. Palomo JM, Fernández-Lorente G, Mateo C, Fuentes M, Fernández-Lafuente R, Guisan JM. Modulation of the enantioselectivity of Candida antarctica B lipase via conformational engineering. Kinetic resolution of (±)-α-hydroxy-phenylacetic acid derivatives. Tetrahedron-Asymmetr. 2002 Jul 5; 13 (12): 1337–1345. [ Links ]
17. Palomo JM. Lipases enantioselectivity alteration by immobilization techniques. Curr Bioact Compd. 2008 Aug; 4 (2): 126-138. [ Links ]
18. Bradford MM. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976 May 7; 72 (1-2): 248-254. [ Links ]
19. Ortiz C. Ingeniería de biocatalizadores de lipasas: nuevos métodos de purificación y nuevos protocolos de modulación de propiedades [Tesis Doctoral]. [Madrid]: Universidad Autónoma de Madrid; 2004. 27 p. [ Links ]
20. Sabuquillo P, Reina J, Fernández-Lorente G, Guisán JM, Fernández-Lafuente R. Interfacial affinity chromatography of lipases: separation of different fractions by selective adsorption on supports activated with hydrophobics groups. Biochim Biophys Acta. 1998 Nov 10; 1388 (2): 337-348. [ Links ]
21. Bastida A, Sabuquillo P, Armisén P, Fernández-Lafuente R, Huguet J, Guisan JM.Asinglestep purification, immobilization, and hyperactivation of lipases via interfacial adsorption on strongly hydrofobic supports. Biotechnol Bioeng. 1998 Jun 5; 58 (5): 486-493. [ Links ]
22. Fernández-Lorente G, Ortiz C, Segura RL, Fernández-Lafuente R, Guisán JM, Palomo JM. Purification of different lipases from Aspergillus niger using a highly selective adsorption on hydrophobic supports. Biotechnol Bioeng. 2005 Dic 20; 92 (6): 773-779. [ Links ]
23. Armisén P, Mateo C, Cortés E, Barredo JL, Salto F, Diez B, et al. Selective adsorption of poly-His tagged glutaryl acylase on tailor-made metal chelate supports. J Chromatogr A. 1995 Jul 2; 848 (1-2): 61-70. [ Links ]
24. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15; 227 (5259): 680-685. [ Links ]
25. Palomo JM, Muñoz G, Fernández-Lorente G, Mateo C, Fernández-Lafuente R, Guisán, JM. Interfacial adsorption of lipases on very hydrophobic support (octadecyl-Sepabeads): immobilization, hyperactivation and stabilization of the open form of lipases. J Mol Catal B-Enzym. 2002 Dec 2; 19-20: 279-286. [ Links ]
26. Heinsman NWJT, Valente AM, Smienk HGF, Van der Padt A, Franssen MCR, De Groot A, et al. The effect of ethanol on the kinetics of lipase-mediated enantioselective esterification of 4-methyloctanoic acid and the hydrolysis of its ethyl ester. Biotechnol Bioeng. 2001 Nov; 76 (3): 193-199. [ Links ]
27. Fernández-Lorente G, Palomo JM, Fuentes M, Mateo C, Guisán JM, Fernández-Lafuente R. Self-assembly of Pseudomonas fluorescens lipase into bimolecular aggregates dramatically affects functional properties. Biotechnol Bioeng. 2003 Apr 20; 82 (2): 232-237. [ Links ]
28. Wilson L, Palomo JM, Fernández-Lorente G, Illanes A, Guisán JM, Fernández-Lafuente R. Effect of lipase-lipase interactions in the activity, stability and specificity of a lipase from Alcaligenes sp. Enzyme Microbial Tech. 2006 Jun 26; 39 (2): 259-264. [ Links ]
29. Polizzi KM, Bommarius AS, Broering JM, Chaparro-Riggers JF. Stability of biocatalysts. Curr Opin Chem Biol. 2007 Apr; 11 (2): 220-225. [ Links ]
30. Goldstein L. Kinetic behavior of immobilized enzyme Systems. Methods Enzymol. 1976; 44: 397-443. [ Links ]