Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.18 no.1 Medellín Jan./Apr. 2011
FARMACOLOGÍA Y TOXICOLOGÍA
INHIBICIÓN IN VITRO DEL VENENO DE Bothrops asper CON EXTRACTOS ETANÓLICOS DE Brownea ariza B. (CAESALPINIACEAE)
IN VITRO INHIBITION OF Bothrops asper VENOM BY ETHANOL EXTRACTS FROM Brownea ariza B. (CAESALPINIACEAE)
Viviana L. MACK-WEN G.1*; Leidy B. RICO G.1; Juan C. ALARCÓN P.1,2; Jaime A. PEREAÑEZ J.1,2
1 Departamento de Farmacia. Facultad de Química Farmacéutica. Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
2 Programa Ofidismo / Escorpionismo. Facultad de Medicina. Universidad de Antioquia. A.A. 1226. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: vmack@farmacia.udea.edu.co.
Recibido: Noviembre 10 de 2009
Aceptado: Diciembre 3 de 2010
RESUMEN
En Colombia, cerca del 90% de los accidentes ofídicos son ocasionados por serpientes del género Bothrops, cuyos venenos provocan alteraciones locales y sistémicas, como edema, anticoagulación, hemorragia y mionecrosis. El suero antiofídico es el único tratamiento efectivo, pero su limitada acción local y escasa disponibilidad en zonas geográficas aisladas hace necesaria la búsqueda y validación de alternativas terapéuticas que actúen como recurso y disminuyan el porcentaje de secuelas de estos accidentes. Recientes estudios han reportado acción inhibitoria del extracto etanólico de Brownea rosademonte (Caesalpiniaceae) sobre algunos efectos locales de estos venenos. Así, en el presente estudio in vitro se evaluó la capacidad inhibitoria de extractos etanólicos de hojas y corteza de Brownea ariza sobre las actividades proteolítica, fosfolipasa A2 y coagulante del veneno de B. asper; esta última según el efecto de coagulación in vitro, se relaciona con anticoagulación observada in vivo. Los resultados mostraron que los extractos de corteza inhiben la acción de fosfolipasas A2 (93,2 ± 0,4%), prolongan el tiempo de coagulación (más de 10 min), e inhiben la actividad proteolítica, aunque ésta última con menores efectos que el extracto foliar (77 ± 0,6% y 93,8 ± 0,6% respectivamente).
Palabras clave: Bothrops asper, Brownea ariza, veneno de víboras, actividad proteolítica, fosfolipasas A2.
ABSTRACT
In Colombia, about 90% of snakebites are caused by Bothrops snakes, whose venoms cause in vivo, local and systemic disturbances, such as edema, myonecrosis, blood-clotting disorders and hemorrhage. Antivenom is the only effective treatment to manage these poisonings, but its limited action at local level and little availability in geographically isolated areas makes necessary the validation and search for therapeutic alternatives acting as an immediate resource to reduce the percent of sequels caused in these snakebites. Recent studies have reported the inhibitory action of the Brownea rosademonte (Caesalpiniaceae) extract against some local effects produced by these snakes. Therefore, in this in vitro research the inhibitory ability of the ethanol extract of leaves and bark from Brownea ariza was evaluated on proteolytic, phospholipase A2 and coagulant activities of B. asper venom, which is related with anticoagulation observed in vivo. The results showed that bark extracts inhibit phospholipase A2 activity (93,2 ± 0,4%), extend the clotting time of plasma (more than 10 minutes) and inhibit the proteolytic activity, although the latter showed lesser effects than those observed with leaves extract (77 ± 0,6% and 93,8 ± 0,6%, respectively).
Key words: Bothrops asper, Brownea ariza, viper venom, proteolytic activity, phospholipases A2.
INTRODUCCIÓN
En Colombia, el accidente ofídico es un problema de salud pública, y, según los informes, las serpientes de los géneros Bothrops (particularmente B. asper), Porthidium y Bothriechis, ocasionan la mayor accidentalidad, principalmente en los departamentos de Antioquia, Chocó, Meta, Norte de Santander, Casanare, Caldas y Cauca, en los que causan una mortalidad del 5%, y secuelas permanentes en un porcentaje similar de los afectados (1).
El veneno de Bothrops asper (mapaná, cuatro narices, jergón), es una compleja mezcla de polipéptidos, sustancias no proteicas como aminas (histamina, bradiquidina, serotonina y acetilcolina), que generalmente producen intenso dolor, edema e hipotensión, y componentes proteicos que contienen enzimas tales como hemorraginas, proteasas, fosfolipasas A2, neurotoxinas y miotoxinas que actúan por diferentes mecanismos (2) y ocasionan manifestaciones fisiopatológicas locales como mionecrosis, hemorragia y edema, y alteraciones sistémicas caracterizadas por coagulopatías, hemorragias, shock cardiovascular y falla renal aguda (3-7).
Para neutralizar estos efectos, los protocolos deben incluir la utilización del antiveneno correspondiente, pero por las particularidades geográficas de nuestro país, en algunos casos éstos no están disponibles de manera inmediata para todas las comunidades, o no contrarrestan todos los efectos inducidos por estas toxinas debido a la rápida biodisponibilidad de estas últimas (8-10). Por estas razones es necesaria la búsqueda de alternativas, naturales o sintéticas, que disminuyan o neutralicen los mencionados efectos (11, 12) y, entre ellas las plantas son una fuente importante, al punto que algunas de ellas han sido utilizadas tradicionalmente como método curativo contra la mordedura de serpientes, especialmente en áreas tropicales donde existe mayor biodiversidad (1, 12-14).
Una de estas plantas activas contra el efecto letal y hemorrágico del veneno de B. asper, es la Brownea rosademonte (Caesalpiniaceae), cuya corteza ejerce un efecto neutralizante in vivo del 100% sobre los efectos hemorrágicos y letales inducidos por el veneno de B. asper, y una inhibición (25%) de la actividad proteolítica del mismo (1, 13-15); sin embargo, esta planta se encuentra principalmente en zonas selváticas de difícil acceso, y por ello, al buscar especies cercanas que sirvan como eventuales alternativas para el tratamiento inicial e inmediato del accidente ofídico, se debe considerar la Brownea ariza (palo de cruz, rosa de monte, ariza, entre otros), cuya amplia distribución y reconocido uso como antihemorrágica sobre heridas abiertas (16) la convierten en una fuente metabólica viable con potenciales propiedades antiofídicas.
La B. ariza B., conocida tambien como B. princeps L. o Hermesias ariza K, es un árbol de 3 a 10 metros de altura, perenne, con ramas jóvenes amarillo-tormentosas, folíolos alternos o subopuestos y elípticos. Se distribuye principalmente desde Perú hasta Panamá; y en Colombia es utilizada en medicina popular en caso de hemorragias internas o heridas sangrantes y contra la disentería y la diarrea (17).
MATERIALES Y MÉTODOS
Hojas y corteza provenientes de árboles de B. ariza, ubicados e identificados en el Jardín Botánico Joaquín Antonio Uribe de Medellín (1538 m.s.n.m.), sirven como material vegetal de partida, una vez lavados con agua destilada, secados (38ºC/2 días), molidos, puestos en percolación (etanol 96%, 48 horas), filtrados, concentrados con ayuda de un rotaevaporador (BÜCHI R-124®), liofilizados y almacenados a -20ºC hasta su utilización. Así mismo, una mezcla homogénea previamente colectada a partir de 40 especímenes adultos de B. asper, provenientes de diferentes zonas geográficas del departamento de Antioquia, Colombia, sirve como veneno total, una vez centrifugado, liofilizado y almacenado a -20ºC, hasta su utilización.
Inhibición del efecto coagulante: En experimentos realizados por triplicado, diferentes concentraciones de los extractos, mezcladas con una dosis de veneno de 1,0 µg disueltas en 50 µL de PBS, pH 7,2, se incuban a 37ºC por espacio de 30 minutos. Pasado este tiempo, se adicionan 300 µL de plasma humano procedente de donantes sanos, se registra el tiempo de formación del coágulo y se determina el tiempo de prolongación de la coagulación, con base en el efecto producido por el control positivo (veneno de B. asper) (18).
Inhibición de la actividad proteolítica: 0,02 mg/mL de veneno (en PBS) se mezclan con cada uno de los extractos (relación 1:20 (veneno/extracto p/p), se incuban (37ºC/30 min), y se adicionan 2 mL de caseína al 1% en PBS, pH 7,2 a cada una de las mezclas, como requisito previo de una nueva incubación bajo las condiciones descritas. Pasado este tiempo, se detiene la reacción con adición de ácido tricloroacético al 5%, y tras 30 minutos de reposo se centrifuga (3500 rpm/10 min), obteniéndose un sobrenadante al que se le determina su absorbancia (280 nm) contra un blanco de reactivos. Los resultados de los ensayos, realizados por triplicado se expresan como porcentaje de inhibición, tomando como 100% de actividad proteolítica la del control positivo (veneno de B. asper) (19).
Actividad de fosfolipasa A2: 1 mL de soluciones previamente incubadas (37°C/30 min), que incluyen mezclas de veneno (30 µg), con diferentes cantidades de extracto etanólico de B. ariza, se agrega a un sustrato (yema de huevo) y se incuba por 15 min a las condiciones de temperatura descritas. Pasado este tiempo se le adiciona una mezcla de extracción y heptano, con el fin de separar los ácidos grasos liberados y titularlos con NaOH 0,018 N, usando como indicador azul de timol en etanol. Los resultados de los experimentos, efectuados por triplicado, se expresan como porcentaje de inhibición, asumiendo un 100% de actividad en el control positivo (veneno de B. asper) (20).
Electroforesis SDS-PAGE: 40 µg de veneno se incuban con 400 µg de cada extracto (30 min/a 37°C). Pasado este tiempo se disponen muestras sobre geles de poliacrilamida (12%), se someten al campo eléctrico (Mini Protean-II® de BioRad) (60 min/100 voltios) (21), y se realiza tinción proteica con azul de Coomasie R 250. Se utilizan marcadores de peso molecular de amplio rango (15-190 KDa). Todas las muestras son corridas en condiciones no reducidas.
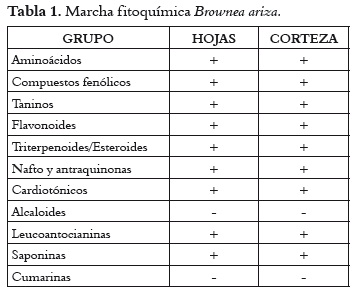
Marcha fitoquímica: Las pruebas por triplicado y con el fin de detectar alcaloides, esteroides y/o terpenoides, flavonoides, naftoquinonas y antraquinonas, aminoácidos, compuestos fenólicos, cardiotónicos, leucoantocianinas, saponinas y taninos, se llevaron a cabo de acuerdo con el método propuesto por Sanabria, 1989 (22), y la de cumarinas, con el planteado por Domínguez, 1979 (23).
Tratamiento estadístico: Con ayuda de SPSS 14.0 (http://www.spss.com; SPSS Inc. 233 South Wacker Drive, 11th Floor, Chicago, IL 60606-6412), los datos se sometieron a análisis de varianza de una vía, y test de Bonferroni, expresando los resultados como media ± S.E.M (error estándar de la media) y asumiendo diferencias estadísticamente significativas con una probabilidad de error p < 0,05.
RESULTADOS Y DISCUSIÓN
Inhibición del efecto coagulante
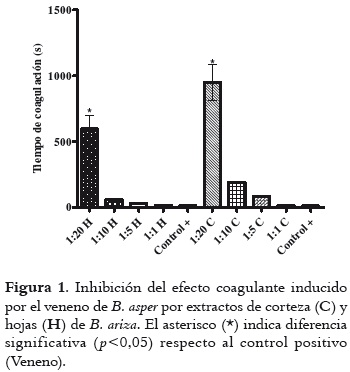
En la figura 1 se observa que la co-incubación de un microgramo de veneno (control positivo) con plasma, induce la coagulación al término de 23 ± 0,4 segundos; pero este tiempo se prolonga de manera considerable y con diferencia estadísticamente significativa al emplear los extractos, especialmente de corteza, y a las mayores concentraciones utilizadas (950,4 ± 135,3 y 593,2 ± 1,3 segundos; corteza y hojas respectivamente), sin que esto signifique relación entre efecto y concentración, pues no existen diferencias estadísticamente significativas en las relaciones 1:1, 1:5 y 1:10 con respecto al control.
Actividad de fosfolipasa A2
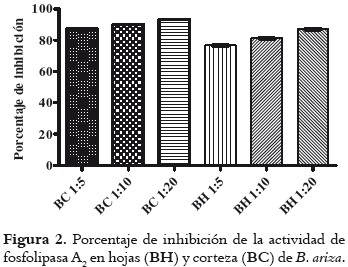
La figura 2 muestra que la relación 1:20 ejerce el mayor efecto inhibitorio para los dos extractos (93,2 ± 0,4% para corteza y 87 ± 0,4% para hojas), demostrando la corteza, en todas las relaciones, mayor capacidad neutralizante con respecto a las hojas, sin que esta inhibición sea dependiente de la concentración de extracto utilizado, pues las relaciones 1:5 y 1:10 de cada extracto no muestran diferencias estadísticamente significativas.
Inhibición de la actividad proteolítica
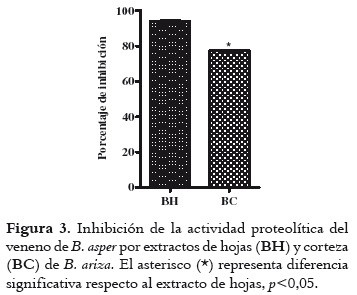
En la figura 3 se observa que la actividad proteolítica valorada para los extractos en proporción 1:20 con relación al veneno muestra una inhibición del 93,8 ± 0,6% de la actividad proteolítica del veneno, cuando se utiliza el extracto de hojas y una del 77,2 ± 0.6%, cuando es empleado el extracto de corteza; datos relacionados con absorbancias (280 nm) de 0,232 ± 0,002 para veneno; 0,014 ± 0,001 para hojas y 0,053 ± 0,002 para corteza.
Electroforesis SDS-PAGE
Como se observa en la figura 4, la complejidad de los extractos no permite evidenciar grandes cambios en las proteínas del veneno cuando éste es pre-incubado con los extractos y llevado a electroforesis; por lo tanto, se descarta una eventual degradación proteolítica del veneno por parte del extracto como posible mecanismo de acción de los extractos de B. ariza.
Marcha fitoquímica
En la tabla 1 se puede evidenciar que los extractos etanólicos de las hojas y corteza de B. ariza presentan diferentes metabolitos secundarios, entre ellos algunos con posible acción antiofídica como: taninos, esteroides y/o triterpenoides, flavonoides, y compuestos fenólicos.
DISCUSIÓN
Numerosas plantas han demostrado ejercer efectos sobre las actividades de los venenos de serpientes, entre ellas Brownea rosademonte, que inhibe algunos de los efectos del veneno de B. asper (13-15); y así, los ensayos in vitro realizados con extractos etanólicos de hojas y corteza de B. ariza muestran que la planta, posiblemente, tiene la capacidad de inhibir los efectos locales del envenenamiento de B. asper.
El efecto anticoagulante in vitro que demuestra el veneno de B. asper está relacionado con la capacidad de sus proteasas (metaloproteasas y serinproteasa) de activar algunos factores de coagulación como el V y el X, y convertir el fibrinógeno en fibrina, lo que finalmente conduce a la formación de un coágulo inestable (24). In vitro, este coágulo se mantiene, ya que el sistema fibrinolítico no está disponible; caso contrario al de las condiciones in vivo, ya que el consumo masivo de fibrinógeno genera coágulos inestables que finalmente son disueltos por el sistema fibrinolítico, lo que lleva a la anticoagulación de los pacientes (25). Estas proteasas han sido aisladas del veneno de B. asper (24), y tienen peso molecular variable y características cinéticas dependientes del sustrato con el que se trabaje; de hecho, las metaloproteasas son enzimas dependientes de Zn2+, el cual es un requerimiento estricto para su actividad proteolítica sobre los componentes de la membrana basal de los capilares (26). Por su parte, las serinproteasas tienen preferencia por el fibrinógeno, y de ahí se deriva su alta actividad anticoagulante (27). Las fosfolipasas A2 son otro tipo de toxinas presentes en el veneno de B. asper (24), cuya catálisis depende de Ca2+, y tienen aspartato e histidina en su sitio activo (28) degradan fosfolípidos de membrana e inducen efectos como miotoxicidad, neurotoxicidad, anticoagulación, al formar complejos con el factor Xa de la cascada de coagulación.
La inhibición de las actividades proteolítica, coagulante y de fosfolipasa A2 del veneno de B. asper por parte de los extractos de hojas y corteza de B. ariza podría estar relacionada con los compuestos presentes en dichos extractos, pues algunos triterpenoides han mostrado ser inhibidores de metaloproteasas y fosfolipasas A2 (6, 29), mientras que los flavonoides lo han sido de estas últimas (30). Si bien ha sido propuesta una inhibición competitiva por parte de estos compuestos hacia las enzimas mencionadas (31), también podría pensarse en un mecanismo de inhibición menos específico, ya sea por la formación de complejos inactivos entre la enzima y los compuestos en mención, o por la quelación del Ca2+ y/o Zn2+ requerido por las fosfolipasas A2 y metaloproteasas para su ciclo catalítico. Además, los extractos de hojas y corteza de B. ariza poseen taninos, compuestos que también son inhibidores de fosfolipasas A2, y probablemente, por la formación de puentes de hidrógeno con los aminoácidos del sitio activo (32, 33); sin embargo, como con los flavonoides, se podría pensar en un mecanismo de inhibición menos específico, sea por quelación o por precipitación de proteínas mediante la formación de complejos macromoleculares inactivos (34), los cuales, cabe resaltar, no fueron detectados por medio de la electroforesis practicada.
Por lo anterior, y con el fin de relacionar específicamente las actividades inhibitorias con la presencia metabólica, es necesario, en futuros trabajos, el aislamiento y caracterización de los metabolitos presentes en los extractos, pues solo así se podrá determinar el mecanismo directo por el cual se ven inhibidas las actividades que ocasiona el veneno.
CONCLUSIONES
Teniendo en cuenta los resultados obtenidos en este estudio se concluye que B. ariza podría llegar a ser una alternativa válida como tratamiento inicial del accidente ofídico, en especial para aquellos protagonizados por la serpiente B. asper, pues muestra, en algunos casos, mejor efectividad que otras conocidas y reportadas, como B. rosademonte. Además, es de fácil acceso, pues es una especie localizable en muchas zonas urbanas, y esto facilitaría su adquisición y uso.
De los extractos analizados, se logró detectar una mayor inhibición de la actividad proteolítica y coagulante por parte del extracto de corteza en comparación con el foliar; mientras que la marcha fitoquímica muestra que en la planta hay presencia de metabolitos que pueden ser claves en la dinámica del proceso de inhibición de los efectos del veneno. Por esta razón, se deben continuar estudios sobre esta planta, que permitan el afianzamiento en el conocimiento y tratamiento de dichos accidentes.
AGRADECIMIENTOS
Los autores agradecen al Programa de Ofidismo/ Escorpionismo de la Universidad de Antioquia, por la utilización de las instalaciones, equipos e insumos necesarios para la ejecución de este proyecto; al doctor Jaime Cogollo, Director del Jardín Botánico Joaquín Antonio Uribe, de Medellín, y a todo el personal de esta institución que hizo posible la recolección del material vegetal; finalmente, al CODI (Universidad de Antioquia), que brindó el aporte económico necesario para la elaboración de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Otero R, Núñez V, Jiménez S, Fonnegra R, Osorio R, García M, et al. Snakebites and ethnobotany in the northwest region of Colombia Part I: Traditional use of plants. J Ethnopharmacol. 2000 Aug; 71 (3): 493-504. [ Links ]
2. Chippaux JP, Goyffon M. Venoms, antivenoms and immunotherapy. Toxicon. 1998 Jun; 36 (6): 823-846. [ Links ]
3. Maiorano VA, Marcussi S, Daher MAF, Oliveira CZ, Couto LB, Gomes OA, et al. Antiophidian properties of the aqueous extract of Mikania glomerata. J Ethnopharmacol. 2005 Dec; 102 (3): 364-370. [ Links ]
4. Borges MH, Soares AM, Rodrigues VM, Oliveira F, Fransheschi AM, Rucavado A, et al. Neutralization of proteases from Bothrops snake venoms by the aqueous extract from Casearia sylvestris (Flacourtiaceae). Toxicon. 2001 Dec; 39 (12): 1863-1869. [ Links ]
5. Villar JAFP, Lima FTD, Veber CL, Oliveira ARM, Calgarotto AK, Marangoni S, et al. Synthesis and evaluation of nitrostyrene derivative compounds, new snake venom phospholipase A2 inhibitors. Toxicon. 2008 Jun; 51 (8): 1467-1478. [ Links ]
6. Da Silva JO, Fernandes RS, Ticli FK, Oliveira CZ, Mazzi MV, Franco JJ, et al. Triterpenoid saponins, new metalloprotease snake venom inhibitors isolated from Pentaclethra macroloba. Toxicon. 2007 Aug; 50 (2): 283-291. [ Links ]
7. Gutierrez JM, Lomonte B. Local tissue damage induced by Bothrops snake venoms. A Review. Mem Inst Butantan. 1989 Sep; 51 (4): 211-223. [ Links ]
8. Bon C. The serum-therapie was discovered 100 years ago. Toxicon. 1996 Feb; 34 (2): 142-143. [ Links ]
9. Gowda TV. Venom Phospholipase A2 Enzymes. Chichester: Willey; 1997. Kini RM, editor. Interaction of snake venom phospholipases A2 with plant isolates. P. 205-221. [ Links ]
10. Lomonte B, Lungren J, Johansson B, Bagge U. The dynamics of local tissue damage induced by Bothrops asper snake venom and myotoxin II on the mouse cremaster muscle: an intravital and electron microscopic study. Toxicon. 1994 Jan; 32 (1): 41-55. [ Links ]
11. Lomonte B, Leon G, Angulo Y, Rucavado A, Nuñez V. Neutralization of Bothrops asper venom by antibodies, natural products and synthetic drugs: Contributions to understanding snakebite envenomings and their treatment. Toxicon. 2009 Dec 1; 54 (7): 1012-1028. [ Links ]
12. Daduang S, Sattayasai N, Sattayasai J, Tophrom P. Screening of plants containing Naja naja siamensis cobra venom inhibitory activity using modiWed ELISA technique. Anal Biochem. 2005 Jun; 341 (2): 316-325. [ Links ]
13. Otero R, Núñez V, Jiménez S, Fonnegra R, Osorio R, García M, et al. Snakebites and ethnobotany in the northwest region of Colombia, Part II: Neutralization of letal and enzymatic effects of Bothrops atrox venom. J Ethnopharmacol. 2000 Aug; 71 (3): 505-511. [ Links ]
14. Otero R, Núñez V, Barona J, Fonnegra R, Jiménez S, Osorio R G, et al. Snakebites and ethnobotany in the northwest region of Colombia, Part III: Neutralization of the haemorrhagic effect of Bothrops atrox venom. J Ethnopharmacol. 2000 Nov; 73 (1-2): 233-241. [ Links ]
15. Núñez V, Otero R, Barona J, Saldarriaga M, Osorio RG, Fonnegra R, et al. Neutralization of the edema-forming, defibrinating and coagulant effects of Bothrops asper venom by extracts of plants used by healers in Colombia. Braz J Med Biol Res. 2004 Jul; 37 (7): 969-977. [ Links ]
16. Perez-Arbeláez E. Plantas útiles de Colombia. 3 ed. Medellín, Colombia: Editorial Victor Hugo; 1990. [ Links ]
17. Correa JE, Bernal H. Especies vegetales promisorias de los países del convenio Andrés Bello. 1 ed. Bogotá: Editora Guadalupe Ltda.; 1990. Caesalpinaceae: Brownea ariza; p. 202-206. [ Links ]
18. Theakston RDG, Reid HA. Development of simple standard assay procedures for the characterization of snake venoms. Bull World Health Organ. 1983; 61 (6): 949-956. [ Links ]
19. Lomonte B, Gutierrez JM. La actividad proteolítica de los venenos de serpientes de Costa Rica sobre la caseína. Rev Biol Trop. 1983; 31 (1): 37-40. [ Links ]
20. Dole, VP. A relation between non esterified-fatty acids in plasma and the metabolisms of glucose. J. Clin Invest. 1956 Feb; 35 (2): 150-154. [ Links ]
21. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15; 227: 680-685. [ Links ]
22. Sanabria GA. Análisis Fitoquímico preliminar. Bogotá, Colombia: Universidad Nacional, Departamento de Farmacia; 1983. 133 p. [ Links ]
23. Domínguez XA. Métodos de investigación Fitoquímica. Nuevo León, México: Editorial Limusa S.A.; 1979. 281 p. [ Links ]
24. Angulo Y, Lomonte B. Biochemistry and toxicology of toxins purified from the venom of the snake Bothrops asper. Toxicon. 2009 Dec 1; 54 (7): 949-957. [ Links ]
25. White J. Snakes venoms and coagulopathy. Toxicon. 2005 Jun 15; 45 (8): 951-967. [ Links ]
26. Ramos OH, Selistre-de-Araujo HS. Snake venom metalloproteases--structure and function of catalytic and disintegrin domains. Comp Biochem Physiol C Toxicol Pharmacol. 2006 Mar-Apr; 142 (3-4): 328-346. [ Links ]
27. Swenson S. Markland JR. F.S. Snake venoms fibrin(ogen)olytic enzymes. Toxicon. 2005 Jun 15; 45 (8): 1021-1039. [ Links ]
28. Kini RM. Excitement ahead: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon. 2003 Dec 15; 42 (8): 827-840. [ Links ]
29. Jain MK, Yu BZ, Rogers JM, Smith AE, Boger ET, Ostrander RL, Rheingold AL. Specific competitive inhibitor of secreted phospholipase A2 from berries of Schinus terebinthifolius. Phytochemistry. 1995 Jun; 39 (3): 537-547. [ Links ]
30. Lindahl M, Tagesson C. Flavonoids as phospholipase A2 inhibitors: Importance of Their Structure for Selective Inhibition of Group II Phospholipase A2. Inflammation. 1997 Jun; 21 (3): 347-356. [ Links ]
31. Lättig J, Böhl M, Fischer P, Tischer S, Tietböhl C, Menschikowski M, et al. Mechanism of inhibition of human secretory phospholipase A2 by flavonoids: rationale for lead design. J Comput Aided Mol Des. 2007 Aug; 21 (8): 473-483. [ Links ]
32. Da Silva SL, Calgarotto AK, Chaar JS, Marangoni S. Isolation and characterization of ellagic acid derivatives isolated from Casearia sylvestris SW aqueous extract with anti-PLA2 activity. Toxicon. 2008 Nov; 52 (6): 655-666. [ Links ]
33. Leanpolchareanchai J, Pithayanukul P, Bavovada R, Saparpakorn P. Molecular docking studies and anti-enzymatic activities of Thai mango seed kernel extract against snake venoms. Molecules. 2009 Mar 31; 14 (4): 1404-1422. [ Links ]
34. Haslam E. Natural polyphenols (Vegetable tannins) as drugs: Possible modes of action. J Nat Prod. 1996 Feb; 59 (2): 205-215. [ Links ]