Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.19 no.3 Medellín Seot./Dec. 2012
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
PARÁMETROS CINÉTICOS Y PERFIL DE ÁCIDOS GRASOS DE CADENA CORTA DE BACTERIAS ÁCIDO LÁCTICAS TERMOTOLERANTES CON DIFERENTES FUENTES DE CARBONO
KINETICS PARAMETERS AND SHORT CHAIN FATTY ACIDS PROFILE OF THERMOTOLERANT LACTIC ACID BACTERIA WITH DIFFERENT CARBON SOURCES
Juan DÍAZ-VELA M.Sc.1, Lino MAYORGA-REYES Ph.D2, Alfonso TOTOSAUS S. Ph.D3, María de Lourdes PÉREZ-CHABELA Ph.D.1*
1 Departamento de Biotecnología. Universidad Autónoma Metropolitana. Iztapalapa, México D. F.
2 Sistemas Biológicos. Universidad Autónoma Metropolitana. Xochimilco, México D. F.
3 Laboratorio de Ciencia de los Alimentos. Tecnológico de Estudios Superiores de Ecatepec. México.
* Autor a quien se debe dirigir la correspondencia: lpch@xanum.uam.mx.
Recibido: Septiembre 17 de 2012 Aceptado: Diciembre 17 de 2012
RESUMEN
Antecedentes: Los prebióticos son sustancias obtenidas de fuentes vegetales, las cuales son digeribles en el colon donde se sitúa el mayor número de flora intestinal. Las inulinas de achicoria y agave son utilizadas como prebióticos en distintos alimentos, proporcionando beneficios al aumentar la flora microbiana benéfica. Objetivos: Determinar el efecto de diferentes fuentes de carbono como inulina de agave, achicoria, y albedo de naranja sobre los parámetros cinéticos y el perfil de ácidos grasos de cadena corta de dos bacterias ácido lácticas, a saber: P. pentosaceous y A. viridans. Métodos: Se realizó el análisis químico proximal (humedad, proteína, pH, cenizas, extracto etéreo y fibra total) del albedo de naranja (AN), inulina de agave (IA) e inulina de achicoria (ICh). Se realizó fermentaciones de 12 h con las bacterias ácido lácticas, utilizando inulina de achicoria (ICh), de agave (IA), y albedo de naranja (AN) como fuente de carbono en concentraciones de 0,5, 1,0 ó 1,5% (p/v), utilizando glucosa como testigo. La producción de ácidos grasos de cadena corta (AGCC) se realizó mediante la técnica de HPLC (ácido láctico) y cromatografía de gases (ácido acético, propiónico y butírico). Los resultados fueron analizados mediante un análisis de varianza (ANOVA) y la diferencia entre medias se llevó a cabo mediante un análisis de medias de Tukey (α= 0,05). Resultados: El AN presentó un porcentaje significativamente (P < 0,05) mayor de humedad, cenizas, extracto etéreo y fibra total; mientras que IA tuvo mayor porcentaje de proteína y un pH más alto (P < 0,05). Para ambas bacterias, el mayor crecimiento fue con ICh al 1,0% (P < 0,05), siendo el ácido láctico el metabolito de mayor producción. Con AN al 1,0%, las dos cepas mostraron un menor tiempo de duplicación, además de una mayor producción de ácido láctico, acético y butírico (P < 0,05). Conclusiones: Con la utilización de AN, a las actuales condiciones experimentales, se obtuvo menores tiempos de generación en comparación con las inulinas, y una mayor producción de ácidos orgánicos, por lo que concluimos que el AN puede ser considerado como un prebiótico potencial.
Palabras clave: Prebióticos, inulina, fermentación, análisis proximal, bacterias ácido lácticas.
ABSTRACT
Background: Prebiotics are substances obtained from vegetable sources which are digestible in the colon where is situated most of the intestinal flora. The chicory inulin and agave are used as prebiotics in different foods, providing benefits by increasing the beneficial microbial flora. Objectives: The aim of this study was to determine the effect of different carbon sources, such as inulin from agave, chicory, or orange albedo on the kinetic parameters and the profile of short chain fatty acids of lactic acid bacteria. Methods: Proximate analysis (moisture, protein, pH, ash, ether extract and total fiber) of orange albedo, agave inulin and chicory inulin was performed. Fermentation batches (12 h) were performed with two lactic acid bacteria, P. pentosaceus and A. viridans, employing chicory (CI), agave inulin (AI), and orange albedo (OA) as carbon source at different concentrations of 0.5, 1.0 and 1.5% (w/v), against glucose as control. The production of short chain fatty acids (SCFA) was performed using the HPLC technique (lactic acid) and gas chromatography (acetic, propionic and butyric acids). The results were analyzed using analysis of variance (ANOVA) and the difference between means was performed using a Tukey means analysis (α = 0.05). Results: OA showed a significantly (P < 0.05) higher moisture, ash, ether extract and total fiber, while AI had the highest percentage of protein and a higher pH (P < 0.05). For both strains, maximum growth was observed with 1.0% CI (P < 0.05), being lactic acid the major metabolite produced. With 1.0% OA, both strains showed shorter duplication time, and a higher lactic, acetic and butyric acids production (P < 0.05). Conclusions: By using OA, in the present experimental conditions, were obtained lower generation times compared with inulins, and increased production of organic acids, from which we conclude that the OA may be regarded as a potential prebiotic.
Keywords: Prebiotic, inulin, fermentation, proximate analysis, lactic acid bacteria.
INTRODUCCIÓN
Los prebióticos han sido definidos como ingredientes alimenticios no-digeribles que afectan benéficamente al huésped por estimulación selectiva del crecimiento y/o actividad de una o un número limitado de bacterias en el colon, generando beneficios a la salud (1). Recientemente han redefinido el concepto de prebiótico como un ingrediente fermentable selectivo que permite cambios específicos, además de conferir beneficios sobre la composición y/o actividad de la microflora gastrointestinal (2). Los ingredientes prebióticos se consideran además como parte de aquellos alimentos funcionales que pueden modificar de manera positiva los procesos fisiológicos y biológicos en la nutrición, o como auxiliares en el tratamiento de enfermedades humanas (3). Los prebióticos deberán ser fermentados únicamente por bacterias del colon, promoviendo algunas funciones fisiológicas especificas a través de la liberación de metabolitos por las bacterias, en especial los ácidos grasos de cadena corta al lumen intestinal (4). Las bacterias del colon presentan diferentes grados de fermentación, dependiendo de los carbohidratos que vayan a metabolizar, donde aquellos carbohidratos con un bajo nivel de polimerización son metabolizados de una forma más efectiva, aun por encima de azucares como la glucosa. Durante la fermentación de ingredientes los prebióticos por parte de los probióticos en el colon mejoran la producción de ácidos grasos de cadena corta como butírico, acético y propiónico, los cuales son rápidamente absorbidos. El butirato es la mayor fuente de energía para los colonocitos, el propionato es mayormente absorbido por el hígado, y el acetato entra en periférica para ser metabolizado por tejidos periféricos. Estos ácidos grasos de cadena corta pueden reducir el riesgo de desarrollar desordenes gastrointestinales, cáncer y enfermedades cardiovasculares (5).
Dentro de los ingredientes prebióticos, la inulina ha sido una de las más utilizadas por su resistencia al proceso digestivo, además de ser considerada como fibra dietética y por ser un compuesto que mediante estudios in-vitro e in-vivo resulta efectivo sobre el crecimiento de la microflora intestinal, disminuyendo microorganismos patógenos como clostridium, donde en algunos tratamientos se incrementó la relación de butirato, indicando un cambio en la actividad bacteriana (6). Por otro lado, el albedo es un tejido alto en fibra que se encuentra en diversas frutas cítricas, es de color blanco y esponjoso localizado en la cáscara. Este material puede ser considerado como ingrediente funcional debido al contenido de fibra, además de ser una buena fuente de oligosacáridos pécticos con actividad prebiótica (7).
El objetivo general de este trabajo fue determinar el efecto de diferentes fuentes de carbono como inulina de agave, achicoria y albedo de naranja sobre los parámetros cinéticos y el perfil de ácidos grasos de cadena corta de dos bacterias ácido lácticas, P. pentosaceous y A. viridans. Los objetivos específicos fueron: determinar el análisis químico proximal del AN, IA e ICh; cuantificar el crecimiento viable de las bacterias en estudio con las diferentes fuentes y concentraciones de carbono; y, cuantificar la producción de ácidos grasos de cadena corta.
MATERIALES Y MÉTODOS
Obtención de muestras
La inulina de achicoria (Cichorium intybus L.) e inulina de agave (Agave spp.) fueron obtenidas a partir de Nano Nutrition S.R.L. de C.V. (Naucalpan, México). El albedo de naranja fue obtenido de acuerdo a la metodología reportada por Durán et al., 2008 (8). El albedo (parte blanca y esponjosa) fue retirado manualmente de las cascaras de naranja (Citrus sinensis), eliminando la limonina con una solución de NaCl al 15% a 95°C por 30 min. Posteriormente, fue secado en una estufa a 60 °C durante 24 h, después fue molido en un molino manual, fue tamizado con una malla No. 80 y fue almacenado al vacío a temperatura ambiente hasta su análisis y utilización.
Análisis proximal
Se determinó la humedad (Método Oficial 925.40), proteína total (Método Oficial 960.52), pH (Método Oficial 994.18), cenizas (Método Oficial 940.18), extracto etéreo como grasa total (920.26) y fibra total (Método Oficial 991.43), de la AOAC, a las muestras de albedo de naranja, inulina de agave e inulina de achicoria (9).
Preparación del inóculo
Las cepas utilizadas, Pediococcus pentosaceus y Aerococcus viridans, previamente identificadas como bacterias lácticas termotolerantes y probióticas, fueron reactivadas en caldo MRS, incubando a 37°C durante 12 h (10, 11). Después de este paso, se realizó la adaptación de las bacterias en medio de cultivo tripticasa de soya, peptona y extracto de levadura (TPY, por las siglas en ingles de Trypticase- Peptone-Yeast), incubando a 37°C durante 12 h a pH 6,5 (12). El inóculo se preparó al transferir a medio TPY una alícuota (2 mL) de los tubos de bacterias activadas, incubando a 37°C durante 12 h a 200 rpm.
Cinética del crecimiento y pH
Las fermentaciones fueron realizadas de acuerdo a la metodología propuesta por Bustamante et al., 2006 (13), utilizando medio TPY suplementando con 0,5, 1,0 y 1,5 % (p/v) de albedo de naranja, inulina de agave, inulina de achicoria y glucosa (testigo), como fuentes de carbono. Se inoculó aproximadamente 3 log10 UFC/mL en matraces de fermentación a una temperatura de 37°C y una agitación de 200 rpm. Se tomó alícuotas (2 mL) a partir del tiempo cero hasta completar 12 h de fermentación con intervalos de una hora para la determinación del crecimiento bacteriano (conteo en placa de agar TPY incubadas a 37°C durante 24 h, reportando UFC/mL) y pH. Se calculó la tasa específica de crecimiento ''k'' y tiempo de duplicación ''g'' (como el inverso de ''k'') como medidas de la capacidad de adaptación de las bacterias a las diferentes fuentes de carbono, de acuerdo a la ecuación 1 (14):
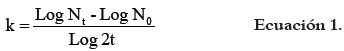
dónde: Nt = número final de células (UFC/ mL); N0 = número inicial de células (UFC/mL); t = tiempo de fermentación (h).
Producción de ácidos grasos de cadena corta
Para la determinación de ácidos grasos de cadena corta, se tomó alícuotas de 2 mL a los tiempos 0, 6 y 12 h de fermentación. El análisis se realizó de acuerdo a la metodología propuesta por Manderson et al., 2005 (15), con algunas modificaciones. Para el análisis del ácido láctico se utilizó cromatografía de líquidos HPLC modelo 250 (Perkin Elmer, Norwalk) en una columna Resex Organic Acids (7.8 x 300 mm), detector de índice de refracción, y ácido sulfúrico (0.5 mN) como fase móvil a un flujo isocrático de 0.6 mL/min y una temperatura de 50°C. El análisis de ácido acético, propiónico y butírico se llevó a cabo mediante cromatografía de gases HP 5890 Series II (Perkin Elmer, Shelton) utilizando una columna AT- 1000 (10 m x 0.250 mm), detector de ionización de flama, N2 como gas de arrastre, un flujo de 1 mL/min y una rampa de temperatura (90-120°C @ 5°/min).
Análisis estadístico
Para el análisis del efecto de los tratamientos utilizados se aplicó un diseño factorial completo de dos factores: fuente de carbono (albedo de naranja, inulina de agave e inulina de achicoria) y la concentración de éstos como fuente alternativa de carbono (0,5, 1,0 y 1,5 %). Los resultados fueron analizados mediante un análisis de varianza (ANOVA), utilizando el programa SPSS Versión 15 para Windows®. La diferencia entre medias en la determinación de los parámetros fisicoquímicos se llevó a cabo mediante un análisis de medias de Tukey (α= 0,05) con el mismo paquete estadístico.
RESULTADOS
Análisis proximal
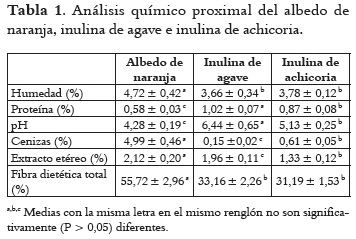
La Tabla 1 muestra los resultados del análisis proximal y microbiológico para albedo de naranja, inulina de agave e inulina de achicoria. El albedo de naranja tuvo mayor contenido de humedad que las inulinas. Las diferentes condiciones de temperatura, de tiempo de secado, y las diferencias intrínsecas de la materia prima influyeron directamente sobre la liberación del agua, provocando en algunos casos el efecto de endurecimiento de los residuos impidiendo la liberación óptima de agua (16). Con respecto al pH de las muestras, el valor más bajo (P < 0,05) se obtuvo con albedo de naranja, debido probablemente al contenido de ácidos orgánicos en cítricos (17). El contenido de cenizas más bajo (P < 0,05) se observó en inulina de agave (0,15 %), mientras que el albedo de naranja tuvo el mayor porcentaje (4,99 %). El contenido de cenizas está relacionado con la concentración de calcio en albedo de naranja, donde el calcio varía de acuerdo al estado de madurez de este tipo de frutos cítricos (18). Respecto al extracto etéreo, el albedo de naranja tuvo valores mayores (P < 0,05) que las inulinas, debido probablemente a la presencia de ceras epicuticulares de la cáscara en este tipo de frutos cítricos (19). El contenido de proteína fue mayor para la inulina de agave y menor para el albedo de naranja con valores de 1,02 y 0,58 %, respectivamente.
Cinética del crecimiento
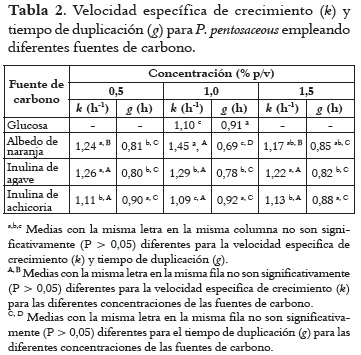
La capacidad de adaptación al medio de cultivo por parte de las bacterias analizadas se vio reflejada en los parámetros de velocidad específica de crecimiento y el tiempo de duplicación. La Tabla 2 muestra los resultados para P. pentosaceus con los diferentes tipos y concentraciones de fuentes de carbono. La velocidad específica de crecimiento fue significativamente mayor (P < 0,05) al utilizar albedo de naranja e inulina de achicoria a concentraciones de 0,5 y 1,5%. De este modo, los tiempos de duplicación fueron significativamente (P < 0,05) menores para estos sustratos. Al comparar con la glucosa a una concentración del 1,0%, el albedo de naranja tuvo valores significativamente (P < 0,05) mayores de crecimiento (1,46 h-1), seguido de inulina de agave (1,29 h-1), y con valores de duplicación menores (0,69 – 0,78 h) que con glucosa o inulina de achicoria (0,91 – 0,92 h). Los valores de la velocidad específica de crecimiento y tiempo de duplicación fueron significativamente (P < 0,05) mayores al 1,0% de fuente de carbono.
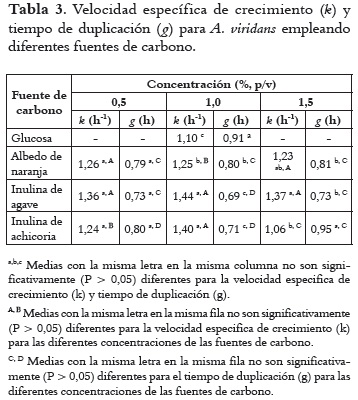
La Tabla 3 muestra los resultados de parámetros de crecimiento para A. viridans. A concentraciones de 0,5 % de fuente de carbono no hay diferencia significativa (P > 0,05), y a concentraciones de 1,5% los valores de g fueron significativamente (P < 0,05) mayores para inulina de achicoria en comparación con inulina de agave y albedo de naranja. Al utilizar el 1,0% del albedo de naranja e inulina de achicoria se obtuvo valores significativamente (P < 0,05) mayores de g (1,44 y 1,40 h-1, respectivamente), y por lo tanto, valores significativamente (P < 0,05) menores de tiempo de duplicación (0,70 h). Los valores de la tasa específica de crecimiento y de tiempo de duplicación fueron significativamente (P < 0,05) mayores al 1,0% de fuente de carbono.
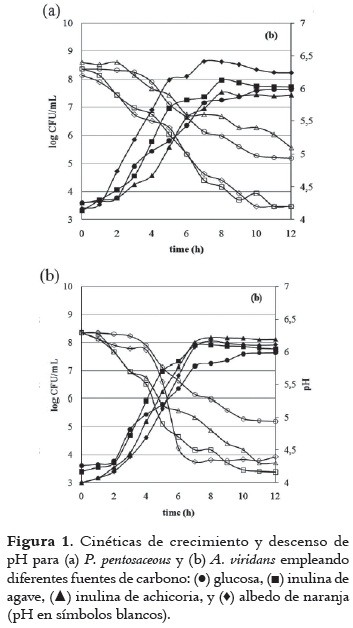
La Figura 1 muestra las curvas de crecimiento celular y pH de las bacterias lácticas utilizadas para las diferentes fuentes de carbono al 1%. En general, se observó diferencias en las curvas de crecimiento y disminución del pH para ambos microorganismos al cambiar la fuente de carbono. El acortamiento de las fases de adaptación al utilizar otras fuentes de carbono diferentes a la glucosa da cuenta de la degradación de los compuestos disponibles en albedo de naranja, inulina de agave e inulina de achicoria por P. pentosaceous y A. viridans.
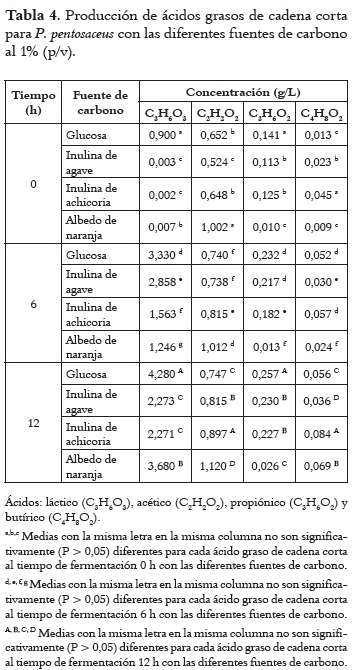
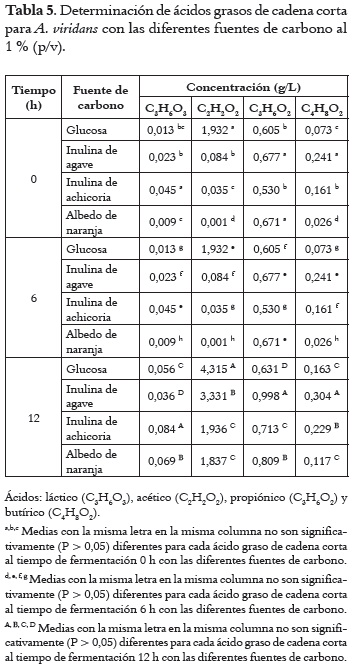
Producción de ácidos grasos de cadena corta
En la Tabla 4 se observa la producción de ácidos orgánicos de cadena corta para P. pentosaceus con las diferentes fuentes de carbono al 1%. Al inicio de la fermentación la producción de ácido láctico fue significativamente (P < 0,05) mayor con glucosa como sustrato que con el resto de los ingredientes prebióticos. Este comportamiento fue similar a las 6 y 12 h de fermentación. La menor cantidad de ácido láctico producida por las diferentes fuentes de carbono utilizadas fue con las inulinas. En los ácidos grasos de cadena corta, al inicio de la fermentación el utilizar albedo de naranja resultó en valores significativamente mayores (P < 0,05) que con el resto de los ingredientes prebióticos o glucosa, comportamiento que se observó a las 6 y 12 h de fermentación. La producción de ácido propiónico fue significativamente mayor (P < 0,05) con glucosa que con los ingredientes prebióticos durante los intervalos de muestreo de la fermentación. Finalmente, para el ácido butírico la fermentación de inulina de achicoria tuvo valores significativamente mayores (P < 0,05) al inicio y a las 6 y 12 h, en comparación con el resto de ingredientes prebióticos o glucosa.
En la Tabla 5 se presenta los resultados de la producción de ácidos orgánicos de cadena corta para las fermentaciones de A. viridans con las diferentes fuentes de carbono al 1%. Para este microorganismo, la producción de ácido láctico fue significativamente mayor (P < 0,05) al utilizar inulina de achicoria al inicio, 6 y 12 h de fermentación. La producción de ácido acético fue significativamente mayor (P < 0,05) con glucosa durante toda la fermentación que con las otras fuentes de carbono. La producción de ácido láctico y ácido propiónico fue significativamente mayor (P < 0,05) durante toda la fermentación con inulina de achicoria. Las inulinas de achicoria y agave tuvieron un mayor efecto en la producción de ácido propiónico y butírico.
DISCUSIÓN
El contenido de proteína pudo deberse a la naturaleza de las muestras, su estado de maduración y al contenido de glucoproteínas presentes en la pared celular primaria donde éstas forman estructuras con la celulosa (20). El mayor contenido de fibra total (P < 0,05) se presentó con el albedo de naranja a 55,72%, resultado que se da probablemente por la presencia de celulosa, hemicelulosa y lignina en la composición de la naranja, siendo estos compuestos una fuente de fibra insoluble (21).
La tendencia de las curvas de crecimiento muestran una fase exponencial prolongada, sin transiciones que indiquen un crecimiento diáxico o poliáuxico, lo que indica la continuidad en el consumo de sustrato para la producción de biomasa (22); además, una fase de inducción para el consumo de estos sustratos no es necesaria, por lo que son igual de buenos que la glucosa para soportar el crecimiento (23). La corta duración de la fase de adaptación con inulina y albedo de naranja refleja una óptima adaptación al medio de cultivo tanto con P. pentosaceus como con A. viridans, resaltando una diferencia entre ambas cepas respecto a la velocidad de crecimiento y número de células viables durante el experimento, lo cual se relaciona con lo reportado por Kaplan et al., 2000 (23), donde muestran que existe diferencia de crecimiento bacteriano entre diferentes cepas (Bifidobacterium y Lactobacillus) al utilizar fructooligosacáridos como fuente de carbono. Los valores mayores para k y g al cambiar la fuente de carbono corroboran la capacidad fermentativa de fructooligosacáridos y/o pectinas por estas bacterias lácticas. Stewart et al., 2008 (28), reportaron una rápida fermentación de fructooligosacáridos comparados con inulina de achicoria, siendo importante el grado de polimerización de la fuente de carbono durante el crecimiento de las bacterias. La composición de la fuente de carbono tiene efecto marcado sobre la acidificación (disminución de pH por la producción de ácidos orgánicos volátiles y ácido láctico) y el crecimiento de probióticos (bifidobacterias o lactobacilos), donde el metabolismo fermentativo es más rápido con oligofructosacáridos que con inulinas, ya que éstas últimas al tener una mayor grado de polimerización tienen un prolongado efecto bifidogénico o prebiótico (24). Se ha reportado efectos positivos con relación al crecimiento de bacterias lácticas usando fuentes alternas de carbono, mostrando tasas específicas de crecimiento similares que con glucosa (25). En este estudio se observó un mejor crecimiento con fuentes alternas de carbono a la glucosa; sin embargo, algunos estudios han reportado un crecimiento más lento con componentes prebióticos, en relación con las hexosas, pero con una biomasa final similar; lo cual bajo las condiciones experimentales usadas en este estudio demuestra un óptimo aprovechamiento de los carbohidratos en el AN o las inulinas (26). Las diferencias en la velocidad de crecimiento entre las diferentes cepas utilizadas puede atribuirse a las preferencias individuales por una fuente de carbono monomérica (glucosa) en lugar de carbohidratos oligoméricos (27). El albedo de naranja contiene una diversidad de carbohidratos en su composición, siendo los azucares reductores, fibra dietética soluble (21%) y fibra dietética insoluble (79%) los aprovechables por las bacterias (28). Ghoddusi et al., 2007 (29), reportaron un mejor crecimiento de bacterias lácticas al tener una combinación de carbohidratos como fuente de carbono en el medio de cultivo, en comparación con aquellas fermentaciones donde sólo usaban inulina u otros carbohidratos por separado, lo cual está relacionado con lo que se obtuvo en este experimento al considerar al albedo de naranja como un compuesto no purificado con diversos carbohidratos en su composición.
La adaptación a un medio pobre en monosacáridos confiere un metabolismo altamente adaptable a consumir oligo o polisacáridos, dando una ventaja competitiva a cierto tipo de bacterias, además de afectar fuertemente los productos de la fermentación, sobre todo en la producción de ácidos grasos de cadena corta (22). La producción de ácidos grasos de cadena corta varía tanto en cantidad como en tipo de ácido graso de cadena corta, lo cual está en función del tipo de cepa y fuente de carbono utilizada (30). Un incremento en la población microbiana con fuentes de carbono alternas a la glucosa supone un incremento en la producción de metabolitos (32) como lo son el ácido láctico, acético propiónico y butírico (31, 33).
CONCLUSIONES
Las tres fuentes de carbono utilizadas son una buena fuente de fibra, siendo mayor el porcentaje con albedo de naranja. Las bacterias lácticas presentaron un mayor crecimiento y una menor fase de adaptación cuando se utilizó albedo de naranja en comparación con las dos inulinas, siendo estas últimas consideradas como prebióticos. Se concluye que el albedo de naranja presentó mejores propiedades que las dos inulinas utilizadas, por lo que se considera su uso como prebiótico potencial.
AGRADECIMIENTOS
Juan Díaz Vela agradece al Consejo Nacional de Ciencia y Tecnología (CONACyT), México, por el otorgamiento de la beca No. 224727 para sus estudios de posgrado.
REFERENCIAS BIBLIOGRÁFICAS
1. Gibson GR, Roberfroid MB. Dietary modulation of the colonic microbiota: Introducing the concept of prebiotics. J Nutr. 1995 Jun; 125 (6): 1401 - 1412. [ Links ]
2. Gibson GR, Probert HM, Van Loo JA, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: Updating the concept of prebiotics. Nutr Res Rev. 2004 Dec; 17 (2): 259 -275. [ Links ]
3. Salminen S, Bouley C, Boutron-Ruault M, Cummings JH, Franck A, Gibson GR, et al. Functional food science and gastrointestinal physiology and function. Br J Nutr. 1998 Aug; 80 (1): 147 - 171. [ Links ]
4. Cummings JI, Macfarlane GT, Englyst IN. Prebiotic digestion and fermentation. Am J Clin Nutr. 2001 Feb; 73 (2): 415 - 420. [ Links ]
5. Hijova E, Chmelarova A. Short chain fatty acids and colonic health. Bratisl Lek Listy. 2007 Aug; 108 (8): 354 - 358. [ Links ]
6. Roberfroid MB. Dietary fiber, inulin, and oligofructose. A review comparing by their physiological effects. Crit Rev Food Sci Nutr. 1993 Feb; 33 (2): 103 - 148. [ Links ]
7. Hotchkiss AT, Olano-Martin E, Grace WE, Gibson GR, Rastall RA. Pectic oligosaccharides as prebiotics. Oligosaccharides in Food and Agriculture. Washington DC, Virginia: EUA: American Chemical Society; 2003. 54 - 62 p. [ Links ]
8. Durán-Mendoza T, Mendiola-Campuzano JVH, Urrieta-Saltijeral JM, Hernández-Vélez RM, Angulo-Guerrero O. Evaluación de la incorporación de fibra dietética procedente del bagazo de naranja en un embutido tipo longaniza. IV Simposio Internacional de Ciencia y Tecnología de Alimentos; 2008; Villahermosa, Tabasco: México; 351-359 p. [ Links ]
9. AOAC. Official methods of analysis of the Association of Official Analytical Chemist International. Total, soluble and insoluble dietary fiber in foods. Method 991.43. Washington DC, Virginia: EUA; 1999. [ Links ]
10. Ramírez-Chavarín NL, Wacher-Rodarte C, Pérez-Chabela ML. Characterization and identification of thermotolerant lactic acid bacteria isolated from cooked sausages as bioprotective cultures. J Muscle Foods. 2010 Jul; 21 (3): 585 - 596. [ Links ]
11. De Man JC, Rogosa M, Sharpe ME. A medium for the cultivation of lactobacilli. J App Bacteriol. 1960 Apr; 23 (1): 130 - 135. [ Links ]
12. Muñoa FJ. Pares R. Selective medium for isolation and enumeration of Bifidobacterium spp. App Environ Microbiol. 1988 Jul; 54 (7): 1715 - 1718. [ Links ]
13. Bustamante P, Mayorga L, Ramírez H, Martínez P, Barranco E, Azaola A. Evaluación microbiológica de compuestos con actividad prebiótica. Rev Mex C Farm. 2006 Apr-Jun; 37 (2): 5 - 9. [ Links ]
14. Stanbury PF, Whitaker A, Hall SJ. Principles of Fermentation Technology. 2th ed. Oxford, Inglaterra: Butterworth Heinemann; 1995. 13 - 31 p. [ Links ]
15. Manderson K, Pinart M, Tuohy KM, Grace WE, Hotchkiss AT, Widmer W, et al. In vitro determination of prebiotic properties of oligosaccharides derived from an orange juice manufacturing by-product stream. App Environ Microbiol. 2005 Dec; 71 (12): 8383 - 8389. [ Links ]
16. Garau MC, Simal S, Rosselló C, Femenia A. Effect of air-drying temperatura on physico-chemical properties of dietary fiber and antioxidant capacity of orange (Citrus aurantium v. Canoneta) byproducts. Food Chem. 2007 Jan; 104 (3): 1014 - 1024. [ Links ]
17. Clements RL. Organic acids in citrus fruits. II. Seasonal changes in the orange. J Food Sci. 1964 May; 29 (3): 281 - 286. [ Links ]
18. Agustí M, Martínez-Fuentes A, Mesejo C. Citrus fruit quality. Physiological basis and techniques of improvement. Agrociencia. 2002 Sep; 6 (2): 1 - 16. [ Links ]
19. Storey R, Treeby MT. The morphology of epicuticular wax and albedo cells of orange fruit in relation to albedo breakdown. J Hort Sci Biotechnol. 1994 Feb; 69 (2): 329 - 338. [ Links ]
20. Carpita NC. Gibeaut DM. Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. Plant J. 1993 Jan; 3 (1): 1 - 30. [ Links ]
21. Lario Y, Sendra E, García-Pérez J, Fuentes C, Sayas-Barberá E, Fernández-López, J, et al. Preparation of high dietary fiber powder from lemon juice by-products. Inn Food Sci Emerg Technol. 2004 Mar; 5 (1): 113 - 117. [ Links ]
22. Rossi M, Corradini C, Amaretti A, Nicolini M, Pompei A, Zanoni S, et al. Fermentation of fructooligosaccharides and inulin by bifidobacteria: a comparative study of pure and fecal cultures. App Environ Microbiol. 2005 Oct; 71 (10): 6150 - 6158. [ Links ]
23. Kaplan H, Hutkins RW. Fermentation of fructooligosaccharides by lactic acid bacteria and bifidobacteria. App Environ Microbiol. 2000 Jun; 66 (6): 2682 - 2684. [ Links ]
24. Pompei A, Cordisco L, Raimondi S, Amaretti A, Pagnoni U, Matteuzzi D, et al. In vitro comparison of the prebiotic effects of two inulin-type fructans. Anaerobe. 2008 Nov; 14 (5): 280 - 286. [ Links ]
25. Cardelle-Cobas A, Corzo N, Olano A, Peláez C, Requena T, Ávila M. Galactooligosaccharides derived from lactose and lactulose: influence of structure on Lactobacillus, Streptococcus and Bifidobacterium growth. Int J Food Microbiol. 2011 Sep; 149 (1): 81 - 87. [ Links ]
26. Yeo SK, Liong MT. Effect of prebiotics on viability and growth characteristics of probiotics in soymilk. J Sci Food Agric. 2010 Jan; 90 (2): 267 - 275. [ Links ]
27. Gopal P, Sullivan P, Smart J. Utilisation of galactooligosaccharides as selective sustrates for growth by lactic acid bacteria including Bifidobacterium lactis DR10 and Lactobacillus rhamnosus DR20 . Int Dairy J. 2001 Jan; 11 (1-2): 19 - 25. [ Links ]
28. Aravantinos-Zafiris G, Oreopoulou V, Thomopoulos CD. Fibre fraction from orange peel residues after pectin extraction. Food Sci Technol-LEB. 1994 Oct; 27 (5): 468 - 471. [ Links ]
29. Ghoddusi HB, Grandison MA, Grandison AS, Tuohy KM. In vitro study on gas generation and prebiotic effect of some carbohydrates and their mixtures. Anaerobe. 2007 Oct-Dec; 13 (5-6): 193 - 199. [ Links ]
30. Hernandez-Hernandez O, Sanz ML, Kolida S, Rastall RA, Moreno J. In vitro fermentation by human gut bacteria of proteolytically digested caseinomacropeptide nonenzymatically glycosylated with prebiotic carbohydrates. J Agric Food Chem. 2011 Nov; 59 (22): 11949 - 11955. [ Links ]
31. Stewart ML, Timm DA, Slavin JL. Fructooligosaccharides exhibit more rapid fermentation than long-chain inulin in an in vitro fermentation system. Nutr Res. 2008 May; 28 (5): 329 - 334. [ Links ]
32. Cardelle-Cobas A, Olano A, Corzo N, Villamiel M, Collins M, Kolida S, et al. In vitro fermentation of lactulose-derived oligosaccherides by mixed fecal microbiota. J Agric Food Chem. 2012 Feb; 60 (8): 2024 - 2032. [ Links ]
33. Chen J, Liang R-h, Liu W, Li T, Liu Ch-m, Wu S, et al. Pecticoligosaccherides prepared by dynamic high-pressure microfluidization and their in vitro fermentation properties. Carbohydr Polym 2013 Jan; 91 (1): 175 - 182. [ Links ]