Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.20 no.1 Medellín Jan./Apr. 2013
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
ADICION DE Carnobacterium maltaromaticum CB1 EN CHORIZO Y MORCILLA EMPACADOS AL VACIO, PARA INHIBIR EL CRECIMIENTO DE Listeria monocytogenes
ADDITION OF Carnobacterium maltaromaticum CB1 IN VACUUM PACKAGED CHORIZO AND MORCILLA, TO INHIBIT THE GROWTH OF Listeria monocytogenes
María I. GONZALEZ H.1*, Wan YIEN2, Jorge A. CASTRILLON V.2, Ángela ORTEGA P.3
1 Centro de Investigación y Desarrollo. Negocio Cárnico. Grupo Nutresa. Cra 64C # 104-3. Medellín, Colombia. mgonzalezh@zenu.com.co.
2 Departamento de Investigación y Desarrollo. Laboratorios Griffith. 151 Pharmacy Ave. Toronto, Ontario, Canadá.
3 Departamento de Investigación y Desarrollo. Laboratorios Griffith. Km 39 Autopista Medellín, Bogotá, Colombia.
Recibido: Septiembre 06 de 2012
Aceptado: Mayo 03 de 2013
RESUMEN
Antecedentes: En años recientes la demanda de productos alimenticios percibidos como ''naturales'' se ha incrementado de manera importante, los cuales no contienen dentro de sus ingredientes conservantes o aditivos de origen químico o artificial. Al retirar de la fórmula estos conservantes/aditivos artificiales se puede generar en el producto un medio ideal de crecimiento de bacterias alterantes o patógenas. Esto es particularmente cierto en productos cárnicos procesados empacados al vacío, donde su alta actividad acuosa, bajo pH y un largo periodo de almacenamiento a condiciones de refrigeración generan un ambiente ideal para el crecimiento de microorganismos patógenos como Listeria monocytogenes. Por tanto, esto genera la necesidad de nuevas y efectivas tecnologías que permitan su control y eliminación. Los Bio-Conservantes (adición de bacterias vivas a los productos cárnicos) ofrecen una solución ideal a este tipo de problemas directamente relacionados con la seguridad alimentaria, y a la vez satisfacen la demanda por parte de los consumidores de productos saludables. Objetivos: Determinar si el cultivo C. maltaromaticum CB1 puede controlar el crecimiento de una cepa nativa de L. monocytogenes en morcilla y chorizo empacados al vacío (película de baja permeabilidad al oxigeno). Métodos: Tres lotes diferentes de chorizo y morcilla producidos a nivel industrial fueron posteriormente inoculados con una cepa nativa de L. monocytogenes a un nivel de 102 UFC/g junto con el bio-conservante C. maltaromaticum CB1 a un nivel de 103 UFC/g. A los tratamientos denominados como control no se les aplicó el bio-conservante. Después de ser empacados al vacío, los productos fueron almacenados a dos temperaturas diferentes de 4°C (refrigeración) y 8°C (abuso de temperatura) durante 35 días. En intervalos de 7 días se hizo recuentos del crecimiento de la L. monocytogenes utilizando agar Oxford. Resultados: Se obtuvo una reducción significativa (P < 0.05) en los recuentos de L. monocytogenes tanto en la morcilla como en el chorizo tratados con bio-conservante C. maltaromaticum CB1 y almacenados a 4°C y 8°C respectivamente, en comparación con los productos denominados control. Conclusiones: La cepa de C. maltaromaticum CB1 demostró ser efectiva en el control del crecimiento de la cepa nativa de L. monocytogenes en chorizo y morcilla.
Palabras clave: Biotecnología, Carnobacterium, bacteriocinas, productos cárnicos.
ABSTRACT
Background: In recent years, there has been a marked increase in consumer demand for foods that are perceived as ''natural'' that contain no artificial preservatives or food additives. Removing artificial preservatives/food additives from the food provides the perfect environment for growth of both spoilage and pathogenic bacteria. This is particularly true for vacuum packaged processed meat products where the high water activity, low acid pH and the long storage under refrigeration creates the perfect environment for Listeria monocytogenes to grow. Thus, there is a need for the introduction of new and effective technologies to control or kill Listeria monocytogenes. Biopreservation (adding live bacteria to the meat products) offers the ideal solution of this food safety issue, while satisfying consumer demand for safe wholesome foods. Objectives: To determine if the biopresevative culture C. maltaromaticum CB1 is able to control the outgrowth of an indigenous L. monocytogenes in vacuum packaged (low oxygen permeability film) chorizo and Morcilla. Methods: Triplicate independent batches/ lots of commercially produced Chorizo and Morcilla were inoculated with the indigenous L. monocytogenes strain at 102 CFU/g and with the biopreservative C. maltaromaticum CB1 at 103 CFU/g. Control products did not receive the biopreservative treatment. Following vacuum packaging, the products were stored at either 4 or 8°C for 35 days. At 7 day intervals the growth of L. monocytogenes was enumerated using Oxford Agar. Results: There was a significant reduction (P < 0.05) in the number of L. monocytogenes at 4 and 8°C in the Morcilla and Chorizo where the biopreservative C. maltaromaticum CB1 had been added compared to control products. Conclusions: C. maltaromaticum CB1 was shown to be effective in controlling the outgrowth of L. monocytogenes in Chorizo and Morcilla.
Keywords: Biotechnology, Carnobacterium, bacteriocins, meat products.
INTRODUCCIÓN
La industria cárnica está bajo constante escrutinio por parte de los consumidores y los medios de comunicación debido a diferentes casos de intoxicación que han sido causados por patógenos emergentes como la L. monocytogenes, Salmonella, E. coli (enterotoxigenica cepas ETEC), entre otros (1). Esto ha generado ansiedad en los consumidores y una falta de confianza en los productos cárnicos procesados, mostrando que, a pesar de los avances tecnológicos recientes, los problemas relacionados a la seguridad alimentaria no han sido resueltos (2)
La L. monocytogenes es el organismo que causa la Listeriosis, una enfermedad transmitida a través de los alimentos (ETA), lo cual es motivo de preocupación, ya que éste es uno de los patógenos más letales, con una tasa de mortalidad de entre el 20 y el 30%, causando una gran alarma a nivel mundial por parte de los productores de alimentos, los consumidores y las autoridades de salud (3). Esta preocupación se ha acentuado en los últimos anos después de que los investigadores y las autoridades sanitarias han llegado a la conclusión de que no es posible eliminar completamente la L. monocytogenes de las plantas procesadoras de alimentos. La L. monocytogenes es intrínsecamente resistente a condiciones extremas de temperatura (ya que puede crecer a temperaturas entre 1°C y 45°C) (3). Es el crecimiento de L. monocytogenes a temperaturas de refrigeración (4°C) el principal motivo de preocupación tanto para productores como para consumidores (4), especialmente en los grupos de alto riesgo como las personas inmunodeficientes, mujeres embarazadas y lactantes; es también una de las causas principales de abortos, septicemia e infecciones del sistema nervioso central (5).
El uso de conservantes químicos en productos alimenticios ha sido condenado por los consumidores debido a sus potenciales efectos secundarios a largo plazo (6). La Bio-conservación de los alimentos ha tenido gran aceptación en la industria de alimentos procesados y las bacterias ácido lácticas (BAL) juegan un papel importante en esta tendencia (7). La Bio-conservación se define como la extensión de la vida útil y la generación de una mayor seguridad en los alimentos utilizando flora natural que actúa inhibiendo o retardando el crecimiento y la actividad de microorganismos patógenos o de degradación (8). Algunas especies de bacterias ácido lácticas (BAL) producen metabolitos o bacteriocinas. Las bacteriocinas son un grupo de moléculas de proteínas o péptidos de bajo peso molecular que se producen en los ribosomas de las bacterias y que tienen la capacidad de interferir en el crecimiento de otras bacterias filogenéticamente relacionadas, a través de la desestabilización de la membrana citoplasmática, causando la lisis celular y evitando así su crecimiento y su reproducción (9). Estas cepas de bacterias ácido lácticas también pueden ser antagonistas de microorganismos que deterioran los alimentos. Las bacteriocinas son fácilmente degradadas por las enzimas proteolíticas presentes en el tracto gastrointestinal sin efectos tóxicos, y algunas de las producidas por las BAL son sólo activas contra especies filogenéticamente relacionadas, mientras que otras son activas frente a otros organismos Gram (+) (10, 11).
El C. maltaromaticum es una bacteria ácido láctica que produce metabolitos antimicrobianos y bacteriocinas que tienen la habilidad de controlar el crecimiento y/o desarrollo de bacterias patógenas y alterantes que se pueden producir durante el almacenamiento de productos cárnicos empacados al vacío (12). El género Carnobacterium, consta de nueve especies: C. alterfunditum, C. divergens, C. funditum, C. gallinarum, C. inhibit, C. maltaromaticum, C. mobile, C. pleistocenium, C. viridans, Carnobacterium sp, de las cuales sólo el C. divergens y el C. maltaromaticum han sido aisladas de los productos alimenticios (13).
El C. maltaromaticum es una bacteria ácido láctica atípicamente homofermentativa la cual produce ácido láctico a partir de la glucosa (14), es tolerante a ciclos de congelación/descongelación, condiciones de alta presión, capaz de crecer a bajas temperaturas y con presencia anaeróbica de CO2. El C. maltaromaticum CB1 produce tres bacteriocinas: carnocyclin A, piscicolin 126 y carnobacteriocin BM1, las cuales han demostrado ser efectivas en inhibir el crecimiento del Enterococcus faecalis, Enterococcus faecium, Pediococcus acidilactici, C. divergens, Lactococcus lactis, Lactobacillus curvatus, Lactobacillus casei, Leuconostoc gelidum, Staphylococcus aureus, Clostridium botulinum, y altamente efectiva para inhibir el crecimiento de la L. monocytogenes (15). La actividad antimicrobiana de las bacteriocinas se debe a que forman poros en la membrana de la bacteria objetivo, lo cual genera una pérdida de substancias de bajo peso molecular (16, 17).
A través de la incorporación del C. maltaromaticum CB1 directamente sobre la superficie de los productos cárnicos en el momento de empacar, se favorece la producción in situ de bacteriocinas que inhiben el crecimiento de bacterias patógenas como la L. monocytogenes (18).
El Chorizo y la Morcilla son productos altamente perecederos y susceptibles a deterioro microbiano debido a su bajo contenido de sal (2%); bajo pH (6) y a su actividad acuosa (Aw) (> 0,945); estas condiciones generan el crecimiento de diferentes microorganismos relacionados con la contaminación post proceso (19), que puede afectar la salud del consumidor, las cualidades nutritivas del producto y producir cambios organolépticos no deseados en el producto alimenticio en un corto periodo de tiempo.
La combinación de las diferentes barreras tradicionales que desaceleran o evitan el crecimiento microbiano (temperatura, tiempo de cocción, pH, Aw, entre otros) así como las nuevas técnicas de Bio-conservación pueden proporcionar un mecanismo aceptado por los consumidores para controlar el crecimiento de microorganismos patógenos y alterantes (4).
El objetivo de este estudio fue evaluar la eficacia del Bio-conservante producido por la bacteria ácido láctica C. maltaromaticum CB1 al ser adicionada en productos cárnicos (morcilla y chorizo) que fueron inoculados con una cepa de L. monocytogenes.
MATERIALES Y MÉTODOS
Muestras
Los productos cárnicos (chorizo y morcilla) fueron producidos en la planta de Frigosur (Caloto, Colombia) Grupo Nutresa, a partir de formulaciones estándar y con base en los protocolos de elaboración, envasado y transporte establecidos. Los productos control fueron inoculados con una cepa nativa de L. monocytogenes, mientras que las muestras de ensayo fueron inoculadas con C. maltaromaticum CB1 y la cepa nativa de L. monocytogenes. Una vez producidas todas las muestras fueron transportadas bajo condiciones controladas de refrigeración al Centro de Investigación y Desarrollo de Industria de Alimentos Zenú SAS en Medellín, Colombia, al Laboratorio Tecnimicro en Medellín, Colombia y al Instituto de Medicina Tropical - Universidad CES de Medellín, Colombia, donde fueron procesadas y almacenadas en cámaras de temperatura controlada, a 4°C y 8°C. Tres repeticiones fueron realizadas en los lotes de producción independientes. Igualmente, se hizo tres réplicas de lotes independientes de producción.
Análisis Microbiológicos
Aislamiento e Identificación de L. monocytogenes
El aislamiento de la cepa nativa de L. monocytogenes se realizó de acuerdo a los parámetros establecidos en AFNOR VALIDATION (núm. BIO-12/9-07/02 protocolo común para las pruebas y VIDAS LIS VIDAS® LMO2). La cepa nativa de L. monocytogenes fue aislada con hisopos estériles en diferentes áreas de proceso (equipos, mostradores, pisos, paredes, etc.) dentro de la planta de Frigosur (Caloto, Colombia). Las muestras tomadas usando hisopos individuales fueron enjuagadas con 10 ml de caldo Fraser y fueron encubadas (Memmert modelo de incubadora 400 D06060) durante 24 - 26 horas a 30 ± 1°C. El análisis de identificación se realizó utilizando VIDAS® L. monocytogenes II, según la norma AOAC OMA 2004, 02.
Activación y crecimiento de la cepa nativa de L. monocytogenes
La cepa nativa fue reactivada mediante la transferencia de 0,1 ml de solución de células maestras a 10 ml de caldo de soya tripticasa (TSB) y fue encubada durante 8 horas a una temperatura de 37°C. Para preparar el inóculo a utilizar en las muestras de productos cárnicos se reactivó otros dos sub-cultivos de la solución de células maestras previamente inoculadas, transfiriendo 0,1 ml a 10 ml de (TSB) seguido de una nueva incubación durante 8 horas a una temperatura de 37°C; una centrifugación a 5000 g por 10 min a 37°C y lavado con solución salina al 0,85%, se realizó la suspensión y dilución en serie de las células en agua peptonada con el fin de proporcionar el stock del inóculo de L. monocytogenes a 1 x 106 UFC/ml.
Preparación del C. maltaromaticum
Laboratorios Griffith Colombia (Km 39 Autopista Medellín - Bogotá, Marinilla, Antioquia, Colombia) proporcionó una preparación comercial liofilizada de C. maltaromaticum CB1, la cual fue reconstituída siguiendo las instrucciones proporcionadas por el productor, disolviendo 2,2 g en 100 ml de agua estéril destilada a una temperatura de 4°C.
Inoculación de las muestras cárnicas con L monocytogenes y C. maltaromaticum CB1
El chorizo y la morcilla fueron transferidos de manera independiente a bolsas estériles. Se adicionó inóculo stock (0,5 ml) de L. monocytogenes a cada uno de los empaques, obteniendo una concentración de 5 x 102 UFC / g de L. monocytogenes. A las muestras prueba se les agregó 1,5 ml adicionales del C. maltaromaticum CB1 reconstituido. Cada uno de los empaques fue sellado al vacío (Komet a vacio, modelo DIGI-GAS 1995) y almacenado a 4 u 8°C.
Muestreo y Análisis
Las muestras control y prueba tanto del chorizo como de la morcilla que fueron almacenadas a 4 y 8°C fueron enumeradas en el día cero y evaluadas semanalmente para determinar la tasa de crecimiento de la L. monocytogenes. Este procedimiento se hizo por triplicado. Para su evaluación, las muestras fueron enjuagadas en 500 ml de una solución de agua peptonada (20) y diluidas a diferentes concentraciones seriales, también en agua peptonada. Posteriormente, cada una de las diluciones de L. monocytogenes se sembró en agar tipo Oxford y se incubó durante 48 horas a una temperatura de 37°C. El C. maltaromaticum se sembró en agar tipo CTSI y se incubó a 25°C durante 48 horas (21).
Análisis estadístico
El análisis estadístico de los datos obtenidos fue realizado utilizando LSD Fishers de SYSTA comparación por pares.
RESULTADOS
Resultados Microbiológicos
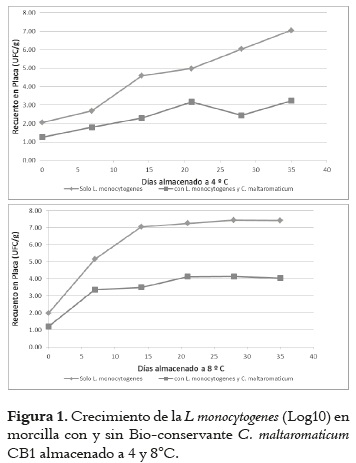
Morcilla
Los recuentos de L. monocytogenes en la morcilla almacenada a 4°C e inoculada con el cultivo Bioconservante de C. maltaromaticum CB1 mostraron una reducción significativa (P < 0,05) a lo largo de la vida útil del producto (35 días) en comparación al control, ya que al final de dicho tiempo se notó una diferencia de 4 log en los recuentos de L. monocytogenes. Se pudo apreciar también una inhibición en la fase inicial de 0,8 log en producto inoculado. Los recuentos de la L. monocytogenes en morcilla almacenada a 8°C e inoculada con el cultivo Bioconservante C. maltaromaticum CB1 asimismo mostraron una reducción significativa (P < 0,05) a lo largo de la vida útil del producto (35 días). Al final de este tiempo se detectó una diferencia de 3,5 log con respecto al control. Se detectó además una reducción inicial de 0,8 log de L. monocytogenes igual que las muestras almacenadas a una temperatura de 4°C (ver figura 1). En la morcilla inoculada con el C. maltaromaticum CB1 y almacenada a 4°C la L. monocytogenes creció de manera lenta a lo largo de los 35 días de almacenamiento, iniciando en 2 logs y llegando finalmente a un nivel de población de 3,0 log UFC/g, en contraste con la morcilla inoculada con el C. maltaromaticum CB1 y almacenada a 8°C, en la cual la L. monocytogenes creció de manera exponencial durante los primeros 7 días en 2,5 log, y alcanzó una densidad de poblacional máxima después del día 20 de 4,0 log CFU/g. La población de L. monocytogenes en las muestras control almacenadas a 4°C creció de manera constante a lo largo de los 35 días de vida útil, llegando a un nivel de log 7, mientras que en la muestras control almacenadas a una temperatura de 8°C creció de forma rápida a lo largo de los primeros 14 días, llegando a un nivel máximo de población de 7 log, el cual se mantuvo a lo largo del tiempo restante del estudio.
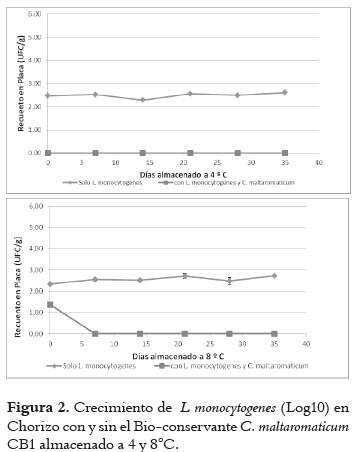
Chorizo
Los recuentos de L. monocytogenes en chorizo almacenado a 4°C e inoculado con el Bio-conservante C. maltaromaticum CB1 mostraron una reducción significativa (P < 0,05) a lo largo de la vida útil del producto de 35 días, por debajo del nivel de detección comparado con el control. Durante los 35 días de almacenamiento la diferencia de 2,5 log en L. monocytogenes fue continua.
Los recuentos de L. monocytogenes en chorizo almacenado a 8°C e inoculado con el Bio-conservante C. maltaromaticum CB1 ostraron una reducción significativa (P < 0,05) a lo largo de la vida útil del producto de 35 días. Al final de la vida útil del chorizo se detectó una diferencia de 2,5 logs con respecto al control. De manera excepcional, a 1,0 log de la inculcación inicial con la L. monocytogenes, se observó que en el chorizo inoculado con el Bio-conservante C. maltaromaticum CB1 hubo una reducción poblacional de hasta por debajo del nivel de detección en el día 7 y permaneció constante durante los 35 días del estudio (Figura 2).
La población de listeria en las muestras control a 4 y 8°C no creció significativamente (P > 0,05) desde el nivel de inoculación.
DISCUSIÓN
El C. maltaromaticum es capaz de crecer en productos cárnicos a temperaturas tan bajas como 2-1,5°C (22-24), y es con frecuencia un miembro predominante (hasta un 26%) de las Gram positivas o BAL aisladas de la flora microbiana común en la carne fresca (res, cerdo, oveja y pollo). Su capacidad para crecer a bajas temperaturas lo convierte en una opción ideal como Bio-conservante. Adicionalmente, se ha encontrado que C. maltaromaticum crece independientemente de si los productos son almacenados aeróbicamente, empacados al vacío o sometidos a una atmosfera modificada, incluyendo composición de gas de CO2/N2 (%) en rangos de 10:90 a 80:20, (24-32).
El C. maltaromaticum también ha sido aislado en variedad de productos cárnicos procesados, incluyendo tocino de cerdo curado (25), jamones (33, 34), cárnicos españoles (35), carnes de pollo cocidas (28), pollo tratado con presiones (408–888MPa) (36), cerdo y pollo irradiados (26). En ocasiones ha sido aislado de salchichas fermentadas (37, 38).
El Carnobacterium tiene la capacidad de producir péptidos antimicrobianos, es decir bacteriocinas, (39, 16) y las caracterizadas del Carnobacterium pertenecen a las clases I y II (17). Hasta ahora la única bacteriocina clase I (lantibiotic) aislada y reportada es la producida por el Carnobacterium (40). Por otro lado, a la clase II pertenecen 10 bacteriocinas de secuencias de aminoácidos, las cuales comprenden pequeñas pediocinas como péptidos antimicrobianos. El espectro de inhibición de las bacteriocinas clase II, como la generada por el Carnobacterium, incluye la Listeria y su actividad antimicrobiana se ejerce por la formación de poros, la disipación del potencial de la membrana y la fuga interna de sustancias de bajo peso molecular (5, 17). Recientemente, las bacteriocinas de C. maltaromaticum CB1 han sido caracterizadas, mostrando una potente actividad contra cierto tipo de microrganismo, especialmente numerosas especies de Listeria (41).
Todas estas evidencias sugieren que C. maltaromaticum CB1 es una opción ideal como Bioconservante para productos cárnicos procesados. En este estudio se demuestra que con la adicción de C. maltaromaticum CB1 se logra proteger ambos productos, morcilla y chorizo, de la cepa nativa de L. monocytogenes. Además de controlar el crecimiento a temperaturas de refrigeración (4°C), el C. maltaromaticum CB1 también es capaz de controlar el crecimiento de la cepa nativa de L. monocytogenes bajo abuso de temperatura simulada (8°C). Se observó además que en el chorizo hubo un buen control del crecimiento de la cepa nativa de L. monocytogenes; sin embargo, en contacto con el Bio-conservante se produjo un potente efecto listericida. Este comportamiento sugiere que es importante más investigación, que podría conducir a una alternativa de bioconservación mejorada para la industria de cárnicos procesados.
CONCLUSIONES
El crecimiento de la cepa nativa de L. monocytogenes fue inhibido por la presencia del Bio-conservante C. maltaromaticum CB1, en ambos productos morcilla y chorizo a 4 y 8°C.
Se evidenció una mayor eficacia en el control del crecimiento de Listeria monocytogenes en presencia del agente bioconservante C. maltaromaticum en chorizo.
La adición del Bio-cosnervante C. maltaromaticum CB1 para alimentos, y particularmente carnes procesadas, es efectivo para controlar el crecimiento de la Listeria.
REFERENCIAS BIBLIOGRÁFICAS
1. Batz MB, Hoffmann S, Morris JG. Ranking the disease burden of 14 pathogens in food sources in the United States using attribution data from outbreak investigations and expert elicitation. J Food Prot. 2012 Jul; 75 (7): 1278-1291. [ Links ]
2. Christine M, Bruhn L, Howard G. Consumer food safety knowledge and practices. J Food Safety. 1999. 19: 73-87. [ Links ]
3. Lundén JM, Miettinen MK, Autio TJ, Korkeala, HJ. Persistent Listeria monocytogenes strains show enhanced adherence to food contact surface after short contact times. J Food Prot. 2000 Sep; 63 (9): 1204-1207. [ Links ]
4. Leistner, L. Basic aspects of food preservation by hurdle technology. Int J Food Microbiol. 2000 Apr; 55 (1-3): 181-186. [ Links ]
5. Suzuki M, Yamamoto T, Kawai Y, Inoue N, Yamazaki K. Mode of action of piscicocin CS526 produced by Carnobacterium piscicola CS526. J Appl Microbiol. 2005 Aug; 98 (5): 1146-1151. [ Links ]
6. Ricke SC. Perspectives on the use of organic acids and short chain fatty acids as antimicrobials. Poult Sci. 2003 Apr; 82 (4): 632-639. [ Links ]
7. Vamanu E, Vamanu A. Viability of the Lactobacillus rhamnosus IL1 strain in simulated gastrointestinal conditions. J Pharmacology. 2010; 6 (5): 732-737. [ Links ]
8. Michael E. Stiles Biopreservation by lactic acid bacteria. Antonie van Leeuwenhoek. 1996 Oct; 70 (2-4): 331-345. [ Links ]
9. O'Keeffe T, Hill C. Enciclopedy of Food, Microbiology. Editorial Academic Press. Londres, Gran Bretaña. 1999. Bacteriocins . 183-197. [ Links ]
10. Guerrero I, Mendiolea E, Prado A. Inoculation of lactic acid bacteria on meat surfaces as a means of decontamination in semitropical conditions. Meat Sci. 1995 Jan; 40 (3): 397-411. [ Links ]
11. Ganzlec G, Hertela C, Vossen Van Der Jos M, Hammesa W. Effect of bacteriocina producing lactobacilli on the survival of Escherichia coli and Listeria in a dynamic model of the stomach and the small intestine. J Syst Evo Microbiol. 1999 Feb; 48 (2): 21-35. [ Links ]
12. Gálvez A, López R, Abriouel H, Valdivia E, Ben N. Application of bacteriocins in the control of foodborne pathogenic and spoilage bacteria. Crit Rev Biotechnol. 2008; 28 (2) : 125-152. [ Links ]
13. Joborn A, Dorsch M, Olsson J, Westerdahl A, Kjelleberg S. Carnobacterium inhibens isolated from the intestine of atlantic salmon (Salmo salar). Int J Syst Evo Microbiol. 1999 Oct; 49 (4): 1891-1898. [ Links ]
14. Hammes W, Hertel C. The general Lactobacillus and Carnobacterium. The Procaryotes: An evolving electronic resource for the microbiological community. 2003. 320 - 403. [ Links ]
15. Laursen BG, Bay L, Cleenwerck I, Vancanneyt M, Swings J, Dalgaard P, et al. Carnobacterium divergens and Carnobacterium maltaromaticum as spoilers or protective cultures in meat and seafood: phenotypic and genotypic characterization. Syst Appl Microbiol. 2005 Mar; 28 (2): 151-164. [ Links ]
16. Coventry M, Gordon J, Wilcock A, Harmark K, Davidson B, et al. Detection of bacteriocins of lactic acid bacteria isolated from foods and comparison with pediocin and nisin. J Appl Microbiol. 1997 Jul; 83 (2): 248-258. [ Links ]
17. Drider D, Firmland G, H'echard Y, McMullen L, Pr'evost H. The continuing story of class IIa bacteriocins. Microbiol Mol Biol Rev. 2006 Jun; 70 (2): 564-582. [ Links ]
18. Brillet M, Pilet F, Prevost H, Bouttefroy A, Leroi F. Biodiversity of Listeria monocytogenes sensitivity to bacteriocin-producing Carnobacterium strains and application in sterile cold-smoked salmon. J Appl Microbiol. 2004; 97(5): 1029-1037. [ Links ]
19. Mataragas M, Drosinos H, Metaxopoulos J. Antagonistic activity of lactic acid bacteria against Listeria monocytogenes in sliced cooked cured pork shoulder stored under vacuum or modified atmosphere at 4+/-2ºC. Food Microbiol. 2003 Apr; 20 (2), 259- 265. [ Links ]
20. Luchansky JB, Porto A, Wallace F. Recovery of Listeria monocytogenes from vacuum-sealed packages of frankfurters: Comparison of the U.S. Department of Agriculture (USDA) Food Safety and Inspection Service Product Composite Enrichment Method, the USDA Agricultural Research Service (ARS) Product Composite Rinse Method, and the USDA-ARS Package Rinse Method. J Food Prot. 2002 Mar; 65 (3), 567-570. [ Links ]
21. Rivar D, Stiles E, Smith M, Lynn M. Comparision of lactatediacetate and biopreservative for control of Listeria monocytogenes on vacuum packaged wieners. University of Alberta, 2003. [ Links ]
22. Lynn M, Stiles M. Microbial ecology of fresh pork stored under modified atmosphere at -1°C, 4.4°C and 10°C. Int. J. Food Microbiol. 1993; 18: 1-4. [ Links ]
23. Sakala R, Hayashidani H, Kato Y, Hirata T, Makino Y, Fukushima A, et al. Change in the composition of the micro flora on vacuumpackaged beef during chiller storage. Int J Food Microbiol. 2002 Mar 25; 74 (1-2): 87-99. [ Links ]
24. Jones RJ. Observations on the succession dynamics of lactic acid bacteria populations in chill-stored vacuum packaged beef. Int J Food Microbiol. 2004 Feb 1; 90 (3): 273-282. [ Links ]
25. Shaw B, Harding C. Numerical taxonomic study of lactic acid bacteria from vacuum-packed beef, pork, lamb and bacon. J Appl Bacteriol. 1984 Feb; 56 (1): 25-40. [ Links ]
26. Grant I, Patterson M. A numerical taxonomic study of lactic acid bacteria isolated from irradiated pork and chicken packaged under various gas atmospheres. J. Appl Bacteriol. 1991 Apr; 70 (4): 302-307. [ Links ]
27. McMullen LM, Stiles ME. Microbial ecology of fresh pork stored under modified atmosphere at -1°C, 4.4°C and 10°C. Int J Food Microbiol. 1993; 18: 1-4. [ Links ]
28. Barakat K, Griffiths W, Harris J. Isolation and characterization of Carnobacterium Lactococcus and Enterococcus spp. from cooked, modified and atmosphere packaged, refrigerated poultry meat. Int. J. Food Microbiology. 2000Dec 5; 62 (1-2): 83-94. [ Links ]
29. Susiluoto T, Korkeala H, Björkroth K. Leuconostoc gasicomitatum is the dominating lactic acid bacterium in retail modified-atmosphere- packaged marinated broiler meat strips on sell-by-day. Int J Food Microbiol. 2003Jan 15; 80 (1): 89-97. [ Links ]
30. Björkroth J, Ristiniemi M, Vandamme P, Korkeala H. Enterococcus species dominating in fresh modified atmosphere-packaged, marinated broiler legs are overgrown by Carnobacterium and Lactobacillus species during storage at 6°C. Int J Food Microbiol. 2005; 97 (3): 267-276. [ Links ]
31. Leisner J, Greer G, Dilts B, Stiles M. Effect of growth of selected lactic acid bacteria on storage life of beef stored under vacuum and in air. Int J. Food Microbiol. 1995; 26: 231-243. [ Links ]
32. Vihavainen E, Lundström H, Susiluoto T, Koort J, Paulin L, Auvinen P, et al. Role of broiler carcasses and processing plant air in contamination of modified-atmosphere-packaged broiler products with psychrotrophic lactic acid bacteria. Appl Environ Microbiol. 2007 Feb; 73 (4): 1136-1145. [ Links ]
33. Borch E, Molin G. The aerobic growth and product formation of Lactobacillus, Leuconostoc, Brochothrix, and Carnobacterium in batch cultures. Appl Microbiol Biotech. 1989; 30: 81-88. [ Links ]
34. Jack R, Wan J, Harmark K, Davison B, Hillier A, Wettenhall RE. et al. Characterisation of the chemical and antimicrobial properties of piscicolin 126, a bacteriocin produced by Carnobacterium piscicola JG126. Applied and Environmental Microbiology. 1996; 62: 2897-2903. [ Links ]
35. Chenoll E, Macian M, Elizaquivel P, Aznar R. Lactic acid bacteria associated with vacuum-packed cooked meat product spoilage: population analysis by rDNA-based methods. J. Applied Microbiology. 2007 Feb; 102 (2): 498-508. [ Links ]
36. O'Brien J, Marshall R. Microbiological quality of raw ground chicken processed at high isostatic pressure. J Food Prot. 1996 Feb 59 (2): 146-150. [ Links ]
37. Schillinger U, Lucke F. Antibacterial activity of Lactobacillus sakei isolated from meat. Appl. Environ. Microbiol. 1989 Aug; 55(8): 1901-1907. [ Links ]
38. Larrouture C, Montel M. Effects of environmental factors on leucine catabolism by Carnobacterium piscicola. Int J Food Microbiol. 2003 Mar 25; 81 (3): 177-184. [ Links ]
39. Lewu C, Kaiser A, Montville T. Inhibition of food-borne bacterial pathogens by bacteriocins from lactic acid bacteria isolated from meat. App Environ Microbiol. 1991 Jun; 57 (6): 1683-1688. [ Links ]
40. Stoffels G, Nes I, Gudmundsdottir A. Isolation and properties of a bacteriocin-producing Carnobacterium piscicola isolated from fish. J. Appl Bacteriol. 1992 Oct: 73 (4): 309-316. [ Links ]
41. Martin L, Van J, Gameau S, Whittal R, Zheng J, McMullen L, et al. Isolation and characterisation of Carnocyclin A, a novel circular bacteriocin produced by Carnobacterium maltaromaticum UAL307. Appl Environ Microbiol. 2008 Aug; 74 (15): 4756-4763. [ Links ]