Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Vitae
versión impresa ISSN 0121-4004
Vitae vol.20 no.1 Medellín ene./abr. 2013
REVISIONES
LAS ESTATINAS: QUÍMICA, TÉCNICAS ANALÍTICAS, BIOSÍNTESIS Y FARMACOCINÉTICA
STATINS: CHEMISTRY, ANALYTICAL TECHNIQUES, BIOSYNTHESIS AND PHARMACOKINETICS
Ivonne J. NIETO-RAMIREZ D.Sc.1, Carolina CHEGWIN-ANGARITA M.Sc.1*, Lucia ATEHORTÚA Ph.D.2, Liuda J. SEPÚLVEDA A. Q.F.2
1 Universidad Nacional de Colombia, Bogotá, Colombia.
2 Universidad de Antioquia. Medellín, Colombia.
* Autor a quien se debe dirigir la correspondencia: cchegwina@unal.edu.co.
Recibido: Abril 10 de 2012
Aceptado: Mayo 16 de 2013
RESUMEN
Antecedentes: Las estatinas presentan principalmente un efecto hipocolesterolémico, pero asimismo acciones biológicas adicionales, como efecto antiinflamatorio e inmunomodulador, actividad antioxidante, reducción de la incidencia de algunos tipos de cáncer, efectos benéficos en el metabolismo óseo y en el tratamiento de enfermedades neurodegenerativas y el SIDA. Se dividen en dos clases: las estatinas naturales y las sintéticas, las cuales surgen como producto de la necesidad de potencializar el efecto de las primeras. Estas propiedades han impulsado las investigaciones encaminadas a la comprensión de su comportamiento químico y sus propiedades fisicoquímicas, así como la comprensión de la relación entre sus estructuras y las ya mencionadas actividades. Su estudio ha permitido el desarrollo de técnicas analíticas eficientes tanto para su determinación en diferentes matrices, como la optimización de los procesos de extracción, separación, cuantificación y elucidación estructural, así como ahondar en el planteamiento de sus rutas biosintéticas, lo que aportará herramientas para poder intervenir, mediante la biotecnología, en los procesos biosintéticos, buscando el aumento de su producción por un organismo específico. Objetivos: El objetivo de este trabajo es presentar una revisión de la química, biosíntesis, farmacocinética y técnicas analíticas para la determinación de las estatinas con el fin de aportar, de manera rápida, conocimientos a quienes realizan investigaciones sobre estos metabolitos. Métodos: La revisión abarcó los últimos 12 años y se efectuó realizando la selección de aquellas investigaciones más relevantes que permiten conocer la química, las variaciones estructurales, las técnicas analíticas empleadas para la determinación de las estaninas y sus rutas biosintéticas. Asimismo, se pretendió abarcar un conocimiento general de sus acciones biológicas, farmacología y farmacocinética, tópicos estrechamente relacionados con sus diferencias estructurales. Resultados: Se obtiene un panorama general de los principales aspectos para el estudio de las estatinas, permitiendo seleccionar los mejores parámetros de acuerdo con lo requerido por los diferentes investigadores en el área. Conclusiones: La identificación de las estatinas requiere de diferentes procedimientos de extracción y separación, siendo los más empleados la SOE y la HPLC, respectivamente. Sus acciones biológicas están íntimamente relacionadas con su estructura. Los estudios de su toxicidad en mamíferos han demostrado que no hay evidencia de efecto carcinogénico, mutagénico, ni tóxico.
Palabras clave: Estatinas, actividad biológica, farmacología, farmacocinética.
ABSTRACT
Background: Statins show mainly a hypochlosterolemic effect but also present additional biological actions such as anti-inflammatory and immune-modulator, antioxidant activity, reduction of the incidence of some types of cancer, beneficial effects on bone metabolism, as well as in the treatment of neurodegenerative diseases, and AIDS. They are divided in two types; natural statins and synthetic statins, which arise from the need of increasing the effect of the former ones. These properties have encouraged researches to aim at the comprehension of their chemical behavior and physical-chemical properties, as well as the comprehension of the relationship between their structures and the activities aforementioned. This study has allowed the development of efficient analytic techniques both for their determination in different matrices and the optimization of the obtaining process, separation, quantification and structural elucidation, as well as to examine in depth the raising of biosynthetic routes, which will give tools that enable to intervene through biotechnology in the biosynthetic processes, searching for the increase of its production by a specific organism. Objectives: The purpose of this work is to present a review of chemistry, biosynthesis, pharmacopeia and analytic techniques with the aim of quickly contribute to the knowledge of the ones performing researches on these metabolites. Methods: This review approaches the last 12 years and was carried out by performing the selection of the most relevant researches that allow knowing the statins chemistry, structural variations, the analytic techniques used for their determination, and their biosynthetic routes as well. Likewise, it was intended to cover a general knowledge of their biological, pharmacological, and pharmacokinetic aspects, topics closely related with their structural differences. Results: A general approach of the main aspects for the study of statins is obtained. This allows selecting the parameters according to the required by different researchers on this area. Conclusions: The identification of statins requires of different obtaining and separation processes, being SOE and HPLC the most used, respectively. Their biological actions are closely related with their structure. Studies on toxicity in mammals have demonstrated that there is no evidence of cancerogenic, mutagenic, and toxic effects.
Keywords: Statin, analytical techniques, pharmacology, pharmacokinetic.
INTRODUCCIÓN
En la comunidad científica día a día se trabaja en la búsqueda de medicamentos que ayuden a la solución de diferentes dolencias que aquejan a la sociedad, como es el caso de las enfermedades cardiovasculares, en particular la enfermedad coronaria, considerada la principal causa de mortalidad en los países desarrollados, siendo la aterosclerosis el común denominador dentro de la mayoría de los pacientes. Aunque el desarrollo de la aterosclerosis depende de una compleja interacción entre diversos factores y procesos, se ha establecido una clara asociación entre los niveles elevados de colesterol en plasma y el aumento de la enfermedad aterosclerótica (1). Las estatinas han demostrado ser una excelente alternativa para reducir los niveles de colesterol y adicionalmente presentan un importante número de efectos pleiotrópicos, definidos éstos como todas aquellas bioacciones de un medicamento que son independientes de las originales para las que fue concebido, a saber: actividad antiinflamatoria, antioxidante, tratamientos para enfermedades del sistema nervioso central, enfermedades autoinmunes, gastrointestinales, osteoporosis, degeneraciones maculares, entre otras (2). Las primeras estatinas descubiertas fueron aisladas de hongos micromicetos del género Aspergillus, Penicillium y Monascus y posteriormente se encontró que también son biosintetizados por macromicetos del género Pleurotus (3, 4). La biotecnología ha desempeñado un papel fundamental en lo que respecta a la optimización de las condiciones para favorecer la biosíntesis de estos bioactivos por procesos fermentativos. La química ha contribuido en la construcción de las bases del estudio de las estatinas, elucidando sus estructuras y estableciendo la relación estrecha que éstas tienen con sus bioacciones, investigando acerca de cómo ocurren los procesos biosintéticos en los hongos para poder intervenir en ellos y favorecer su biosíntesis desde un organismo en particular, lo que requiere del desarrollo de procesos de aislamiento, separación y posterior purificación. Esta disciplina, de la mano de la farmacología, ha permitido determinar cómo ocurren los procesos de absorción, distribución, biotransformación y posterior excreción de estos compuestos.
En esta revisión se presenta una visión de los aspectos más importantes de las diferentes investigaciones relacionadas con la química de las estatinas, pasando por todas las etapas descritas antes y que han sido el pilar para la construcción del importante desarrollo que se tiene en la actualidad sobre este prometedor grupo de medicamentos.
GENERALIDADES
Las estatinas conforman un grupo de medicamentos empleados inicialmente por su efecto hipocolesterolémico, pero el avance de las investigaciones sobre sus propiedades biológicas han permitido determinar que estos compuestos exhiben a la vez importantes efectos pleiotrópicos que ponen de manifiesto sus bondades en tratamientos para esclerosis múltiple, desórdenes neurodegenerativos como el Alzheimer, cardiopatías no isquémicas, prevención de fracturas y regularmente reducción en la incidencia de algunos tipos de cáncer, así como el debilitamiento del potencial metastásico (1). Estas características no están relacionadas con su efecto en la disminución del colesterol sino con una posible acción antiinflamatoria (5).
Se pueden dividir en dos grupos: las de origen natural y aquellas que son productos de síntesis. Dentro de las primeras se encuentran: lovastatina, simvastatina, pravastatina y mevastatina, producidas por algunos hongos nativos o por procesos fermentativos, mientras que la fluvastatina, atorvastatina, cerivastatina, rosuvastatina y pitavastatina (NK-104) son producto de síntesis (6). Una de las ventajas de las estatinas naturales es que no presentan los efectos secundarios exhibidos por las sintéticas. La primera estatina natural, mevastatina (compactina), fue aislada de Penicillium citrinum en 1971 y de ella no se conoce hasta el presente uso clínico (3). En la actualidad las comercialmente disponibles son lovastatina (Mevacor ®, Merck Frosst), pravastatina (Pravachol®, Bristol-Meyers Squibb), simvastatina (Zocor®, Merck Frosst), fluvastatina (Lescol®, Novartis), atorvastatina (Lipitor®, Parke-Davis) y rosuvastatina (Crestor®, Astra-Zeneca) (7). Para el caso específico de la cerivastatina (Baycol®/Lipobay®, Bayer), que se comercializó durante un buen periodo de tiempo, fue voluntariamente retirada del mercado desde 2001 después de determinar clínicamente que su empleo produce rabdomiolisis. Dentro de las estatinas sintéticas de última generación se encuentra la pitavastatina, la cual está disponible para uso en Japón, y en Europa se encuentra en la fase III de prueba (8).
ESTRUCTURA DE LAS ESTATINAS
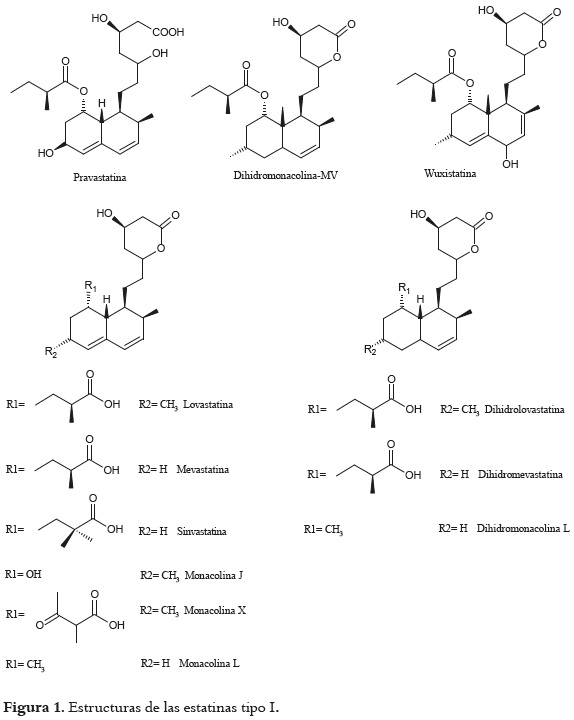
La clasificación dada a las estatinas puede aplicarse teniendo en cuenta la estrecha relación que las mismas guardan con su estructura. Todas las naturales conocidas como tipo I, poseen una mayor porción policétida que las del tipo II, presentan en común el anillo hexahidronaftaleno funcionalizado con un éster α-metilbutírico y una β-hidroxi-δ- lactona enlazada por un puente etilénico, pero difieren las unas de las otras por la posición de los metilos sobre el anillo y la cadena lateral, como es el caso de la lovastatina (Mevinolina, Monacolina K, Mevacor) que contiene una cadena lateral metilbutírica y un grupo 6-α-metilo, ausente en la mevastatina (Compactina, ML-236B, CS-500). La pravastatina (Eptastatina, Pravacol) en su forma comercial se encuentra como la sal sódica del β-hidroxiácido. La simvastatina (Sinvinolina, Zocor) contiene un grupo metilo adicional en la posición 2' de la cadena lateral (9). El anillo de la β-hidroxi-δ-lactona de estos compuestos puede sufrir una apertura hidrolítica y convertirse en los correspondientes ácidos 3',5'-dihidroxiheptanoicos, que son las formas activas y las responsables del efecto inhibidor de la Hidroximetilglutaril (HMG) CoA reductasa (10). Adicionalmente, a estos compuestos se ha identificado y caracterizado otros estructuralmente relacionados como la dihidrolovastatina y la dihidromevastatina aisladas de Aspergillus terreus, las monacolinas X y M extraídas de Monascus ruber, que tienen diferencias en el C8 de la cadena lateral (11). Las monacolinas J y L aisladas de Aspergillus terreus, con la ausencia de la cadena metilbutírica de la lovastatina. En la monacolina J un grupo hidroxilo está presente en el C8, mientras que éste es sustituido por un hidrógeno en la monacolina J y la dihidromonacolina L (9). La dihidromonacolina-MV es la estatina más recientemente aislada de Monascus purpureus y se caracteriza por ser un derivado de la dihidrolovastatina, donde el grupo éster corresponde a un 2-metilpropionato (12). Zhuge et al., 2008 (13), reportaron el aislamiento de la Wuxistatina como producto de bioconversión de la lovastatina por parte de una cepa bacteriana de Amycolatopsis sp., adicionando un hidroxilo en la posición 5, derivándose así un aumento de cuatro veces su efecto inhibidor de la HMG-CoA reductasa. En la figura 1 aparecen las estructuras de las diferentes estatinas naturales, donde se puede ver claramente las diferencias estructurales antes descritas.
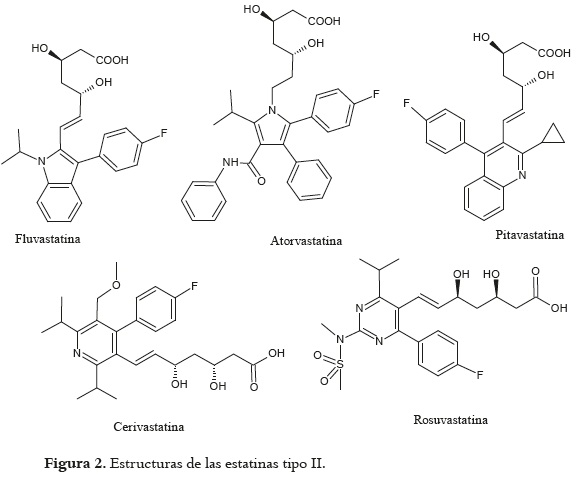
Con respecto a las estatinas del tipo II, éstas surgieron como producto de las diversas investigaciones adelantadas en busca de la obtención de un medicamento hipocolesterolémico, con una acción farmacológica potenciada con respecto a las estatinas naturales. Las estructuras de la atorvastatina (Lipitor), fluvastatina (Lescol) y cerivastatina (Baycol y Lipobay) son distintas entre sí y muy diferentes a las estatinas naturales.
Únicamente la porción afín con la HMG CoA reductasa, responsable de su acción inhibitoria, es común a ambos tipos de estatinas (9). Todas ellas son de magnitud molecular más grande que las naturales y tienen en común una cadena lateral fluorofenil, un grupo metiletil y un ácido heptenoico (8). La pitavastatina es una estatina nueva y altamente efectiva que ya está disponible para su uso en algunos países (14). En la figura 2 se encuentran las estructuras de las estatinas del tipo II.
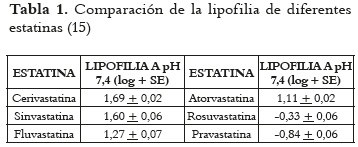
Las características estructurales previamente especificadas están estrechamente relacionadas con las propiedades fisicoquímicas de las estatinas. Existen diferencias entre su lipofilia, tal como se puede apreciar en la tabla 1, las cuales se reflejan en su facilidad de paso a través de las membranas celulares por difusión pasiva, y explica por qué la pravastatina no atraviesa fácilmente las membranas celulares mientras que la simvastatina sí lo hace (15).
MÉTODOS DE EXTRACCIÓN
La solubilidad es dentro de las propiedades fisicoquímicas una de las más fundamentales y particularmente útil en una amplia variedad de aplicaciones biológicas, químicas, farmacéuticas y ambientales. Esta propiedad es la base para una selección adecuada de la técnica de extracción que se debe aplicar para el estudio de un componente específico en cualquier matriz. En los últimos años se han realizado estudios relacionados con la solubilidad de algunas estatinas en diferentes disolventes orgánicos, en su mayoría alcoholes (16, 17) y en acetato de etilo (7, 18). En esta última investigación los autores determinaron que las extracciones desde medios acuosos son más eficientes a pH bajos. Lee et al., 2007 (19), reportan el uso de ultrasonido como una herramienta eficiente, simple y segura para realizar la extracción de lovastatina desde cápsulas de Monascus.
El interés por el desarrollo de técnicas óptimas para la determinación de estatinas en formulaciones farmacéuticas y en matrices biológicas que requieren el uso indispensable de procedimientos para la eliminación de interferencias, ha incrementado la evaluación de técnicas que permitan lograr este objetivo. Entre éstas se incluye la extracción líquido-líquido (LLE), extracción en fase sólida (SPE) y extracción con disolventes orgánicos sobre matrices sólidas (SOE) (20). Pansuriya et al., 2009 (21), evaluaron el empleo de extracción con CO2 supercrítico con metanol como cosolvente, para aislar las formas tanto lactónica como hidroxiácida de la lovastatina obtenida por fermentación en estado sólido de Aspergillus terreus sobre salvado de trigo.
Los autores resaltan las ventajas de esta técnica como son: limpieza, seguridad, no inflamabilidad, no corrosividad, no toxicidad, empleo de solventes eco amigables, no contaminantes y libres de residuo perjudicial, concluyendo que la metodología empleada tiene potencial para el aislamiento de la estatina a partir del producto obtenido por la fermentación y con menos impurezas que las metodologías reportadas hasta este momento. Más recientemente, Martín et al., 2011 (7), comparan la extracción por sorción en barra de agitación (SBSE), la microextracción dispersiva líquido-líquido (DLLME) y la SPE para analizar la presencia de los inhibidores en aguas residuales, concluyendo que la SPE genera los mejores resultados para la mayoría de los analitos (74-93% en agua pura, 46-97% en muestras de rio y 64-93% en aguas residuales de efluentes). La pravastatina fue pobremente extraída por DLLME hasta el punto de no ser determinada. La SBSE únicamente se pudo emplear con la lovastatina y la simvastatina pero con proporciones de recuperación de 19 y 38%, respectivamente; De igual manera, mencionan que a pesar de la baja precisión de la DLLME y la SBSE sobre la SPE, ofrecen algunas ventajas: ambas técnicas son simples, presentan bajos efectos matriz y requieren pocos volúmenes de disolventes orgánicos.
METODOS DE SEPARACIÓN E IDENTIFICACIÓN
Dentro de las técnicas de separación de las estatinas se incluye la cromatografía líquida de alta eficiencia (HPLC) y la cromatografía de gases (CG), siendo la primera de ellas la más empleada, prevaleciendo la utilización de separaciones en fase reversa y el uso de detectores UV y DAD, raramente se emplea detectores de fluorescencia o de espectrometría de masas (MS) (20). Sin embargo, estos métodos traen consigo algunos problemas como son la complejidad de los procedimientos, el consumo de disolventes orgánicos grado cromatográfico, la polución por los mismos y el consumo de columnas cromatográficas. Estas desventajas han llevado al uso de la electroforesis capilar de alta eficiencia, constituyéndose en una opción con ventajas tales como los bajos costos de los análisis, el volumen pequeño de muestra, la automatización y la alta selectividad (22-24). Damic et al., 2010 (22), y Nigovic et al., 2008 (23), evaluaron el efecto del pH y de la concentración del buffer usado, la influencia de un modificador orgánico, del voltaje aplicado y validaron el método, concluyendo que su uso es confiable, simple, seguro, de bajo costo y puede ser empleado en matrices complejas con sensibilidades que están en el orden de los ng/ ml. Recientemente se ha empleado cromatografía líquida de ultra rendimiento (UPLC) como una herramienta que provee mayores factores de capacidad, mejor resolución, aumento de sensibilidad y alta velocidad de análisis con límites de detección de 0,08ng/ml en tiempos de análisis de 2 min (25). Jun-Jun et al., 2009 (26), utilizaron espectrometría de masas séxtuple (MS1-MS6) en modo positivo con ionización por electrospray para la determinación de monacolina J, obteniendo información muy completa y útil sobre el patrón de fragmentación de esta molécula.
En revisiones previas se presenta aspectos relacionados con las técnicas de análisis de las diferentes estatinas como la de Nirogi et al., 2007 (8), quienes se enfocaron en las técnicas de cuantificación utilizando MS como método de detección para la atorvastatina, simvastatina, lovastatina, pravastatina, fluvastatina, rosuvastatina y pitavastatina, resaltando que el empleo de HPLC en combinación con espectrometría de masas en modo tándem (MS/ MS) es la técnica analítica con mejores ventajas para la cuantificación de las estatinas en muestras biológicas. En el mismo año Hernando et al., 2007 (27), exploraron la LC-MS para la determinación de estatinas en muestras ambientales, determinando que la aplicación de esta técnica permite la detección de concentraciones en niveles de trazas en diferentes matrices acuosas y muestras de suelos. Los autores hacen una detallada descripción y análisis de las diferencias entre los métodos empleados, las condiciones de las corridas y el efecto matriz que puede influenciar drásticamente en la sensibilidad y reproducibilidad del método. Novákova et al., 2008 (28), estudiando la aplicación de los métodos de HPLC en la determinación de simvastatina y atorvastatina en varios campos de aplicación y contemplando la interconversión entre las formas ácidas y lactónicas de las estatinas, concluyeron que la LC-MS/MS se posiciona como el método de elección para los análisis en mención debido a su alta selectividad y sensibilidad.
A pesar de ser la cromatografía HPLC con diferentes detectores la técnica por excelencia empleada para la determinación de estatinas en distintas matrices, también hay reportes relacionados con el empleo de otras técnicas. Tharpa et al., 2009 (29), usaron titulaciones indirectas con mezclas de bromato-bromuro en medio ácido como agentes bromadores y tiocianato de hierro (III) como agente auxiliar, para la determinación de simvastatina en medicamentos comerciales. Este método tiene las ventajas de ser exacto y preciso, además de estar libre de las interferencias comúnmente encontradas en los excipientes de las tabletas. Asimismo, en este artículo mencionan diversas técnicas espectrofotométricas, resaltando que su investigación es la primera en reportar el uso de una titulación. Hacen alusión al empleo de la reducción por la simvastatina de hierro (III) a hierro (II) y la subsecuente formación de azul de Prusia con ferricianuro, que es determinado a 730 nm. Igualmente, mencionan la opción de quelatar el hierro (II) formado con 1,10-fenantrolina o 2,2'-bipiridina y medir el producto formado a 480 ó 490 nm. Finalmente, haciendo alusión al estudio de Vijaya et al., emplearon la formación de un color amarillo por la unión de simvastatina con nitrato férrico en ácido nítrico concentrado.
Con respecto a la identificación de las estatinas, la mayoría de las técnicas que se encuentran reportadas emplean detectores UV o DAD, debido a que ellas presentan un espectro de absorción característico con un máximo en 237 nm y dos hombros en 227 nm y 243 nm, generados por el anillo hexahidronaftaleno de las estatinas tipo I. La identificación generalmente se hace por comparación de los tiempos de retención con patrones ya reportados, como en el estudio de Yong-Guo et al., 2004 (30), quienes identificaron 14 estatinas en el arroz rojo fermentado utilizando para su separación y posterior identificación HPLC-DAD y MS. En la figura 3 está el perfil por HPLC-DAD para el extracto etanólico del arroz rojo fermentado.
Millership et al., 2001 (31), resaltan la importancia de tener cuidado con los casos específicos en donde la determinación de las estatinas se realiza en medicamentos de uso comercial, debido a la posible presencia de algunos excipientes que interfieren cuando se emplean medidas directas de absorbancia como ocurre con el ácido ascórbico. Los autores emplearon espectroscopia de derivadas para eliminar ese problema con excelentes resultados.
En lo referente al desarrollo de métodos para la identificación simultánea de las estatinas tipo I y II existen pocas investigaciones. Pasha et al., 2006 (32), determinaron lovastatina, simvastatina, pravastatina, atorvastatina y rosuvastatina en formulaciones farmacéuticas y en estudios in vitro usando LC-UV en un tiempo de 36 min. Gomes et al., 2009 (33), reportaron la validación de un método por HPLCUV con arreglo de diodos para determinar pravastatina, atorvastatina, rosuvastatina y fluvastatina en productos farmacéuticos con tiempos no mayores a 5 min, pero en corridas cromatográficas distintas. Los autores se enfocaron en que los métodos fueran específicos para determinaciones cuantitativas en presencia de los productos de degradación respectivos para cada medicamento. Al año siguiente Damic et al., 2010 (22), desarrollaron un método para la determinación de lovastatina, simvastatina, pravastatina, atorvastatina, fluvastatina y rosuvastatina en una sola corrida utilizando cromatografía capilar electrocinética miceliar (MEKC) con excelentes resultados en términos de separación y con un tiempo de análisis inferior a los 5 min. La tabla 2 presenta, a manera de ejemplo, algunos de los métodos de extracción y separación empleados actualmente.
BIOSÍNTESIS
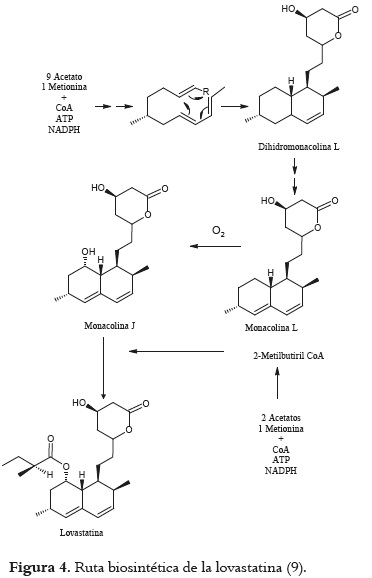
Las primeras investigaciones efectuadas sobre la biogénesis de las estatinas se enfocaron en las monacolinas J y L mediante el empleo de 14C marcado y cepas de Monascus ruber, sugiriendo que estos compuestos son precursores de la lovastatina y pueden estar clasificados como intermediarios en su biosíntesis. Desde una visión general estos trabajos permitieron demostrar que la monacolina L es la primera estatina sintetizada a partir de nueve unidades acetato y, posteriormente, convertida a monacolina J por una reacción de hidroxilación. Asimismo la monacolina K se derivada de la monacolina J.
La monacolina X, el derivado α-metil-β- cetobutiril éster de la monacolina J, es convertida a lovastatina, mientras que ésta es acumulada en los cultivos de cepas mutantes produciendo cantidades no detectables de lovastatina (9).
Otros estudios han demostrado que la lovastatina L es el precursor de la lovastatina J a través de la acción de un sistema monooxigenasa que envuelve al citocromo P-450, presente en los extractos libres de células de M. ruber. Experimentos posteriores, empleando los extractos libres de células del Monascus y células vivas de Paecilomyces viridis, muestran la transformación de monacolina J a lovastatina. Por otra parte, una combinación de técnicas físicas indican una conversión de la monacolina J en monacolina L, vía un paso que es muy distinto de la síntesis de lovastatina (considerado el α-metilbutirilester de la monacolina J) (9).
Con respecto a las investigaciones específicas sobre la biogénesis de lovastatina, fueron realizadas en cepas de Aspergillus terreus empleando precursores marcados, arrojando como resultado que los pasos biosintéticos inician desde unidades acetato (de 4 y 8C ) enlazadas las unas a las otras en modo cabeza cola para formar dos cadenas policétidas. El grupo metilo presente en la cadena lateral o en el C6 de algunas estatinas deriva de la metionina, como ocurre frecuentemente en el metabolismo fúngico, y se inserta en la estructura antes del cierre de los anillos. Este mecanismo demuestra que la mevastatina, la cual carece del grupo 6α-metilo en C6, no es un intermediario en la biosíntesis de la lovastatina. La cadena lateral más grande es entonces ciclada y en ciertas estatinas esterificadas por una cadena lateral en C8. Los átomos de oxigeno presentes en la cadena lateral son insertados, posteriormente, por una oxidación aeróbica usando un precursor deoxigenado. Estudios sobre la incorporación de 13C en la lovastatina y la simvastatina hechos sobre cepas de Penicillium citrinum y Monascus ruber, indicaron una ruta similar, la hidroxilación enzimática y la subsecuente esterificación en C8 también fueron observadas. En la figura 4 está esquematizada la ruta biosintética de la lovastatina (9).
Investigaciones más recientes se han centrado en el estudio de la cinética enzimática en conjunto con la regulación y la expresión genética implicada en la biosíntesis de estatinas en A. terreus. El primer trabajo estudió el mecanismo involucrado en la biosíntesis de lovastatina, particularmente en lo referente a las dos cadenas policétidas. Los resultados incluyen la caracterización de mutantes lov bloqueados en A. terreus mostrando que el sistema sintasa policétido multifuncional (PKSs) comprende una lovastatina nonacétido sintasa (LNKs) involucrada en la ciclación de la principal cadena policétida, para formar el anillo hexahidronaftaleno, y una dicetidosintasa (LDKs) envuelta en la transferencia de la cadena lateral metilbutiril a la monacolina J. Estudios de la estructura primaria de la PKS que forma el nonacétido de la lovastatina han provisto nuevos detalles de su biosíntesis. La caracterización del gen LNKs fue de fundamental importancia para entender cómo los esqueletos carbonados de la dihidromonacolina L y la lovastatina se ensamblan. La LNKs, producida por el gen lovB, interactúa con lovC (un enoil reductasa putativo), para catalizar las reacciones en la primera parte de la biosíntesis, que conduce a la dihidromonacolina L.
En el paso final la LDKs, hecha por lovF, interactúa con lovD (enzima transesterasa) que cataliza la fijación del ácido 2-metilbutirico en la monacolina J, derivada desde la monacolina L. Asimismo, se ha dilucidado las principales características de los genes que codifican estas enzimas y los factores reguladores en la producción de lovastatina en A. terreus. Una reacción intramolecular Diels-Alder endo cierra el nonacétido para formar un sistema bicíclico con la misma estereoquímica del anillo de la dihidromonacolina L, catalizada por LNKs purificada de A. nidulans. Finalmente, en una cepa de A terreus, se investigó los pasos post-PKS envueltos en la biosíntesis de lovastatina, en la cual el gen lovC se interrumpe. Estos resultados demuestran que el papel de la proteína lovC es asegurar el correcto ensamblaje de la cadena nonacétida en la lovastatina por la proteína lovB. En contraste, la construcción de cadena lateral metilbutiril por la LDKs (proteína lovF) no requiere la proteína lovC. El estudio también demostró que la proteína lovC no tiene ninguna función detectable en el proceso post-PKS de la dihidromonacolina L (9). En la figura 5 aparecen los grupos de genes involucrados en la biosíntesis de la lovastatina.
En conclusión, los recientes avances en la clonación de genes han contribuido a la identificación de muchas de las enzimas envueltas en la biosíntesis de lovastatina y han confirmado los pasos biosintéticos hipotetizados en las primeras investigaciones (9).
Además de lo anterior se ha determinado que hay una asociación entre la producción de lovastatina y el crecimiento de Aspergillus terreus, al igual que un efecto inhibidor del nitrógeno orgánico sobre la biosíntesis de la estatina (58). Bizukojc et al., 2007 (59), estudiaron el impacto de suplementar el medio de cultivo de A. terreus con vitaminas del grupo B para determinar su efecto sobre la biosíntesis de la forma ácida de la lovastatina. Los investigadores postulan la idea de que como la biosíntesis de lovastatina requiere cantidades importantes de coenzimas en las células, la aplicación de sus precursores en la forma de vitaminas del grupo B podría influenciar positivamente el proceso. Encontraron que en un medio deficiente de nitrógeno, el grupo de vitaminas B, especialmente la nicotinamida, piridoxina y Dpantotenato de calcio, así como una mezcla de ellas con tiamina y riboflavina, aumentan la eficiencia de la biosíntesis de lovastatina. Barrios-González et al., 2010 (60), publicaron una revisión relacionada con la producción biotecnológica y las aplicaciones de las estatinas, en donde se realiza una descripción muy completa de la biosíntesis de la lovastatina y la compactina, especialmente enfocada hacia aspectos bioquímicos y genéticos relacionados con el proceso biosintético.
FARMACOLOGÍA
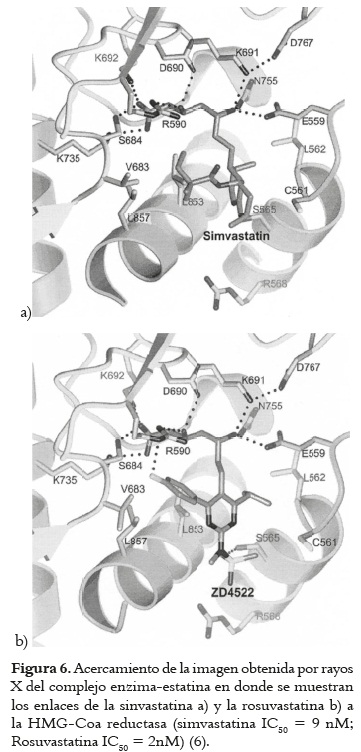
Todos los inhibidores de la HMG-CoA reductasa funcionan similarmente, por medio de enlaces al sitio activo de la enzima inhibiendo sus funciones. Sus diferencias estructurales están relacionadas con la potencia de inhibición de la enzima. Las estatinas comparten un componente estructural que es muy similar a la porción HMG de la HMG-CoA y todas difieren de ella en que son más voluminosas y más hidrofóbicas. La porción afín con HMG está covalentemente enlazada a un grupo hidrofóbico rígido, el cual va desde muy hidrofóbico (cerivastatina) hasta uno parcialmente hidrofóbico (rosuvastatina). En la figura 6 que corresponde a una ampliación de la imagen por rayos X del complejo enzima estatina reportado por Istvan, 2003 (6), se resalta las diferencias entre la rosuvastatina clasificada como de tipo II (estatinas sintéticas) y la simvastatina correspondiente al tipo I (estatinas naturales).
Al comparar las potencias inhibitorias de las dos por sus IC50 se evidencia claramente que la rosuvastatina, al tener un mayor número de interacciones con la enzima, presenta una mayor potencia. En la misma figura las líneas punteadas muestran las interacciones entre la porción afín de las estatinas con la porción HMG de la enzima y se evidencia que éstas son predominantemente iónicas o polares.
Para el caso de las estatinas tipo I hay envueltos numerosos enlaces de hidrogeno, así como interacciones del anillo de la decalina con una hélice de la enzima. En contraste, los grupos metiletil de los inhibidores de tipo II reemplazan funcionalmente el anillo de la decalina y tienen una interacción enlazante adicional entre los grupos fluorofenil y un residuo de la HMG-CoA reductasa. Además de estas interacciones la rosuvastatina y la atorvastatina tienen un puente de hidrogeno con el residuo Ser565 de la enzima, envolviendo un átomo de oxígeno sulfona (SO2R2) en el caso de la rosuvastatina y un átomo de oxígeno de un carbonilo en el caso de la atorvastatina (6).
FARMACOCINÉTICA DE LAS ESTATINAS
Cualquier medicamento en general luego de ser consumido por el paciente atraviesa por el proceso de absorción, distribución por los distintos órganos, sistemas o espacios corporales, modificación por procesos químicos y finalmente expulsión.
Absorción
Todas las estatinas son absorbidas rápidamente luego de su administración, alcanzando las concentraciones máximas plasmáticas a las 4 h (61). Con excepción de la lovastatina y la simvastatina, las cuales son administradas en forma lactónica como prodrogas y deben ser hidrolizadas in vivo a la correspondiente forma β-hidroxiácida para tener actividad farmacológica, todas las estatinas son administradas como la forma activa que es la β-hidroxiácida. La ingesta de alimentos tiene efectos variables en la absorción de las estatinas, la cual disminuye la biodisponibilidad para la fluvastatina, pravastatina y atorvastatina. Sin embargo, el efecto hipocolesterolémico no difiere cuando se toma con la cena o antes de acostarse. El tiempo de vida media en el plasma es de 2 a 3 horas para todas las estatinas exceptuando la atorvastatina, que está en el rango entre 14 a 20 horas, por lo que se puede acumular en el plasma, alcanzando un estado estacionario de concentración después de dosis múltiples (15, 61).
Distribución
Excepto la pravastatina todas las estatinas se enlazan fuertemente a las proteínas del plasma (principalmente albúmina); por lo tanto, la exposición sistémica a restos de drogas activas no enlazadas es extremadamente baja. Adicionalmente, ya que las estatinas son altamente captadas por el hígado, las interacciones por desplazamiento son también limitadas.
Como resultado del bajo enlazamiento de la pravastatina a las proteínas, la proporción de esta que no está enlazada es 10 veces mayor que la de cualquier otra estatina; sin embargo, generalmente, la amplia distribución tisular es prevenida por las altas propiedades hidrofilicas de la pravastatina (15).
Metabolismo
Todas las estatinas son metabolizadas por el citocromo P450 (CYP450) y las enzimas (CYP3A4, CYP2C9, CYP2D6, CYP1A2) presentes en el hígado y en el intestino. La pravastatina tiene múltiples pasos metabólicos, por lo tanto decrece la posibilidad de cualquier interacción del medicamento con la enzima CYP-2C9. La fluvastatina es predominantemente metabolizada por el citocromo CYP-2C9 y también por CYP-3A4 y CYP-2C8, y el uso de inhibidores CYP-2C9 es raro. La cerivastatina y atorvastatina son metabolizados en parte por CYP-C3A4, pero si el citocromo está inhibido, podrá ser eliminado por la vía de otros pasos metabólicos con la disminución en la velocidad de degradación. La simvastatina y la lovastatina son exclusivamente dependientes de CYP 3A4 (15). Los metabolitos activos de la atorvastatina extienden su efecto sobre la HMGCoA reductasa resultando en tiempos de vida media de 20-30h (61).
Excreción
Con excepción de la pravastatina todas las estatinas y sus metabolitos son excretados a través de la bilis en las heces después de su metabolismo por el hígado. En consecuencia, la disfunción hepática es un factor de riesgo de miopatía inducida por estatinas y por ende los productores recomiendan tener precaución cuando prescriben estatinas a pacientes con un historial de enfermedades hepáticas (61). La cantidad de estatinas excretadas en la orina es mínima, excepto la pravastatina la cual está cerca del 20% (15). La pravastatina es eliminada tanto por el riñón como por el hígado principalmente como el fármaco sin alterar. La rosuvastatina también se elimina, en gran parte sin cambios, tanto por el riñón como por el hígado y sus propiedades farmacocinéticas no se alteran en los pacientes con insuficiencia renal leve a moderada (61).
Toxicología
Las propiedades farmacológicas importantes de las estatinas han conllevado a un estudio muy profundo de sus características y por consiguiente de su toxicidad. En agosto del 2001 se reportó que la cerivastatina causaba varias miopatías y rabdomiolisis con una inesperada alta frecuencia comparada con otras estatinas de igual o mayor eficiencia, razón por la que fue retirada del mercado (62).
Muchos de los inhibidores de la HMG-CoA reductasa son metabolizados por el hígado. El daño a este órgano es evaluado por un persistente nivel elevado de sus transaminasas, aspartato amino transferasa (ATS) y alanino amino transferasa (ALT). El tratamiento con estatinas comúnmente lleva a un pequeño aumento de ALT. Los niveles de ALT tres veces más altos del límite normal indican en el paciente una potencial disfunción hepática (ictericia colestásica). Más del 5% de los pacientes han mostrado un leve aumento en ATS y ALT a las seis semanas de haber iniciado terapia. La elevación de las transaminasas por encima de los umbrales tóxicos están presentes en 1-2% de los pacientes con tratamiento de estatinas, y los síntomas clínicos dependen de los pacientes. Adicionalmente, la frecuencia de elevación persistente de las transaminasas es consistente con todas las estatinas comercializadas y en dosis dependiente (15). Con la información que en la actualidad está disponible con respecto a la toxicidad de las estatinas en mamíferos, no hay evidencia relativa a un efecto carcinogénico, mutagénico ni tóxico para su reproducción, ni efectos endocrinos, por lo que no pueden ser clasificadas como sustancias con toxicidad potencial crónica de acuerdo a los criterios establecidos en EUA (27).
En la tabla 3 se encuentran resumidas las propiedades farmacocinéticas de las estatinas.
CONCLUSIONES
Las estatinas, policétidos con variadas acciones biológicas y estructuras químicas diferentes dependiendo de su procedencia comparten un componente estructural que es muy similar a la porción HMG de la HMG-CoA, lo que les permite que actúen como hipocolesterolémicas por inhibición de la HMG-CoA reductasa. La identificación de las estatinas en formulaciones farmacéuticas y en matrices biológicas requiere de diferentes procedimientos experimentales que incluyen para su extracción LLE, SPE y SOE, siendo esta última la de más amplio empleo. Dentro de las técnicas de separación se emplean HPLC y CG, donde la primera de ellas es la más empleada, prevaleciendo la utilización de separaciones en fase reversa y el uso de detectores UV y DAD, aunque existen técnicas de aplicación más restringida como las titulaciones indirectas y la espectrometría de masas séxtuple (MS1-MS6). En cuanto a su farmacocinética, todas las estatinas se absorben rápidamente, con un tiempo de vida media en el plasma entre 2 a 3 horas, exceptuando la atorvastatina. Su efecto hipocolesterolémico no difiere cuando son tomadas con la cena o antes de acostarse. Estudios de su toxicidad en mamíferos han demostrado que no hay evidencia de efecto carcinogénico, mutagénico ni tóxico.
AGRADECIMIENTOS
Los autores agradecen tanto a la División de Investigación de la sede Bogotá de la Universidad Nacional de Colombia, como al CODI, Convocatoria Estrategia de sostenibilidad 2013-2014 de la Universidad de Antioquia, por la financiación para la elaboración de esta revisión.
REFERENCIAS BIBLIOGRÁFICAS
1. Liao JK, Laufs U. Pleiotropic effects of statins. Annu Rev Pharmacol. 2005 Aug; 45: 89-118. [ Links ]
2. Almuti K, Rimawi R, Spevack D, Ostfeld RJ. Effects of statins beyond lipid lowering: Potential for clinical benefits. Int J Cardiol. 2006 Apr; 109 (1): 7-15. [ Links ]
3. Moore RN, Bigam G, Chan JK, Hogg AM, Nakashima TT, Vederas JC. Biosynthesis of the Hypocholesterolemic Agent Mevinolin by Aspergillus terreus. Determination of the Origin of Carbon, Hydrogen, and Oxygen Atoms by 13C NMR and Mass Spectrometry. J Am Chem Soc. 1985 Jun; 107 (12): 3694-3701. [ Links ]
4. Gunde-Cimerman N, Friedrich J, Cimerman A, Benicki N. Screening fungi for the production of an inhibitor of HMG CoA reductase: production of mevinolin by the fungi of the genus Pleurotus. FEMS Microbiol Lett. 1993 Aug; 111 (2-3): 203-206. [ Links ]
5. Endres M. Statins: Potential new indications in inflammatory conditions. Atheroscler Suppl. 2006 Apr; 7 (1): 31-35. [ Links ]
6. Istvan E. Statin inhibition of HMG-CoA reductase: a 3-dimensional view. Atheroscler Suppl. 2003 Mar; 4 (1): 3-8. [ Links ]
7. Martín J, Buchberger W, Alonso E, Himmelsbach M, Aparicio I. Comparison of different extraction methods for the determination of statin drugs in wastewater and river water by HPLC/QTOF- MS. Talanta. 2011 Jul; 85 (1): 607-615. [ Links ]
8. Nirogi R, Mudigonda K, Kandikere V. Chromatography–mass spectrometry methods for the quantitation of statins in biological samples. J Pharm Biomed Anal. 2007 Jun; 44 (2): 379-387. [ Links ]
9. Manzoni M, Rollini M. Biosynthesis and biotechnological production of statins by filamentous fungi and application of these cholesterol-lowering drugs. Appl Microbiol Biot. 2002 Apr; 58 (5): 555-564. [ Links ]
10. Kim HJ, Lee I-S, Kang SS. Cholesterol biosynthesis inhibitors of microbial origin. Studies in Nat Prod Chem. 2006; 33: 751-784. [ Links ]
11. Endo A, Hasumi K, Nakamura T, Kunishima M, Masuda M. Dihydromonacolin L and monacolin X, new metabolites those inhibit cholesterol biosynthesis. J Antibiot. 1985 Jul; 38 (3): 321- 328. [ Links ]
12. Dhale MA, Divakar S, Kumar SU, Vijayalakshmi G. Isolation and characterization of dihydromonacolin-MV from Monascus purpureus for antioxidant properties. Appl Microbiol Biot. 2007 Oct; 73 (5): 1197-1202. [ Links ]
13. Zhuge B, Fang HY, Yu H, Rao ZM, Shen W, Song J, et al. Bioconversion of lovastatin to a novel statin by Amycolatopsis sp. Appl Microbiol Biot. 2008 Mar; 79 (2): 209-216. [ Links ]
14. Masana L. Pitavastatin – from clinical trials to clinical practice. Atheroscler Suppl. 2010 Dec; 11 (3): 15-22. [ Links ]
15. R.Veillard N, Mach F. Review Statins: the new aspirin? Cell Mol Life Sci. 2002 Sep; 59 (11): 1771-1786. [ Links ]
16. Jia C-Y, Yin Q-X, Gong J-B, Wang J-K. Solubility of Form A Pravastatin Sodium in Aqueous 2-Propanol Mixtures. J Chem Eng Data. 2009 Dec; 54 (1): 154-156. [ Links ]
17. Nti-Gyabaah J, Chiew YC. Solubility of Lovastatin in Ethyl Acetate, Propyl Acetate, Isopropyl Acetate, Butyl Acetate, sec-Butyl Acetate, Isobutyl Acetate, tert-Butyl Acetate, and 2-Butanone, between (285 and 313) K. J Chem Eng Data. 2008 Aug; 53 (9): 2060-2065. [ Links ]
18. Eksangsri T, Habaki H, Kawasaki J. Extraction of compactin (ML-236B): equilibrium distribution in water ethyl acetate system. Chem Eng Process. 2004 Dec; 43 (10): 1203-1210. [ Links ]
19. Lee C-L, Hung H-K, Wang J-J, Pan T-M. Improving the Ratio of Monacolin K to Citrinin Production of Monascus purpureus NTU 568 under Dioscorea Medium through the Mediation of pH Value and Ethanol Addition. J Agric Food Chem. 2007 Jul; 55 (16): 6493-6502. [ Links ]
20. Erturk S, Onal A, Cetin SM. Analytical methods for the quantitative determination of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors in biological samples. J Chromatogr B. 2003 Apr; 793 (2): 193-205. [ Links ]
21. Pansuriya RC, Singhal RS. Supercritical Fluid Extraction of Lovastatin from the Wheat Bran Obtained after Solid-State Fermentation. Food Technol Biotech. 2009 Jul; 47 (2): 159-165. [ Links ]
22. Damic M, Nigovic B. Fast Analysis of Statins in Pharmaceuticals by MEKC. Chromatographia. 2010 Dec; 71 (3-4): 233-242. [ Links ]
23. Nigovi B, Vegar I. Capillary Electrophoresis Determination of Pravastatin and Separation of Its Degradation Products. Croat Chem Acta. 2008 Mar; 81 (4): 615-622. [ Links ]
24. Kocijan A, Grahek R, Bastarda A, Kralj LZ. Fast analysis of pravastatin in production media. J Chromatogr B Analyt Technol Biomed Life Sci. 2005 Jun; 822 (1-2): 311-315. [ Links ]
25. Yuan H, Wang F, Tu J, Peng W, Li H. Determination of lovastatin in human plasma by ultra-performance liquid chromatography– electrospray ionization tandem mass spectrometry and its application in a pharmacokinetic study. J Pharm Biomed Anal. 2008 Dec; 46 (4): 808-813. [ Links ]
26. Jun-Jun H, Bi-Yun H, Hong J, Mu Y. Mass Spectrum Characterization of Monacolin J (MS1-MS6). J Chin Mass Spec Soc. 2009; 30 (3): 154-159. [ Links ]
27. Hernando MD, Agüera A, Fernández-Alba AR. LC-MS analysis and environmental risk of lipid regulators. Anal Bioanal Chem. 2007 Sep; 387 (4): 1269-1285. [ Links ]
28. Novakova L, Satinsky D, Solich P. HPLC methods for the determination of simvastatin and atorvastatin. Trac-Trend Anal Chem. 2008 Apr; 27 (4): 352-368. [ Links ]
29. Tharpa K, Basavaiah K. Bromatometric Assay of Simvastatin in Pharmaceuticals. J Anal Chem+. 2009 Mar; 64 (11): 1193-1198. [ Links ]
30. Li Y-G, Zhang F, Wang Z-T, Hu Z-B. Identification and chemical profiling of monacolins in red yeast rice using high-performance liquid chromatography with photodiode array detector and mass spectrometry. J Pharmaceut Biomed. 2004 Jun; 35 (5): 1101-1112. [ Links ]
31. Millership JS, Chin J. Determination of Simvastatin in Tablet Formulations by Derivative UV Spectrophotometry. J Anal Chem. 2010 Jun; 65 (2): 164-168. [ Links ]
32. Pasha K, Muzeeb S, Basha SJS, Shashikumar D, Mullangi R, Srinivas NR. Analysis of five HMG-CoA reductase inhibitorsatorvastatin, lovastatin, pravastatin, rosuvastatin and simvastatin: pharmacological, pharmacokinetic and analytical overview and development of a new method for use in pharmaceutical formulations analysis and in vitro metabolism studies. Biomed Chromatogr. 2006 Jun; 20 (3): 282-293. [ Links ]
33. Gomes FP, García PL, Alves JMP, Singh AK, Kedor-Hackmann ERM, Santoro MIRM. Development and Validation of Stability- Indicating HPLC Methods for Quantitative Determination of Pravastatin, Fluvastatin, Atorvastatin, and Rosuvastatin in Pharmaceuticals. Anal Lett. 2009 Apr; 42: 1784-1804. [ Links ]
34. Gunde-Cimerman N, Plemenita A, Cimerman A. A hydroxymethylglutaryl- CoA reductase inhibitor synthesized by yeasts. FEMS Microbiol Lett. 1995 Jul; 132 (1-2): 39-43. [ Links ]
35. Manzoni M, Rollini M, Bergomi S, Cavazzoni V. Production and purification of statins from Aspergillus terreus strains. Biotechnol Tech. 1998 Jul; 12 (7): 529-532. [ Links ]
36. Manzoni M, Bergomi S, Rollini M, Cavazzoni V. Production of statins by filamentous fungi. Biotechnol Lett. 1999 Feb; 21 (3): 253-257. [ Links ]
37. Ye LY, Firby PS, Moore MJ. Determination of Lovastatin in Human Plasma Using Reverse-Phase High-Performance Liquid Chromatography With UV Detection. Ther Drug Monit. 2000 Aug; 22 (6): 737-741. [ Links ]
38. Chang Y-N, Huang J-C, Lee C-C, Shih I-L, Tzeng Y-M. Use of response surface methodology to optimize culture medium for production of lovastatin by Monascus ruber. Enzyme Microb Tech. 2002 Jan; 30 (7): 889-894. [ Links ]
39. López JLC, Pérez JAS, Sevilla JMF, Fernández FGA, Grima EM, Chisti Y. Production of lovastatin by Aspergillus terreus: effects of the C:N ratio and the principal nutrients on growth and metabolite production. Enzyme Microb Tech. 2003 May; 33 (2-3): 270-277. [ Links ]
40. Rajh SJ, Kreft S, Strukelj B, Vrecer F. Comparison of CE and HPLC Methods for Determining Lovastatin and Its Oxidation Products after Exposure to an Oxidative Atmosphere. Croat Chem Acta. 2003 May; 76 (3): 263-268. [ Links ]
41. Miao X-S, Metcalfe CD. Determination of cholesterol-lowering statin drugs in aqueous samples using liquid chromatography– electrospray ionization tandem mass spectrometry. J Chromatogr A. 2003 Apr; 998 (1-2): 133-141. [ Links ]
42. Alarcón J, Águila S. Lovastatin production by Pleurotus ostreatus: effects of the C:N ratio. Z Naturforsch C. 2006 Jan-Feb; 61 (1-2): 95-98. [ Links ]
43. Alarcón J, Águila S, Arancibia-Avila P, Fuentes O, Zamorano- Ponce E, Hernández M. Production and Purification of Statins from Pleurotus ostreatus (Basidiomycetes) Strains. Z Naturforsch C. 2003 Jan-Feb; 58 (1-2): 62-64. [ Links ]
44. Meyyanathan S, Ramasarma G, Suresh B. Análisis de la simvastatina en preparaciones farmacéuticas mediante cromatografía de capa fina de alto rendimiento. Ars Pharm. 2004; 45 (2): 121-129. [ Links ]
45. Chen F, Hu X. Study on red fermented rice with high concentration of monacolin K and low concentration of citrinin. Int J Food Microbiol. 2005 Mar; 103 (3): 331- 337. [ Links ]
46. Xu B-J, Wang Q-J, Jia X-Q, Sung C-K. Enhanced lovastatin production by solid state fermentation of Monascus ruber. Bioprocess Biosyst Eng. 2005; 10 (1): 78-84. [ Links ]
47. Lai L-ST, Tsai T-H, Wang TC, Cheng T-Y. The influence of culturing environments on lovastatin production by Aspergillus terreus in submerged cultures. Enzyme Microb Tech. 2005 Apr; 36 (5-6): 737-748. [ Links ]
48. Barrett B, Huclová J, Borek-Dohalský V, Nemec B, Jelínek I. Validated HPLC-MS/MS method for simultaneous determination of simvastatin and simvastatin hydroxy acid in human plasma. J Pharm Biomed Anal. 2003 May; 32 (3): 517-526. [ Links ]
49. Valera HR, Gomes J, Lakshmi, Gururaja R, Suryanarayan S, Kumar D. Lovastatin production by solid state fermentation using Aspergillus flavipes. Enzyme Microb Tech. 2005 Oct; 37 (5): 521-526. [ Links ]
50. Bauer S, Mwinyi J, Stoeckle A, Gerloff T, Roots I. Quantification of pravastatin in human plasma and urine after solid phase extraction using High Performance Liquid Chromatography with ultraviolet detection. J Chromatogr B Analyt Technol Biomed Life Sci. 2005 Apr; 818 (2): 257-262. [ Links ]
51. Yang D-J, Hwang LS. Study on the conversion of three natural statins from lactone forms to their corresponding hydroxy acid forms and their determination in Pu-Erh tea. J Chromatogr A. 2006 Jun; 1119 (1-2): 277-284. [ Links ]
52. Porcel ER, López JLC, Ferrón MAV, Pérez JAS, Sánchez JLG, Chisti Y. Effects of the sporulation conditions on the lovastatin production by Aspergillus terreus. Bioprocess Biosyst Eng. 2006 Jun; 29 (1): 1-5. [ Links ]
53. Bizukojc M, Ledakowicz S. A macrokinetic modelling of the biosynthesis of lovastatin by Aspergillus terreus. J Biotechnol. 2007 Jul; 130 (4): 422-435. [ Links ]
54. Shaligram NS, Singh SK, Singhal RS, Szakacs G, Pandey A. Compactin production in solid-state fermentation using orthogonal array method by P. brevicompactum. Biochem Eng J. 2008 Oct; 41 (3): 295-300. [ Links ]
55. Shen-Tu J, Xu X, Liu J, Hu X, Chen J, Wu L, et al. Determination of Pitavastatin in Human Plasma by LC–MS–MS. Chromatographia. 2009 May; 69 (9-10): 1041-1047. [ Links ]
56. Chairote E-O, Lumyong S, Chairote G. Study on cholesterol lowering compounds in red yeast rice prepared from thai glutinous rice. As. J Food Ag-Ind. 2010; 3 (2): 217-228. [ Links ]
57. Piecha M, Sarakha M, Trebse P, Kocar D. Stability studies of cholesterol lowering statin drugs in aqueous samples using HPLC and LC–MS. Environ Chem Lett. 2010; 8 (2): 185-191. [ Links ]
58. Bizukojc M, Ledakowicz S. Simultaneous biosynthesis of (+)-geodin by a lovastatin-producing fungus Aspergillus terreus. J Biotechnol. 2007 Jul; 132 (4): 453-460. [ Links ]
59. Bizukojc M, Pawlowska B, Ledakowicz S. Supplementation of the cultivation media with B-group vitamins enhances lovastatin biosynthesis by Aspergillus terreus. J Biotechnol. 2007 Jan; 127 (2): 258-268. [ Links ]
60. Barrios-González J, Miranda RU. Biotechnological production and applications of statins. Appl Microbiol Biotechnol. 2010 Oct; 85 (4): 869-883. [ Links ]
61. Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: an update. Fundam Clin Pharmacol. 2004 Aug; 19 (1): 117-125. [ Links ]
62. Gelissen IC, Browmn AJ. Drug targets beyond HMG-CoA reductase: Why venture beyond the statins?. Front Biology. 2011 Jan; 6 (3): 197-205. [ Links ]