Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Vitae
Print version ISSN 0121-4004
Vitae vol.21 no.2 Medellín May/Aug. 2014
REVISIONES ESTRUCTURADAS
EL ÁRBOL TROPICAL Calophyllum brasiliense: UNA REVISIÓN BOTÁNICA, QUÍMICA Y FARMACOLÓGICA
THE TROPICAL TREE Calophyllum brasiliense: A BOTANICAL, CHEMICAL AND PHARMACOLOGICAL REVIEW
Julio César GARCÍA-ZEBADÚA 1,2, Ricardo REYES-CHILPA2*, Maira HUERTA-REYES3, Jorge Iván CASTILLO-ARELLANO2, Sandra SANTILLÁN-HERNÁNDEZ2, Beatriz VÁZQUEZ-ASTUDILLO2, José Alberto MENDOZA-ESPINOZA4
1 Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México. México D.F., México.
2 Instituto de Química, Universidad Nacional Autónoma de México. México D.F., México.
3 Unidad de Investigación en Farmacología, Hospital de Especialidades. Instituto Mexicano del Seguro Social. México D.F., México.
4 Plantel Casa Libertad. Universidad Autónoma de la Ciudad de México. México D.F., México.
* Autor a quien se debe dirigir la correspondencia: chilpa@unam.mx.
Recibido: Julio 11 de 2013
Aceptado: Abril 09 de 2014
RESUMEN
Antecedentes: Calophyllum brasiliense Cambess. Es un árbol de la familia Calophyllaceae, separada recientemente de Clusiaceae (Guttiferae). Se distribuye ampliamente en selvas tropicales lluviosas del continente americano, desde Brasil hasta México. Esta especie sintetiza diversos metabolitos secundarios en hojas, flores, frutos, corteza y raíz, tales como cumarinas, cromanonas, xantonas, terpenos, flavonoides y compuestos fenólicos, los cuales presentan múltiples propiedades biológicas. Objetivos: Ofrecer una visión general de las características botánicas, químicas y farmacológicas de C. brasiliense, así como evidencias químicas, anatómicas y genéticas que sugieren la existencia de quimiotipos (fenotipos químicos) en la especie. Métodos: Se revisó la información disponible en las bases de datos NCBI y SciFinder®, se seleccionaron investigaciones relevantes que permitieron conocer los compuestos químicos aislados y su actividad biológica. Resultados: Entre los compuestos sintetizados por C. brasiliense destacan calanólidos e inofilums, especialmente el (+)-calanólido A, como inhibidores potentes de la enzima transcriptasa reversa del virus de inmunodeficiencia humana tipo 1 (VIH-1) y baja toxicidad a linfocitos humanos. El (+)-calanólido A, una dipiranocumarina tetracíclica, podría ser el primer fármaco de origen natural aprobado por la FDA (EUA) en el tratamiento del VIH/SIDA. Otros compuestos, tales como cumarinas tipo mammea, cromanonas, xantonas y triterpenos, mostraron actividad contra protozoarios, células tumorales humanas, como bactericidas y antiespasmódicos. La actividad más importante de cumarinas tipo mammea es contra protozoarios como Leishmania y Trypanosoma. En relación a L. amazonensis, destacó (-)-mammea A/BB presentando buena actividad y selectividad contra amastigotes y promastigotes, y baja toxicidad en macrófagos humanos. La (-)-mammea A/BA, y las xantonas preniladas mostraron alta citotoxicidad sobre líneas celulares tumorales humanas y T. cruzi. Las evidencias químicas, anatómicas y genéticas indican que existen quimiotipos en C. brasiliense, sugiriendo un proceso de especiación en curso en el taxón. Las secuencias ribosomales (ITS) discriminaron al quimiotipo 1 (produce coumarinas tipo mammea) de los quimiotipos 2 y 3 (biosintetizan calanólidos e inofilums), siendo útiles como posibles códigos de barras. Conclusiones: El adecuado manejo de C. brasiliense mediante técnicas silvícolas y biotecnológicas, así como el conocimiento científico y tecnológico, podrían aportar soluciones a países en desarrollo, por ejemplo mediante producción de fitomedicamentos, a enfermedades como el VIH/ SIDA, Leshmaniasis y la Enfermedad de Chagas.
Palabras clave: Calophyllum brasiliense, cumarinas, VIH/SIDA, Trypanosoma, Leishmania.
ABSTRACT
Rationale: Calophyllum brasiliense Cambess. Is a tree belonging to Calophyllaceae family, recently separated from Clusiaceae (= Guttiferae). This species is widely distributed in the Tropical Rain Forests of the American continent, from Brazil to Mexico. It synthesizes a wide variety of secondary metabolites isolated from leaves, flowers, fruits, bark and roots, such as coumarins, chromanones, xanthones, terpenes, flavonoids and phenolic compounds, which exhibit multiple biological properites. Objective: To provide a comprehensive view of the botanical, chemical and pharmacological characteristics of C. brasiliense, and to present chemical, anatomical and genetic evidences supporting the notion of chemotypes (chemical phenotypes) in this species. Methods: Information available in the databases NCBI and SciFinder® was reviewed, and relevant investigations were selected regarding to chemical compounds isolated and their biological activity. Results: Among compounds synthesized by C. brasiliense, calanolides and inophyllums stand out, specially (+)-calanolide A, since these can inhibit reverse transcriptase of human immunodeficiency virus type 1 (HIV-1). (+)-Calanolide A, a tetracyclic dipyranocoumarin, could be the first drug of natural origin approved by the FDA (US) in the treatment of HIV/AIDS. Other compounds, such as mammea type-coumarins, chromanones, xanthones, and triterpenes showed antitumor, antiparasitic, antibacterial and antispasmodic activity. Most important activity of mammea type-coumarins is against protozoa, such as Leishmania, and Trypanosoma. Regarding to L. amazonensis, (-)-mammea A/BB stands out, being highly potent and selective against amastigotes, and promastigotes, but poorly toxic to human macrophages. (-)-Mammea A/BA as well as prenylated xanthones showed high citotoxicity against human tumor cell lines and T. cruzi. The chemical, anatomical and genetical evidences supported the idea of chemotypes in C. brasiliense, suggesting a current process of speciation in this taxon. The ribosomal ITS sequences discriminate chemotype 1 (produces mammea type coumarins) from chemotypes 2 and 3 (synthesize calanolides and inophyllums) being useful like possible barcodes. Conclusions: The proper management of Calophyllum brasiliense with forestry and biotechnological methods, as well as scientific and technological knowledge, could provide solutions to developing countries, for instance through the production of phytomedicines against HIV/AIDS, and illnesses caused by protozoa such as Leshmaniasis and Chaga's Disease.
Keywords: Calophyllum brasiliense, coumarins, HIV/AIDS, Trypanosoma, Leishmania.
INTRODUCCIÓN
Uno de los géneros botánicos que han despertado gran interés a nivel mundial en los últimos años dentro del área químico-farmacológica-médica es Calophyllum (Calophyllaceae/Clusiaceae/Guttiferae), esto a partir del descubrimiento en especies asiáticas de los calanólidos (1) e inofilums (2), dos tipos de dipiranocumarinas tetracíclicas con la propiedad de inhibir la replicación del virus de inmunodeficiencia humana tipo 1 (VIH-1). El género Calophyllum está compuesto por 187 especies de árboles que se distribuyen en las regiones tropicales del mundo, principalmente en la región indo-pacífica (3). Únicamente ocho especies de Calophyllum se encuentran en el continente americano; en cuanto a diversidad, destacan Cuba con cinco (4) y Colombia con tres (5). La especie Calophyllum brasiliense crece en los bosques lluviosos tropicales y está ampliamente distribuida, desde Sudamérica (Brasil y norte de Argentina) hasta México (3, 6, 7). Varios constituyentes químicos se han aislado de este árbol entre ellos, triterpenos, xantonas, biflavonoides, cromanonas, y cumarinas con propiedades biológicas diversas como antibacterial, antifúngica, antiespasmódica, analgésica, antiúlcera, antineoplásica y antiviral (inhibición de la replicación del VIH-1) (1, 8-27). Las cumarinas son las de mayor relevancia. De las hojas de C. brasiliense se han aislado dipiranocumarinas anti-VIH-1, como el (+)-calanólido A que es un potente inhibidor de la enzima transcriptasa reversa del virus de inmunodeficiencia humana tipo 1 (TR de VIH-1) (19, 20). Este compuesto actualmente se encuentra en la fase clínica II del desarrollo de fármacos y podría ser el primer fármaco de origen natural en ser aprobado por la Administración de Fármacos y Alimentos (FDA EUA) para el tratamiento del VIH/SIDA (28, 29).
La obtención y uso de dipiranocumarinas de C. brasiliense con propiedades anti-TR de VIH-1 permitiría a países latinoamericanos, aprovechar su riqueza natural en la posible solución a un problema de salud complejo como el VIH/SIDA. Aunque el calanólido A ha sido considerado como el compuesto más promisorio entre las dipiranocumarinas, su concentración en las hojas de C. brasiliense es baja (0.001%) y menor que los calanólidos B y C (0.009% y 0.003%, respectivamente) (19) por lo cual, una alternativa sería producir un extracto estandarizado en su contenido de calanólidos. Desde esta perspectiva sería necesario lograr el aprovechamiento sustentable de este recurso fitogenético mediante procedimientos silvícolas para lograr la cosecha sustentable de hojas (30, 31). Por otra parte, para incrementar el rendimiento de los calanólidos, los procedimientos biotecnológicos (cultivo de tejidos, órganos o células in vitro) ha sido la alternativa explorada, logrando un incremento en la producción de calanólidos B y C (3 veces más) en callos de explantes de semillas respecto a los biosintetizados en hojas de plantas de invernadero (32). Un reto adicional es la existencia de fenotipos químicos o quimiotipos (33) en esta especie, debido a que existen poblaciones con diferencias cualitativas en la composición química de las hojas; es decir, no todos los ejemplares de esta especie producen calanólidos antivirales. Desde el punto de vista de la ciencia básica, lo anterior podría reflejar el proceso evolutivo que ocurre en el taxón. Mientras que, desde una perspectiva aplicada implicaría la necesaria elección de material genético para el aprovechamiento sustentable en plantaciones de esta especie.
Sin embargo, a pesar de que existen muchos estudios fitoquímicos y de actividad biológica sobre este árbol, hasta el momento no se cuenta con información sistematizada que reúna aspectos químicos y farmacológicos de la especie. Por lo tanto, con la finalidad de ofrecer una visión integral de los estudios que se han realizado sobre C. brasiliense el objetivo de este trabajo fue presentar una revisión de las características botánicas, los compuestos químicos aislados de diferentes órganos y sus propiedades farmacológicas reportadas en la base de datos de (PubMed) NCBI y SciFinder®, así como las evidencias químicas, anatómicas y genéticas que apoyan la noción de quimiotipos en esta especie. Este trabajo pretende contribuir en la sistematización de la información como base para continuar los estudios químicos y farmacológicos de compuestos y extractos promisorios para el desarrollo de fitomedicamentos.
MÉTODOS
Para la búsqueda de literatura se utilizaron particularmente términos como el nombre a nivel género y especie (Calophyllum/C. brasiliense); así como palabras relacionadas (calanólidos). Las bases de datos empleadas fueron la plataforma de acceso libre PubMed (NCBI) y acceso restringido SciFinder®. Desde 1946 hasta 2012 se obtuvieron 2005 registros, seleccionando aquellos trabajos con aspectos relevantes en química, actividad biológica, farmacología de extractos y compuestos aislados de C. brasiliense disponibles en texto completo y de forma libre. Aquellos tópicos relacionados con anatomía, genética y síntesis orgánica de compuestos aislados de C. brasiliense fueron excluidos por no tratarse a profundidad en esta revisión; así como aquellas investigaciones sobre otras especies del género Calophyllum. Los documentos citados refieren aspectos relacionados a botánica, fitoquímica y farmacología de la especie aquí descrita, las cuales se encuentran en idioma inglés, español, portugués y francés. En la figura 1, se presenta el diagrama de flujo de información.
RESULTADOS
De acuerdo a los criterios de búsqueda e inclusión durante el periodo de consulta en las bases de datos PubMed (NCBI) y SciFinder® (1946 a 2012) se encontraron 2005 documentos relacionados a botánica, química, actividad biológica y farmacología de extractos y compuestos aislados de C. brasiliense (207 en PubMed y 1798 en SciFinder®), de los cuales se incluyeron 80 investigaciones y, por tanto, 1925 registros no fueron incluidos.
Botánica
Historia
Etimológicamente, Calophyllum significa “hoja hermosa” y brasiliense es relativo a Brasil, donde se describió por primera vez (34). Esta especie es conocida popularmente como palo Santa María (México); cedro María (Centroamérica); ocuje (Cuba); barí (República Dominicana); dalemarie (Haití); árbol de aceite (Colombia), jacareuba, guanandi o guarandi (Brasil), balsamaría (Bolivia) y lagarto caspi (Perú), entre otros (27, 34-38). La especie C. brasiliense es compleja, difícil de clasificar y actualmente es el único representante de este género distribuido ampliamente en el continente americano. Los taxónomos experimentan confusión para caracterizarla. La especie fue descrita por primera vez en 1825 por Jacob Cambessèdes, en “Flora Brasiliae Meridionalis” (39). En 1923, Paul C. Standley en su obra “Trees and Shrubs of Mexico” separó los especímenes de C. brasiliense de Sudamérica de los de México y Centroamérica; estos últimos los dividió en dos nuevas especies: Calophyllum rekoi Standl en honor al Dr. Reko colector del espécimen en Oaxaca y C. chiapense Standl colectada en Chiapas (México) (40). Sin embargo, en 1932 tras examinar más especímenes de México, Centroamérica, Sudamérica y las Antillas, integra las especies C. chiapense y C. rekoi reduciendolas a una variedad geográfica de C.brasiliense, nombrando al taxón México-Centroamericano como C. brasiliense var. Rekoi Standl (41). Años después, D'Arcey y Keating (1979), establecen que el taxón México-Centroamericano es una especie y no una variedad de C. brasiliense, por lo cual retoman el nombre original C. rekoi (42). En un estudio más reciente Hammel (2001), reconoce en “Flora de Nicaragua” al taxón México-Centroamericano como C. brasiliense var. rekoi Standl (citado en 40). Actualmente el Missouri Botanical Garden (http://www.tropicos.org) (43) indica la siguiente clasificación taxonómica:
Clase Equisetopsida C. Agardh
Subclase Magnoliidae Novák ex Takht.
Superorden Rosanae Takht.
Orden Malpighiales Juss. ex Bercht. & J. Presl.
Familia Calophyllaceae J. Agardh
Género Calophyllum L.
Especie C. brasiliense Cambess.
Morfología
Calophyllum brasiliense es un árbol de 20 a 30 m (hasta 50 m) de altura y diámetro a la altura del pecho de 40 a 60 cm (hasta 1.8 m) de tronco cilíndrico y recto con ramas ascendentes de copa redondeada, extendida y densa (44-47). La corteza con 10 a 20 mm de grosor esta longitudinalmente fisurada, de color pardo morena a café, laminada, fibrosa, amarga con un exudado lechoso intensamente amarillo; el duramen de color rosa claro a café rojizo (6, 35, 45). Las hojas son coriáceas, decusadas, elípticas u oblongas, simples, opuestas, glabras, con el margen entero, ápice agudo; haz verde oscuro y brillante, envés verde pálido; venas secundarias numerosas y paralelas; láminas de 6x2.5 cm a 14x5.5 cm (6, 45-47). Inflorescencias en forma de panículas axilares, 2 a 5 cm de largo, cada una con 2-10 flores. Las flores son pequeñas, numerosas y blancas, ligeramente perfumadas, actinomórficas, 4 sépalos, crema-amarillos, redondas y cóncavas; dioicas (6, 44-46). Los frutos son drupas de 1 a 3 cm de largo, ovoides o esféricos, verde-amarillos, en la madurez de olor fragante, con el endocarpio duro, y una semilla grande por fruto. El endocarpio contiene fibras que se contraen y arrugan cuando seco (6, 45, 46) contienen semillas esféricas u ovoides de 1 a 2.3 cm de largo y ancho, testa color crema-café, suave, esponjosa de 1 mm de grosor; el embrión es recto de color blanco-amarillas, sin endospermo, ocupando toda la cavidad de la semilla, mide de 1.3 a 1.5 cm (6, 44, 45). En la figura 2, se pueden apreciar las principales características del árbol como son el aspecto de la corteza, forma y coloración de flores, hojas y frutos.
Fenología
El follaje es perennifolio, pero en zonas más secas algunos árboles tiran sus hojas en abril o mayo (44). La floración es anual, aunque la mayor floración en gran parte de su ámbito geográfico tiene lugar de junio a julio. En Centroamérica hay una segunda floración de noviembre a diciembre. En México de julio a diciembre. La polinización es entomófila (37, 46-49). La producción de los frutos es anual y se inicia cuando el árbol tiene aproximadamente 5 años de edad. El período de fructificación ocurre de octubre a diciembre e incluso se pueden encontrar frutos hasta enero. En América Central ocurre una segunda fructificación entre mayo y julio. La diseminación de las semillas se realiza por animales silvestres quienes consumen los frutos, especialmente murciélagos (quiropterocora) y son de tipo recalcitrante (37, 44, 47-49). Además, el índice de germinación es proporcional al contenido de humedad; debido a ello, la germinación varía entre 3 a 8 semanas y es de tipo hipogea, con dos cotiledones carnosos y radícula corta. La germinación varia de 70 a 80% sembradas sin endocarpio; pero con endocarpio quebrado alcanza 95% y con el fruto entero 75% (50).
Distribución y Hábitat
Se distribuye desde el sur de México a través de Centroamérica y las Antillas hasta el norte de Sudamérica. Habita desde cero hasta 1700 msnm, con precipitaciones de 1350 a 4000 mm y temperaturas medias anuales de 20 a 28 °C. Crece en las faldas de pequeñas colinas con suelos aluviales, arcillosos o sílico-arcillosos, muy húmedos o saturados de agua y ácidos (pH 4.5 a 6.0) e incluso en suelos secos. En América Central vive en faldas de colinas costeras; estos suelos son ricos en Fe y Al, pero pobres en K y P. También se encuentra en planicies cercanas a ríos, lagunas y ciénegas, pero su crecimiento es menor (35, 37, 44-49).
Etnobotánica
Algunas partes de la planta son usadas en la medicina tradicional por su actividad en diversas afecciones que incluyen actividad anti-microbiana, enfermedades gastrointestinales, dolor, diabetes, entre otros (23). En Colombia se obtiene un aceite verdoso y de olor fuerte de la corteza de C. brasiliense, C. lucidum y C. mariae. Este aceite se emplea para aplicaciones dermatológicas (curar llagas y heridas) (5). En la medicina popular de Brasil, esta especie es usada frecuentemente para tratamiento de inflamaciones y úlceras (11). La infusión de la corteza se usa en el tratamiento de reumatismo, varices, hemorroides y úlceras (10). También se emplea en afecciones hepáticas, gástricas, dolor, diabetes, hipertensión y herpes (21). En Perú, la población emplea la planta para tratar afecciones virales y tumorales (27). En México, algunas poblaciones emplean el aceite de las semillas para combatir enfermedades cutáneas (5), o la corteza para preparar un té para las parturientas (embarazadas) por nueve días para limpiar la matriz (51). Además el látex es usado por los indígenas Popolucas para tratar el dolor de dientes y prevenir infecciones (52).
Fitoquímica
Los compuestos aislados del árbol tropical C. brasiliense pueden clasificarse estructuralmente en siete grupos principales: compuestos fenólicos simples, triterpenos, esteroles, flavonoides, xantonas, cromanonas y cumarinas.
Compuestos fenólicos simples
Sustancias que presentan un núcleo bencénico soportando un grupo hidroxilo o más. En la figura 3 se presentan compuestos denominados ácidos fenólicos (presentan un grupo aril-carboxílico), ácido gálico [1], ácido protocatechuico [2] (11, 16, 24) y ácido shikímico [3] (15, 24) aislados de las hojas de C. brasiliense. Los dos primeros también presentes en frutos (16), mientras que ácido protocatechuico [2] se ha encontrado en extractos de flores, raíces y tallos (16, 21).
Triterpenos y Esteroles
Los triterpenos son compuestos formados por 30 C, su estructura se origina por fusión de dos cadenas de 15 C (sesquiterpenos) generadas por la unión cabeza-cabeza de unidades de 5 C; mientras que los esteroles presentan de 27 a 29 C. En la figura 4 se muestran las estructuras químicas de triterpenos y esteroles aislados de C. brasiliense, entre ellos compuestos de la familia de los friedelanos, tales como friedelina [4] y canofilol [5] aislados del duramen (8, 14, 22, 53, 54). Además de ellos, en las hojas se ha identificado el β-sitosterol [6] (20, 24, 38). En sus raíces se ha encontrado friedelina [4] y ácido betulínico [7] (15, 16).
Flavonoides
Compuestos derivados de fenil-benzo-γ-pirona [fenil cromona], a partir de una molécula de fenilalanina y tres de malonil-CoA. La estructura base es un esqueleto C6-C3-C6, el cual puede sufrir posteriormente modificaciones y adiciones de grupos funcionales, originando una familia muy diversa de compuestos químicos. En la figura 5 se encuentran las estructuras químicas de los flavonoides aislados de C. brasiliense. En las hojas se reportó la presencia de quercetina [8] e hiperósido (= quercetin-3-Ogalactosido) [9] (11) y el flavanol (-)-epicatequina [10]. Estos dos compuestos también identificados en frutos (16). De hojas y flores se aislaron el biflavonoide amentoflavona [11] (11,19, 24).
Xantonas
Compuestos con un núcleo estructural C6-C1- C6, puede presentar sustituyentes de diversa naturaleza química, principalmente grupos isoprenilo (C5) dando lugar a xantonas: simples y complejas. En la figura 6 se observan las diferentes xantonas aisladas de C. brasiliense. Estos compuestos se han aislado principalmente de la madera de duramen proveniente de ejemplares colectados en Brasil (8, 53) y México (Chiapas) (22, 23, 54). La muestra mexicana presentó cinco xantonas preniladas, jacareubina [12], 6-dehidroxi-jacareubina (= 6-desoxi-jacareubina) [13], 1,3,5,6-tetrahidroxi- 2-(3,3-dimetil-alil)-xantona [14] 1,3,5-trihidroxi- 2-(3,3-dimetil-alil)-xantona [15] y 1,5-dihidroxi- 2-(3,3-dimetil-alil)-3-metoxi-xantona [16] (22, 23). También se ha aislado calofilina B o guanandina [17] y dehidro-cicloguanandina [18] (Gottlieb et al., 1968 citado en 55); mientras que en la corteza de las muestras brasileñas se encontraron, brasixantonas A, B, C, D, E, F y G [19-25] (13), jacareubina [12], 6-desoxi-jacareubina [13], pirano-jacareubina [26], garcinona B [27], toxiloxantona A [28], cudraxantona F [29], latisxantona C [30], 8-desoxi-gartanina [31], 4-hidroxi-xantona [32], 1,2-dimetoxi-xantona [33], 3,8-dihidroxi-1,2-dimetoxi-xantona [34], 1,3,5,6-tetrahidroxi-2-(3-metil-2-butenil)-xantona [35] (14, 15), y en raíces 1,5-dihidroxi-xantona [36] (16).
Cromanonas
En la resina de la corteza se encontraron los isómeros ácido brasiliensico [37] y ácido isobrasiliensico [38] (56), así como ácido inofiloídico [39] (57); ácido brasiliemsofílico A, B y C [40-42] e isobrasiliemsofílico A, B y C [43-45] (17). En el aceite de la semilla se hallaron ácido apetálico [46] e isoapetálico [47] (58); mientras que en hojas se aislaron, además de estas dos cromanonas, su isómero estructural ácido calolóngico [48] (15, 20, 24). En la figura 7 se presentan las estructuras de diversas cromanonas aisladas de C. brasiliense.
Cumarinas
Grupo de compuestos formados sobre la base de un esqueleto benzo-α-pirona (59). Dentro de las cumarinas aisladas de C. brasiliense se encuentran principalmente dos grupos: cumarinas tipo mammea y dipiranocumarinas tetracíclicas.
Cumarinas tipo Mammea. Denominadas de esta forma por estar presentes principalmente en el género Mammea (Clusiaceae). En la figura 8 se encuentran las estructuras de mammeas aisladas de C. brasiliense. En extractos de hojas se han encontrado mammea A/BA, A/BB, A/BD, B/BA, B/ BB, C/OA, C/OB, B/BA ciclo F, B/BB ciclo F e isomammeigina [49-58] (15, 24, 25). En la corteza de ramas se identificó mammea B/BB [52] (13), mientras que de frutos (52) se aislaron mammea A/BA [49], A/BB [50].
Dipiranocumarinas tetracíclicas. Estos compuestos están estructuralmente relacionados entre sí; pero difieren en el sustituyente del carbono C4, de tal manera que se han descrito tres grupos denominados, calanólidos (prenilo en C-4), inofilums (fenilo en C-4) y cordatólidos (metilo en C-4). Solo compuestos de los dos primeros han sido aislados de C. brasiliense. En la figura 9 se presentan las estructuras químicas de estas cumarinas. El (+)-calanólido A, (-)-calanólido B o costatólido, y (+)-calanólido C [59-61] fueron aislados de los extractos de hojas (13, 15, 19). El inofilum A, C, D y E [62-65] se han extraído de extractos de la corteza de sus ramas (13) y el soulatrólido [66] de hojas (20).
En la figura 10 se observan las estructuras de otras cumarinas aisladas de este árbol tropical como son las brasimarinas A, B y C [67-69] (13) y la cumarina tricíclica denominada trivialmente como GUT-70 o 5-metoxi-2,2-dimetil-6-(2-metil- 1-oxo-2-butenil)-10-propil-2H,8H-benzol(1,2- b;3,4-b)dipirano-8-ona [70] (15, 60) las cuales se han aislado de la resina de corteza; mientras que calofilólido [71], calanona [72] y calocumarina A [73] se han extraído de la corteza de ramas (13).
Propiedades biológicas
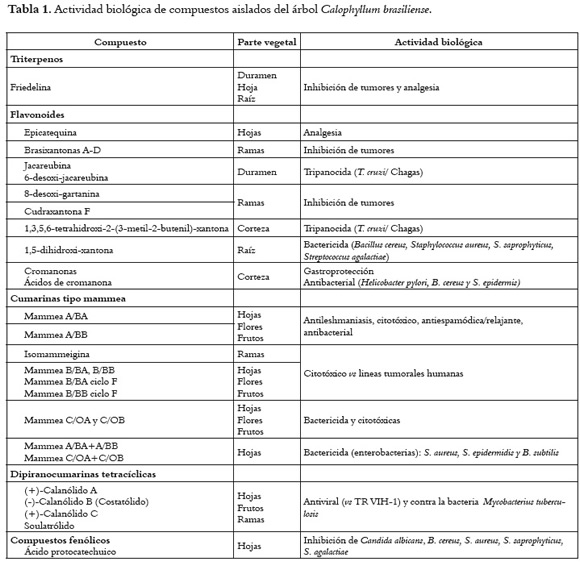
Los compuestos y extractos obtenidos de C. brasiliense poseen diversas propiedades biológicas, destacando su actividad antiviral (vs VIH-1), antitumoral, antiparasitaria (vs protozoarios) y antibacteriana. También presentan efecto gastroprotector, antiespasmódico y analgésico. Los estudios se han enfocado a compuestos con actividad anti-VH-1, especialmente (+)-calanólido A. En la tabla 1 se resumen estos aspectos.
Efecto gastroprotector
Calophyllum brasiliense se usa en la medicina popular de Brasil para aliviar trastornos gastrointestinales. En relación a esto, se reportó que la administración oral en ratones y ratas de la fracción diclorometano en dosis de 12.5 a 250 mg/ml disminuye significativamente las lesiones gástricas inducidas por etanol; también las redujo en modelos inducidos por estrés hipotérmico e indometacina, observándose propiedades citoprotectora, antiúlcera y antisecretora. Por otra parte, la fracción de hexano inhibió significativamente la formación de úlceras únicamente en el modelo de inducción por indometacina. Estudios posteriores demostraron que las xantonas naturales 12-13 y un derivado acetilado 1-hidroxi-3, 5, 6-tri-acetil-(3,3-dimetilalil)- xantona, así como la mammea 49 y 55 inhiben la H+,K+-ATPasa aislada del estómago de perro. Las xantonas inhibieron esta enzima con valores de IC50 de 47 μM a 1.6 mM; mientras que las cumarinas presentaron una IC50 de 110 y 638 μM, sugiriendo que efectivamente estos compuestos poseen un efecto gastroprotector (61).
Además, en otro estudio relacionado con problemas gástricos encontró que los extractos de esta especie presentan actividad in vitro e in vivo contra Heliobacter pylori en ratones infectados (62). Recientemente, se reportó que el extracto hexánico (dosis= 5 a 100 mg/kg) y una fracción conteniendo mezcla de ácidos de cromanona (dosis= 20 a 100 m/kg) presentan prevención de úlceras gástricas causadas por etanol e indometacina en ratas; así como, reducción de los niveles de actividad de las enzimas oxidantes glutationa, malondialdehido y catalasa en estómago de ratones con lesiones de ulcera gástrica inducida, en forma similar al obtenido por las drogas de referencia. También encontraron actividad contra H. pylori; pero esta fue menor que la exhibida por la droga de referencia (63). Esto demostró que extractos y compuestos aislados de C. brasiliense poseen potente actividad gastroprotectora.
Efecto analgésico y antinociceptivo
Las fracciones de hexano y acetato de etilo del extracto metanólico de hojas exhibieron efecto analgésico en el modelo de contorsiones abdominales inducida por ácido acético en ratones; mientras que los flavonoides 8 y 11, y la xantona 36 causaron una fuerte inhibición. Por otra parte, en el modelo con formalina, las fracciones de hojas y raíces exhibieron actividad solo en la fase inflamatoria pero no en la neurogénica (11). Estudios posteriores confirmaron con los mismos modelos que el extracto metanólico, así como las fracciones polar (no soluble en cloroformo) y poco polar (soluble en cloroformo) de flores, frutos y raíces (10 mg/kg, v.i.p.) ejercen efecto analgésico significativo. Este efecto se incrementó en las fracciones polares en el modelo con ácido acético, posiblemente por la presencia de compuestos fenólicos y flavonoides (11). En el caso de las raíces, el extracto poco polar fue más eficaz; mientras que la fracción polar fue más potente con ID50≈ 1 mg/kg, siendo cerca de 25 veces más activo que la aspirina (ácido acetilsalicílico) y el paracetamol (acetaminofén) con un efecto inhibidor dosis-dependiente (16).
El triterpeno 4 y la xantona 36 presentaron efecto inhibidor en el modelo de contracciones abdominales de forma dosis-dependiente. Mientras que, el flavonoide 10 presentó efecto analgésico considerablemente más potente que los fármacos de referencia, lo que indica que es uno de los compuestos responsables de dicho efecto. El extracto de raíces, así como sus fracciones polar y poco polar (10 mg/kg, v.i.p) resultaron más efectivas en la segunda fase (inflamatoria) del modelo con formalina en relación con los fármacos ácido acetilsalicílico e indometacina (16).
Actividad antiespasmódica
Los extractos metanólicos de hojas, raíces, flores y frutos causaron un efecto inhibitorio significativo en la respuesta contráctil elicitada por la acetilcolina en íleon de cobayo, la cual ocurrió en forma no competitiva y dependiente de la concentración con una IC50 de 1.47 mg/ml. También causó un efecto relajante en preparaciones de músculo liso de duodeno de rata, con una IC50 de 0.18 mg/ml (26).
Actividad antiparasitaria
Trypanosoma cruzi. El efecto del extracto metanol/ acetona del duramen de C. brasiliense se investigó contra epimastigotes y tripomastigotes de T. cruzi causante de la enfermedad de Chagas. Las xantonas 12 (MC100= 50 µg/ml, 153 µM), 13 (MC100= 50 µg/ml, 161 µM) y 35 (MC100= 70 µg, 213 µM) presentaron potente actividad tripanocida (14). Otro estudio también encontró que las cumarinas tipo mammea presentan mayor actividad contra epimastigotes que con tripomastigotes. Cumarinas con sustituyentes en el carbono 6 de tipo prenilo no ciclizadas son más potentes que las ciclizadas (25). Mayor actividad fue observada con mammea 52 (MC100= 15 y 25 µg/ml, respectivamente), seguido de las mammeas 49-51; mientras que las cumarinas con sustituyentes prenil ciclizados en C6, tales como, las mammeas 56, 57 y 58 fueron menos activas contra ambas etapas de T. cruzi (MC100> 200 µg/ml). A diferencia de las mammeas, el compuesto de referencia, el cloruro de berberina, fue más potente contra las formas tripomastigote que epimastigote (MC100= 7 y 300 µg/ml, respectivamente) (25).Leishmania amazonensis. Bioensayos empleando extractos de diclorometano de hojas y una fracción de hexano de este extracto, mostraron actividad sobre las formas promastigote y amastigote axénicas de L. amazonensis (IC50= 40 µg/ml y 3.69 µg/ ml, 17 µg/ml y 3.25 µg/ml; respectivamente) (15). De la fracción con hexano se aisló la mammea 50, la cual presentó mayor actividad (IC50= 3 µg/ ml vs. promastigote y 0.88 µg/ml vs amastigotes), además resultó ser poco tóxica para los macrófagos J774G8 (CC50= 25 µg/ml), esto significa que fue selectiva para los protozoarios (15). Las formas promastigote tratadas con este compuesto (72 h, 3 µg/ml) exhibieron en microscopia electrónica de transmisión, alteraciones ultra-estructurales como: células bi-nucleadas, múltiple vacuolización del citoplasma, intensa actividad exocítica en la región de la bolsa flagelar e hinchazón de mitocondrias con presencia de membranas concéntricas en la matriz mitocondrial. Estos resultados son promisorios ya que los fármacos actuales empleados en el combate a la Leishmaniasis son extremadamente tóxicos y los parásitos han desarrollado resistencia a los mismos (15).
Actividad moluscicida
Los extractos hidroalcohólicos de hojas y ramas colectadas en Brasil presentaron actividad contra el molusco Biomphalaria glabrata, vector del protozoario Schistossoma sp causante de la elefantiasis. Los extractos en concentración de 25 ppm causaron 100% de mortalidad del molusco. El compuesto aislado de estos extractos fue la mammea 50, la cual presentó una LD50 de 0.67 ppm y LD90 de 1.47 ppm después de 24 horas, la cual es comparable en potencia con el moluscicida de referencia, niclosamida (LD50= 0.77 ppm y LD90= 1.75 ppm). Esto significa que puede ser un sustituto potencial de esta sustancia que es utilizada en el combate de los hospederos intermediarios de Schistossoma sp (64).
Actividad antitumoral
Las xantonas aisladas de las ramas de C. brasiliense colectado en Brasil mostraron actividad citotóxica. Las brasixantonas 19-22, así como las xantonas 29 y 31 inhibieron al 100% la actividad de promoción del tumor en un modelo in vitro denominado activación del antígeno “early” del virus Epstein-Barr inducida por TPA [12-O-tetradecanoilforbol-13-acetato] en células Raji, la IC50 de las brasimarinas fueron 349, 342 y 348 mol/32 pmol TPA, respectivamente (12, 13).
Las mammeas 49, 50 y 52-58 mostraron citotoxicidad a 31 µM en mayor o menor grado sobre tres líneas celulares tumorales humanas (PC3, K562 y U251), mientras que el triterpeno 4 solo inhibió el crecimiento de PC3. Los compuestos fenólicos 2 y 3, así como el triterpeno 5 fueron inactivos (24). El compuesto con mayor actividad fue la mammea 49 con una IC50= 0.04 a 0.59 μM contra dichas líneas tumorales, seguida por la mezcla de mammea A/ BA y A/BB (IC50= 0.04 a 0.59 μM). La actividad citotóxica de las mammeas está determinada por la presencia de un sustituyente propil, pentil o fenil sobre C4. El sustituyente γ,γ- dimetil alilo en C-6 incrementa la citotoxicidad, pero disminuye si se cicliza a dihidro-furano o anillo de pirano (24).
Actividad fungicida
Los extractos metanólicos de diferentes partes de este árbol colectado en Brasil fueron evaludos sobre el crecimiento de Candida albicans y C. tropicalis, pero no observaron actividad con extractos, ni con las fracciones polar (cloroformo) y no polar (acetato de etilo). Sin embargo, el ácido fenólico 2 a concentración de 400-500 µg/ml (2.6-3.2 mM) presentó moderada actividad contra estos microorganismos (21). En un estudio posterior se observó efecto inhibitorio sobre el crecimiento de C. albicans cuando fueron tratadas con extracto acuoso y etanólico (100 mg/ml y 200 mg/ml) de hojas de C. brasiliense colectadas en Perú (27). Por otro lado, las xantonas 12-16 aisladas del duramen de C. brasiliense fueron activas contra el hongo Lenzites trabea causante de pudrición morena de la madera (22), lo cual sugiere que también podrían tener actividad contra hongos de interés médico.
Actividad bactericida
Los ácidos de cromanonas 40-45 aislados de la corteza presentaron alta a moderada actividad contra Bacillus cereus y Staphylococcus epidermis a concentraciones inhibitorias medias entre 1 y 4 µg/ml (17). También se ha evaluado la actividad inhibitoria de los extractos de hexano, metanol y acetona de hojas colectadas en México, así como de los ácidos fenólicos 2-3, triterpenos 4-5, mammeas 49, 50 y 52-58 sobre 14 cepas de enterobacterias: Escherichia coli enteropatogénica (EPEC/029358, ETEC/050933), E. coli enteroinvasiva (EIEC/28918), E. coli (ATCC/25922), E. coli agregativa (AGG/049766), Salmonella typhi (RRE/095426), S. typhi (ATCC/6539), Salmonella typhimurium (074289), Shigella dysenteriae (Dys 3), Staphylococcus aureus (2 cepas), Staphylococcus epidermidis, Pseudomona aeruginosa (ATCC/27853), y Bacillus subtilis. Sin embargo, solo la mezcla de mammea A/ BA+A/BB y C/OA+C/OB redujeron el crecimiento de S. aureus, S. epidermidis y B. subtilis, aunque en menor medida que el cloramfenicol (24). Por otro lado, el extracto metanólico de hojas, tallo, raíces, flores y frutos colectados en Brasil, así como de las fracciones polar (no soluble en cloroformo) y no polar (soluble en cloroformo) de los extractos de metanol fueron evaluados sobre los microorganismos: B. cereus, Enterobacter cloacae, E. coli, Proteus mirabilis, P. aeruginosa, S. typhimurium, S. aureus, Staphylococcus saprophyticus, Streptococcus agalactiae (21). Los resultados indicaron que todos los extractos son activos contra una o más bacterias Gram-positivas (B. cereus, S. aureus, S. saprophyticus y S. agalactiae) en un rango de concentraciones de 100-1000 µg/ml, pero no observaron actividad contra las bacterias Gram-negativas (E. cloacae, E. coli, P. mirabilis, S. typhimurium). De los compuestos aislados de estos extractos, el compuesto 2 presentó actividad contra ambos grupos de bacterias; mientras que la xantona 36 únicamente fue activa contra bacterias Gram-positivas. Los compuestos 1, 4 y 10 no exhibieron actividad microbicida (21).
Actividad antiviral (vs TR VIH-1)
Los calanólidos son dipiranocumarinas tetracíclicas con actividad potente contra el VIH-1 causante del SIDA, actúan como inhibidores no nucleosídicos de la transcriptasa reversa de dicho virus. Existen diversos compuestos de este tipo, de los cuales el más activo y ampliamente estudiado es el (+)-calanólido A [59]. Dicho compuesto fue aislado por primera vez [1992] del árbol trópical Calophyllum langinerum de Malasia (1). El calanólido 59 es el compuesto líder de tres series de dipiranocumarinas tetracíclicas, presentes en diversas especies del género Calophyllum, que están estructuralmente relacionadas, denominadas calanólidos (prenilo en C-4) (1), inofilums (fenilo en C-4) (2) y cordatólidos (metilo en C-4) (65).
Las propiedades anti-TR VIH-1 del calanólido 59 se describieron por primera vez mediante dos ensayos de viabilidad celular in vitro en células linfoblásticas T humanas infectadas con el virus. En el ensayo con XTT tetrazolium-formazan detuvo la replicación del VIH-1 y confirió 100% de protección contra los efectos citopáticos (EC50= 0,1 µM) del virus. La citotoxicidad del compuesto contra células no infectadas se manifestó a concentraciones 200 veces mayores (IC50= 20 µM), resultando con un buen índice terapéutico (IC50/EC50= 200). Resultados similares se obtuvieron con un segundo método, estableciendo además el calanólido 59 inhibía la producción de TR y de la proteína viral gp24. También se demostró que inhibe específicamente la actividad de la TR de VIH-1 mediante ensayos sobre moldes homopoliméricos de poliA y poliT. Sin embargo, el calanólido 59 fue inactivo en células infectadas con VIH-2. Además de este calanolido, se aisló el (-)-calanólido B [60], el cual presentó actividad anti-VIH-1, pero requirió concentraciones cuatro veces mayores para lograr niveles de citoprotección equivalentes al (+)-calanólido A [59] (1). Un año más tarde se aislaron los inofilums B y P de C. inophyllum de Malasia, los cuáles inhibieron la enzima TR de VIH-1 (EC50= 38 y 130 nM, respectivamente) y brindaron protección contra los efectos citopáticos del VIH-1 en cultivos celulares infectados (2). A finales de la década de 1990's se aislaron los cordatólidos A y B de C. cordato-oblongum de Sri Lanka, los que también inhibieron la actividad enzimática de la TR de VIH-1 in vitro (IC50= 12.3 y 19 μM, respectivamente) (65).
El primer ensayo de actividad del calanólido 59 in vivo se realizó con un modelo de células linfoblastoide humana (CEM-SS) infectadas con VIH-1 IIIb implantadas dentro de una fibra plástica hueca en ratón. El compuesto administrado oral o parenteralmente, inhibió la replicación del virus (66). Posteriormente se examinó su perfil de seguridad en animales, así como su farmacocinética en voluntarios humanos VIH negativos con dosis única (67, 68). En los estudios clínicos de fase I, este calanólido 59 fue administrado en dosis de hasta 800 mg dos veces al día durante 5 días, encontrándose que era bien tolerado aunque se observaron efectos adversos transitorios de baja intensidad, tales como mareo, cefalea, naúseas y mal sabor en boca. Los niveles en plasma fueron variables, pero a las dosis más altas se alcanzaron niveles de posible eficacia terapéutica (68, 69).
Los estudios realizados indican que el calanólido 59 es un inhibidor no nucleosídico de la enzima TR de VIH-1, con características importantes, tales como: selectividad contra el VIH-1; actividad contra cepas VIH-1 resistentes a zidovudina y lamivudina, fármacos inhibidores de transcriptasa análogos a nucleósidos (ITRAN) generalmente prescritos, así como a cepas con la mutación Y181C (tirosina por cisteína) la cual confiere resistencia a la mayoría de los inhibidores de transcriptasa no análogos a nucleósidos (ITRNN), esta es una características única e importante de este calanólido, además de que no se presentaron cepas resistentes después de una monoterapia de 14 días en la fase clínica IB en pacientes infectados, sugiriendo que este compuesto puede retardar la emergencia de mutaciones virales. En estudios preclínicos el calanólido 59 presentó interacción sinérgica en combinaciones dobles (con zidovudina, lamivudina o estavudina), así como en combinación triple que combinan inhibidores de proteasa (nelfinavir) e ITRAN (lamivudina), este sinergismo puede tener implicaciones terapéuticas importantes; debido a su naturaleza lipofílica se distribuye rápidamente en el sistema nervioso central y sistema linfático, penetrando en los reservorios virales; no se presentan efectos adversos importantes, lo que significa que es bien tolerado por los humanos. La tolerancia favorable y el perfil farmacocinético del calanólido 59, demostrados en la fase IA y IB, sugieren que puede ser desarrollado como un fármaco de ingesta de 1-2 veces por día, lo cual favorecería el apego de los pacientes al tratamiento de acuerdo a Sarawak MediChem Pharmaceuticals Inc, 2007 (citado en 31). Además el (+)-calanólido A [59] es el único agente anti-VIH que también inhibe el crecimiento de Mycobacterium tuberculosis (70), una de las principales infecciones oportunistas en pacientes con SIDA.
Quimiotipos de Calophyllum brasiliense: ¿evolución de un taxón?
¿Qué tan homogénea puede ser una especie en su composición química? ¿Existen diferencias químicas entre ejemplares colectados en diferentes localidades? El estudio de Calophyllum brasiliense ha permitido esbozar algunas respuestas, pues se ha demostrado la existencia de poblaciones con diferencias en la composición química de las hojas, llevando a concluir que en México existen al menos dos quimiotipos (19,24,71), también llamados “fenotipos químicos” (33). El inicio de este capítulo de la investigación fue completamente inesperado y fortuito. Como resultado de un estudio bioprospectivo donde se evaluaron los efectos inhibitorios sobre la enzima TR de VIH-1 de los extractos orgánicos de las hojas de 21 especies de Clusiaceae presentes en México, se encontró que la especie más activa fue C. brasiliense. Tanto el extracto de hexano (77.9%) como el de acetona (81.3%) y el de metanol (83.3%) presentaron actividad contra la enzima TR de VIH- 1 (18). El fraccionamiento biodirigido del extracto hexánico permitió aislar las dipiranocumarinas: (+)-calanólido A, (-)-calanólido B, (+)-calanólido C [59-61] y soulatrólido [66]. Estos compuestos fueron identificados como responsables de las propiedades anti-TR de VIH-1 (19). Además, el extracto de C. brasiliense inhibió la replicación del VIH-1 en linfocitos CD4+ y resultó poco tóxico sobre linfocitos CD4+ cultivados in vitro. Curiosamente, años atrás, esta especie no había sido considerada como posible fuente de compuestos anti-VIH en un estudio bioprospectivo previo realizado en los E.U.A. ya que no presentó dipiranocumarinas (calanólidos) en cromatografía en capa fina, así como por resonancia magnética nuclear de protón (9). Estos resultados contradictorios fueron aclarados años después, pues se demostró que en México existen al menos dos quimiotipos de C. brasiliense (19, 24). En efecto, con base en el análisis por CCF, HPLC, y estudios clásicos de aislamiento e identificación espectroscópica de compuestos, se encontró que existen dos poblaciones o fenotipos químicos de C. brasiliense. La primera, llamada quimiotipo 1 (QTP1), contiene como constituyentes mayoritarios del extracto hexánico de las hojas cumarinas tipo mammea [49, 50 y 52-58] (24); mientras que el segundo quimiotipo (QTP2) presenta como componentes mayoritarios cromanonas [46-47], además este biosintetiza como constituyentes minoritarios dipiranocumarinas tetracíclicas 59-61 y 66 (19). Ambos quimiotipos contienen los triterpenos 4 y 5, así como el flavonoide 11. Sin embargo, únicamente las dipiranocumarinas tetracíclicas presentes en el QTP2 son activas contra la enzima TR de VIH-1, mientras que las coumarinas tipo mammea presentes en el QTP1 no poseen actividad contra esta enzima, aunque presentaron actividad citotóxica contra tres líneas tumorales humanas (19, 24).
En un estudio reciente se detectó por cromatografía en capa fina y HPLC ejemplares localizados principalmente en el Estado de Chiapas (sureste de México) con un perfil cromatográfico particular, al que se le denomino tentativamente quimiotipo 3 [QTP3]. Los extractos de hexano de las hojas de C. brasiliense QTP3 colectadas en dos localidades de Chiapas mostraron semejanzas con el QTP2, pues contienen dipiranocumarinas del tipo de los inofilums, calanólidos, pero con bajo contenido de cromanonas (71). Los extractos de ambas localidades fueron potentes inhibidores de la enzima TR de VIH-1. Sin embargo, solo el colectado en la región del Soconusco presentó un perfil toxicológico relativamente seguro en ratones. Además, no se observó daño en tejido hepático, por el contrario se apreció un posible efecto inmuno-estimulante mediante el incremento de megacariocitos en bazo (71). Al respecto, se ha reportado que el extracto de metanol de raíces de C. brasiliense colectado en Brasil induce el crecimiento in vitro de células del bazo de ratones (72). También se reportó que este extracto presentó actividad inmuno-estimulatoria sobre células mononucleares de sangre periférica humana de manera dosis-dependiente en concentraciones de 100-200 μg/ml (73).Diferencias anatómicas y genéticas entre quimiotipos
No solo se han encontrado variaciones cualitativas y cuantitativas en la composición química de poblaciones de C. brasiliense en México, que permiten postular la existencia de quimiotipos en dicha especie (19, 24, 71), este fenómeno, también se ha observado en otras especies del género Calophyllum. Por ejemplo, las especies de Calophyllum de Sri Lanka se han divido en dos grupos de acuerdo a su composición química (74); también la especie C. inophyllum de las Islas Polinesias se ha separado en varios grupos después de comparar los perfiles cromatográficos por HPLC de numerosos ejemplares (75).
¿La existencia de quimiotipos en C. brasiliense es una respuesta al ambiente o está determinada genéticamente? nosotros nos inclinamos por la segunda hipótesis y con esta perspectiva se han realizado diversos estudios morfológicos, anatómicos y genéticos con especímenes de México. Se examinaron las hojas de 20 ejemplares de C. brasiliense depositados en el herbario MEXU, se consideraron las variables de largo y ancho de la hoja, número de venas en 5 mm y longitud del peciolo. Sin embargo, las diferencias entre los QTP1 y QTP2 no resultaron estadísticamente significativas. Si bien se requiere ampliar la muestra, al parecer los quimiotipos no reflejan de manera contundente diferencias en su morfología. Sin embargo, el análisis de la preferencia en la distribución altitudinal de ejemplares del MEXU, indicó que el 22% de QTP1 se encuentran desde 0 hasta 200 msnm, mientras que este porcentaje fue de 38% para los QTP2. El límite de distribución altitudinal es de 1200 msnm para los QTP1, mientras que para los segundos solo alcanza los 1000 msnm. Es decir, al parecer el QTP2 tolera condiciones más secas.
En este contexto, se realizó un estudio anatómico comparativo de las hojas de plántulas de los QTP1 y QTP2 de C. brasiliense, el cual si mostró diferencias estructurales estadísticamente significativas (76). En el primer quimiotipo, la epidermis de la hoja presenta dos estratos, el parénquima en empalizada en un solo estrato, el tejido vascular de la nervadura central en forma de V cerrada. En el segundo, la epidermis de la hoja presenta un estrato, parénquima en empalizada en dos estratos y el tejido vascular de la nervadura central en forma de U cerrada (76,77).
Con el objetivo de establecer claramente si existían diferencias a nivel genético entre los diferentes quimiotipos de C. brasiliense en México se realizó el análisis filogenético de la región de los espaciadores internos transcritos (ITS por sus siglas en inglés) localizados en el ADN ribosomal (77). Esta investigación demostró que los ejemplares de C. brasiliense del QTP2 procedentes del Estado de Veracruz, como los del llamado QTP3 del Estado de Chiapas presentaron una alta similitud genética con solo ligeras diferencias en la región amplificada, sugiriendo que posiblemente el llamado QTP3 solo es una variante del QTP2. En contraste, el QTP1 presento varias diferencias en la región del ITS al comparar con QTP2 y QTP3, adicionalmente se observó que posee una mayor similitud filogenética con C. inophyllum que con el QTP2 (77).
Los anteriores estudios sugieren que la existencia de quimiotipos en poblaciones de C. brasiliense de México podría deberse a un proceso de rápida diversificación, es decir evolutivo, en el taxón; donde los cambios genéticos son observables en la composición química y anatomía de las hojas, pero no en su morfología. Desde el punto de vista biosintético, tanto cumarinas tipo mammea, dipiranocumarinas y cromanonas poseen precursores comunes, por lo tanto están relacionados (78,79), por ejemplo se ha sugerido que la mammea A/BB [50] podría ser un precursor de inofilum B, compuestos aislados principalmente en C. inophyllum (24). Mutaciones puntuales podrían inhabilitar la expresión de una enzima y favorecer la de otra, dando lugar a fenotipos químicos o quimiotipos diferentes. Desde el punto de vista farmacéutico, determinar el perfil químico de los extractos es fundamental para el desarrollo de un fitofármaco (80). La presencia y abundancia de dipiranocumarinas en la materia prima es crucial puesto que solo los ejemplares de QTP2 y su variante QTP3 podrían ser usados como fuente de fitomedicamentos anti-TR de VIH-1; sin embargo, los QTP1 podrían ser fuente de Cumarinas tipo mammea con propiedades antitumorales y contra protozoarios.
La presente revisión pretende mostrar un panorama general de la fitoquímica y farmacología de compuestos aislados de C. brasiliense, especialmente Cumarinas, con la finalidad de orientar trabajos tendientes al posible desarrollo de fitomedicamentos. Sin embargo, la amplísima distribución geográfica de la especies, su alta variabilidad química y genética limita la generalización de los resultados. Adicionalmente, por limitaciones de espacio, ofrecer un panorama más amplio es una tarea futura, tal como los avances en la síntesis de compuestos líderes, e investigaciones sobre la genética y anatomía del árbol; además, de revisar algunas otras especies del género Calophyllum donde se han encontrado compuestos activos, así como estudios concernientes al cultivo in vitro de tejidos para la producción de metabolitos secundarios.
CONCLUSIONES
Calophyllum brasiliense representa un recurso fitogenético y fitoquímico muy valioso para los países latinoamericanos, pues biosintetiza compuestos cuya diversidad de acción farmacológica representan una alternativa en el desarrollo de fitomedicamentos para hacer frente a los problemas de Salud Pública. Entre estos compuestos destacan los calanólidos e inofilums en el tratamiento del VIH/SIDA, ya que debido a sus características farmacológicas y toxicológicas, los han colocado como fuertes candidatos para ser incorporados al cuadro de medicamentos antirretrovirales. También destacan las Cumarinas tipo mammea, las cuales presentan propiedades contra protozoarios y como antitumorales. Dichos compuestos podrían eventualmente permitir el desarrollo de fitofármacos a base de extractos y/o fracciones enriquecidas estandarizadas, lo que no solo representaría efectividad y seguridad, sino reducción de los costos del tratamiento VIH/SIDA, Leishmaniasis y la enfermedad de Chagas.
AGRADECIMIENTOS
Este trabajo fue financiado por los proyectos IN203810, IG200513 DGAPA-UNAM y PICSA 10-55 del Instituto de Ciencia y Tecnología del Distrito Federal. Julio César García Zebadúa agradece el apoyo brindado por el Posgrado en Ciencias Biológicas- UNAM y CONACYT por la beca doctoral otorgada. Sandra Santillán agradece al CONACyT y el Posgrado en Ciencias Biomédicas-UNAM el apoyo para obtener una beca postdoctoral. Agradecemos la ayuda en el laboratorio de Eduardo Aguilar, Alicia Fonseca, Irma Sustaíta, Yoli Medina, María de los Ángeles Cauich García, así como en las colectas botánica, herbario e invernadero de Lucio Lozada, Estebán Martínez, Laura Cortes Zarraga y Araceli Zárate Aquino.
Conflicto de interés: Los autores hacemos constar que no existe declaración de intereses.
REFERENCIAS
1. Kashman Y, Gustafson KR, Fuller RW, Cardellina JH II, Mc- Mahon JB, Currens MJ, et al. The Calanolides, a novel HIV inhibitory class of coumarin derivates from the tropical rainforest tree, Calophyllum laginerum. J Med Chem. 1992 Jul; 35 (15): 2735-2743. [ Links ]
2. Patil AD, Freyer AJ, Eggleston DS, Haltiwanger RC, Bean MF, Taylor PB, et al. The inofilums, novel inhibitors of HIV-1 reverse transcriptase isolated from the Malasyan tree, Calophyllum inofilum Linn. J Med Chem. 1993 Dec; 36 (26): 4131-4138. [ Links ]
3. Stevens PF. A revision of the old world species of Calophyllum (Guttiferae). J Arnold Arbor. 1980 Apr; 61 (2): 117-171. [ Links ]
4. Bisse J. Árboles de Cuba. La Habana (Cuba): Ed. Científico- Técnica; 1981. 384 p. [ Links ]
5. García-Barriga H. Flora medicinal de Colombia. Botánica Médica, 2ª Ed. vol. 2. Bogotá (Colombia): Tercer Mundo Editores; 1992. 537 p. [ Links ]
6. Pennington TD and Sarukhán J. Árboles tropicales de México. 2ª Ed. D.F. (México): Universidad Nacional Autónoma de México- Fondo de Cultura Económica; 1998. 521 p. [ Links ]
7. Rodríguez ME, Cardozo AE, Krauczuk ER, Fontana JL, Iriart D. Calophyllum brasiliense (Clusiaceae): Nuevo registro para la flora de la Argentina. Bol Soc Argent Bot. 2009 Ago-Dic; 44 (3-4): 361-366. [ Links ]
8. Pereira MOS, Gottlieb OR, Magalhaes MT. Novas xantonas do Calophyllum brasiliense. An Acad Bras Cienc. 1967 Jun; 39 (2): 255-256. [ Links ]
9. Mckee TC, Covington CD, Fuller RW, Bokesch HR, Young S, Cardellina II JH, et al. Pyranocoumarins from tropical species of the genus Calophyllum: a chemotaxonomic study of extracts in the National Cancer Institute collection. J Nat Prod. 1998 Oct; 61 (10): 1252-1256. [ Links ]
10. Sartori NT, Canepelle D, De Souza P, Martins DTO. Gastroprotective effect from Calophyllum brasiliense Camb. bark on experimental gastric lessions in rats and mice. J Ethnopharmacol. 1999 Nov; 67 (2): 149-156. [ Links ]
11. Da Silva KI, dos Santos AR, Manttos PE, Yunes RA, Delle-Monache F, Cechinel-Filho V. Chemical composition and analgesic activity of Calophyllum brasiliense leaves. Therapie. 2001 Jul-Aug; 56 (4): 431-434. [ Links ]
12. Ito C, Itoigawa M, Mishina Y, Cechinel V, Mukainaka T, Tozuda H, Nishino H. Chemical constituents of Calophyllum brasiliensis: Structure elucidation of seven new xantones and their cancer chemopreventive activity. J Nat Prod. 2002 Mar; 65 (3): 267-272. [ Links ]
13. Ito C, Itoigawa M, Mishina Y, Cechinel V, Enjo F, Tozuda H, Nishino H, Forukawa H. Chemical constituents of Calophyllum brasiliense. 2. Structure of three new coumarins and cancer chemopreventive activity of 4-substituted coumarins. J Nat Prod. 2003 Mar; 66 (3): 368-371. [ Links ]
14. Abe F, Nagafuyi S, Okabe H,Akahane A, Estrada-Muñiz E, Huerta-Reyes M, Reyes-Chilpa R. Trypanocidal Constituents in Plants 3. Leaves of Garcinia intermedia and heartwood of Calophyllum brasiliense. Biol Pharm Bull. 2004 Jan; 27 (1): 141-143. [ Links ]
15. Brenzan MA, Piloto-Ferreira IC, Campana-Lonardoni MV, Honda PA, Filho ER, Nakamura CV, et al. Activity of extracts and coumarins from the leaves of Calophyllum brasiliense on Leishmania braziliensis. Pharm Biol. 2008 Jun; 46 (6): 380-386. [ Links ]
16. Isaias DEB, Niero R, Noldin VF, de Campos-Buzzi F, Yunes RA, Delle-Monache F, Cechinel-Filho V. Pharmacological and phytochemical investigations of differents parts of Calophyllum brasiliense (Clusiaceae). Pharmazie. 2004 Nov; 59 (11): 879- 881. [ Links ]
17. Cottiglia F, Dhanapal B, Sticher O, Heilmann J. New Chromanone acids with antibacterial activity from Calophyllum brasiliense. J Nat Prod. 2004 Apr; 67 (4): 537-541. [ Links ]
18. Huerta-Reyes M, Basualdo M, Lozada L, Jimenez-Estrada M, Soler C, Reyes-Chilpa R. HIV-1 inhibition by extracts of Clusiaceae species from Mexico. Biol Pharm Bull. 2004 Jun; 27 (6): 916-920. [ Links ]
19. Huerta-Reyes M, Basualdo M, Abe F, Jimenez-Estrada M, Soler C, Reyes-Chilpa R. HIV-1 inhibitory compounds from Calophyllum brasiliense leaves. Biol Pharm Bull. 2004 Sept; 27 (9): 1471-1475. [ Links ]
20. Huerta-Reyes M. Evaluación de la actividad inhibitoria de metabolitos secundarios de Clusiaceae mexicanas sobre el VIH-1 [doctoral thesis]. [D.F., México]: Universidad Nacional Autónoma de México; 2004. 197 p. [ Links ]
21. Pretto JB, Cechinel-Filho V, Noldin VF, Sartori MRK, Isaias DEB and Bella-Cruz A. Antimicrobial activity of fractions and compounds from Calophyllum brasiliense (Clusiaceae/Guttiferae). Z Naturforsch. C. 2004 Sept-Oct; 59 (9-10): 657-662. [ Links ]
22. Reyes-Chilpa R, Jimenez-Estrada M, Estrada-Muñiz E. Antifungal xanthones from Calophyllum brasiliense heartwood. J Chem Ecol. 1997 Jul; 23 (7): 1901-1911. [ Links ]
23. Mesía-Vela S, Sanchez RI, Estrada-Muñiz E, Alavez-Solano D, Torres-Sosa C, Jiménez-Estrada M, Reyes-Chilpa R, Kauffman FC. Natural Producs Isolated from Mexican Medicinal Plants, Novel Inhibitors of Sulfotransferases SULT1A1 and SULT2A1. Phytomedicine 2001 Nov; 8 (6): 481-488. [ Links ]
24. Reyes-Chilpa R, Estrada-Muñiz E, Ramirez-Apan T, Amekraz B, Aumelas A, Jankowsky C, Vazquez-Torres M. Cytotoxic effects of mammea type coumarins from Calophyllum brasiliense. Life Sci. 2004 Aug; 75 (13): 1635-1647. [ Links ]
25. Reyes-Chilpa R, Estrada-Muñiz E, Vega-Avila E, Abe F, Kinjo J, Hernández-Ortega. Trypanocidal constituents in plants. 7.Mammea-type coumarins. Mem Inst Oswaldo Cruz. 2008 Aug; 103 (5): 431-436. [ Links ]
26. Emendörfen F, Emendörfen F, Bellato F, Noldin VF, Niero R, Cechinel-Filho V, Maia CA. Evaluation of the relaxant action of some brazilian medicinal plants in isolated guinea-pig ileum and rat duodenum. J Pharm Pharm Sci. 2005 Mar; 8 (1): 63-68. [ Links ]
27. Flores W, Fuentes R, Galindo D, González F, Hernández G, Hernández K, Hidalgo I, Zamudio del Carpio D, Castañeda B, Ibañez L y Larrea H. Evaluación de los efectos antioxidante, antibacteriano y antifúngico de Calophyllum brasiliense Cambess (Lagarto Caspi). Rev Horizonte Med. 2008 Dic; 8 (2): 7-16. [ Links ]
28. Butler MS. Natural products to drugs: natural product derived compounds in clinical trials. Nat Prod Rep. 2005 Apr; 22 (2): 162-195. [ Links ]
29. Buttler MS. Natural products to drugs: natural product derived compounds in clinical trials. Nat Prod Rep. 2008 Jun; 25 (3): 475-516. [ Links ]
30. Tapia-Tapia EC y Reyes-Chilpa R. Productos forestales no maderables en México: aspectos económicos para el desarrollo sustentable. Maderas y Bosques. 2008; 14 (3): 95-112. [ Links ]
31. Reyes-Chilpa R y Huerta-Reyes M. Compuestos naturales de plantas de la familia Clusiaceae: Inhibidores del virus de inmunodeficiencia humana tipo 1. Interciencia. 2009 Jun; 34 (6):385-392. [ Links ]
32. Bernabé-Antonio A, Estrada-Zúñiga ME, Buendía-González L, Reyes-Chilpa R, Chávez-Ávila VM, Cruz-Sosa F. Production of anti-HIV-1 calanolides in callus culture of Calophyllum brasiliense (Cambess). Plant Cell Tiss Organ Cult. 2010 Oct; 103: 33-40. [ Links ]
33. Desjardins AE. Natural product chemistry meets genetics: when is a genotype a chemotype? J Agr Food Chem. 2008 Sept; 56(17): 7587-7592. [ Links ]
34. Do Souza AM. Estrutura genética de populaçôes naturais de Calophyllum brasiliense Camb. [doctoral thesis]. [Minas Gerais, Brasil]: Universidade Federal de Lavras: 2006. 154 p. [ Links ]
35. Chudnoff M. Tropical Timbers of the World. Agrie Handbook 607. Washington, D.C. (US): US Department of Agriculture, Forest Service; 1984. 466 p. [ Links ]
36. Ortega-Escalón F, Castillo-Morales I, Carmona-Valdovinos T. Angiospermas arbóreas de México. Num. 3. Anatomía de la madera de veintiséis especies de la selva Lacandona, Chiapas. La madera y su uso. Num. 26. D.F. (México): Instituto de Ecología A. C. y Universidad Autónoma Metropolitana; 1991. 200 p. [ Links ]
37. Spliter P. Ecología de Bosques Tropicales: Descripción de siete especies forestales nativas del bosque húmedo tropical en el sur de Costa Rica. [dissertation on the internet]. Eschborn (Alemania): Programa de acompañamiento en Ecología Tropical; 1997 (cited 2013 Oct 9). 77 p. Available from: http://www2.gtz.de/dokumente/bib/97-1456.pdf. [ Links ]
38. Buffon-Isaias DE. Isolamento e identificaçao de principios ativos de Calophyllum brasiliense Camb. (Clusiaceae) [master's thesis]. [Vale do Itajaí, Brasil]: Universidade do Vale do Itajaí: 2005. 83 p. [ Links ]
39. Cambessedes J. Flora brasiliae meridionalis: Calophyllum brasiliense. 1825; 1: 321, pl. 67. [ Links ]
40. Sustaita-Aranda I. Contribución al conocimiento taxonómico del género Calophyllum (Gutiffereae): Quimiotipos de C. rekoi Standl y C. brasiliense Cambess [bachelor's thesis]. [D.F., México]: Universidad Nacional Autónoma de México: 2006. 56 p. [ Links ]
41. Standley PC. Revision of some american species of Calophyllum. Trop Woods. 1932; 30: 6-9. [ Links ]
42. D'Arcy WGD and Keating RC. Anatomical support for the taxonomy of Calophyllum (Guttiferae) in Panama. Ann Missouri Bot Garden. 1979; 66: 557-571. [ Links ]
43. Tropicos.org. Missouri Botanical Garden. Calophyllum brasiliense Cambess. [Internet]. Saint Louis, Missouri, U.S. (cited 2012 Dic 13). Available on: http://www.tropicos.info/Name/7800054?langid=66. [ Links ]
44. Joker D and Salazar R. Calophyllum brasiliense Cambess. Seed Leaflet. CATIE Nota Técnica Num. 46. [Internet]. October, 2000. Denmark: Danida Forest Seed Centre. 24 Ene, 2013. Available from: http://curis.ku.dk/portal-life/files/20646780/calophyllum_brasiliense_int.pdf. [ Links ]
45. Kearns DM, Berry PE, Stevens PF, Cuello NL, Pipoly JJ III, Robson NKB, Holst BK. Flora of the Venezuela Guayana, vol. 4, Caesalpinaceae-Ericaeae. St. Louis, Missouri (U.S): Missouri Botanical Garden Press; 1998. 799 p. [ Links ]
46. OFI-CATIE. Árboles de Centroamérica. Calophyllum brasiliense, 427-430 p [Internet]. 24 Ene, 2013. Available from: http://www.arbolesdecentroamerica.info/index.php/en/species/item/download/61_0afbdeddc1608f131a6e1b679b3836a9. [ Links ]
47. Flores E. Árboles y semillas del neotrópico, vol. 3, no. 1. San José (Costa Rica): INISEFOR/Museo Nacional de Costa Rica; 1994.110 p. [ Links ]
48. Betancourt AB. Silvicultura especial de árboles maderables tropicales. La Habana (Cuba): Editorial Científico Técnica; 1987. 427 p. [ Links ]
49. Thirakul S. Manual de dendrología del bosque latifoliado. La Ceiba (Honduras): Corporación Hondureña de Desarrollo Forestal/Canadian International Development; 1990. 485 p. [ Links ]
50. Herrera J, Lines K y Vázquez W. Estudio de la germinación y la conservación de semillas de cedro María (Calophyllum brasiliense). Tecnol en Marcha. 2006; 19(1): 61-722. [ Links ]
51. Soto-Núñez JC. Las plantas medicinales y su uso tradicional en la cuenca del rio Balsas: Estado de Michoacán y Guerrero, México [bachelor's thesis]. [D.F., México]: Universidad Nacional Autónoma de México: 1995. 231 p. [ Links ]
52. González-Paredes M. Estudio etnobotánico de Calophyllum brasiliense Cambess (Guttiferae): Anatomía de fruto, fitoquímica y evaluación de la actividad antiviral de hojas y frutos [master's thesis]. [D.F., México]: Universidad Autónoma de Chapingo: 2006. 129 p. [ Links ]
53. Da Silva Pereira MO, Gottlieb OR, Taveira Magalhaes M. Chemistry of brazilian Guttiferae. IX. Xanthone constituents of Calophyllum brasiliense Engl. An Acad Brasil Cienc. 1966; 38: 425-427. [ Links ]
54. Estrada-Muñiz E. Cumarinas y Xantonas de Calophyllum brasiliense: Evaluación de su actividad antiviral, citotóxica y antibacteriana [master's thesis]. [D.F., México]: Universidad Nacional Autónoma de México: 2001. 65 p. [ Links ]
55. Xiao-Hui S, Man-Li Z, Li-Geng L, Chang-Hong H, Yu-Cheng G, Qing-Wen S. Chemical constituents of the plants of the genus Calophyllum. Chem Biodivers. 2008 Dec; 5 (12): 2579-2608. [ Links ]
56. Stout GH, Krhan MM, Breck GG. Calophyllum products II: Brasiliensie and inophyllodie acids. Tetrahedron Lett. 1968; 29 (9): 3285-3290. [ Links ]
57. Canappele D, Vieira PC, Dall'Oglio EL, da Silva LE, Souza PT Jr. Unequivocal NMR assignments: O-methoxy-methyl esters derivatives of acid chromanones from Calophyllum brasiliense Camb (Guanandi). Nat Prod Res. 2008 Jul; 22 (10): 846-853. [ Links ]
58. Plattner RD, Spencer GF, Weisleder D, Kleiman R. Chromannone acids in Calophyllum brasiliense seed oil. Phytochemistry. 1974 Nov; 13 (11): 2597-2602. [ Links ]
59. Wójtowicz K. Comparison of the effect of 4-hydroxycoumarin and umbelliferone on the phase transition of dipalmitoylphosphatidylcholine (DPPC) bilayers. Pharmacol Rep. 2008 Jul-Aug; 60 (4): 555-560. [ Links ]
60. Kimura S, Ito C, Jyoko N, Segawa H, Kuroda J, Okada M, Adachi S, Nakahata T, Yuasa T, Cechinel Fhilo V, Furukawa H, Maekawa T. Inhibition of leukemic cell growth by a novel anti-cancer drug (GUT-70) from Calophyllum brasiliense that acts by induction of apoptosis. Int J Cancer. 2005 Jan; 113 (1): 158 -1665. [ Links ]
61. Reyes-Chilpa R, Baggio CH, Alavez-Solano D., Estrada-Muñiz E, Kauffman FC, Sanchez RI, Mesia-Vela S. Inhibition of gastric H+,K+-ATPase activity by flavonoids, coumarins and xanthones isolated from Mexican medicinal plants. J Ethnopharmacol. 2006 Apr; 105 (1-2): 167-172. [ Links ]
62. Souza MC, Bezerra AMS, Martins DC, Real VV, Do Santos NRA, Raoc VS, Da Silva RM, De Oliveira MDT. In vitro and in vivo anti-Helicobacter pylori activity of Calophyllum brasiliense Camb. J Ethnopharmacol. 2009 Jun; 123 (3): 452-458. [ Links ]
63. Scalon-Lemos LM, Bezerra-MartinsT, Henrique-Tanajura G, Gazoni VF, Bonaldo J, Strada CL, et al. Evaluation of antiulcer activity of chromanone fraction from Calophyllum brasiliense Camb. J Ethopharmacol. 2012 May; 141: 432-439. [ Links ]
64. Gasparotto Jr A, Brenzan MA, Piloto IC, Nakamura CV, Prado- Dias Filho B, Rodrigues-Filho E, Ferreira AG. Phytochemical study and evaluation of the molluscicidal activity of Calophyllum brasiliense Camb. (Clusiaceae). Quim Nova. 2005; 28 (4): 575-578. [ Links ]
65. Dharmaratne HRW, Wanigasekera WMA, Mata-Greenwood E, Pezzuto JM. Inhibition of human immunodeficiency virus type 1 reverse transcriptase activity by cordatolides isolated from Calophyllum cordatooblongum. Planta Med. 1998 Jun; 64 (5): 460- 461. [ Links ]
66. Xu ZQ, Hollingshead MG, Borgel S, Elder C, Khilevich A, Flavin MT. In vivo anti-HIV activity of (+)-calanolide A in the hollow fiber mouse model. Bioorg Med Chem Lett. 1999 Jan; 9(2): 133- 138. [ Links ]
67. Xu ZQ, Norris KJ, Weinberg DS, Kardatze J, Wertz P, Frank P and Flavin MT. Quantification of (+)-calanolide A, a novel and naturally occurring anti-HIV agent, by high-performance liquid chromatography in plasma from rat, dog and human. J. Chromatogr. B Biomed Sci Appl. 2000 Jun; 742 (2): 267-275. [ Links ]
68. Creagh T, Ruckle JL, Tolbert DT, Gilbtner J, Eiznhamer DA, Dutta B, Flavin MT, Xu ZQ. Safety and pharmacokinetics of single doses of (+)-calanolide A, a novel naturally occuring non-nucleoside reverse transcriptase inhibitor, in healthy, human inmunodeficiency virus-negative human subjects. Antimicrob Agents Chemother. 2001 May; 45 (5): 1379-1386. [ Links ]
69. Eiznhamer DA, Creag T, Ruckle JL, Tolbert DT, Giltner J, Dutta B, Flavin MT, Jenta T and Xu ZQ. Safety and pharmacokinetic profile of multiple escalating doses of (+)-calanolide A, a naturally occurring non-nucloside reverse transcriptase inhibitor, in healthy HIV-negative volunteers. HIV Clin Trials. 2002 Nov- Dec; 3 (6): 435-450. [ Links ]
70. Xu ZQ, Barrow WW, Suling WJ, Westbrook L, Barrow E, Lin YM, Flavin MT. Anti-HIV natural product (+)-calanolide A is active against both drug-susceptible and drug resistant strains of Mycobacterium tuberculosis. Bioorg Med Chem. 2004 Mar; 12 (5): 1199-1207. [ Links ]
71. García-Zebadúa JC, Magos-Guerrero GA, Mumbrú-Massip M, Estrada-Muñoz E, Contreras-Barrios MA, Huerta-Reyes M, Campos-Lara MG, Jiménez-Estrada M, Reyes-Chilpa R. Inhibition of HIV-1 reverse transcriptase, toxicological and chemical profile of Calophyllum brasiliense extracts from Chiapas, México. Fitoterapia. 2011 Oct; 82 (7): 1027-1034. [ Links ]
72. Zadonai RH, Coelho F, Ferreira J, Bittencourt AK, Weber M, Niero R, Cechinel V, Casagranda E. Evaluation of the proliferative activity of metanol extracts from six medicinal plants in murine spleen cells. Braz J Pharm Sci. 2010 Apr-Jun; 46 (2): 323-333. [ Links ]
73. Phillipi ME, Duarte BM, Vieira CDS, DeSouza MT, Niero R, Cechinel-Fhilo V, Casagranda-Bueno E. Immunostimulatory activity of Calophyllum brasiliense, Ipomea pes-caprae, and Matayba elaeagnoides demonstrated by human peripheral blood mononuclear cells proliferation. Acta Pol Pharm Drug Res (Natural Drugs). 2010 Jan-Feb; 67 (1): 69-73. [ Links ]
74. Bandara BMR, Ranjith H, Dharmaratne W, Sotheeswaran S, Balasubramaniam S. Two chemical distinct groups of Calophyllum species from Sri Lanka. Phytochemistry. 1986 Jan; 25(2): 425-428. [ Links ]
75. Lauré F, Raharivelomanana P, Butaud JF, Bianchini JP, Gaydou EM. Screening of anti-HIV-1 inofilums by HPLC-DAD of Calophyllum inofilum leaf extracts from French Polynesia Islands. Anal Chim Acta. 2008 Aug; 624 (1): 147-153. [ Links ]
76. Zavaleta-Mancera H, Reyes-Chilpa R and García-Zebadúa JC. Leaf structure of two chemotypes of Calophyllum brasiliense from Mexico. Microsc Microanal. 2011 Jul; 17 (suppl 2): 340-341. [ Links ]
77. Santillan S, Zarza E, Zavaleta-Mancera A, Navarro-Zayas X, González-MárquezH, Reyes-Chilpa R. Assessment of the phylogenetic and anatomical differences among three chemotypes of the tropical rainforest tree Calophyllum brasiliense in Mexico. Botanical Sci. Forthcoming. [ Links ]
78. Gautier J, Cave A, Kunesch G and Polonsky J. On the biosynthesis of neoflavonoids. Experientia. 1972; 28 (7): 759-761. [ Links ]
79. Ramiandrasoa F, Kunesch N, Poisson J. Le calofloride, intermédiaire d'un type nouveau de la biogenèse des néoflavonoïdes. Tetrahedron. 1983; 39(23): 3923-3928. [ Links ]
80. Singh IP and Bodiwala HS. Recent advances in anti-HIV natural products. Nat Prod Rep. 2010 Jan; 27(12): 1781-1800. [ Links ]