Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae vol.21 no.3 Medellín set./dez. 2014
ALIMENTOS: CIENCIA, TECNOLOGÍA E INGENIERÍA
EVALUACIÓN PRELIMINAR DEL BIOENSAYO PARA LA DETECCIÓN DE ANTIMICROBIANOS EN MÚSCULO BOVINO
PRELIMINARY EVALUATION OF THE BIOASSAY FOR THE DETECTION OF ANTIMICROBIAL IN BOVINE MUSCLE
Karen Lorena VELA PERDOMO, MSc(c).1; Mc allister TAFUR GARZÓN, PhD2, Martha Patricia VELA FLÓREZ, MSc.3, Martha Cecilia SUÁREZ ALFONSO, PhD(c)4
1 Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá; Dirección Técnica de Inocuidad e Insumos Veterinarios, Subgerencia de Protección Animal, Instituto Colombiano Agropecuario ICA. Bogotá, Colombia.
2 Dirección Técnica de Inocuidad e Insumos Veterinarios, Subgerencia de Protección Animal, Instituto Colombiano Agropecuario ICA, Bogotá, Colombia.
3 Laboratorio de Residuos de Medicamentos Veterinarios, Área de microbiología, Laboratorio Nacional de Insumos Pecuarios LANIP, Subgerencia de Análisis y Diagnóstico Instituto Colombiano Agropecuario ICA. Bogotá-Colombia.
4 Laboratorio de Microbiología. Departamento de Salud Animal, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia. Bogotá, Colombia.
* Autor a quien debe dirigirse la correspondencia: mcsuarezal@unal.edu.co.
Recibido: Noviembre 22 de 2013
Aceptado: Septiembre 11 de 2014
RESUMEN
Antecedentes: En Colombia, la vigilancia del cumplimiento de los Límites Máximos de Residuos LMRs de antimicrobianos veterinarios en carne bovina es exigua, debido a que la capacidad analítica es insuficiente para monitorear un gran número de muestras y un amplio rango de antibióticos. El bioensayo es un método microbiológico desarrollado por la agencia de salud pública (FSIS) del Departamento de Agricultura de Estados Unidos, para la detección, identificación y semicuantificación de residuos antimicrobianos. Objetivos: Se evaluó preliminarmente el bioensayo para determinar su uso como prueba de detección cualitativa para el monitoreo y vigilancia de residuos de cuatro antimicrobianos en músculo bovino, como contribución al sistema de gestión de inocuidad en el marco del Acuerdo sobre la aplicación de Medidas Sanitarias y Fitosanitarias, bajo lineamientos de la Comisión Europea, Decisión 2002/657/ CE. Métodos: El protocolo de experimentación usó tejidos fortificados con diferentes concentraciones de penicilina G potásica, oxitetraciclina, eritromicina y estreptomicina, como representantes de cuatro familias de antibióticos de uso veterinario en Colombia. Para el establecimiento de los criterios de funcionamiento del bioensayo se prepararon seis repeticiones de cada uno de los niveles o concentraciones probadas por antimicrobiano, incluyendo un nivel sin fortificación y cinco niveles de concentraciones antibióticas menores, iguales y superiores al Límite Máximo de Residuos LMRs de cada uno de los antimicrobianos analizados. Resultados: Se establecieron preliminarmente los criterios de funcionamiento del método (especificidad, límites de detección y estabilidad). La técnica mostró excelente especificidad (ningún falso-positivo); los límites de detección se determinaron para los cuatro antibióticos con relación a sus respectivos LMRs: Betalactámicos (penicilina G =LMR), tetraciclinas (oxitetraciclina =LMR), macrólidos (eritromicina =LMR) y aminoglucósidos (estreptomicina >4 LMR); sin embargo, la sensibilidad del bioensayo para estreptomicina no fue satisfactoria. La estabilidad de los analitos en la matriz fortificada al límite de detección, resultó adecuada durante el período de tiempo evaluado. Conclusiones: El método del bioensayo preliminarmente evaluado es aplicable a la detección de una amplia gama de residuos antimicrobianos en músculo bovino, a concentraciones iguales a los LMRs.
Palabras clave: Residuos antimicrobianos, Límite Máximo de Residuos LMRs, bioensayo.
ABSTRACT
Background: In Colombia, the vigilance of the Maximum Residue Limits MRLs of veterinary antimicrobials in cattle meat is limited, because the analytical capacity is insufficient to monitor a large number of samples and a wide range of antibiotics. The bioassay is a microbiological method developed by the health public agency (FSIS) of the United States Department of Agriculture (USDA) for the detection, identification and semiquantification of antimicrobial residues in cattle muscle. Objective: It was evaluated preliminary the bioassay for use as a test for the qualitative detection for monitoring and surveillance of four antimicrobials in cattle muscle, as contribution to the inocuity management system within the agreement framework about the application of Sanitary and Phytosanitary Measures; using some guidelines of the European Decision 2002/657/EC. Methods: The experimental protocol used fortified tissues with varying concentrations of penicillin G potassium, oxytetracycline, erythromycin and streptomycin, as representatives of the four important families of veterinary antibiotics used in Colombia. To establish the performance criteria of the bioassay were prepared six replicates of each of the levels or concentrations tested for antimicrobial, including a level without fortification and five levels of lower antibiotic concentrations, equal and above MRL Maximum Residue Limit for each one of the tested antimicrobials. Results: The performance characteristics of method were preliminarily determined (specificity, detection limits and stability). The test showed excellent specificity (no false positive); detection limits were determined for the four antibiotics in relation to their respective Maximum Residue Limit MRLs: Beta-lactams (penicillin G =MRL), tetracyclines (oxytetracycline =MRL), macrolides (erythromycin =MRL) and aminoglycosides (streptomycin >4 MRL); however, the sensitivity of bioassay for the streptomycin was unsatisfactory. Stability of the analytes in the matrix was adequate during the period evaluated. Conclusions: The preliminary bioassay method evaluated is applicable to the detection of a broad range of antimicrobial residues in bovine muscle at concentrations at the MRLs.
Keywords: antimicrobial residues, Maximum Residue Limit MRLs, bioassay.
INTRODUCCIÓN
En la especie bovina los antimicrobianos son administrados con fines terapéuticos o profilácticos (1) (2). Errores en la posología y el incumplimiento del tiempo de retiro, podrían generar la presencia de residuos en la carne destinada al consumo humano, pudiendo afectar la salud del consumidor por reacciones alérgicas o alteraciones de la microbiota intestinal o favoreciendo la selección de bacterias resistentes (3) (4). Se considera que las condiciones de inocuidad de la carne son un requisito indispensable para mejorar la competitividad de la cadena cárnica bovina y el acceso a mercados internacionales (5) (6), por lo que es fundamental contar con una técnica analítica microbiológica de referencia internacional como el bioensayo (7). Como una contribución al sistema de gestión de inocuidad en el marco del Acuerdo sobre la aplicación de Medidas Sanitarias y Fitosanitarias MSF mediante el trabajo conjunto del sector oficial y académico, se evaluó por primera vez en Colombia el bioensayo para la detección de residuos de cuatro antimicrobianos en músculo bovino. El trabajo de investigación fue desarrollado en el Laboratorio de Residuos de Medicamentos Veterinarios (área de microbiología analítica) del Laboratorio de Insumos Pecuarios LANIP del Instituto Colombiano Agropecuario ICA, ubicado en Mosquera-Cundinamarca.
En consideración al gran número de muestras y de antimicrobianos a determinar, resulta inviable la utilización inicial de técnicas de alta especificidad como los métodos fisicoquímicos cromatográficos, debido a su elevado costo y laboriosidad. Por tal razón para monitorear la presencia de residuos antimicrobianos, el primer paso es la detección, cribado o screening (8). Este documento describe una evaluación preliminar del bioensayo como un método de screening para residuos de cuatro antimicrobianos en tejido muscular bovino.
La Decisión Europea 2002/657/CE (9) define los métodos de cribado como los ''utilizados para detectar la presencia de una sustancia, o tipo de sustancias, al nivel de interés. Estos métodos permiten tratar un elevado número de muestras y se utilizan para cribar grandes cantidades de muestras en busca de posibles resultados no conformes. Están diseñados específicamente para evitar resultados de falso conforme''. Con frecuencia la etapa de cribado se basa en métodos microbiológicos porque son económicos, rápidos y de amplia gama de detección (multiresiduos) (8). El bioensayo trabaja con placas de agar con condiciones específicas que las hacen sensibles preferencialmente a una determinada familia de antibióticos: la placa 1 a tetraciclinas, la 2 a ß-lactámicos, la 3 a aminoglucósidos y la placa 4 a macrólidos (10).
El establecimiento de las características de funcionamiento de un método microbiológico, idealmente debería emplear matrices usadas como tejido blanco y músculo dosificado o incurrido (procedente de un animal al cual se le ha administrado el antibiótico). Sin embargo, en la especie bovina, la producción de materiales incurridos para cada antimicrobiano a concentraciones específicas, consumiría mucho tiempo y dinero (4). Por lo tanto, para establecer si el bioensayo detecta la presencia de residuos antibióticos al nivel de interés en músculo y si puede cumplir los criterios de funcionamiento descritos en la Decisión Europea 2002/657/CE (9), se emplearon extractos de músculo blanco bovino y de músculo bovino fortificado a diferentes concentraciones antimicrobianas, con el objetivo de evaluar el método microbiológico del bioensayo y determinar su uso como prueba de screening para el monitoreo y vigilancia de residuos antimicrobianos en carne bovina, contribuyendo a garantizar la inocuidad alimentaria.
MATERIALES Y MÉTODOS
Soluciones antimicrobianas
Se utilizaron estándares antibióticos Sigma- Aldrich®, preparando soluciones stock de 1.000 ppm de cada antibiótico, después de la corrección de la potencia: Penicilina G potásica se disolvió en buffer fosfato 0,1 M pH 6±0,1; clorhidrato de oxitetraciclina en HCl 0,01 N; eritromicina en metanol y buffer fosfato 0,2 M pH 8±0,1; y sulfato de estreptomicina en agua destilada.
Organismos de prueba
Kocuria rhizophila, ATCC 9341a; esporas de Bacillus cereus var. mycoides, ATCC 11778 y esporas de Bacillus subtilis, ATCC 6633.
Placas del bioensayo
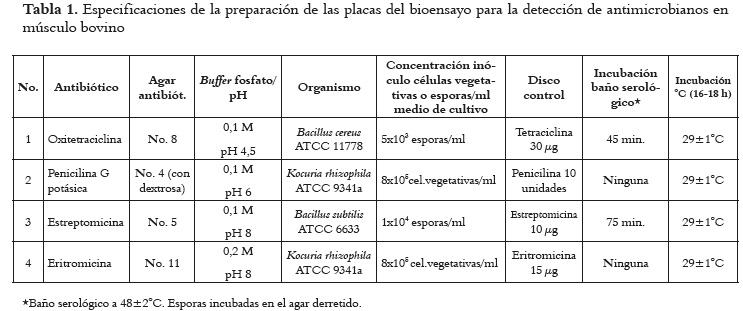
Se realizó el bioensayo en cuatro placas para la detección cualitativa de residuos antimicrobianos en músculo bovino según los lineamientos de la ''Guía de Laboratorio de Microbiología, MLG 34.02'' del USDA/FSIS (10), denominada ''Bioassay for the detection, identification and quantitation of antimicrobial residues in meat and poultry tissue''. Las características y especificaciones para la preparación de cada una de las placas se indican en la tabla 1.
Preparación de los inóculos bacterianos
Para la obtención de la suspensión de células vegetativas, la cepa de trabajo fue sembrada e incubada y su cultivo cosechado, lavado, centrifugado, resuspendido y cuantificado para usarse en la preparación de las placas 2 y 4 del bioensayo. Las esporas de Bacillus subtilis y Bacillus cereus fueron obtenidas en agar esporulante (previa siembra e incubación), cosechadas y lavadas por centrifugación. El contenido de células vegetativas o esporas/ml de suspensión se calculó por recuento en superficie en placas de Petri.
Con el número estimado de células vegetativas/ esporas por ml de suspensión, se calculó el volumen requerido para inocular el agar antibiótico correspondiente, de tal forma que se cumpliera con las concentraciones finales de microorganismos especificadas en la tabla 1.
Inoculación de agares
La suspensión de células vegetativas o esporas bacterianas a la concentración requerida fue adicionada al medio de cultivo correspondiente a 48±2ºC licuado y se mezcló mediante agitación, vertiendo 8 - 8,5 ml del agar en placas de Petri de 100x15 mm. El agar fue distribuido uniformemente hasta cubrir el fondo, permitiendo que se solidificara sobre una superficie nivelada. Las placas se rotularon y almacenaron entre 2 y 8°C hasta el siguiente día.
Tejido blanco
Con el fin de disponer de tejido proveniente de animales no tratados con ningún medicamento veterinario (tejido blanco), para ser usado como control negativo y para fortificarlo, se obtuvo músculo de bovinos machos criados en una granja del Instituto Colombiano Agropecuario ICA. A estos animales no se les administraron productos farmacéuticos de ninguna clase durante los cuatro meses previos al sacrificio. El tejido fue homogenizado y almacenado a -70°C.
Tejido fortificado
La fortificación con cada analito se realizó mediante la adición de las concentraciones antibióticas al tejido blanco antes de la extracción. Por ejemplo, para obtener una concentración en músculo equivalente a 0,05 ppm ó 50 ppb de penicilina G (nivel correspondiente al LMR), 125 μl de una solución de 2 ppm del antibiótico ß-lactámico se añadieron a 5±0,2 g de músculo homogenizado. Después de la fortificación, el tejido se dejó reposar durante quince minutos antes de la extracción. Los tejidos fueron fortificados y analizados durante el mismo día.
Para el establecimiento de los criterios de funcionamiento del bioensayo, se prepararon seis (6) repeticiones de cada uno de los niveles o concentraciones probadas por antimicrobiano. Así, el nivel 0 correspondió a las matrices que no fueron fortificadas, y los niveles 1, 2, 3, 4 y 5, a las concentraciones antibióticas menores, iguales y superiores al LMR de cada uno de los cuatro antimicrobianos (9, 10).
Preparación de los extractos
A las muestras de músculo bovino fortificadas y no fortificadas, pesadas en porciones de 5±0,2 g en bolsas estériles identificadas con los tipos de soluciones buffer pH 4,5; pH 6; pH 8 0,1 M y pH 8 0,2 M, se les adicionaron 20±0,5 ml del buffer correspondiente.
Los tejidos y las soluciones tamponadas fueron mezclados en un homogenizador de alimentos (Stomacher® 400 Circulator Seward), durante sesenta (60) segundos a 592 r.p.m. Los extractos obtenidos se dejaron reposar por cuarenta y cinco (45) minutos y luego se transfirieron a tubos, los cuales fueron centrifugados durante 10 minutos a 5 °C y 4.000 r.p.m.
Montaje
Las placas se rotularon de acuerdo a lo indicado en la tabla 1 y a la concentración antibiótica evaluada. Cuidadosamente se ubicaron seis cilindros (cilindros plásticos de 8 mm de diámetro interno, 9 mm de diámetro externo y 10 mm de altura) en cada placa, identificando el inicial mediante una línea demarcada al reverso y al lado de cada caja.
Tres placas enteras fueron usadas para cada concentración probada, llenando los cilindros con 200±4 μl del extracto de la matriz de prueba correspondiente. Las placas se incubaron a 29±1°C durante 16 a 18 horas. Después de la remoción de los cilindros, la zona de lectura fue alineada a ''0'' y se empezó a leer el resultado desde el primer pozo en el sentido de las manecillas del reloj, empleando para tal fin un calibrador.
Determinación de la sensibilidad
Se empleó un rango de cinco concentraciones para fortificar músculo bovino del que se obtuvieron los extractos. Adicionalmente se usó extracto de tejido blanco como control negativo.
Una zona de inhibición > 9 mm indicó un resultado positivo, considerando que corresponde a la medida del diámetro externo de los cilindros. Para fijar el límite de detección se tuvo en cuenta el criterio establecido por la Decisión 2002/657/CE, de manera que el porcentaje de falsos resultados negativos fuera inferior al 5% al nivel del límite de detección (11). Se estableció como el límite de detección del antibiótico para la matriz el nivel en el que en las seis repeticiones (dieciocho lecturas) se observaron resultados positivos.
Evaluación de la especificidad
Se analizaron extractos obtenidos de 24 muestras de tejido blanco de bovinos. Estas matrices se probaron con el bioensayo en las cuatro placas. El cálculo de la especificidad relativa se realizó mediante la fórmula: Verdaderos Negativos/Verdaderos Negativos + Falsos Positivos * 100.
Análisis de la estabilidad
Para la determinación de la estabilidad de los analitos en la matriz, se consideraron las directrices de la Comisión Europea (12), que al respecto plantea en la Decisión 2002/657/CE (9) el procedimiento para enriquecer material en blanco con el analito de interés, incluyendo las instrucciones sobre la temperatura de conservación de las muestras, indicando que el tejido debe almacenarse como mínimo a -20°C, o menos si es necesario. Por esta razón y considerando también los resultados de estudios relacionados (13), se prepararon soluciones de antimicrobianos a los límites de detección establecidos, y se inocularon en músculo blanco que posteriormente se congeló a -70°C . El bioensayo se realizó a éstas matrices el día en que fueron fortificadas y a los 30 días posteriores a la adición de los antibióticos.
Comparación del desempeño del bioensayo y prueba comercial
Con el fin de comprobar el adecuado desempeño del bioensayo evaluado, se analizaron muestras de músculo diafragmático (n=100) obtenidas de bovinos machos y hembras faenados en una planta de beneficio ubicada en la ciudad de Bogotá D.C. De manera paralela, las muestras fueron procesadas mediante la prueba comercial Premi®Test (DSM) que cuenta con la evaluación de los criterios de funcionamiento establecidos en la Decisión Europea 2002/657/CE (9), con validación de AOAC (Association of Analytical Communitie) (14) y AFNOR (French Association for Normalisation), basada en la comparación con el método de referencia de las cuatro placas, el cual es oficial en Francia, y con el protocolo STAR (prueba con cinco placas) (15). La prueba comercial se usó de acuerdo a las instrucciones del fabricante. En resumen, 100 μl de fluido cárnico fueron adicionados en la superficie de cada ampolla, dejándola reposar durante 20 minutos a temperatura ambiente para permitir la pre-difusión. Luego se eliminó el exceso de fluido por lavado doble con agua destilada que fue descartada. Las ampollas fueron cubiertas con la lámina y llevadas a baño serológico a 64°C durante tres horas, periodo durante el cual el control negativo viró a amarillo. La prueba se fundamenta en la inhibición del crecimiento bacteriano de Geobacillus stearothermophilus (antes Bacillus stearothermophilus).
Como controles positivos de ambos métodos microbiológicos, se usaron tejidos incurridos de un bovino al que se le administró por inyección intramuscular un medicamento veterinario registrado, que contenía penicilina G procaínica, penicilina G potásica y sulfato de estreptomicina, cuyo tiempo de retiro aprobado es de 30 días. El producto se usó a una dosis práctica de 1 ml por cada 15 kg de peso vivo (15.000 UI de penicilinas por kg de peso del animal y 20 mg de estreptomicina por kg de peso vivo); se utilizó material desechable para la aplicación cada 12 horas, alternando los puntos de inyección entre el glúteo profundo derecho y el izquierdo, hasta completar ocho inyecciones consecutivas. Ocho horas después de la última administración, el bovino fue sacrificado y se tomaron muestras de tejido muscular.
RESULTADOS
Determinación de la sensibilidad
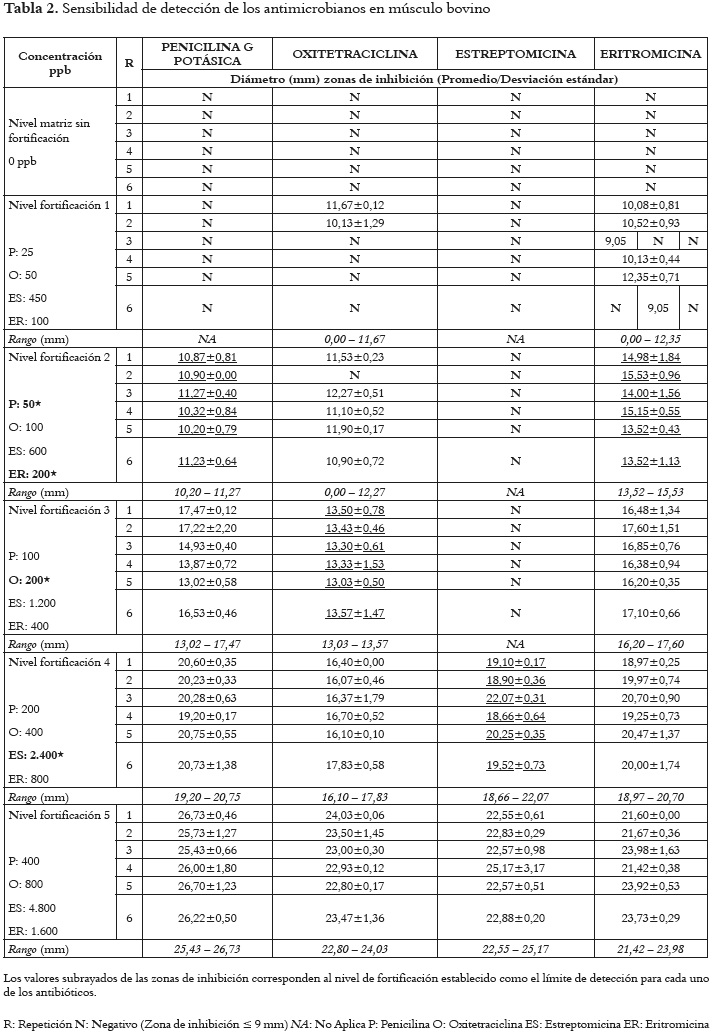
Los resultados de la sensibilidad para cada uno de los antimicrobianos en músculo bovino se muestran en la tabla 2. Los valores subrayados de las zonas de inhibición corresponden al nivel de fortificación establecido como el límite de detección para cada uno de los antibióticos, en razón a que las dieciocho mediciones tuvieron un porcentaje de falsos resultados negativos inferior al 5% (error ß) al nivel de interés (11).
Las porciones de músculo fortificadas con 50 ppb de penicilina G potásica, produjeron zonas de inhibición cuya medida promedio fue de 10,79 mm con una desviación estándar σ de 0,69. Para el caso de oxitetraciclina, el promedio de los halos de inhibición generados a la concentración de 200 ppb fue de 13,36 mm con una σ de 0,85. Las matrices adicionadas con 2.400 ppb de estreptomicina formaron zonas de inhibición con una medida promedio de 20,30 mm y con una σ de 2,30. Finalmente, el promedio de los halos de inhibición producidos por las porciones de músculo fortificadas con 200 ppb de eritromicina, fue de 14,45 mm y la σ 1,29.La figura 1 muestra la relación entre los límites de detección establecidos para los cuatro antimicrobianos y sus respectivos LMRs en músculo. Se determinó que el bioensayo detectó penicilina G potásica, oxitetraciclina y eritromicina al nivel de los LMR en músculo bovino, establecidos por el Codex Alimentarius para los tres primeros compuestos y por la Agencia Europea del Medicamento EMA para el caso de eritromicina, antibiótico para el cual el Codex Alimentarius no ha definido LMRs en la especie bovina. Sin embargo, la sensibilidad frente a estreptomicina (aminoglucósidos) se evidenció en un nivel correspondiente a cuatro veces el LMR.
Evaluación de la especificidad
Se evaluaron extractos obtenidos de 24 muestras de músculo bovino procedente de animales no tratados previamente con ningún antimicrobiano. El análisis de estos tejidos con el bioensayo en las cuatro placas, no mostró resultados falsos positivos. Por lo tanto, la especificidad determinada fue del 100%.
Análisis de la estabilidad
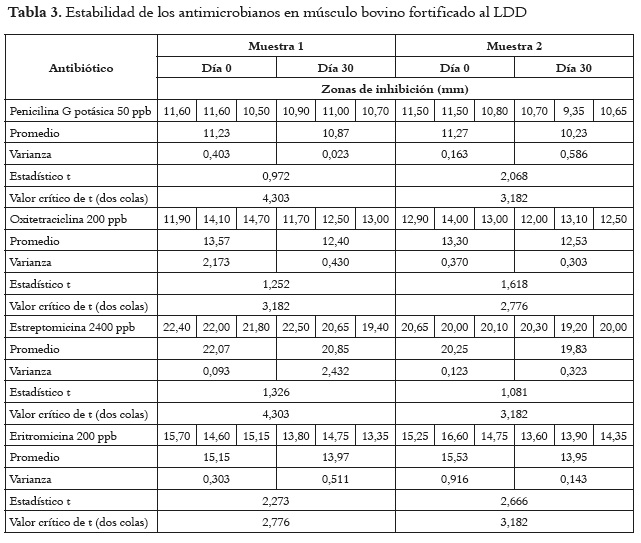
Las soluciones de antimicrobianos preparadas a los límites de detección establecidos, con las que se fortificaron cuatro porciones de 5±0,2 g de músculo blanco por sustancia antibiótica, luego de realizarles el bioensayo a dos muestras el mismo día de la fortificación y a los 30 días de congelación a -70°C, produjeron zonas de inhibición superiores a 9 mm para todos los extractos de los tejidos. A los diámetros de las zonas de inhibición generadas el día cero y el día treinta por las concentraciones correspondientes al límite de detección de cada uno de los antibióticos en músculo bovino, se les realizó la ''Prueba t para dos muestras suponiendo varianzas desiguales'', con el propósito de investigar si habían diferencias estadísticamente significativas en el tamaño de los halos, debidas al almacenamiento de las muestras durante un mes a la temperatura de -70°C. Los resultados pueden observarse en la tabla 3.
DISCUSIÓN
El bioensayo multiplacas descrito en la Guía de Laboratorio de Microbiología del Food Safety and Inspection Service -FSIS-, agencia de salud pública dentro del United States Department of Agriculture -USDA-, es un método microbiológico de referencia internacional que se evaluó por primera vez en Colombia, empleando matrices fortificadas con diferentes concentraciones de penicilina G potásica, oxitetraciclina, eritromicina y estreptomicina, como representantes de cuatro familias de antibióticos de uso veterinario. Se establecieron los parámetros de sensibilidad, especificidad y estabilidad, considerando algunos lineamientos de la guía de la Decisión Europea 2002/657/CE que se refiere al funcionamiento de los métodos analíticos.
Un método de screening eficiente requiere ser de bajo costo y alto rendimiento, capaz de identificar potenciales muestras no conformes a partir de una gran cantidad de muestras (9), (16). Las pruebas de inhibición microbiológicas fueron los primeros métodos desarrollados para la detección de residuos antibióticos, y aún son ampliamente usadas porque son muy costo-efectivas y en contraste por ejemplo con pruebas inmunológicas o basadas en receptores, tienen la posibilidad de cubrir una amplia gama de residuos antibióticos. Además, mediante la introducción de un procedimiento preliminar de identificación microbiológica, es posible realizar una caracterización post-screening del residuo que reducirá significativamente los costos y esfuerzos dedicados a la identificación y cuantificación por métodos químicos confirmatorios.
En este sentido, la evaluación de los criterios de funcionamiento del método, resulta esencial en la selección de una estrategia analítica para la determinación de residuos (4).
Al respecto de la determinación de la sensibilidad, se ha demostrado que los residuos antibióticos tienden a acumularse en el tejido renal, por lo que varias técnicas microbiológicas y kits comerciales de cribado como Belgian Kidney Test BKT, New Dutch Kidney Test NDKT, Four Plate Test FPT, Swab Test On Premises STOP, Two Plate Test, Calf Antibiotic and Sulfa Test CAST, Fast Antibiotic Screen Test FAST y Premi® Test, emplean de manera rutinaria esta matriz de prueba (4, 8, 10, 17-19). Sin embargo, teniendo en cuenta que la carne bovina es un producto calificado como de potencial exportable (5) y es el tejido que con más frecuencia es consumido, se seleccionó una técnica que usara músculo como matriz de prueba.
El bioensayo detectó penicilina G potásica, oxitetraciclina y eritromicina al nivel de los LMRs en músculo bovino, establecidos por el Codex Alimentarius y en la normatividad nacional del Ministerio de Salud y Protección Social (Resolución 1382 de 2013) (20), para los tres primeros compuestos, y por la Agencia Europea del Medicamento EMA para el caso de eritromicina, antibiótico para el cual el Codex Alimentarius no ha definido LMRs en la especie bovina. Los límites de detección se establecieron con base en el criterio establecido por la Decisión 2002/657/CE, según el cual el porcentaje de falsos resultados negativos debe ser inferior al 5% al nivel del límite de detección (11). Para estas concentraciones de antibióticos, una vez analizadas las muestras de músculo bovino, en todos los casos resultaron positivas al nivel del límite máximo de residuos, provocando halos superiores a 9 mm. Por lo tanto se cumple con el criterio fijado en la Decisión 2002/657/CE, dado que el porcentaje de falsos negativos no supera el 5% a estas concentraciones y se concluye que la técnica es válida para el uso previsto.
Sin embargo, en éste estudio la sensibilidad frente a estreptomicina no fue satisfactoria ya que la detección se evidenció en un nivel correspondiente a cuatro veces el LMR en músculo. Esto es concordante con los hallazgos de Gaudin y col., quienes validaron el protocolo STAR (Screening Test for Antibiotic Residues) que comprende cinco placas para el screening de residuos antibióticos en músculo de diferentes especies animales, en el que se determinó un límite de detección para estreptomicina, ocho veces superior al LMR (21).
Otros estudios desarrollados por Stead y col. (16) evidencian que la sensibilidad de Premi® Test para compuestos aminoglucósidos en músculo fue insuficiente. En el mismo sentido, Pikkemaat y col (22) compararon tres métodos microbiológicos (Nows Antibiotic Test NAT, STAR y Premi® Test) con muestras de bovinos y porcinos procedentes de monitoreo de rutina. Con respecto a la detección de aminoglucósidos, la mayor diferencia se determinó entre NAT y STAR, y fue asociada a la matriz usada en las pruebas; NAT detectó muestras positivas en riñón, de las cuales en cuatro se confirmó por LC-MS-MS la presencia de residuos de neomicina, estreptomicina y gentamicina, a niveles de aproximadamente la mitad de los LMRs en riñón. No obstante, ni el método STAR ni la cromatografía líquida acoplada a espectrometría de masas detectaron niveles de residuos en la carne de esos animales.
Ésta observación puede tener implicaciones importantes para los métodos de screening microbiológicos basados en el análisis de muestras de riñón, y que usan Bacillus subtilis como organismo de prueba. La sensibilidad de ésta bacteria a los aminoglucósidos, podría conducir a una condenación injusta a una canal bovina, fundamentada en un resultado positivo a la prueba en riñón. En general, el riñón se considera un buen indicador de presencia de residuos de antimicrobianos en otras partes del organismo, pero debido al mecanismo de excreción renal de los aminoglucósidos, ellos representan una excepción a ésta regla.
En éste sentido, se sugiere probar variaciones al método del bioensayo en músculo, como pretratamiento del tejido (17) o el uso de la matriz sin dilución ni extracción como lo describe el método alemán descrito por Nouws y col (23), Nouws (24) y Gesche (25), así como el método de las cuatro placas 26), con el propósito de valorar la sensibilidad a los aminoglucósidos en músculo.
Con relación a la evaluación de la capacidad de detección, sería ideal emplear pruebas que analizaran tejido intacto y calcular los límites de detección usando muestras provenientes de animales medicados experimentalmente (8, 27). Sin embargo, en la especie bovina el uso de tejidos fortificados para la determinación de los límites de detección se constituye en una valiosa opción, considerando que la producción de materiales incurridos para cada antibiótico a las concentraciones adecuadas es una tarea que consumiría mucho tiempo y sería extremadamente costosa. Además, sería realmente difícil obtener de manera exacta las concentraciones deseadas después del tratamiento de los animales (21). Alternativamente, algunos otros estudios del desempeño de métodos microbiológicos de screening usan muestras provenientes de programas de monitoreo (4, 8, 28). La mayoría de acercamientos provechosos usaron animales sacrificados de emergencia, de los que se disponía información que indicaba que ellos fueron sacrificados antes del final del periodo de retiro. Sin embargo, estos estudios arrojaron únicamente un número limitado de muestras positivas que representaban solo un grupo pequeño de sustancias, planteando el cuestionamiento sobre si otros residuos estuvieron presentes y no fueron detectados debido a que el método fue insensible.
En el presente estudio las muestras de músculo procedentes de bovinos faenados no mostraron residuos antimicrobianos. Los resultados de los métodos microbiológicos del bioensayo y la prueba comercial fueron compatibles al indicar la ausencia de residuos antibióticos en los tejidos de los animales sacrificados en la planta de beneficio. Los resultados son confiables en razón a que los límites de detección establecidos para la prueba microbiológica del bioensayo cumplen con los LMRs en músculo bovino fijados por la legislación nacional. En el mismo sentido, la capacidad de detección de la prueba comercial Premi® Test, que es considerada la única prueba microbiológica de tubo para la cual hay una cantidad sustancial de literatura disponible (8), también se ajusta para penicilina G, oxitetraciclina y eritromicina, en relación con los respectivos LMRs en músculo bovino.
En contraste, las muestras dosificadas o incurridas con penicilina G procaínica, penicilina G potásica y estreptomicina fueron identificadas por el bioensayo como positivas a la presencia de residuos de los antibióticos betalactámicos, más la prueba no indicó resultados positivos para el caso de residuos del antimicrobiano aminoglucósido, lo cual es concordante con los hallazgos de Pikkemaat y col (22) y con la sensibilidad de detección determinada para la estreptomicina en el bioensayo. Por otra parte, la prueba comercial con la que se analizaron los tejidos incurridos indicó que las muestras contenían residuos antibióticos. No obstante, teniendo en cuenta la sensibilidad insuficiente de Premi® Test para compuestos aminoglucósidos (16), es posible afirmar que la detección de los residuos presentes en las muestras incurridas correspondió a los generados por las penicilinas.
Parece difícil comprender la verdadera capacidad de detección de las técnicas microbiológicas. Debido a la carencia de métodos de fortificación apropiados y a la imposibilidad de obtener un rango ajustado de tejidos incurridos a los niveles adecuados, los métodos de screening con frecuencia se validan usando únicamente soluciones estándares (28-30). De hecho, la guía de laboratorio de USDA/ FSIS que describe el bioensayo para la detección, identificación y semicuantificación de residuos antimicrobianos en tejidos de bovinos y aves (10), establece que la concentración más baja de una solución estándar de referencia que produce una zona de inhibición de al menos 8 mm sobre una placa en particular, es señalada como la concentración mínima inhibitoria, y es la que define los límites de detección para los residuos antibióticos. Sin embargo esto es altamente cuestionable puesto que el alcance de la información obtenida no puede compararse con la evaluación del desempeño de una prueba sobre tejidos incurridos, dado que se omite el efecto potencial de la matriz (8).
Una cuarta posibilidad es trabajar ''tejidos simulados o fortificados'' como lo presenta éste documento. Bajo estas condiciones el efecto de la matriz se tiene en cuenta, aproximándose más a muestras de músculo incurridas (21). La unión de los antibióticos al tejido muscular homogenizado es posible durante la inoculación (8) y esto fue evidenciado en la determinación de los límites de detección de oxitetraciclina, penicilina G potásica y eritromicina, casos en los cuales la sensibilidad fue igual a los correspondientes LMRs.
En este sentido, se ha planteado limitar el número de compuestos para validar los métodos de amplia gama de detección señalando ''compuestos representativos'' ya que se asume que uno o dos miembros de un mismo grupo antibiótico pueden actuar como representantes para el grupo entero (21). No obstante, esto hay que tratarlo cuidadosamente en razón a que la bioactividad relativa de compuestos dentro de un grupo puede diferir cuando ellos son expuestos a diferentes bacterias de prueba (22).
Respecto a la evaluación de la especificidad de los métodos analíticos, la Decisión Europea 2002/657/ CE (9) describe dos pasos. El primero consiste en examinar las sustancias estrechamente relacionadas con el o los analitos, tales como isómeros, metabolitos y productos de degradación que pueden interferir con la especificidad del método analítico. Sin embargo, en razón a que el bioensayo es una prueba de tamizaje diseñada para detectar una cantidad importante de sustancias antimicrobianas, la medición de la especificidad no es relevante para este método.
Secundariamente, la guía europea plantea la importancia de estudiar cualquier interferencia que pudiera resultar de los componentes de la matriz. En virtud de ello, se evaluaron extractos obtenidos de 24 muestras de músculo bovino procedentes de animales que no habían sido tratados con ningún antimicrobiano. El análisis de estos tejidos con el bioensayo en las cuatro placas, no mostró resultados falsos positivos, indicando que los constituyentes de la matriz no afectan la especificidad del bioensayo.
Finalmente, en relación con el análisis de la estabilidad, a los diámetros de las zonas de inhibición generadas el día cero y el día treinta por las concentraciones correspondientes al límite de detección de cada uno de los antibióticos en músculo bovino, se les realizó la ''Prueba t para dos muestras suponiendo varianzas desiguales'', con el propósito de investigar si habían diferencias estadísticamente significativas en el tamaño de los halos, debidas al almacenamiento de las muestras durante un mes a la temperatura de -70°C. En todos los casos, el ''Estadístico t'' tuvo un valor inferior al ''Valor crítico de t (dos colas)'', por lo que la hipótesis nula no fue rechazada, encontrando igualdad en los diámetros de las zonas de inhibición producidas por las muestras analizadas el mismo día de la fortificación y treinta días después de la misma. En éste sentido, es posible afirmar que la capacidad de detección de los antimicrobianos en los extractos, no se ve afectada por las condiciones de tiempo (30 días) y temperatura (-70°C), y se concluye que los analitos son estables en la matriz inoculada con la concentración establecida como límite de detección.
Al respecto de la estabilidad de antibióticos betalactámicos en músculo, se encontraron coincidencias con los hallazgos de Verdon y col (13), quienes mediante pruebas microbiológicas demostraron la estabilidad de residuos de ampicilina en muestras incurridas de músculo porcino almacenadas durante 30 días a -75°C. Al tenor de los avances realizados en química analítica desde la adopción de la Directiva 96/23/CE, que han dejado obsoleto el concepto de métodos de rutina y métodos de referencia y lo han reemplazado por un planteamiento en el que se establecen criterios de funcionamiento y procedimientos de validación de los métodos de cribado y confirmación, consideramos importante validar completamente el bioensayo de acuerdo a lo establecido en la Decisión de la Comisión 2002/657/CE, con una optimización previa del límite de detección para la placa de aminoglucósidos, el cual aunque es mejor que el reportado para otros métodos microbiológicos cualitativos, se determinó superior al LMR establecido para la matriz de músculo bovino.
CONCLUSIONES
En el presente estudio se evaluaron criterios de funcionamiento del bioensayo (especificidad, límites de detección y estabilidad) según algunos lineamientos de la Decisión Europea 2002/657/ CE, para la detección de residuos de cuatro representantes antimicrobianos en músculo bovino. La prueba mostró excelente especificidad (ningún falso-positivo); los límites de detección se determinaron para los cuatro antibióticos con relación a sus respectivos límites máximos de residuos: Betalactámicos (penicilina G =LMR), tetraciclinas (oxitetraciclina =LMR), macrólidos (eritromicina =LMR); sin embargo, la sensibilidad del bioensayo frente a aminoglucósidos (estreptomicina >4 LMR) no fue satisfactoria. La estabilidad de los analitos en la matriz fortificada al límite de detección de cada uno de los antibióticos, resultó adecuada durante el período de tiempo evaluado. El método analítico microbiológico del bioensayo es aplicable a la detección preliminar de una amplia gama de residuos antimicrobianos en músculo bovino.
La evaluación preliminar que se realizó del bioensayo, determinó que puede ser usado como un método de screening para el monitoreo y vigilancia de los residuos de antimicrobianos en carne bovina, con la ventaja de mejorar las posibilidades y precisión de la identificación presuntiva de residuos de tetraciclinas, betalactámicos y macrólidos, lo cual puede reducir los esfuerzos y costos en la confirmación. La evaluación del desempeño del método analítico microbiológico del bioensayo, apoyará la implementación del ''Programa de Control de Residuos de Medicamentos Veterinarios'' en Colombia, contribuyendo a garantizar la inocuidad alimentaria para proteger la salud de los consumidores, mejorar las condiciones de competitividad y cumplir los requisitos del comercio internacional de alimentos de origen animal.
AGRADECIMIENTOS
Al Instituto Colombiano Agropecuario ICA, en especial a la Dirección Técnica de Inocuidad e Insumos Veterinarios y al Laboratorio Nacional de Insumos Pecuarios LANIP. Al Frigorífico Guadalupe EFEGE, por el apoyo logístico que permitió la toma de las muestras. Al Laboratorio de Microbiología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia y a la Dirección de Investigación sede Bogotá DIB, por haber contribuido a la financiación del trabajo a través de la convocatoria de apoyo a programas de posgrado.
Conflicto de intereses
Los autores no declaramos conflicto de intereses con los resultados.
REFERENCIAS
1. Anadón A, Martinez-Larranaga M. Residues of antimicrobial drugs and feed additives in animal products: regulatory aspects. Livestock Production Science. 1999;59(2):183-98. [ Links ]
2. Sumano H, Ocampo L. Farmacología veterinaria. México: McGraw-Hill Interamericana; 2006. 1092 p. [ Links ]
3. Doyle E. Veterinary drug residues in processed meats-Potential health risk. A review of the scientific literature. Fri Briefings, Food Research Institute, University of Wisconsin 2006. 11 p. [ Links ]
4. Myllyniemi A-L. Development of microbiological methods for the detection and identification of antimicrobial residues in meat: Faculty of Veterinary Medicine, University of Helsinki; 2004. 87 p. [ Links ]
5. DNP DNdP. Documento Consejo Nacional de Política Económica y Social Conpes 3375: Política nacional de sanidad agropecuaria e inocuidad de alimentos para el sistema de medidas sanitarias y fitosanitarias. In: Rural MdAyD, Social MdP, Ministerio de Ambiente VyDT, Ministerio de Comercio IyT, editors. Bogotá 2005. 39 p. [ Links ]
6. DNP DNdP. Documento Consejo Nacional de Política Económica y Social CONPES 3676 Consolidación de la política sanitaria y de inocuidad para las cadenas láctea y cárnica. 2010. 84 p. [ Links ]
7. DNP DNdP. Documento Consejo Nacional de Política Económica y Social CONPES 3376: Política sanitaria y de inocuidad para las cadenas de la carne bovina y de la leche. 2005:39. [ Links ]
8. Pikkemaat MG. Microbial screening methods for detection of antibiotic residues in slaughter animals. Analytical and bioanalytical chemistry. 2009;395(4):893-905. [ Links ]
9. CCE CdlCE. Decisión de la Comisión 2002/657/CE del 12 de agosto de 2002 Por la que se aplica la Directiva 96/23/CE del Consejo en cuanto al funcionamiento de los métodos analíticos y la interpretación de los resultados. Diario Oficial de las Comunidades Europeas. 2002;17(221):8-36. [ Links ]
10. FSIS. Bioassay for the Detection, Identification and Quantitation of Antimicrobial Residues in Meat and Poultry Tissue MLG 34.02. United States Department of Agriculture, Food Safety and Inspection Service, Office of Public Health Science; 2007. 60 p. [ Links ]
11. Diez P, Medina E, Martín M, Calderón V. Validación del método de cribado de las cinco placas para detección de residuos de antibióticos en alimentos. Estimación del límite de detección. In: Centro Nacional de Alimentación. Agencia Española de Seguridad Alimentaria y Nutrición. Ministerio de Sanidad SSeI, editor. 16 ed. Madrid: Rev. Com. Cient. AESAN; 2012. 109-30 p. [ Links ]
12. Residues CCRL. Guidelines for the validation of screening methods for residues of veterinary medicines (initial validation and transfer of method). 2010. 20 p. [ Links ]
13. Verdon E, Fuselier R, Hurtaud-Pessel D, Couëdor P, Cadieu N, Laurentie M. Stability of penicillin antibiotic residues in meat during storage: Ampicillin. Journal of Chromatography A. 2000;882(1):135-43. [ Links ]
14. AOAC. Premi Test AOAC Performance Tested Method. Method Validation Study Report. The Netherlands2006. 109 p. [ Links ]
15. Gaudin V, Juhel-Gaugain M, Morétain J-P, Sanders P. AFNOR validation of Premi® Test, a microbiological-based screening tube-test for the detection of antimicrobial residues in animal muscle tissue. Food Additives and Contaminants. 2008;25(12):1451-64. [ Links ]
16. Stead S, Sharman M, Tarbin J, Gibson E, Richmond S, Stark J, et al. Meeting maximum residue limits: an improved screening technique for the rapid detection of antimicrobial residues in animal food products. Food additives and contaminants. 2004;21(3):216-21. [ Links ]
17. Cantwell H, O'keeffe M. Evaluation of the Premi® Test and comparison with the One-Plate Test for the detection of antimicrobials in kidney. Food additives and contaminants. 2006;23(2):120-5. [ Links ]
18. Pikkemaat MG, Rapallini ML, Zuidema T, Elferink JA, Oostravan Dijk S, Driessen-van Lankveld WD. Screening methods for the detection of antibiotic residues in slaughter animals: comparison of the European Union Four-Plate Test, the Nouws Antibiotic Test and the Premi® Test (applied to muscle and kidney). Food Additives and Contaminants. 2011;28(1):26-34. [ Links ]
19. FSIS. Inhibition Screen Test for Antimicrobial Drugs. In: USDA, editor. CLG-ADD 3022012. 8 p. [ Links ]
20. Social MdSyP. Resolución 1382 de 2013 Por la cual se establecen los límites máximos para residuos de medicamentos veterinarios en los alimentos de origen animal, destinados al consumo humano. 2013. 15 p. [ Links ]
21. Gaudin V, Hedou C, Rault A, Verdon E. Validation of a Five Plate Test, the STAR protocol, for the screening of antibiotic residues in muscle from different animal species according to European Decision 2002/657/EC. Food Additives and Contaminants. 2010;27(7):935-52. [ Links ]
22. Pikkemaat MG, Rapallini ML, Dijk SO-v, Elferink J. Comparison of three microbial screening methods for antibiotics using routine monitoring samples. Analytica chimica acta. 2009;637(1):298-304. [ Links ]
23. Nouws J, Ziv G. A critical evaluation of several microbiological test methods for residues of antimicrobial drugs in ruminants. Archiv für Lebensmittelhygiene. 1979;30. [ Links ]
24. Nouws J. Tolerances and detection of antimicrobial residues in slaughtered animals [Netherlands]. Archiv für lebensmittelhygiëne. 1981;32. [ Links ]
25. Gesche E. Detección de residuos de antibacterianos en carne. Técnica del Bacillus subtilis BGA. Monografías de Med Vet. 1986;8:1-5. [ Links ]
26. Bogaerts R, Wolf F. A standardized method for the detection of residues of anti-bacterial substances in fresh meat. Fleischwirtschaft. 1980;60(4):671-3. [ Links ]
27. Okerman L, Croubels S, Cherlet M, De Wasch K, De Backer P, Van Hoof J. Evaluation and establishing the performance of different screening tests for tetracycline residues in animal tissues. Food additives and contaminants. 2004;21(2):145-53. [ Links ]
28. Currie D, Lynas L, Kennedy DG, McCaughey WJ. Evaluation of a modified EC Four Plate Method to detect antimicrobial drugs. Food Additives & Contaminants. 1998;15(6):651-60. [ Links ]
29. Okerman L, Croubels S, De Baere S, Hoof JV, De Backer P, De Brabander H. Inhibition tests for detection and presumptive identification of tetracyclines, beta-lactam antibiotics and quinolones in poultry meat. Food Additives & Contaminants. 2001;18(5):385-93. [ Links ]
30. Cornet V, Govaert Y, Koenen-Dierick K, Okerman L, Degroodt JM. Interlaboratory study based on a one-plate screening method for the detection of antibiotic residues in bovine kidney tissue. Food Additives & Contaminants. 2005;22(5):415-22. [ Links ]