Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae vol.22 no.2 Medellín maio/ago. 2015
https://doi.org/10.17533/udea.vitae.v22n2a06
DOI:10.17533/udea.vitae.v22n2a06
FOODS: SCIENCE, ENGINEERING AND TECHNOLOGY
ESTUDIO DEL PROCESO DE CLARIFICACIÓN DE HIDROLIZADOS DE ALMIDÓN DE YUCA UTILIZANDO MEMBRANAS CERÁMICAS
STUDY OF CLARIFICATION PROCESS OF CASSAVA STARCH HYDROLYSATES USING CERAMIC MEMBRANES
Maria V. ACEVEDO-ESTUPIÑAN, IQ1; Carlos O. PARRA-ESCUDERO, IQ1; Carlos J. MUVDI-NOVA, IQ, PhD.2*
1 Ingeniero Químico. Escuela de Ingeniería Química. Universidad Industrial de Santander (UIS), Bucaramanga, Colombia.
2 Ingeniero Químico. Escuela de Ingeniería Química. Universidad Industrial de Santander (UIS), Bucaramanga, Colombia.
* Corresponding author: cjmuvdi@uis.edu.co.
Recibido: Agosto 15 de 2014
Aceptado: Septiembre 21 de 2015
RESUMEN
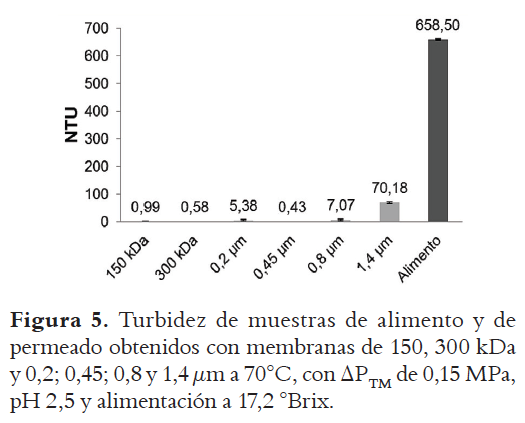
Antecedentes: La etapa de clarificación de hidrolizados de almidón para la producción de jarabes de glucosa es la principal causa de su producción por lotes, además de acarrear altos costos al utilizar filtros rotatorios al vacío, carbón activado y tierras diatomeas que aseguren la calidad del producto. Objetivos: Evaluar la etapa de clarificación de hidrolizados de almidón de yuca obtenidos por vÍa enzimática utilizando tecnología con membranas, a diferentes temperaturas, diámetros de poro de membrana y presiones transmembrana. Métodos: La clarificación se realizó utilizando un piloto compuesto por un tanque enchaquetado, donde se llevó a cabo la reacción de hidrólisis. La filtración se realizaba conectando el tanque a una bomba que permitía enviar el fluido al módulo membranario; la presión transmembrana fue fijada con una válvula a la salida del módulo. Los experimentos se llevaron a cabo usando membranas con diferentes tamaños de poro en un diseño factorial 22, evaluando dos niveles de temperatura (50 y 70°C) y dos niveles de presión transmembrana (0,15 y 0,30 MPa). Se midieron los caudales obtenidos para el retenido y el permeado. Las muestras obtenidas fueron analizadas para evaluar la calidad del permeado (turbidez, cantidad de proteína retenida, contenido de materia seca y °Brix). El análisis estadístico se llevó a cabo con el software Statgraphic Centurion XVI.I®. Resultados: Los resultados obtenidos mostraron que las presiones transmembrana (0,15 y 0,30 MPa) y temperaturas (50 y 70 °C) evaluadas no influyen significativamente sobre la permeabilidad ni calidad del permeado (p-valores > 0,05) permitiendo trabajar con la menor presión tranmembrana (menor desgaste de equipos y menor gasto energético), y a la temperatura de hidrólisis, lo cual permitiría trabajar bajo condiciones de producción en continuo. Además, se observó que es posible utilizar membranas con diámetro de poro de hasta 0,8 µm; aumentado hasta en 5 veces la productividad y disminuyendo la turbidez en un 99%. Conclusiones: Es posible utilizar membranas cerámicas de microfiltración de hasta 0,8 µm, en condiciones moderadas de presión transmembrana y a la temperatura de hidrólisis para la clarificación de hidrolizados de almidón de yuca sin disminuir la calidad del permeado.
Palabras clave: Filtración, membranas, hidrolizado, almidón, yuca.
ABSTRACT
Background: Clarification step of starch hydrolysates for the production of glucose syrups is the main responsible for batch production; in addition, it causes high costs when using rotary vacuum filters, activated carbon and diatomaceous earth to ensure product quality.Objectives: To evaluate the clarification step of hydrolyzed cassava starch obtained enzymatically, using membrane technology at different temperatures, membrane cut-off and transmembrane pressures. Methods: Clarification was conducted using a pilot composed by a jacketed tank, where the hydrolysis reaction was carried out. The filtration was performed by connecting the tank to a pump to send the fluid to the membrane carter; transmembrane pressure was fixed with a valve placed at the end of the module. The experiments were carried out using membranes with different cut-off sizes in a factorial design 22, two temperatures (50 and 70°C) and two transmembrane pressure levels (0.15 and 0.30 MPa) were evaluated. The flows obtained for the retentate and permeate were measured. The obtained samples were analyzed to assess the permeate quality (turbidity, amount of retained protein, dry matter content and °Brix). Statistical analysis was performed with software Statgraphic Centurion XVI.I®. Results: The results showed that the pressures (0.15 to 0.30 MPa) and temperatures (50 and 70°C) evaluated did not influence significantly the permeability, or the quality of the permeate (p-values > 0.05), it can allow to work with lower pressure (less wear on equipment and less energy), at hydrolysis temperature, it would allow to work under conditions of continuous production. Moreover, the possibility to use membranes with pore diameters up to 0.8 µm was observed; it allow to increase up to 5 times the productivity and decrease the turbidity by 99%. Conclusions: It is possible to use ceramic microfiltration membranes up to 0.8 µm in moderate transmembrane pressure, at hydrolysis temperature for clarification of cassava starch hydrolysates without decreasing the quality of the permeate flow.
Keywords: Filtration, membranes, hydrolysate, starch, cassava.
INTRODUCTION
Los jarabes de glucosa son soluciones líquidas altamente viscosas de glucosa concentrada (2,140 cP a 75% de materia seca; 53,7 equivalente dextrosa y 26,7ºC) que pueden contener maltodextrinas (1). Su poder edulcorante está entre 40 y 79; siendo 100 el poder de dulzura de la sacarosa (2). Estos jarabes son muy apreciados en la industria de alimentos ya que proporcionan dulzor, suavidad y brillo a los productos. Además ayudan a la formación de cristales más pequeños, facilitan la masticación de las gomas, y disminuyen la actividad del agua prolongando la duración del producto, entre otros beneficios. Aparte son precursores para otros sacáridos como la fructosa, cuyo poder edulcorante es mayor (80-130). Estas características permiten su utilización en productos como: chocolates, helados y dulces en general (3-6).
La materia prima para la producción de jarabes de glucosa es el almidón, polisacárido formado por unidades de glucosa, que generalmente está compuesto aproximadamente por 80% p/p de amilopectina y 20% p/p de amilosa en base seca. La yuca es una de las principales fuentes de almidón conteniendo hasta un 87,7% p/p en base seca; superando en más del 10% a otras fuentes de almidón como maíz, papa y plátano (7).
La producción de jarabes de glucosa comienza con la hidrólisis, generalmente, enzimática del almidón que permite obtener ED (Equivalentes Dextrosa) superiores a 95 (8). Consta de dos etapas: licuefacción y sacarificación. En la etapa de licuefacción se produce una solución de dextrinas por la acción de las α-amilasas que atacan los enlaces α-1,4 del almidón (9–12), obteniendo hidrolizados de 15-20 ED (6). En la etapa de sacarificación, las glucoamilasas atacan los enlaces α-1,4 y α-1,6 para transformar las dextrinas en azúcares de bajo peso molecular (glucosa, maltosa o mezclas) (9-13). Al terminar esta etapa se puede obtener un hidrolizado con un contenido final de 93-96 ED.
Una vez finalizada la sacarificación, el hidrolizado es clarificado para remover sólidos suspendidos e impurezas insolubles. Para ello, tradicionalmente se utiliza carbón activado con el fin de remover color y sabor, seguido de una filtración frontal mediante filtros prensa o filtros rotatorios al vacío con tierras diatomeas como auxiliar filtrante (9, 14-17). Estos procesos toman mucho tiempo para alcanzar un óptimo de calidad al pasar por varios ''purificadores''. Además, no son económicamente rentables al utilizar varios auxiliares filtrantes por cochada, sin mencionar el impacto medio ambiental al desechar, por ejemplo, las tierras diatomeas. Una alternativa más eficiente para realizar la clarificación es el uso de membaranas. Con esta tecnologóa se ahorraría en otras operaciones unitarias para asegurar la calidad del producto como intercambio iónico, decoloración y uso de carbón activado para retirar sabores. La incorporación de membranas de micro o ultrafiltración permiten obtener una calidad superior en términos de turbidez, color y contenido microbiológico (8). Uno de los grandes problemas de los procesos con membranas es la colmatación. Este fenómeno tiene como efecto la pérdida del rendimiento de la membrana; evidenciada en la disminución del flujo en el permeado. La colmatación depende del tipo de fluido a tratar, del material membranario y de las condiciones de operación. Varios autores han implementado membranas en el proceso de producción de jarabes de glucosa, la mayoría de ellos han trabajado con membranas de ultrafiltración entre 3 y 15 kDa (17-21); por lo tanto, los bajos flujos de permeado alcanzados no son económicamente rentables. Además, estos mismos estudios han utilizado principalmente membranas orgánicas de fibra hueca. Por el material utilizado, estas membranas no pueden ser utilizadas bajo condiciones de temperatura de hidrólisis del proceso, lo cual redundaría en tiempos de parada y mayores costos (22,23). Igualmente, no se ha realizado a la fecha estudios comparativos que busquen analizar el efecto del tamaño de poro sobre la calidad del permeado.
El objetivo de este trabajo fue evaluar la influencia de la temperatura, la presión transmembrana y el diáámetro de poro de membranas cerámicas de microfiltración y ultrafiltración en el mejoramiento de la productividad de la etapa de clarificación, sin disminuir la calidad del producto clarificado y bajo condiciones que permitirían el estudio del proceso bajo una configuración en continuo.
MATERIALES Y MÉTODOS
Protocolo de limpieza de membranas
Al final de cada filtración se llevó a cabo el protocolo de limpieza; en el cual se utiliza una solución de NaOH 0,5 N y 1% de NaClO, a 0,1 MPa y 60°C y 1 h de filtración. Posteriormente se realizó un lavado con agua destilada hasta neutralidad y se verificó la permeabilidad al agua de la membrana.
Materiales e insumos
Almidón de yuca, Almiyuca® suministrado por Almidones de Sucre S.A.S. Sucre, Colombia. Enzimas α-amilasa (Liquozyme SC DS®) y glucoamilasa (Spirizyme Fuel®) suministradas por Novozymes, North America Inc, Franklinton, N.C. United States. Membranas cerámicas monocanal de α-alumina con diámetro de 0,007 m, TAMI®, Nyons, Francia. Bomba de desplazamiento positivo: Bomba rotatoria SI-5009 Tuthill®, Burr Ridge, IL, United States, acoplada con un motor Siemens de 1 HP y 1090 rpm con variador de frecuencia CFW-08 (WEG®, Bogotá, Colombia). HCl al 37%, azul de coomasie G-250, etanol al 99,9% y albúmina de suero bovino (BSA) Merck®, Bogotá, Colombia; ácido ortho fosfórico al 85% suministrado por Yequim Ltda. Bucaramanga, Colombia. Hipoclorito de Sodio al 13% suministrado por Multiquímicos Ltda. Bucaramanga, Colombia, y NaOH en escamas suministrado por Suquin Ltda. Bucaramanga, Colombia.
Producción de hidrolizados de almidón de yuca
Los hidrolizados de almidón utilizados en las pruebas de ultrafiltración y microfiltración, se prepararon a partir de 6 L de una solución almidón de yuca-agua al 20%p/v, bajo agitación (30 rpm). Los parámetros de operación de la reacción de hidrólisis enzimática son los reportados por Ruiz (26) para licuefacción (pH 5, 80°C, tiempo de reacción 15 min y relación enzima/sustrato 0,028%p/p) y para sacarificación (pH 4,5 , 70°C, tiempo de reacción 45 min y relación enzima/sustrato 0,063%p/p). La temperatura de hidrólisis se controló con un baño termostatado y el pH se reguló con NaOH y HCl 2N. Las reacciones de hidrólisis se detuvieron bajando el pH a 2,5 y manteniéndolo durante 1 h. Los hidrolizados fueron almacenados a una temperatura de -20°C.
Proceso de filtración membranaria
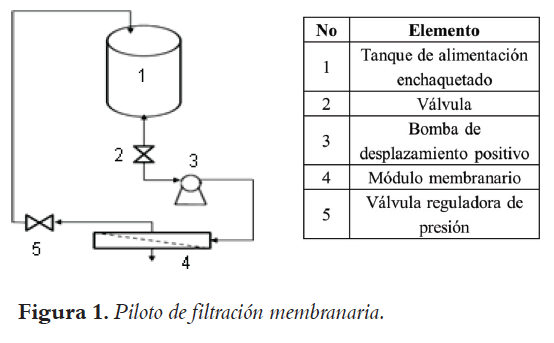
La clarificación de los hidrolizados se llevó a cabo en un piloto de acero inoxidable con capacidad de 10 L, representado en la Figura 1. Éste consiste en un tanque de almacenamiento enchaquetado, el cual asegura la alimentación del hidrolizado al sistema. Una bomba de desplazamiento positivo impulsa la alimentación hacia el módulo membranario, en donde se lleva a cabo la filtración. La presión transmembrana (ΔPTM) se fija con una válvula globo ubicada en la corriente del retenido a la salida del módulo membranario. El retenido es recirculado al tanque de almacenamiento, mientras el permeado se recupera. El caudal de permeado se midió cada 5 min; al final de las pruebas se midió el caudal del retenido y se tomaron muestras de ambos para sus posteriores análisis fisicoquímicos. Las pruebas de filtración membranaria tuvieron una duración de 30 min.
En la primera etapa de la experimentación se analizó el efecto de la temperatura y la presión transmembrana sobre la ultrafiltración del hidrolizado obtenido en la etapa de sacarificación. Se trabajó con una membrana de 15 kDa (membrana que aseguró una retención de enzima superior al 95%). El diseño de experimentos fue de tipo factorial 22 (25). Los niveles evaluados para la temperatura fueron: Tmáx de 70°C, y Tmín de 50°C. Los niveles de temperatura se fijaron teniendo en cuenta tanto el rango de actividad de la enzima glucoamilasa (24), como el rendimiento de la bomba de desplazamiento positivo: a menor temperatura, mayor viscosidad y mejor rendimiento (17, 20, 27, 28). Para la presión transmembrana los niveles evaluados fueron 1,5 y 3 MPa. Es de esperar que a una mayor presión haya una mayor permeabilidad debido a que la fuerza impulsora es la diferencia de presión transmembrana; el nivel máximo de presión evaluado estuvo condicionado a la capacidad del piloto. La filtración del hidrolizado se realizó recirculando el retenido al tanque de alimentación.
En la segunda etapa de la experimentación, se evaluó el efecto del diámetro de poro con el objetivo de estudiar la posibilidad de aumentar la productividad del proceso de clarificación, sin disminuir por tanto, la calidad del producto clarificado. Para esto se utilizaron membranas cerámicas monocanal, cada una con diferentes diámetros de poro: 150 y 300 kDa, y 0,3; 0,45; 0,8 y 1,4 µm. La clarificación se realizó utilizando las mejores condiciones de presión transmembrana y temperatura encontradas en la etapa anterior.
Métodos experimentales
El porcentaje de retención de proteínas en las membranas fue calculado al comparar la cantidad de proteína medida en el permeado con la del retenido, Ecuación 1; la cantidad de proteína en las muestras fue determinada mediante el método de Bradford a 595 nm (24), usando un espectrofotómetro Genesys 20 ThermoSpectronic®.
La turbidez de los hidrolizados clarificados y el retenido fue determinada utilizando un turbidímetro Hach 2100Q® según USEPA 180.1. Los caudales de permeado y retenido se determinaron por gravimetría, pesando el permeado/retenido obtenido en un tiempo determinado con una balanza analítica OHAUS, la permeabilidad de la membrana se calculó al dividir el caudal del permeado en el área superficial de la membrana (diámetro * longitud*π) (16), el porcentaje de pérdida de permeabilidad fue calculado al comparar la permeabilidad a los 10 minutos y a los 30 minutos. El porcentaje de materia seca fue determinado según la norma A.O.A.C. 1980. Para determinar los °Brix se utilizó un refractómetro Fisher No. 13 964 70C de 0-90%. El análisis estadístico se llevó a cabo con el software Statgraphic Centurion XVI.I®. El diseño de experimentos fue de tipo factorial 22 (25).
RESULTADOS
Efecto de la ΔPTM y de la temperatura en la filtración del hidrolizado obtenido en la etapa de sacarificación.
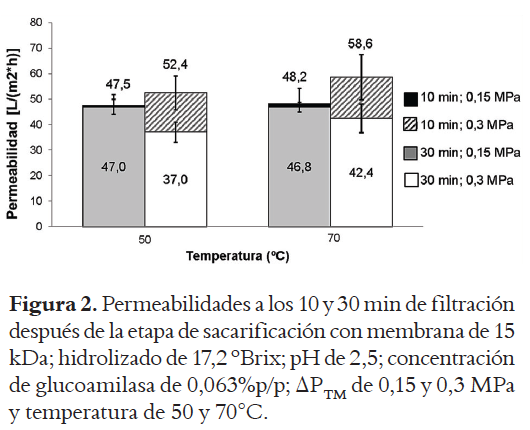
La Figura 2 muestra los resultados obtenidos para las permeabilidades de la membrana de 15 kDa a las condiciones de operación propuestas para sacarificación. En esta figura se puede observar, que para las dos temperaturas estudiadas (50 y 70 °C), el cambio en la permeabilidad al inicio (10 min) y final (30 min) del proceso de filtración, para la ΔPTM de 0,3 MPa, provoca una caída en la permeabilidad de la membrana del 29,4% a 50 °C y del 27,7% a 70 °C.
Sin embargo, con el mismo procedimiento, a 0,15 MPa las pérdidas de permeabilidad están por debajo del 2,8 % Esto puede explicarse por la colmatación de la membrana inducida en el sistema debido a las condiciones de diseño del piloto utilizado; el cual requiere el cierre de la válvula para alcanzar la ΔPTM requerida, haciendo que disminuya la velocidad del retenido, y por lo tanto la velocidad de arrastre sobre la superficie membranaria.
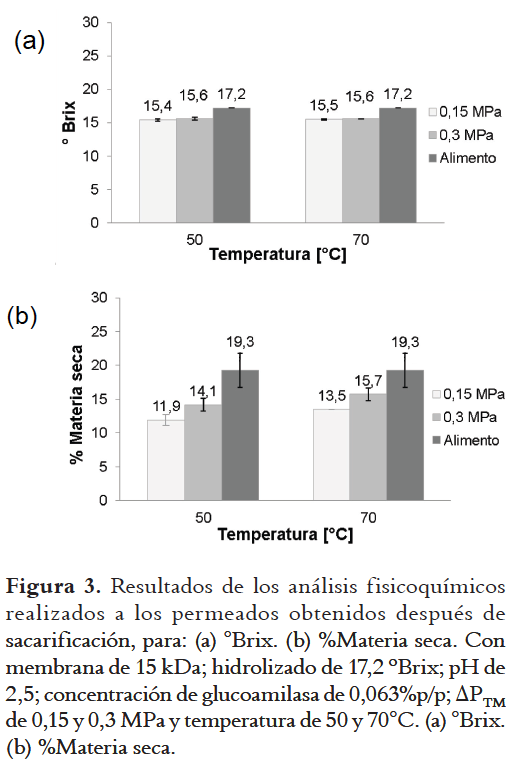
La La Figura 3 muestra los resultados del % de materia seca y los °Brix obtenidos para esta etapa. En la figura se observan valores menores para los permeados con respecto al hidrolizado alimentado en la filtración, tanto para los °Brix (en promedio 9,9%) como para el % de materia seca (en promedio 28,2%). Esto muestra la capacidad de la membrana para retener sólidos (suspendidos y solubles) no deseados en el clarificado, permitiendo el paso de los azúcares solubles. Adicionalmente, se cuantificó la cantidad de proteína, es decir, la cantidad de enzima presente en los permeados obtenidos en esta etapa con la membrana de 15 kDa, y se encontró que en promedio el porcentaje de retención de enzima fue del 97,56% ± 0,76%
Las mejores condiciones de operación encontradas, teniendo en cuenta las condiciones de operación del piloto, fueron ΔPTM 0,15 MPa y 70°C puesto que permiten un menor desgaste de la bomba, al no utilizar la máxima presión, además de menores pérdidas de permeabilidad, y trabajar a la temperatura de hidrólisis.
Efecto del diámetro de poro en la calidad y cantidad de permeado obtenido en la etapa de sacarificación.
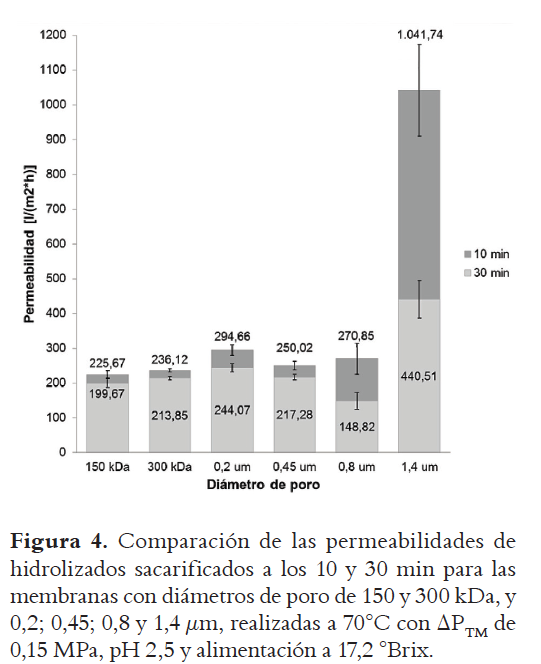
La Figura 4 muestra los resultados de las permeabilidades obtenidas utilizando membranas con diferentes diámetros de poro, evaluados a los 10 y 30 min para las mejores condiciones de operación encontradas previamente, ΔPTM 0,15 MPa y 70°C.
En la figura se pueden observar pérdidas de permeabilidad en todas las membranas. Los porcentajes de pérdida de permeabilidad, calculados al comparar la permeabilidad determinada del retenido con la del concentrado, para las membranas de 150 kDa; 300 kDa; 0,2 µm; 0,45 µm; 0,8 µm y 1,4 µm, son respectivamente 11,52%, 9,43%, 17,16%, 14,46%, 45,06% y 57,71%. Se observa una tendencia de aumento de las pérdidas de permeabilidad con el aumento del diámetro de poro, evidenciando una mayor colmatación de las membranas al aumentar su diámetro de poro.
La Figura 5 muestra los resultados obtenidos al evaluar la turbidez de los permeados obtenidos con diferentes diámetros de poro para las mismas condiciones de la Figura 4. En esta figura se aprecia que la clarificación obtenida con los diferentes diámetros de poro es efectiva, pues se alcanzó una disminución de más del 98,9% en todas las membranas (excluyendo la de 1,4 μm (89%)), con respecto al alimento.
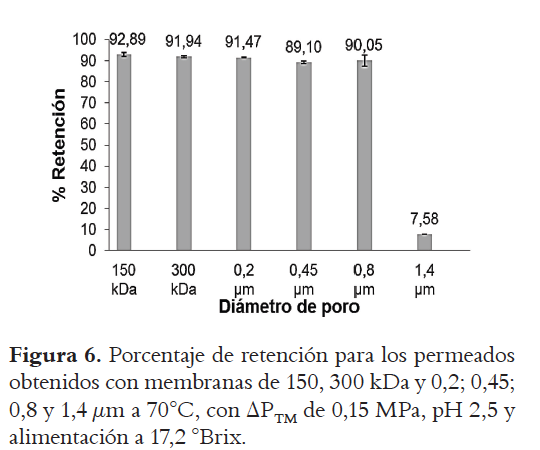
La Figura 6 muestra los resultados obtenidos al evaluar el % de retenciÓn de enzima para todas las membranas evaluadas. En esta se evidencia un % de retención de enzima cercano al 90% (excepto para la membrana de 1,4 μm (7,58%)).
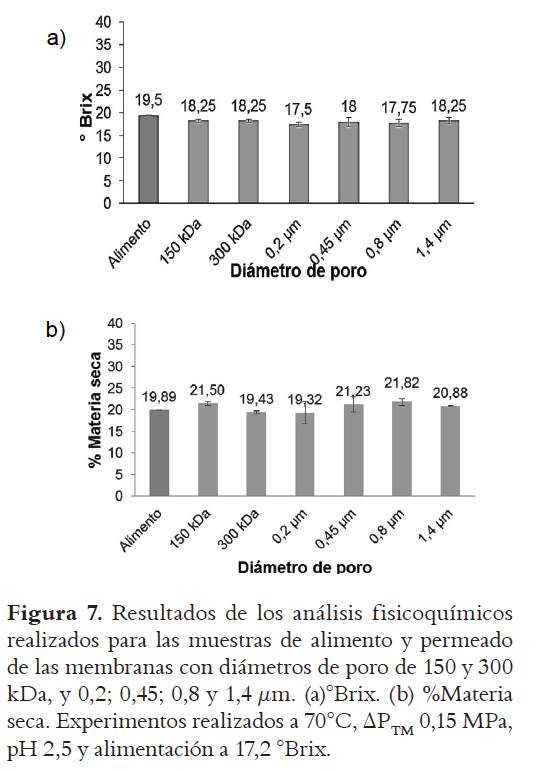
La Figura 7 muestra los análisis fisicoquÍmicos para los permeados obtenidos con las diferentes membranas, para °Brix y % de materia seca. Se observa que estas dos variables de respuesta no presentan variación significativa con el diámetro de poro.
DISCUSIÓN
Los resultados encontrados indican que en las condiciones de operación evaluadas, el efecto de la presión transmembrana y la temperatura no son significativos (los promedios se encuentran dentro de las desviaciones obtenidas); se podría decir, por ejemplo, que a una temperatura de 80°C se puede trabajar tanto con una presión de 0,15 MPa o 0,3 MPa sin obtener una mejora considerable en la permeabilidad. Esto se corroboró mediante un análisis estadístico con el Software Statgraphic Centurion XVI.I®, en el cuál los datos fueron tratados por análisis ANOVA mostrando valores p mayores a 0,05. Los resultados anteriormente señalados indican que es posible trabajar con condiciones más suaves de operación sin afectar el rendimiento del proceso, lo cual redundaría en una reducción de costos y facilidad de operación. Estos resultados son contrarios a lo encontrado por Grzeskowiak- Przywecka & SlomÅska (21), quienes trabajaron con membranas cerámicas Tami® tubulares de 3 canales y diámetros de poro de 3, 5, 8 y 15 kDa para producir jarabes de maltosa a partir de almidón de papa sacarificado a 55°C y presión transmembrana de 0,4-0,6 MPa. Ellos encontraron que la permeabilidad se incrementa linealmente con la presión, su comportamiento lo describen mediante la ecuación y = 44,9x - 14,1 (x: presión transmembranaria, y: flujo de permeado) en un rango de 0,4-0,7 MPa. Sin embargo, la máxima permeabilidad que alcanzaron (a 0,7 MPa) fue de 17 L/m2.h, muy por debajo del flujo de permeado alcanzado en el presente trabajo con la membrana de 15 kDa a 50°C y 0,15 MPa (37 L/m2.h). Igualmente, Gaouar et al. (29) también obtuvieron mayores permeabilidades a mayor presión. Ellos trabajaron con membranas tubulares Carbosep® (ZrO2 soportada en carbón poroso) de 10, 50 y 150 kDa para producir jarabes de maltosa a partir de almidón de yuca sacarificado. Este trabajo muestra que para mantener un flujo constante de permeado de 20 L/m2.h durante 6 h, con una membrana de 50 kDa y temperaturas de operación entre 60 y 68°C, era necesario aumentar la presión transmembrana de 0,2 a 0,44 MPa. Sin embargo, Mameria et al. (18) encontraron que para bajas velocidades lineales, el flujo de permeado es independiente a la presión transmembrana aplicada (al trabajar con presiones mayores a 0,2 MPa a 50°C). Esto lo comprobaron usando una membrana Carbosep M5® de 10 kDa (ZrO2 soportada en carbón poroso) en un biorreactor membranario para sacarificar los residuos sólidos de la producción de aceite de oliva. Los resultados de Mameria et al. (18) concuerdan con los encontrados por Kazemi et al. (30, 31) quienes hallaron que la presión tiene un punto máximo después del cual no se incrementa el flujo de permeado. Estos resultados explican el comportamiento de los encontrados en el presente artículo.
Los datos obtenidos en este trabajo señalan la posibilidad de llevar a cabo el proceso de filtración bajo condiciones moderadas de presión transmembrana, que permitan un menor desgaste de los equipos y menores gastos energéticos. Igualmente, el análisis estadístico muestra que las variables de entrada, en los rangos utilizados, no afectan de forma significativa los °Brix y el % de materia de seca (valores p mayores a 0,05), indicadores de la calidad del producto. Es decir que ni la presión transmembrana ni la temperatura afectan significativamente las características del permeado. Estos resultados son esperados en cuanto a calidad, debido a que la selectividad depende únicamente del tipo de membrana, en este caso la exclusión se realiza por tamaño de poro: solo se permite el paso de sustancias más pequeñas que el poro de la membrana; por lo tanto, estas dos variables no deberían afectar la cantidad de sólidos retenidos por la membrana.
En las pruebas utilizando membranas de micro y ultrafiltración, los resultados muestran una tendencia general de aumento de la colmatación (ensuciamiento) al aumentar el diámetro de poro de la membrana. Esto es debido a la mayor presencia de partículas que pueden pasar parcialmente a través de los poros, impidiendo el paso de otras sustancias. Gaouar et al. (29) encontraron que en todos los casos, después de un período transitorio inicial, el flujo de permeado disminuye con el tiempo y esta disminución es más importante cuanto mayor es el tamaño de poro. La pérdida de permeabilidad fue evaluada en tres de membranas 10, 50 y 150 kDa y sus pÉrdidas de flujo aproximadas son de 10%, 33% y 53%, respectivamente.
En las pruebas de calidad de permeado con membranas cerámicas de diferente tamaño de poro, los resultados obtenidos indican que es posible mejorar la productividad de esta técnica al utilizar una membrana con un diámetro de poro de hasta 0,8 µm. Esto aumentaría el flujo de permeado hasta en 5,2 veces lo obtenido con una membrana de 15 kDa, que es la membrana más utilizada por varios autores (17, 19, 20, 21, 22), sin que ello conlleve a una pérdida significativa de la calidad del permeado. Sobre este tema trabajaron Singh & Cheryan (8) utilizando membranas cerámicas Ceramem® de 0,2 μm a 0,17 MPa y 60°C. Ellos evaluaron el grado de clarificación de los hidrolizados sacarificados de almidón de maíz comparando el color del permeado y del retenido. Sus resultados coinciden con lo obtenido en el presente trabajo y muestran que el hidrolizado clarificado fue consistentemente menor en color a través de todo el proceso; estos resultados confirman que la microfiltración puede ser efectivamente usada para la clarificación del almidón hidrolizado.
CONCLUSIONES
Este trabajo permitió el análisis de la influencia de la temperatura y presión transmembrana en la clarificación de hidrolizados de almidón de yuca, así como la comparación con respecto al flujo de permeado y calidad del permeado utilizando membranas con distintos diámetros de poro. Los resultados de este estudio contribuyen al mejoramiento del proceso de producción de jarabes de glucosa en cuanto a tiempos, calidad y costos.
Específicamente, se encontró que: la presión transmembrana y la temperatura no tuvieron un efecto significativo en la operación de ultrafiltración (bajo las condiciones evaluadas), mostrando que se pueden obtener permeabilidades similares a 1,5 y 3 MPa a 70°C; lo que permite trabajar la hidrólisis bajo condiciones de presión moderadas y a la temperatura de hidrólisis.
Igualmente, los resultados obtenidos evidencian la posibilidad de trabajar con membranas de microfiltración con diámetro de poro de hasta 0,8 µm, sin reducir la calidad del permeado y aumentando la productividad hasta en 5,2 veces; mejorando la eficiencia del proceso de clarificación. Este trabajo permitió comprobar las ventajas del uso de membranas cerámicas de α-alúmina en la etapa de clarificación de hidrolizados de almidón de yuca, entre ellas: resistencia térmica, mecánica y química; ya que las membranas pudieron ser utilizadas en diferentes condiciones de temperatura y presión, además de permitir el uso de hipoclorito de sodio como agente limpiador, según el protocolo de limpieza (32). Otras ventajas como baja colmatación y alta selectividad se ven reflejadas a través de las variables permeabilidad en el tiempo, porcentaje retención y turbidez.
Los resultados obtenidos evidencian la posibilidad de configurar el sistema en continuo para minimizar los tiempos de parada, maximizar los volúmenes producidos y la posible recuperación de enzimas retenidas que podrían ser usadas en reacciones sucesivas, mientras se remueven continuamente los productos a través de la membrana, al mismo tiempo que se clarifica el hidrolizado obtenido.
Limitaciones y recomendaciones
En un trabajo posterior es importante aumentar la superficie membranaria del piloto utilizado, con el fin de establecer estudios para la producción de hidrolizados de almidón de yuca en continuo.
AGRADECIMIENTOS
Los autores agradecen a la Vicerrectoría de Investigación y Extensión de la Universidad Industrial de Santander, a Promitec S.A.S y al Departamento administrativo de Ciencia, Tecnología e Innovación – COLCIENCIAS, por el apoyo brindado para la realización del presente trabajo, que hace parte del proyecto titulado ''Aumento de la productividad de concentrados de jarabes de glucosa obtenidos a partir de hidrolizados de almidón de yuca por métodos no convencionales'' (cód. VIE9417).
REFERENCIAS
1. Hobbs L. Sweeteners from starch; production, properties and uses. Starch: Chemistry and technology. 2009;799-821. [ Links ]
2. Uribe JP. Obtención de jarabe fructosado a partir de almidón de platano [Tesis]. Morelos, México: Instituto Politecnico Nacional; 2004. [ Links ]
3. Arango M. Jarabes de Maíz. Revista de Alimentos.2008;22. [ Links ]
4. Promitec. Promitec soluciones biotecnológicas naturales (sitio en internet). Promitec S.A.S. Disponible en:http://promitec.com.co/ images/documentos/192Ficha%20t%C3%A9cnica%20Jarabe%20 de%20Glucosa%20-%20Nat%20Bio%20080.pdf. Acceso el 25 de Agosto 2012. [ Links ]
5. Tate & Lyle. Tate & Lyle Home (sitio en internet). Disponible en: http://www.tateandlyle.co.uk/NR/rdonlyres/et5lc6vlrt6ftayeubuywmqlxnyd65dcpe3v7fzp6muzg6awn5kseo5gzullqfrgol6vgzketyee3pguit2bwjbgzbb/ Espanol_Edulcorantes_Liquid.pdf. Acceso el 28 de Julio 2012. [ Links ]
6. Kearsley MW, Dziedzic SZ. Handbook of starch hydrolysis products and their derivates. Londres: Blackie Academic & Professional; 1995. [ Links ]
7. Aya WA, Pineda J, Sánchez O, Cardona C. Análisis comparativo de diferentes materias primas amiláceas para la obtención de alcohol carburante. 2006. Memorias del congreso Colombiano de Ingeniería Química, ISSN: 1692-925X. [ Links ]
8. Singh N, Cheryan M. (1998). Properties and Composition of Concentrates and Syrup Obtained by Microfiltration of saccharified Com Starch Hydrolysate. J Cereal Sci. 27:315-320. [ Links ]
9. Henrissat. A classification of glycosyl hydrolases based on aminoacid sequence similarities. Biochemical. 1991; 309-316. [ Links ]
10. Latorre L. Análisis estructural y modificación funcional de la glucoamilasa de Saccharomises Cerevisae Var Diasticus [Tesis doctora]. Departamento de Bioquímica y Biología molecular. Valencia, España: Universidad de Valencia. 2008. [ Links ]
11. Sánchez CP, Mejía CE, Figueroa C, Esquivia M, Agudelo LM, Zapata N. Bioprospección de microorganismos nativos amilolíticos. Facultad de Ciencias Agropecuarias. Universidad de Antioquia. 2004; 2(1):8-17. [ Links ]
12. Rutz, Janssen. Biofuel Technology Handbook. Munich: WIP Renewable Energies. 2007. [ Links ]
13. Amutha R., Gunasekaran P.. Production of ethanol from liquiefied cassava starch using co-immobilized cells of Zymomonas mobilis and Saccharomyces diastaticus. J Biosci Bioeng. 2001. 92, 560-564. [ Links ]
14. Basso A. Vacuum filtration using filteraids. Chemical Engineering. 1982. 89(8), 159-160. [ Links ]
15. Kuske E, Bonnett D. Versatile filter aid helps assure precise quality for corn syrups. Food Engineering. 1977. 49(11), 92-94. [ Links ]
16. Mera, I., & Carrera, J. (2005). Obtencióon de glucosa a paritr de almidón de yuca (Manihot Sculeta). Revista de Biotecnología Universidad del Cauca. 2005; 3(1): 54-63. [ Links ]
17. Slominska L, Niedbach J. Study on the influence of the so-called filtration enzyme action on the membrane filtration process of wheat starch hydrolysates. Desalination. 2009; 296-301. [ Links ]
18. Mameria N et al. Enzymatic saccharification of olive mill solid residue in a membrane reactor. J Memb Sci. 2000; 178, 121-130. [ Links ]
19. Grzeskowiak-Przywecka A., Slominska L. Continuous potato starch hydrolysis process in a membrane reactor with tubular and hollow-fiber membranes. Desalination. 2005; 184, 105-112. [ Links ]
20. López, Ulibarri R, Hall G. Saccharification of cassava flour starch in a hollow fiber membrane reactor. Enzyme Microb Technol. 1997; 398-404. [ Links ]
21. Grzeskowiak-Przywecka A., Slominska L. Saccharification of potato starch in an ultrafilration reactor. J Food Eng. 2007; 79:539-545. [ Links ]
22. AndriÄ P., Meyer A.S., Jensen P.A., Dam-Johansen K. Reactor design for minimizing product inhibition during enzymatic lignocellulose hydrolysis. II. Quantification of inhibition and suitability of membrane reactors. Biotechnol Adv. 2010; 28, 407-425. [ Links ]
23. Sulej-Chojnacka J., KonowaÅ E., Prochaska K.. Contiuous recycle membrane reactor for enzymatic hydrolysis of dual modified potato starch. Desalination. 2005; 184, 105-112. [ Links ]
24. Bradford. M. A rapid and senstive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry 1976. 72, 248-254. [ Links ]
25. Galbiati J. Diseño de experimentos factoriales con aplicaciones a procesos industriales.2007. [ Links ]
26. Ruiz M. Obtención de jarabes de glucosa a partir de almidón de yuca por medio de hidrólisis enzimática, para ser usados como sustrato en la producción de bioetanol [Tesis]. Bucaramanga, Colombia. Universidad Industrial de Santander. Escuela de Química, 2009 [ Links ]
27. Chen Y., Huang S., Tang Z., Chen X., Zhang Z. Structural changes of cassava starch granules hydrolyzed by a mixture of a-amylase and glucoamilase. Carbohydr Polym. 2011; 272-275. [ Links ]
28. Morales S, Álvarez H, Sanchez C. Dynamic models for the production of glucose syrup from cassava starch. Food and Bioproducts Processing. 2008; 25-30. [ Links ]
29. Gaouar O, Zakhia N, Aymard C, Rios GM. Production of maltose syrup by bioconversion of cassava starch in an ultrafiltration reactor. Ind Crops Prod. 1998; 7, 159-167. [ Links ]
30. Kazemi M.A, Soltanieh M., Yazdanshenas M. Mathematical modelng of crossflow microfiltration of diluted malt extract suspension by tubular ceramic membrane. J Food Eng. 2013. 116:926-933. [ Links ]
31. Kazemi M.A, Soltanieh M., Yazdanshenas M., Fillaudeau L. Influence of crossflow microfiltration on ceramic membrane fouling and beer quality. Desalination. 2013. 51:4302-4312. [ Links ]
32. Acosta. J., Rios, S. Aplicación de las técnicas con membranas de microfiltración y ultrafiltración para la clarificación y fraccionamiento de sangre de bovino cruda e hidrolizada. Tesis para optar al título de Ingeniero Químico. Universidad Industrial de Santander. Bucaramanga. 2013. [ Links ]