Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Vitae
versão impressa ISSN 0121-4004
Vitae vol.23 no.1 Medellín jan./abr. 2016
https://doi.org/10.17533/udea.vitae.v23n1a03
DOI: 10.17533/udea.vitae.v23n1a03
PHARMACEUTICAL INDUSTRY
PROPUESTA PARA SELECCIONAR ACEITES ESENCIALES DE PLANTAS DE COLOMBIA PARA INVESTIGACIÓN CON BASE EN SU CITOTOXICIDAD
PROPOSAL TO SELECT ESSENTIAL OILS FROM COLOMBIAN PLANTS FOR RESEARCH BASED ON ITS CYTOXICITY
Sindi Alejandra VELANDIA1 BSc, María Camila FLECHAS11 MSc., Elena E. STASHENKO2 Ph.D., Raquel E OCAZIONEZ1, * Ph.D.
1 Centro Nacional de Investigaciones para la Agroindustrialización de Especies Vegetales Aromáticas Medicinales Tropicales (CENIVAM). Centro de Investigaciones en Enfermedades Tropicales (CINTROP), UIS, Parque Tecnológico Guatiguará, CINTROP, Av Los Bambues, km 2 Autopista, Piedecuesta.
2 Centro de investigación en Biomoléculas (CIBIMOL), Universidad Industrial de Santander, Bucaramanga, Colombia.
Corresponding author: relocaz@uis.edu.co
Recibido: Enero 21 de 2016. Aceptado: Abril 08 de 2016.
RESUMEN
Antecedentes: Conocer la tendencia de productos de plantas a causar toxicidad en humanos es parte de la investigación orientada al descubrimiento de un medicamento natural. Las pruebas en animales son relativamente costosas, de bajo rendimiento, asociadas a sufrimiento del animal y diferencias relativas a la especie hacen difícil inferir efectos en humanos. Las pruebas en célula viva son recomendadas. Objetivos: Estudiar la tendencia a toxicidad de aceites esenciales (AE) de plantas de Colombia usando un ensayo basado en célula. Métodos: Los AE de 18 especies distintas de plantas fueron estudiados. Se usó el ensayo del MTT en seis líneas celulares de humano y animal derivadas de tejido normal y canceroso, las cuales se trataron antes y después de la proliferación. Los AE se organizaron en el orden de una agrupación jerárquica con base en los valores de CC50 y la sumatoria de la jerarquía ponderada en el panel de células (∑JPi ) se usó como indicador de similitud. Cuanto mayor fue el valor de ∑JPi menor fue la tendencia a toxicidad. Resultados: Los AE con valores de CC50 > 200 µg/mL en al menos cinco condiciones experimentales presentaron valores de ∑JPi > 6,0 sugiriendo baja tendencia a toxicidad y fueron en orden descendente (∑JPi en paréntesis): Calycolpus moritzianus (O.Berg) Burret (9,7) < Psidium sartorianum (O. Berg) Nied. (8,9) < Wedelia calycina (6,5) < Lippia micromera Schauer (6,2) ≈ Piper haltonii . (6,2). AE con valores de CC50 < 100 µg/mL en cuatro o más condiciones experimentales presentaron valores ∑JPi < 4.0 sugiriendo alta tendencia a toxicidad y fueron en orden ascendente: Tagetes caracasana Kunth (2,7 â 2,8) > Chromolaena odorata (L.) R.M.King & H.Rob. (3,0) > Ageratina aff. popayanensis (Hieron.) R.M.King & H.Rob. (3,1) > Lantana colombiana López-Pal. (3,3) >Turnera disffusa. (3,4). AE de Tagetes caracasana presentó actividad antiproliferante (CI50: 42,2 y 47,9 µg/mL) sobre células humanas de cáncer de cérvix. Conclusiones: El abordaje metodológico permitió identificar AE con baja y alta tendencia a toxicidad. Los resultados podrían tener valor para predecir actividad in vivo y priorizar muestras para futuras investigaciones.
Palabras clave: Toxicidad, aceite esencial, MTT, planta, fitoterapia.
ABSTRACT
Background: Part of the research process focused on discovering natural medicines is the study of products derived from plants, which may be toxic to humans. Animal-based test methods can be relatively expensive, low-throughput and associated with animal suffering, and differences in animal species may difficult to infer human health effects. Methods based on living cells are recommended. Objectives: To study the tendency to toxicity of essential oils (EOs) from plants of Colombia using a cell-based assay. Methods: EOs from different species (n = 18) of plants were included. The MTT assay was used on six human and animal cell lines derived from normal and cancerous organs, which were treated before and after proliferation. The EOs were arranged in the order of a hierarchical clustering based on their CC50 values, and the sum of weighted hierarchy across cell panel (∑iWH) was used as the similarity metric. The greater the value of ∑iWH lesser tendency to toxicity. Results: The EOs, which showed CC50 values > 200 µg/mL in at least five experimental conditions presented ∑iWH values > 5,0 suggesting lower tendency to toxicity, and they were in descending order (∑iWH in parentheses), as follows: Calycolpus moritzianus (O.Berg) Burret (9,7) < Psidium sartorianum (O. Berg) Nied. 1893 (8,9) < Wedelia calcycina (6,5) < Lippia micromera Schauer (6,2) ≈ Piper haltonii Jacq. (6,2) The EOs, which showed CC50 < 100 µg/mL in four or more experimental conditions presented ∑iWH values < 4.0 suggesting higher tendency to toxicity, and they were in ascending order, as follows: Tagetes caracasana Kunth (2,7 - 2,8) > Chromolaena odorata (L.) R.M.King & H.Rob. (3,0) > Ageratina aff. popayanensis (Hieron.) R.M.King & H.Rob. (3,1) > Lantana colombiana López-Pal. (3,3) > Turnera diffusa (3,4). EO from Tagetes caracasana Kunth presented relevant antiproliferative activity (CI50: < 50.0 µg/mL) on cells from human cervical carcinoma. Conclusions: The methodological approach allows identifying EOs with lower and higher tendency to toxicity. Data generated may be valuable for predicting in vivo toxicity and for prioritizing samples for further studies.
Keywords: Toxicity, essential oils, MTT, plant, phytomedicine.
INTRODUCCIÓN
Los aceites esenciales (AE) son mezclas complejas de compuestos volátiles producidos como metabolitos secundarios de plantas. Al menos 3.000 se han identificado y 300 están comercialmente disponibles para diversos usos como la fabricación de perfumes, cosméticos, productos de limpieza, insecticidas, conservantes y aditivos de alimentos (1-5). Los AE también están presentes en formulaciones de medicamentos homeopáticos, por ejemplo, la aplicación tópica se usa para tratar el acné, dermatomicosis y otras afectaciones de la piel; la aromaterapia para infecciones del tracto respiratorio y afecciones del sistema nervioso y el efecto anticancerígeno están bien documentado (6-9). Varios estudios sugieren que estas propiedades medicinales se deben en gran parte a fortalecimiento del sistema inmune (7, 10).
En términos generales, la práctica medicinal con AE se considera segura para la salud humana. No obstante, el uso inadecuado puede resultar en efectos adversos como irritación o cambios malignos en la piel por aplicación tópica excesiva y convulsiones, hepato-toxicidad y daño renal cuando la absorción sistémica es alta (2, 7). Se ha demostrado que los AE generan especies reactivas de oxígeno resultando en fragmentación del ADN (10,11).
La evaluación inicial del potencial tóxico de productos de plantas se requiere para seleccionar muestras líderes para la fase de descubrimiento de un producto para uso humano. La experimentación animal se recomienda ya que permite inferir con cierta confiabilidad el grado de afectación sobre diversos órganos humanos en el humano, en especial hígado, riñón y cerebro (12), aunque tiene tres limitaciones mayores: i) alto costo en infraestructura para cumplir con parámetros de buenas prácticas; ii) bajo rendimiento debido a que un limitado número de muestras se puede analizar en corto tiempo; iii) el análisis está restringido a muestras que no causen dolor intenso o sufrimiento permanente al animal según normas éticas actuales (12,13). Por estas dificultades viene aummentado el uso de ensayos basados en célula (citotoxicidad in vitro) y el interés de la comunidad científica para que los resultados se tengan en cuenta en la regulación de productos recién descubiertos (14).
Citotoxicidad se define como el efecto acumulativo sobre el número de células debido a apoptosis, necrosis o reducción de la tasa de replicación celular. Existen ensayos in vitro para evaluar cada alteración celular y se recomienda realizarlos en varios tipos de células (15-20). Rezk et al. (21) compararon y jerarquizaron la actividad citotóxica de extractos de plantas usando diversos ensayos, el abordaje permitió identificar las muestras líderes para investigación en antimicrobianos de origen natural. El perfil de citotoxicidad en un panel de células y la jerarquización de la actividad también se usaron para identificar compuestos sintéticos líderes (22).
En Colombia el uso medicinal de AE es muy limitado debido en gran parte a falta de información sobre efectos adversos. En este trabajo se presenta un abordaje metodológico para evaluar y comparar la citotoxicidad de muestras de AE usando el ensayo del MTT [3-(4,5-dimetil-tiazol-2-il)-2,5-difeniltetrazolio], el cual permitió identificar muestras líderes para investigaciones futuras.
MATERIALES Y MÉTODOS
Material vegetal
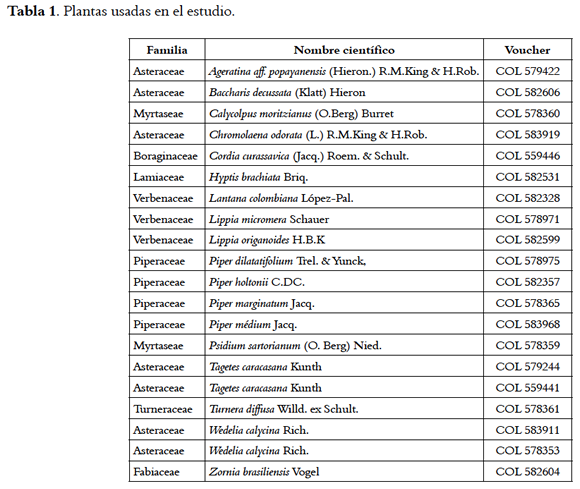
Las plantas se colectaron en áreas rurales y semiurbanas de los departamentos de Santander, Valle del Cauca y Arauca (Tabla 1). La identificación taxonómica fue realizada por el Dr. José Luis Fernández de la Universidad Nacional (Bogotá), una muestra codificada de cada planta se depositó para referencia en el Herbario Nacional de esta Universidad con su respectivo número de voucher.
Muestras
Se analizaron 20 muestras de AE de 18 especies distintas de plantas. La extracción del AE se hizo mediante hidrodestilación asistida por radiación de microondas o mediante extracción por arrastre con vapor. Detalles de los procedimientos han sido publicados (23,24). De cada AE se hizo una preparación concentrada en dimetilsulfóxido (DMSO: 1%) como solvente y se almacenaron alícuotas a -20 °C. La misma muestra se usó para todos los experimentos.
Células
Se usaron seis líneas celulares de las cuales dos son de tejido normal y las otras de canceroso. De origen humano: HEK293 (ATCC® CRL-1573™) de riñón embrionario; HEPG2 (ATCC® CRL-11997™) de carcinoma de hígado; MCF-7 (ATCC® HTB-22™) de carcinoma de glándula mamaria y HELA (ATCC® CCL-2™) de carcinoma cervical. Las tres primeras se cultivaron en medio DMEM-F12 [GIBCO Co.] suplementado con 10% de suero bovino fetal (SBF [GIBCO, Co.]) y antibiótico (P/E: Penicilina/Estreptomicina [Invitrogen Carlsbad, CA.]) y la otra, en medio MEM (GIBCO) suplementado con 8% de SBF y P/E. Las líneas celulares de origen animal fueron: VERO (ATCC® CCL-81™), riñón de mono, que fueron cultivadas en medio MEM suplementado como se mencionó; y B16F10 (ATCC® CRL-6475™) de melanoma de ratón cultivadas en medio RPMI-1640 [GIBCO Co.] suplementado con 10% de SBF y P/E. Para cada línea celular se estableció previamente el tiempo de duplicaciÓn en 24 h como tiempo mínimo para formación de monocapa viable y confluente 50 - 80%.
Ensayo de citotoxicidad
Se usó el ensayo colorimétrico basado en la reducción del MTT a formazán por enzimas oxidorreductasas en células vivas. Se siguió el protocolo previamente descrito (16,17). Brevemente, las células se sembraron en placas de 96 pozos en medio que contenía o no AE a variada concentración (50, 100, 200, 300, 400 y 500 µg/mL) y las placas se incubaron durante 72 h a 37 °C. El medio se removió y luego se adicionaron 20 µL de MTT (Sigma Aldrich, St. Louis, MO) a concentración de 5 mg/mL. Las placas se incubaron nuevamente 4 h a 37 °C, se retiró el MTT y enseguida se adicionaron 100 µL de DMSO para solubilizar los cristales de formazán. La intensidad del color (absorbancia) en cada pozo se cuantificó en un espectrofotómetro Multiskan Go (Thermo Scientific, Waltham, MA, EE.UU.) a 580 nm y se consideró proporcional a la viabilidad celular. Las células se expusieron al AE en el momento de la siembra que aquí se denomina tratamiento a (antes de la proliferación) y 24 h después o tratamiento d (después de la proliferación). Con cada línea celular y cada tratamiento se realizaron tres ensayos independientes por duplicado y células no-tratadas o tratadas con DMSO se incluyeron como controles. El número de células sembradas en cada pozo se determinó en ensayos previos y se seleccionó aquel con el cual la absorbancia de las no-tratadas a las 72 h fue > 0,9.
Análisis de datos
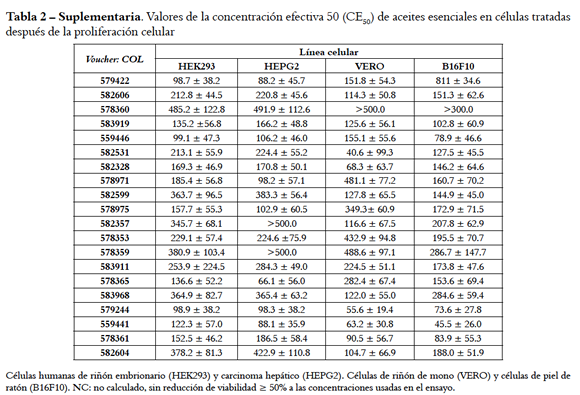
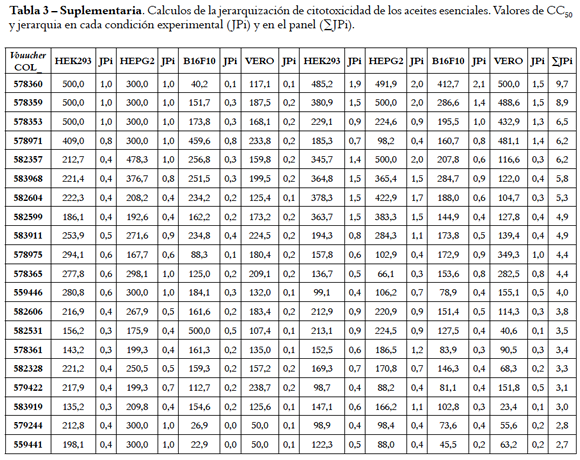
Los valores promedio de absorbancia de experimentos con células tratadas con AE se corrigieron usando el valor promedio de células tratadas con DMSO. Las curvas dosis-respuesta se construyeron, ajustaron y validaron usando el paquete estadístico R (R Development Core Team [2013]. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org). El porcentaje de viabilidad de las células AE-tratadas se calculó referente a 100% de las no-tratadas y la actividad se expresó en µg/mL como concentración citotóxica 50 (CC50) o que causó reducción de la viabilidad en 50%. Se construyó una matriz con los valores de la CC50 de ocho condiciones experimentales (cuatro líneas celulares con dos tratamientos) que se usó para jerarquizar la actividad. Para cada AE, se calculó la jerarquía ponderada individual (JPi) en cada condición experimental así: JPi = (CC50 x r / Cme) x P, donde: r = 5 o valor referente común; Cme = concentración máxima usada en el ensayo; P = valor ponderado de la línea celular como se detalla adelante. La sumatoria de las jerarquías individuales (∑JPi) se usó como indicador de similitud y las muestras se organizaron en orden descendente con base en este valor.
RESULTADOS
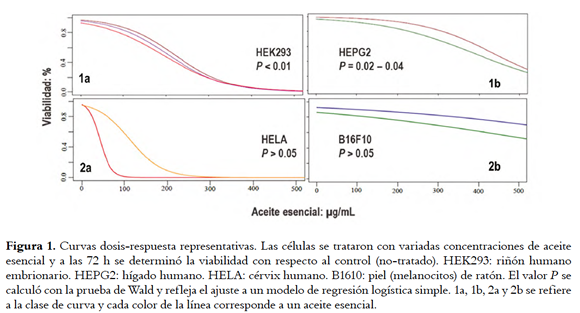
Las curvas dosis-respuesta generadas en los ensayos se agruparon en cuatro categorías dependiendo del ajuste a un modelo de regresión logística simple (Figura 1): curvas con buen ajuste (P[Wald]: < 0.01) se denominaron clase 1a, con ajuste aceptable (P[Wald]: 0.02 - 0.04) clase 1b y sin ajuste clase 2 (P[Wald]: > 0.05). Las clase 2 se denominaron 2a cuando se observó reducción de la viabilidad en 90 - 100% a las menores concentraciones de AE y clase 2b cuando la reducción fue < 50% con cualquier concentración. La curva clase 2b se usó como indicador de susceptibilidad de la línea celular al tratamiento con el AE ya que cuanto mayor la proporción de muestras con este tipo de respuesta, menor fue la susceptibilidad.
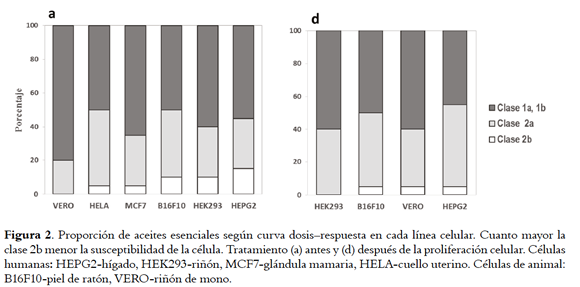
La proporción de AE según curva dosis-respuesta en cada línea celular, se presenta en la Figura 2. Se observó que curvas clase 1a y 1b (buen ajuste) fueron más frecuentes cuando las células se trataron antes (tratamiento a) que despuÉs (tratamiento d) de la proliferación (65,3% vs. 53,3%). Con respecto a la susceptibilidad, el rango por línea celular fue en el siguiente orden (frecuencia de curvas 2b en paréntesis): tratamiento a, VERO (0%) > HELA (5%) ≈ MCF7 (5%) > B16F10 (10%) > ≈ HEK293 (10%) > HEPG2 (15%); tratamiento d, HEK293 (0%) > VERO (5%) ≈ B16F10 (5%) ≈ HEPG2 (50). Los resultados muestran que células de riñón de mono (VERO) expuestas a los dos tratamientos fueron las más susceptibles y al contrario las de hígado humano (HEPG2). Se observó que las células de riñón humano (HEK293) fueron notoriamente más susceptibles después de la proliferación que antes de esta.
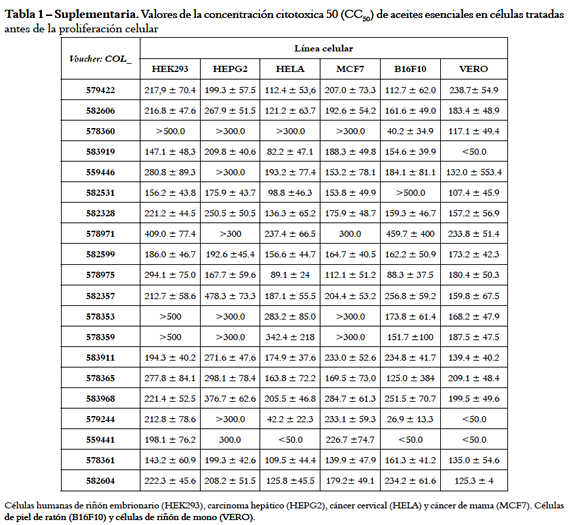
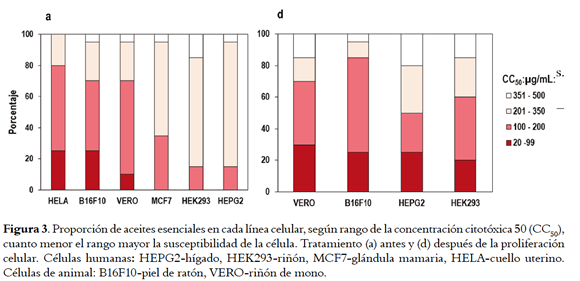
De las curvas dosis-respuesta se derivaron los valores de la CC50 en cada línea celular. Cuando esto no fue posible (curvas clase 2) se asignó la mínima (50 µg/mL) o máxima (500 µg/mL) concentración usada en el ensayo que redujo en > 50% la viabilidad (Tablas 1 y 2, Suplementarias). Los valores CC50 se agruparon en rangos que sirvieron para valorar la citotoxicidad (Figura 3), así: 351 - 500, 201 - 350, 100 - 200 y 20 - 99 µg/mL, respectivamente, como baja, media, alta y muy alta citotoxicidad adoptando criterios de Cos et al. (23) y Ferraz et al. (24), y la proporción de muestras con valores CC50 entre 20 - 99 µg/mL se consideró grado de susceptibilidad. Con tratamiento a, el rango de mayor a menor susceptibilidad (porcentaje de AE con CC50 de 20 - 99 µg/mL en paréntesis) fue como sigue: HELA (25,0%) ≈ B16F10 (25,0%) > VERO (10,0%) > MCF7 (0%) ≈ HEK293 (0%) ≈ HEPG2 (0%); con tratamiento d, fue: VERO (30,0%) > B 16F10 ( 25,0%) ≈ H EGP2 ( 25,0%) > HEK293 (20,0%). Los resultados sugieren que las células de riñón de mono (VERO) fueron más sensibles a los dos tratamientos con AE comparadas con las de riñón (HEK293) e hígado humano (HEPG2). De las células cancerosas, las de cérvix (HELA) y piel (B16F10) fueron más susceptibles que las de glándula mamaria (MCF7) y hepatoma (HEPG2).
Los valores de la CC50 en las líneas celulares de hígado (HEPG2), riñón (HEK293 y VERO) y piel (B16F10) con cada tratamiento se usaron para jerarquizar la actividad de los AE. El total de datos se derivó de ocho condiciones experimentales, esto es, cuatro lÍneas celulares cada una con dos tratamientos. En consideración a que células de origen humano son de mayor interés y que el tratamiento d causó mayor afectación se asignó la siguiente ponderación (% por tratamiento d / % por tratamiento a) de 40/20 para HEPG2/HEK293 y 30/10 para B16F10/ VERO. Se estableció la jerarquía en cada condiciÓn experimental calculando el valor JPi y ∑JPi (Tabla 3 Suplementaria).
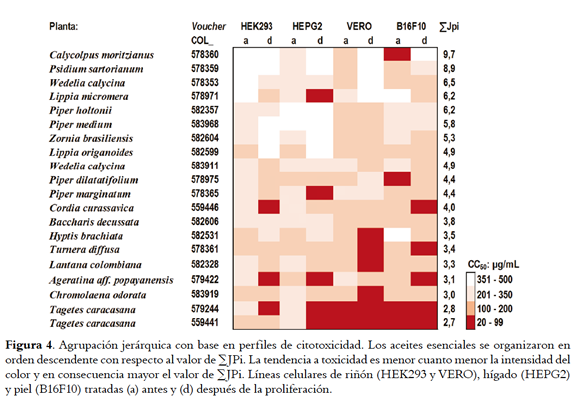
La Figura 4 compara los perfiles de citotoxicidad y presenta la ubicación de cada AE en la agrupación jerárquica. En los primeros lugares se ubicaron los AE con CC50 entre 201 y 500 µg/mL en el mayor número de condiciones experimentales y valores de ∑JPi > 6.0, los primeros se consideraron los menos citotóxicos y en orden descendente fueron en el siguiente rango (∑JPi en paréntesis): Calycolpus moritzianus (9,7) < Psidium sartorianum (8,9) < Wedelia calycina (6,5) < Lippia micromera (6,2) ≈ Piper haltonii (6,2).En últimos lugares se ubicaron las muestras con CC50 de 20 - 200 µg/mL en al menos cuatro de las condiciones experimentales y por lo mismo con valores de ∑JPi < 4.0. Los cinco AE más citotóxicos en orden ascendente fueron en el siguiente rango: Tagetes caracasana (2,7 - 2,8) > Chromolaena odorata (3,0) > Ageratina popayanensis (3,1) > Lantana colombiana (3,3) > Turnera diffusa (3,4).
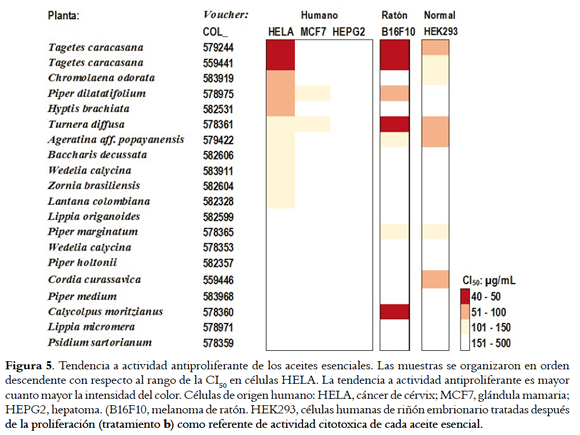
Existe suficiente evidencia para concluir que el AE de variadas especies de plantas inhibe la proliferación in vitro de células cancerosas (6,26). La tendencia de los AE de este estudio a inhibir células de cánceres humanos, se infirió con base en la concentración que redujo la viabilidad en 50% (CI50) con el tratamiento a (las células se sembraron en medio de cultivo que contenía AE). Los valores de la CI50 se agruparon en rangos adoptando criterios de otros estudios (25, 27) y la actividad antiproliferante se categorizó como sigue (valores de CI50 en paréntesis): relevante (< 50 µg/mL), probable (51 - 100 µg/mL), incierta (101 - 150 µg/mL) y ausente (> 150 µg/mL) (Figura 5). Sobre células humanas de cáncer cervical (HELA), se obervó actividad antiproliferante relevante con AE de Tagetes caracasana (CI50 de 42,2 y 47,9 µg/mL) y actividad probable con tres AE en el siguiente rango (CI50: µg/mL, en paréntesis): Chromolaena odorata (82,2) > Piper dilatatifolium (89,1) > Hyptis brachiata (98,8). Sobre células de cáncer de mama (MCF7) y hepatoma (HEPG2), los 20 AE fueron inactivos ya que presentaron valores de CI50 entre 101 y 500 µg/mL. Sobre células de melanoma murino, se observó actividad relevante también con AE de Tagetes caracasana, y además, de Calycolpus moritzianus.
DISCUSIÓN
Los resultados muestran la variación de la citotoxicidad entre AE de especies de plantas de Colombia y con respecto a la célula y tratamiento usados en el ensayo. La jerarquización de la actividad permitió identificar muestras con perfiles de baja y alta tendencia a toxicidad con base en valores de CC50 mayores y menores que 100 µg/mL, respectivamente, en la mayoría de líneas celulares. No se encontraron trabajos similares sobre citotoxicidad de AE luego de una revisión exhaustiva de sistema de búsqueda de artículos científicos. Rezk et al. (21) compararon la citotoxicidad del extracto de especies del género Rhododendron, analizando cada muestra simultáneamente en dos líneas celulares mediante ensayos que miden distinto parámetro de muerte celular. Usando un abordaje distinto de jerarquización, los autores lograron identificar la especie más promisoria para incluir en futuros estudios sobre antimicrobianos.
El ensayo del MTT es ampliamente utilizado para evaluar citotoxicidad de muestras de plantas y moléculas sintéticas (29,30) y en consideración a la facilidad técnica y bajo costo se seleccionó para este estudio. En un intento de robustecer el ensayo minimizando la variación con respecto al tipo y estado fisiológico de la célula, se incluyeron seis líneas celulares derivadas de órganos recomendados para análisis toxicológicos, como riñón, hígado y piel (28), las cuales se trataron en el momento de la siembra y 24 h después dado que el MTT puede evaluar estado quiescente de la célula (30). No se incluyó AE de referencia debido a que el propósito del estudio fue comparar entre si los AE para identificar los de menor tendencia a citotoxicidad y no comparar la actividad con respecto a un referente. No existe un parámetro único de toxicidad in vitro debido, en buena parte a la diversidad de ensayos, por lo que algunos autores han propuesto valores de CC50 < 100 µg/mL como indicador de actividad de muestras vegetales y estudios demuestran relación directa con toxicidad in vivo (6, 23, 24).
La agrupación de los AE analizados, según la curva dosis-respuesta y rango de la CC50, permitió identificar la variación de la citotoxicidad con respecto a la línea celular, la de riñón de mono (VERO) resultó más susceptibles que las de riñón (HEK293) e hígado (HEPG2) humano (Figuras 2 y 3). La variación de citotoxicidad dependiendo del tipo de línea celular ha sido demostrada en otros trabajos (13,21,28). La actividad varió también con respecto al tratamiento, siendo mayor después de la proliferación, que es resultado de esperar, ya que a las 24 h la división celular disminuye porque la monocapa celular ha alcanzado 75 - 80%. Además con este tratamiento, la concentración de suero bovino fetal en el medio de cultivo disminuyó de 10% a 2%) y con esto la señalización para progreso del ciclo celular (27,28).
La variación con respecto a la célula y tratamiento se tuvo en cuenta para jerarquizar los AE con respecto a citotoxicidad y de esta manera se identificaron los menos y más activos (Figura 4). El abordaje metodológico usado permite seleccionar AE para investigaciones futuras en medicamentos naturales o fármacos para patologías humanas. Los AE con baja tendencia a toxicidad pueden contener inhibidores de patógenos y metabolitos que modulen la respuesta inmune hacia un perfil más de protección contra la infección que inflamatorio. El AE de Lippia origanoides, de mediana toxicidad en este estudio, presentó actividad antiviral in vitro promisoria (CC50 < 30 µg/mL e IS > 4.0) sobre el virus dengue y virus de la fiebre amarilla (17,18). AE de Piper medium y Zornia brasiliensis, con baja tendencia a toxicidad en este estudio (seis y siete en la jerarquización), presentaron actividad antidengue promisoria (CC50 = 10 µg/mL e IS > 10) en un estudio en progreso.
La estrategia de jerarquización también permitió identificar AE para estudios de actividad anticancerígena, por ejemplo, el de Hyptis brachiata podría ser seleccionado para estudios futuros sobre medicamentos naturales para cáncer cervical debido a que presentó CI50 < 100 µg/mL en células HELA y CC50 > 200 µg/mL en células HEK293 (riñón) y HEPG2 (hígado), resultados que sugieren actividad promisoria. Aunque el AE de Tagetes caracasana presentó actividad antiproliferante relevante sobre células HELA (CI50 < 50 µg/mL), no se recomienda para futuros estudios debido a su notada toxicidad (∑Jpi < 3,0, último lugar en la jerarquización).
Es conocido que la actividad biológica de los AE depende de su composición química (5,10), aunque en este estudio no se pretendió establecer la relación entre el perfil citotóxico y químico. En estudios previos (23,24,31) y en progreso, se identificaron carvacrol, limoneno, timol, β-felandreno y α-humuleno, dependiendo de la planta, como componentes mayoritarios del AE de Lippia origanoides, Lippia micromera, Pipper medium y Zornia brasiliensis los cuales resultaron de baja toxicidad en este estudio; y cis- y trans-tagenonas, cis- y trans-ocimenonas, óxido de cadineno, carvacrol y germacreno del AE de Tagetes caracasana, Ageratina aff. popayanensis, Lantana colombiana y Hyptis brachiata que fueron los más citotóxicos. De algunos terpenos constituyentes de los AE hemos evaluado la citotoxicidad en ensayos del MTT, el tratamiento de células de riñón humano (HEK293), riñón de mono (VERO) y cérvix humano (HELA) con limoneno a concentración tan alta como 1600 µg/mL no afectó la viabilidad (16) y recientemente encontramos valores de CC50 > 200 µM sobre las mismas células con carvacrol, timol y β-felandreno.
El presente estudio tiene limitaciones relacionadas con el abordaje metodológico y la naturaleza de la muestra que dificultan concluir inequívocamente la tendencia a toxicidad de los AE. El MTT es una prueba colorimétrica que evalúa reducción de la actividad de enzimas como único parámetro de citotoxicidad (29,30); así, un AE con baja tendencia a toxicidad, según el MTT, puede resultar tóxico en un ensayo que evalúe otro parámetro. El MTT puede además generar falsos-positivos con muestras no-tóxicas pero que contienen inhibidores de las enzimas y falsos-negativos con muestras tóxicas que contienen componentes que señalizan la célula para apoptosis sin alterar la actividad enzimática (28-30). Con respecto a la naturaleza de la muestra, el resultado entre ensayos puede haber variado teniendo en cuenta que los AE son mezclas volátiles y, por lo mismo, la composición química se puede alterar durante el almacenamiento y la manipulación.
En futuros trabajos deberán ser considerados varios aspectos para lograr un abordaje metodológico que permita inferir con cierto grado de confiabilidad la toxicidad in vivo de muestras de AE. Entre estos: i) caracterizar la muestra para explicar su ubicación en la agrupación jerárquica dado que la toxicidad depende de su composición química; ii) evaluar la citotoxicidad simultáneamente en varias líneas celulares de origen humano de órganos relevantes en toxicología; iii) usar en cada ensayo AE de baja y alta toxicidad demostrada en ensayos in vivo como muestras de referencia; iv) evaluar simultáneamente varios parámetros de citotoxicidad.
CONCLUSIÓN
El abordaje metodológico usado en el estudio puede ser útil para seleccionar muestras de AE para futuros trabajos orientados al descubrimiento de productos para uso humano. Se demostró la variabilidad de resultados del MTT dependiendo del tipo de célula y en consecuencia la necesidad de usar un panel para evaluar la actividad citotóxica. Dadas las limitaciones de los ensayos basados en célula, se recomienda usar protocolos robustos y reproducibles que permitan inferir con cierto grado de confiabilidad la tendencia de muestras vegetales que pueden ser tóxicos en humanos.
AGRADECIMIENTOS
Las autoras agradecen al Dr. Marcos López de la Fundación Cardiovascular, Bucaramanga, Colombia, Dra. Patricia Escobar y a Henry Bautista por la contribución con las líneas celulares MCF-7, B16F10, HEK293 y HEPG2. Este trabajo está anidado al Programa Bioprospección y desarrollo de ingredientes naturales para las industrias cosmética, farmacéutica y de productos de aseo con base en la biodiversidad colombiana de la UT-BioRed-COCENIVAM. El programa es financiado con recursos del Patrimonio Autónomo Fondo Nacional de Financiamiento para la Ciencia, la Tecnología y la Innovación, Francisco José de Caldas, contrato RC-0572-2012. El material que se utilizó para este trabajo fue proveído por el Estado Colombiano a través del Ministerio del Medio Ambiente y Desarrollo Sostenible. Fue colectado bajo el Contrato de Acceso a Recursos Genéticos y Productos Derivados No. 101 del 3 de junio de 2014, suscrito entre el Ministerio del Medio Ambiente y Desarrollo Sostenible y la Unión Temporal Bio-Red-CO-CENIVAM.
CONFLICTO DE INTERESES
Las autoras manifiestan que no existe ningún conflicto de intereses con los resultados publicados.
REFERENCIAS
1. Baser K.H.C, Buchbauer G (Ed.). Handbook of essential oils: science, technology, and application. USA: Taylor & Francis Group, Boca Raton. 2010. [ Links ]
2. Bilia AR, Guccione C, Isacchi B, Righeschi C, Firenzuoli F, Bergonzi MC. Essential oils loaded in nanosystems: a developing strategy for a successful therapeutic approach. Evid Based Complement Alternat Med 651593. 2014. [ Links ]
3. Dweck AC. Formulating Natural Cosmetics: An Encyclopedia of Ingredients: Natural preservatives - An update. Allured Pub Corp. ISBN-13: 978-1932633757. 2010;107-130 p. [ Links ]
4. Antoniotti S. Tuning of essential oil properties by enzymatic treatment: towards sustainable processes for the generation of new fragrance ingredients. Molecules. 2014; 19(7):9203-9214. [ Links ]
5. Adorjan B, Buchbauer G. Biological properties of essential oils: an updated review. Flavour Fragr. 2010; 25: 407-426. [ Links ]
6. Bayala B, Bassole IH, Scifo R, Gnoula C, Morel L, Lobaccaro J, et al. Anticancer activity of essential oils and their chemical components - a review. Am J Cancer Res. 2014; 4(6): 591-607. [ Links ]
7. Sienkiewicz M, Kowalczyk E, Wasiela M. Recent patents regarding essential oils and the significance of their constituents in human health and treatment. Recent Pat Antiinfect Drug Discov. 2012;7(2):133-140. [ Links ]
8. Lang G. and Buchbauer G. A review on recent research results (2008-2010) on essential oils as antimicrobials and antifungals. A review. Flavour Fragr. J. 2010; 27:13-39. [ Links ]
9. Ben-Arye E, Dudai N, Eini A, Torem M, Schiff E, Rakover Y. Treatment of upper respiratory tract infections in primary care: a randomized study using aromatic herbs. Evid Based Complement Alternat Med 690346. 2011. [ Links ]
10. Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils - A review. Food Chem Toxicol. 2008; 46(2):446-475. [ Links ]
11. Sperotto AR1, Moura DJ, Péres VF, Damasceno FC, Caramão EB, Henriques JA, Saffi J. Cytotoxic mechanism of Piper gaudichaudianum Kunth essential oil and its major compound nerolidol. Food Chem Toxicol. 2013;57: 57-68. [ Links ]
12. Chhabra RS, Bucher JR, Wolfe M, Portier C. Toxicity characterization of environmental chemicals by the US National Toxicology Program: an overview. Int J Hyg Environ Health. 2003; 206 (4-5):437-445. [ Links ]
13. Tweats DJ, Scott AD, Westmoreland C, Carmichael PL. Determination of genetic toxicity and potential carcinogenicity in vitro-challenges post the Seventh Amendment to the European Cosmetics Directive. Mutagenesis. 2006; 22(1):5-13. [ Links ]
14. Ahuja V, Sharma S. Drug safety testing paradigm, current progress and future challenges: an overview. J. Appl. Toxicol. 2014; 34:576-594. [ Links ]
15. Bueno J, Escobar P, Martínez JR, Leal SM, Stashenko EE. Composition of three essential oils, and their mammalian cell toxicity and antimycobacterial activity against drug resistant-tuberculosis and nontuberculous mycobacteria strains. Nat Prod Commun. 2011; 6(11):1743-1748. [ Links ]
16. Gómez LA, Stashenko E, Ocazionez RE. Comparative study on in vitro activities of citral, limonene and essential oils from Lippia citriodora and L. alba on yellow fever virus. Nat Prod Commun. 2013; 8(2):249-252. [ Links ]
17. Meneses R, Ocazionez RE, Martínez JR, Stashenko EE. Inhibitory effect of essential oils obtained from plants grown in Colombia on yellow fever virus replication in vitro. Ann Clin Microbiol Antimicrob. 2009; 6:8:8. [ Links ]
18. Ocazionez RE, Meneses R, Torres FA, Stashenko E. Virucidal activity of Colombian Lippia essential oils on dengue virus replication in vitro. Mem Inst Oswaldo Cruz. 2010; 105(3):304-309. [ Links ]
19. Sarrazin SL, da Silva LA, de Assunção AP, Oliveira RB, Calao VY, da Silva R, et al. Antimicrobial and seasonal evaluation of the carvacrol-chemotype oil from Lippia origanoides Kunth. Molecules. 2015; 20(2):1860-1871. [ Links ]
20. Vera SS, Zambrano DF, Méndez-Sánchez SC, Rodríguez-Sanabria F, Stashenko E, Duque Luna JE. Essential oils with insecticidal activity against larvae of Aedes aegypti (Diptera: Culicidae). Parasitol Res. 2014; 113(7):2647-2654. [ Links ]
21. Rezk A, Al-Hashimi A, John W, Schepker H, Ullrich M-S, Brix K. Assessment of cytotoxicity exerted by leaf extracts from plants of the genus Rhododendron towards epidermal keratinocytes and intestine epithelial cells. BMC Complementary and Alternative Medicine DOI 10.1186/s12906-015-0860-8. 2015; 15:364 [ Links ]
22. Xia M, Huang R, Witt K, Southall N, Fostel J, Cho M-H, et al. Compound cytotoxicity profiling using quantitative high-throughput screening. Environ Health Perspect. 2008; 116(3): 284-291. [ Links ]
23. Stashenko EE, Jaramillo BE, Martínez JR. Comparison of different extraction methods for the analysis of volatile secondary metabolites of Lippia alba (Mill.) N.E. Brown, grown in Colombia, and evaluation of its in vitro antioxidant activity. J Chromatogr A. 2004; 1025(1):93-103. [ Links ]
24. Stashenko E, Martínez JR, Cala MP, Durán DC, Caballero D. Chromatographic and mass spectrometric characterization of essential oils and extracts from Lippia (Verbenaceae) aromatic plants. J Sep Sci. 2013; 36(1):192-202. [ Links ]
25. Cos P, Vlietinck AJ, Berghe DV, Maes L. Anti-infective potential of natural products: How to develop a stronger in vitro 'proof-ofconcept'. J. Ethnopharmacol. 2006; 106(3):290-302. [ Links ]
26. Ferraz R, Bomfim D, Carvalho N, Soares M, da Silva T, Machado W, et al. Cytotoxic effect of leaf essential oil of Lippia gracilis Schauer (Verbenaceae). Phytomed. 2013; 20:615-621. [ Links ]
27. Suffness M, Pezzuto JM.1990. Assays related to cancer drug discovery. In: Hostettmann, K. (Ed.), Methods in Plant Biochemistry: Assays for Bioactivity. Academic Press, London, pp. 71 -133. [ Links ]
28. Yoon M, Campbell JL, Andersen ME, Clewell H. Quantitative in vitro to in vivo extrapolation of cell-based toxicity assay results. Crit Rev Toxicol. 2012; 42(8):633-652. [ Links ]
29. Weyermann J, Lochmann D, Zimmer A. A practical note on the use of cytotoxicity assays. Int J Pharm. 2005; 288(2):369-376. 30. Mossman T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983; 65(1):55-63. [ Links ]
31. Leal SM, Pino N, Stashenko EE, Martínez JR, Patricia E. Escobar. Antiprotozoal activity of essential oils derived from Piper spp. grown in Colombia. J Essential Oil Res. [ Links ]