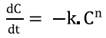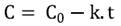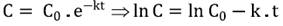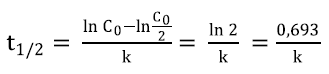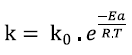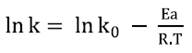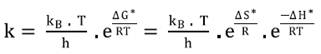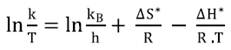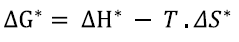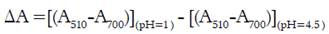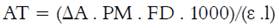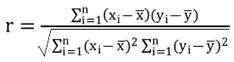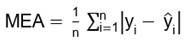Introducción
La calidad nutricional de los alimentos procesados es de vital interés para los consumidores y la industria de alimentos debido al impacto que tienen los nutrientes en la salud de los consumidores. Los arándanos constituyen una fuente rica en fitonutrientes, entre los que se destacan las antocianinas, las que poseen una alta capacidad antioxidante 1 y a las que se les atribuyen propiedades beneficiosas para la salud, como la prevención de enfermedades cardiovasculares, neuronales, cáncer y diabetes, entre otras (2, 3).
Las antocianinas son pigmentos-antioxidantes que están constituidas por una aglicona o antocianidina; la que en su estado natural está glicosidada por uno o más azúcares. Las diferencias en la estructura de la aglicona se deben al número de grupos hidroxilo y al grado de metilación de estos grupos (4, 5).
Los procesos de fabricación de ciertos productos alimenticios, que contienen antocianinas, involucran tratamientos térmicos, como son el escaldado o la pasteurización. Estos procesos ayudan a mantener los alimentos seguros y a prolongar su vida útil 6. Sin embargo, los tratamientos térmicos y posterior almacenamiento pueden influir en el contenido de antocianinas de los productos finales al afectar su estructura (6, 7). Así, Sui et al.6) al estudiar la estabilidad química de soluciones acuosas de antocianinas tratadas térmicamente y almacenadas a las temperaturas de 4, 25, 45 y 65°C publicaron que las antocianinas fueron más estables cuando el almacenamiento se realizó a 4°C. Martínez-Zambrano et al. 8) estudiaron la cinética de degradación de antocianinas de jugo de agraz (Vaccinium meridionale Sw.) almacenados a 4, 17 y 37°C y observaron que ésta siguió una cinética de primer orden y que la degradación de antocianinas se vio acelerada con el incremento de la temperatura.
La combinación de temperatura y tiempo de almacenamiento son variables importantes que deben ser controladas por los industriales para garantizar una mínima pérdida de calidad de los alimentos. Además, aproximaciones empíricas de modelos cinéticos basados en el concepto de orden de reacción (orden cero y uno) son adecuados para controlar y predecir cambios en los parámetros físico-químicos durante el almacenamiento 9. Adicionalmente, el conocimiento de parámetros cinéticos como constante de velocidad de degradación y tiempo de vida media; y de parámetros termodinámicos como energía libre, entalpía y entropía, proporcionan información concerniente a la estabilidad de las antocianinas 10.
Varias son las publicaciones sobre el efecto de la temperatura en la concentración de antocianinas durante un tratamiento térmico. Sin embargo, se encontraron pocos trabajos referidos al efecto de la temperatura de almacenamiento sobre el contenido de antocianinas en jugos de arándanos sin pasteurizar y pasteurizado. En este estudio se planteó la hipótesis de que es posible utilizar enfoques empíricos y enfoques basados en termodinámica estadística para describir el efecto de la temperatura de almacenamiento de jugos de arándanos (Vaccinium corymbosum L.).
El objetivo de la investigación fue evaluar el efecto de la pasteurización en el contenido de antocianinas de jugos de arándanos y estudiar aproximaciones empíricas y parámetros cinéticos y termodinámicos para describir la estabilidad de las antocianinas presentes en jugos de arándanos sin pasteurizar y pasteurizado durante el almacenamiento a diferentes temperaturas.
Materiales y métodos
Obtención de jugo de arándano
Arándanos de la variedad Snowchaser (Vaccinium corymbosum L. 'Snowchaser') fueron recolectados, lavados y pesados. A continuación se realizó una molienda y, para mejorar el rendimiento de obtención de jugo, se efectuó un tratamiento enzimático a 50 °C durante 78 min con enzimas poligalacturonasas 4 y 8 mg/100 g de arándanos de 8600 PGNU/g y 5700 PGNU/g, respectivamente. El jugo obtenido fue filtrado y dividido en dos fracciones iguales. Una fracción fue envasada en bolsas de polietileno estériles con cierre hermético de 250 mL, tratando de que no queden espacios de aire. La otra fracción fue pasteurizada a 77±1 °C durante 85 s, previo al envasado. La pasteurización se realizó en un intercambiador de calor de placas de escala piloto armado en la Facultad de Ciencias de la Alimentación, en el que el agua de calentamiento fue de 95±2 °C y la de enfriamiento de 6±2 °C. La relación temperatura-tiempo de pasteurización se seleccionó según ensayos realizados en laboratorio y cuyo propósito fue encontrar la combinación de estas variables que maximicen la concentración de antocianinas monoméricas totales (resultados aún no publicados).
Estudios durante el almacenamiento
Jugos de arándanos sin pasteurizar (JAS/P) y pasteurizado (JAP) fueron almacenados a las temperaturas de -18, 0, 5 y 10 °C durante 148 días. Se almacenaron 84 envases de jugos sin pasteurizar, 21 envases por cada temperatura de almacenamiento. A intervalos regulares de tiempo fueron retirados 3 envases para evaluar la concentración de antocianinas monoméricas totales (AT). De igual forma se procedió con el jugo pasteurizado.
Cinética de degradación de las antocianinas durante el almacenamiento
El orden de la cinética de degradación de la AT se determinó teniendo en cuenta su variación en los jugos, en función del tiempo de almacenamiento (Ecuación 1). La Ecuación 2 describe una reacción de orden cero y la Ecuación 3, una reacción de primer orden 11.
donde C= AT al tiempo t (mg cianidina-3-glucósido L-1 jugo), C0= AT al inicio del almacenamiento (mg cianidina-3-glucósido L-1 jugo), t= tiempo (días), k= constante de velocidad de degradación, (días-1) y n= orden de la reacción.
Para analizar el ajuste a una cinética de orden cero, se representó, para cada temperatura de almacenamiento, C en función de t. Para analizar el ajuste a una cinética de orden uno se representó el ln C en función de t. A continuación se realizó el análisis de regresión para las cinéticas de orden cero y uno. Estos estudios permitieron establecer cuál de los dos modelos anteriores describió mejor la degradación de las antocianinas con el tiempo. Para los análisis posteriores se trabajó únicamente con el modelo de mejor ajuste.
Parámetros cinéticos de degradación de antocianinas
Constante de velocidad de degradación
A partir de la pendiente de la curva que describe la variación de la AT en función del tiempo de almacenamiento (Ecuación 3) se obtuvieron los valores de las constantes de velocidad de degradación (k) de las AT presentes en los JAS/P y JAP, a las temperaturas de -18, 0, 5 y 10 °C (11, 12).
Tiempo de vida media
El tiempo de vida media (t1/2) es el tiempo necesario para que la concentración de un reactivo descienda a la mitad de su valor inicial (13). Para determinar el tiempo de vida media de las AT en los jugos se reemplazó en la Ecuación 4, para cada temperatura estudiada, los valores de k en el modelo de mejor ajuste (12).
Energía de activación
La diferencia entre la energía de los reactivos y la energía mínima que deben alcanzar para reaccionar es lo que se conoce como energía de activación. Ésta se puede calcular a partir de la expresión de Arrhenius (Ecuación 5) (11).
donde k= constante de velocidad de degradación de AT (días-1), k0= factor de frecuencia o factor preexponencial (días-1), Ea= energía de activación (kJ/mol), R= constante universal de los gases (8,314 J/mol . K) y T= temperatura absoluta (K).
La Ecuación de Arrhenius se puede escribir en forma logarítmica (Ecuación 6).
La Ea se obtuvo a partir del cálculo de la pendiente (-Ea/R) entre la representación de ln k en función de 1/T.
Funciones termodinámicas
El modelo de Eyring está basado en la teoría del estado de transición. Esta teoría, también llamada del complejo activado, describe la reacción entre dos especies pasando por la formación de un complejo activado inestable y en equilibrio con los reactivos, que se descompone en los productos. Sus parámetros son la entalpía de activación (ΔH*) y la entropía de activación (ΔS*). La Ecuación 7 muestra el modelo de Eyring, que relaciona las funciones termodinámicas mencionadas (14).
donde kB= constante de Boltzmann (1,381 . 10-23 J/K), T= temperatura absoluta (K), h= constante de Planck (6,626 . 10-34 J . s), ΔS*= entropía de activación (J/mol . K), ΔH*= entalpía de activación (kJ/mol) y R= constante universal de los gases (8,314 J/mol . K).
La Ecuación de Eyring se puede escribir en forma logarítmica (Ecuación 8):
Para obtener la entalpía de activación (ΔH*) y la entropía de activación (ΔS*) se representó la relación ln(k/T) en función de 1/T. Con el valor de la pendiente (ΔH*/R) y de la constante universal de los gases se calculó ΔH* y con la ordenada en el origen [ln (kB/h)+ΔS*/R] se obtuvo ΔS*.
La energía libre de Gibbs de activación puede ser expresada en términos de la entalpía y la entropía de activación. A partir de la Ecuación 9 se determinó ΔG* (15).
donde ΔG*= Energía libre de Gibbs de activación (kJ / mol), ΔH*= Entalpía de activación (kJ / mol), ΔS*= Entropía de activación (J/mol . K) y T= Temperatura (K).
Análisis de la concentración de antocianinas monoméricas totales
La concentración de antocianinas monoméricas totales (AT) se cuantificó por espectroscopía UV-Visible, mediante el método pH diferencial. Una alícuota de jugo se diluyó con buffer de pH 1,0 y otra alícuota con buffer de pH 4,5 y se registró la absorbancia a 510 y 700 nm. La AT fue calculada mediante las Ecuaciones 10 y 11 (16).
dónde ΔA= cambio en la absorbancia, AT= concentración de antocianinas monoméricas totales (mg cianidina-3-glucósido L-1 de jugo); PM= masa molecular para cianidina-3-glucósido (449,2 g/mol), FD= factor de dilución, Ɛ= coeficiente de extinción molar para cianidina-3-glucósido (26900), l= longitud de paso de celda (1cm), 1000= factor de conversión de gramos a miligramos. Los ensayos se realizaron por triplicado (n=3).
Todas las determinaciones analíticas se realizaron por triplicado.
Análisis estadísticos
Análisis de componentes principales
Se utilizó la herramienta de exploración análisis de componentes principales (ACP) de software STATGRAPHICS Centurión XV para analizar la posible existencia de agrupaciones naturales entre las AT correspondientes a JAS/P y JAP, almacenados a temperaturas de -18, 0, 5 y 10°C y a diferentes tiempos de almacenamiento (17).
Análisis de regresión
Este análisis estadístico se utilizó para determinar el orden de la cinética de degradación de AT (orden cero o uno) que mejor se ajustó a los datos experimentales. La calidad del ajuste sobre los datos experimentales se evaluó con las pruebas: determinación de la significancia de la regresión (modelo significativo: p de regresión<0,05), coeficiente de correlación (r) (Ecuación 12); media del error absoluto (MEA) (Ecuación 13) y prueba de Durbin-Watson (DW) (residuos independientes: p-valor DW> 0,05) (18).
dónde xi e yi= valores observados y x e y = medias muestreales.
donde yi= valor observado, y i= valor predicho o estimado y n= número de observaciones.
Análisis de comparación de medias
Mediante análisis de varianza (ANOVA) y procedimiento de diferencia mínima significativa (LSD) de Fisher se compararon las medias de AT con software STATGRAPHICS Centurión XV. Se consideró que hubo diferencias estadísticas significativas entre medias cuando el p de la tabla de ANOVA fue menor que 0,05.
Resultados
Análisis de componentes principales
La temperatura y el tiempo de almacenamiento son parámetros importantes a tener en cuenta durante el almacenamiento del jugo de arándanos. Así, Martínez et al. (19) al investigar la estabilidad de antocianinas en jugo concentrado de Agraz (Vaccinium meridionale Sw.) almacenado a 4, 17 y 37 ºC, señalaron que la elevación de la temperatura de almacenamiento produce un claro efecto de degradación de las mismas. Es por esto que, se consideró conveniente determinar en qué medida la concentración de antocianinas en jugos de arándanos se vio afectada por la temperatura y el tiempo de almacenamiento.
En un ACP (Figura 1), con 2 componentes quedó explicado el 70 % de la varianza. Los 168 ensayos se agruparon en 5 poblaciones, las que se describen a continuación.
Población 1. Inicio del ensayo (t= 0 días) del JAS/P.
Población 2. JAS/P almacenados durante 12 días a las temperaturas de 0, 5 y 10 °C.
Población 3. JAS/P almacenados durante 12 días a -18 °C y JAS/P almacenados durante 23, 54, 91, 119 y 148 días a todas las temperaturas (T= -18, 0, 5 y 10 °C).
Población 4. Inicio del ensayo (t= 0 días) del JAP.
Población 5. JAP a todas las temperaturas y tiempos de almacenamiento.
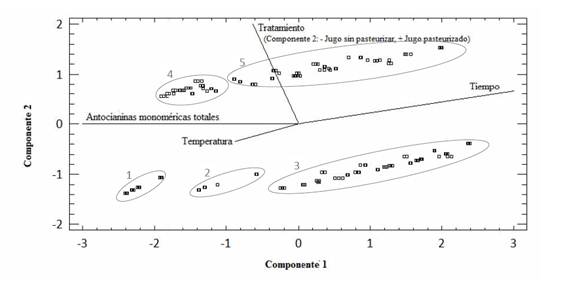
Figura 1 Análisis de componentes principales del estudio de degradación de antocianinas durante el almacenamiento a diferentes temperaturas de jugos de arándanos sin pasteurizar y pasteurizado.
El análisis de la Figura 1 mostró que el tratamiento de pasteurización influyó en el contenido de AT inicial del jugo de arándanos, como así también la temperatura y el tiempo de almacenamiento. El contenido inicial de AT en el JA fue 804,82 mg cianidina-3-glucósido L-1 y en el JAP, 575,24 mg cianidina-3-glucósido L-1 de jugo; por lo que la pasteurización provocó una disminución del 28,5% en la concentración de antocianinas.
Evolución de la concentración de antocianinas monoméricas totales durante el almacenamiento
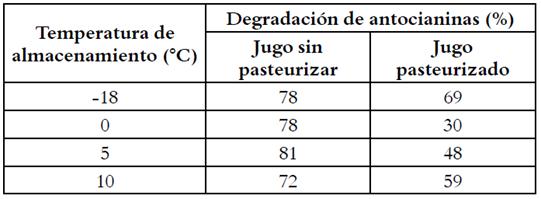
Las AT presentes en los jugos se fueron degradando paulatinamente a medida que fue transcurriendo el tiempo de almacenamiento (Figuras 2 a y b). Los JAS/P presentaron una importante disminución de la concentración de AT en los primeros 23 días, para luego disminuir de manera menos acusada; al igual que los JAP almacenados a -18 °C. Sin embargo, la degradación de los pigmentos-antioxidantes fue gradual en los JAP almacenados a 0, 5 y 10 °C. Al final de los 148 días la degradación de AT en el JAS/P estuvo comprendida entre 72 y 81 % y en el JAP, entre 30 y 69 %, dependiendo de la temperatura de almacenamiento (Tabla 1).
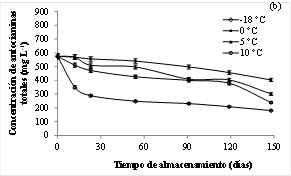

Figura 2 Evolución de la concentración de antocianinas en jugos de arándanos sin pasteurizar (Figura 2a) y en jugos de arándanos pasteurizados (Figura 2b) durante el almacenamiento. Cada punto representa el promedio de 3 réplicas (n=3).
Cinética de degradación de las antocianinas durante el almacenamiento
Con el propósito de determinar cuál de los jugos (JAS/P y JAP) fue más estable frente al almacenamiento y cuantificar el efecto de la temperatura en la estabilidad de las antocianinas, se recurrió a la modelización matemática de las cinéticas de degradación con modelos empíricos de distinto orden. A continuación se muestran los resultados, se analiza el orden de la cinética de la reacción de degradación de AT y se estudian distintos parámetros de modelos empíricos y de termodinámica estadística.
En primer lugar, se ajustaron los valores experimentales (VE) a un modelo de orden cero (M0) y a un modelo de orden uno (M1) (Figura 3). En los JAS/P, las pendientes de las curvas de las Figuras 3 fueron similares para todas las temperaturas estudiadas, lo que estaría indicando que la velocidad de deterioro de las antocianinas fue similar a todas las temperaturas de almacenamiento. En los JAP las pendientes de las curvas fueron mayores cuanto más elevada fue la temperatura de trabajo, con excepción del jugo almacenado a -18°C en los que la pendiente fue mayor.
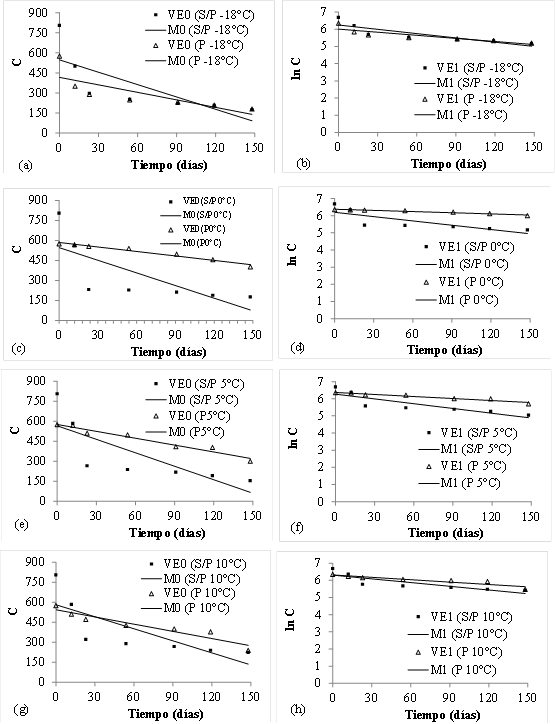
Figura 3 Degradación de antocianinas en los jugos de arándanos sin pasteurizar y pasteurizado durante el almacenamiento a -18, 0, 5 y 10 °C. VE se refiere a los valores experimentales, donde cada punto representa el promedio de 3 réplicas. M0 muestra los datos obtenidos con el modelo de cinética de orden cero y M1, los datos obtenidos con el modelo de cinética de orden uno. Las unidades de C están expresadas en mg cianidina-3-glucósido L-1 jugo.
Para evaluar cuál de los modelos fue el que mejor describió la degradación de AT en función del tiempo de almacenamiento, se realizó un análisis de regresión y se obtuvieron los criterios de calidad del ajuste que figuran en la Tabla 2. Para los JAS/P y JAP a todas las temperaturas ensayadas, los valores de p de regresión de los modelos de orden cero y uno indicaron que hubo una relación significativa (p<0,05) entre las variables C ó ln C, según el modelo analizado, y el tiempo de almacenamiento.
Tabla 2 Modelo de regresión de orden cero y uno y parámetros estadísticos de bondad de ajuste a distintas temperaturas de almacenamiento de jugos de arándanos sin pasteurizar y pasteurizado.
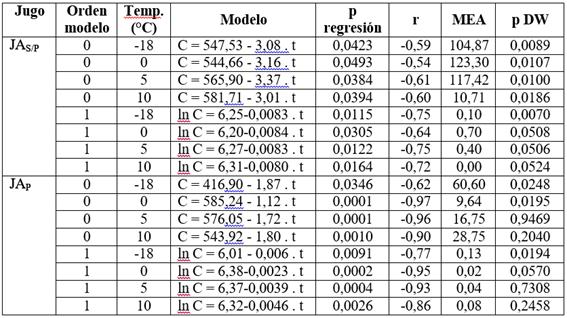
Para el modelo de primer orden los coeficientes de correlación próximos a -1 señalaron que existió una fuerte relación lineal negativa entre ln C y el tiempo de almacenamiento, por lo que, cuanto mayor fue el tiempo de almacenamiento, menor fue la AT y, en consecuencia, mayor fue el deterioro de las antocianinas. Además, para este modelo, las MEA fueron pequeñas y los p DW (> 0,05) señalaron independencia entre los residuos, con excepción del JAP almacenado a -18°C.
Por lo tanto, dado que este modelo, en general, cumplió con los criterios de calidad de ajuste, se propone que la variación de la AT, en los JAS/P y JAP, en función del tiempo de almacenamiento siguió una cinética de primer orden.
Consecuentemente, los siguientes análisis de esta investigación se realizaron para un modelo de primer orden.
Parámetros cinéticos de degradación de antocianinas
En los JAS/P la k no mostró diferencias a las distintas temperaturas estudiadas, mientras que en los JAP la k aumentó con el incremento de la temperatura de almacenamiento, con excepción de los JAP almacenado a -18°C, que mostraron el valor más alto de esta constante (Tabla 3). Para una misma temperatura, k siempre fue menor en los JAP.
Tabla 3. Efecto de la temperatura en la k y el t1/2 de las antocianinas en los jugos de arándanos sin pasteurizar y pasteurizado a distintas temperaturas de almacenamiento.
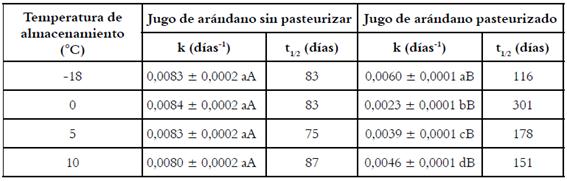
Letras minúsculas diferentes en una misma columna indican que el ANOVA señaló diferencias significativas entre las medias de k a distintas temperaturas, mientras que letras mayúsculas distintas en una misma fila señalan diferencias entre las medias de k del jugo de arándano sin pasteurizar y pasteurizado.
Los JAP tuvieron un t1/2 entre 1,4 y 3,6 veces superior a los JAS/P; siendo más alto cuando los JAP se almacenaron a 0 °C y más bajo cuando se almacenaron a -18 °C (Tabla 3).
Teniendo en cuenta los resultados anteriores, los estudios de los modelos de Arrhenius y Eyring se realizaron para los JAP almacenados a 0, 5 y 10 °C.
Para estudiar el ajuste de la Ecuación de Arrhenius se obtuvo la relación entre las k identificadas y cada una de las temperaturas de tratamiento (Figura 4a). El alto coeficiente de correlación obtenido (-0,92) estaría indicando una alta correlación entre ln k y 1/T y por lo tanto un buen ajuste del modelo de Arrhenius. La Ea obtenida fue de 44,66 kJ/mol.
Las funciones termodinámicas del modelo de Eyring fueron calculadas representando ln (k/T) en función de 1/T (Figura 4b). El coeficiente de correlación obtenido fue -0,91; poniendo de manifiesto una alta correlación entre las variables señaladas.
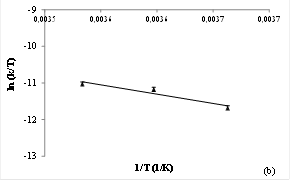

Figura 4 Efecto de la temperatura sobre la constante de velocidad de degradación de las antocianinas presentes en el jugo de arándano pasteurizado (Figura 4a). Relación entre la velocidad de degradación de las antocianinas en jugo de arándano pasteurizado en función de la temperatura (Ecuación de Eyring) (Figura 4b).
El valor de ΔG* (calculado a 25 ºC) fue 83,80 kJ/mol, el de ΔH*, 42,35 kJ/mol y el de ΔS*, -139,09 J/mol.K.
Discusión
En la presente investigación se logró cuantificar el efecto de la pasteurización y del almacenamiento en el contenido de antocianinas de jugos de arándanos, determinándose que la estabilidad de los pigmentos-antioxidantes fue mayor en los JAP almacenados a 0 °C.
El tratamiento térmico de pasteurización a 77±1°C durante 85 s, provocó una disminución de la AT inicial del jugo de arándanos de 28,5 %; en coincidencia con lo publicado por otros autores, que señalan que temperaturas elevadas ocasionan una degradación de antocianinas monoméricas debido a su fácil oxidación, provocando degradación de color y pérdidas en el valor nutricional de productos alimenticios (10, 20). La disminución de la AT obtenida en el presente estudio fue ligeramente superior al obtenido por Pozo-Insfran et al. 21, quienes reportaron una pérdida de 24% de AT durante la pasteurización de jugo de uva a 75 °C durante 15 s.
Durante el almacenamiento también se observó degradación de la AT, tanto en el JAS/P como en el JAP. Sin embargo, el deterioro de los pigmentos-antioxidantes durante los primeros 23 días fue mucho mayor en el JAS/P. Probablemente esto fue debido a la presencia de enzimas nativas de las frutas que también se encuentran en jugos sin pasteurizar, tales como polifenol oxidasa, peroxidasa y β-glucosidasas; las que pueden causar una rápida oxidación de las antocianinas (1, 20).
El deterioro de las antocianinas presentes en los JAP almacenados a -18 °C no fue gradual como los demás JAP almacenados a 0, 5 y 10 °C; sino que tuvo un comportamiento similar al de JAS/P. La pérdida de antocianinas monoméricas totales, desde el inicio hasta el final del almacenamiento en los JAP almacenados a -18 °C fue 69 %. Esta pérdida fue superior a las señaladas por Reque et al. 27, quienes para frutos de arándano almacenados a -18 °C durante 6 meses publicaron 59 % de degradación de antocianinas; mientras que Chaovanalikit y Wrolstad 28 obtuvieron para cerezas, almacenadas a -23 °C durante 6 meses, una degradación de antocianinas mayor que las obtenidas en la presente investigación, alcanzando valores de hasta 87 %.
Los estudios de cinética de degradación de antocianinas durante el almacenamiento de los JAS/P y JAP señalaron que la variación de la AT en función del tiempo de almacenamiento siguió una cinética de primer orden, para todas las temperaturas estudiadas. A la misma conclusión llegaron los autores Martínez-Zambrano et al.8 en sus investigaciones referidas a estabilidad de antocianinas de jugos de agraz almacenados a 4, 17 y 37 °C. En los JAS/P la velocidad de deterioro de las antocianinas fue similar a todas las temperaturas de almacenamiento, probablemente debido a la rápida degradación provocada por enzimas nativas 20. Sin embargo, con excepción de los JAP almacenados a -18 °C, en los JAP el deterioro fue menor cuanto más bajas fueron las temperaturas de almacenamiento. Estos resultados coinciden con los obtenidos por los investigadores Kamiloglu et al. 22, quienes publicaron que la estabilidad de antocianinas de confituras y mermeladas de zanahorias almacenadas a 4 y 25 °C fue mayor cuando la temperatura de almacenamiento fue de 4 °C. También Sui et al.6 obtuvieron que el color de soluciones de antocianinas almacenadas a 4, 25, 45 y 65 °C disminuyó durante el almacenamiento, encontrándose menor degradación a la más baja temperatura.
Los parámetros de los modelos empíricos también pusieron de manifiesto el efecto adverso que provocó la elevación de la temperatura de almacenamiento sobre la AT. En los JAP las k tomaron valores de: 0,0023, 0,0039 y 0,0046 días-1, para las temperaturas de almacenamiento de 0, 5 y 10 °C, respectivamente. Estos resultados fueron más bajos que los publicados por Reyes y Cisneros-Zevallos 23, quienes para extractos acuosos de antocianinas de batatas a pH 3 y almacenados a 25 °C calcularon k de 0,0168 y 0,0072 días-1, dependiendo de la variedad. Un estudio similar realizaron en extractos acuosos concentrados de uva y zanahoria morada, en los que las k fueron 0,1585 y 0,0024 días-1, respectivamente. Por lo tanto, la velocidad de degradación de antocianinas durante el almacenamiento de JAP fue menor que para los extractos acuosos.
En cuanto a los parámetros de termodinámica estadística, no se encontraron publicaciones comparables que hagan referencia a ΔH*, ΔS* y ΔG*. Referido a la Ea, un valor más alto de ésta indica una mayor sensibilidad de las antocianinas a la elevación de la temperatura 24. En el JAP la Ea (44,66 kJ/mol) fue similar a la reportada por Albarici y Pessoa 25 para bebida de açaí (49,24 kJ/mol) y menor que la publicada por Wang y Xu 26 para jugos de mora a 8,90°Brix (75,5 kJ/mol) y a 65°Brix (65,06 kJ/mol). En consecuencia, durante el almacenamiento, las antocianinas en los JAP tuvieron una estabilidad similar que las presentes en la bebida de açaí y mayor estabilidad que las de jugos de mora.
Si bien la proporción de antocianinas deterioradas en los JAP almacenados a -18 °C fue comparable a los publicados por diferentes autores para frutos de arándanos y cerezas, una limitación del presente estudio es que no se logró justificar porque la degradación de las antocianinas en estos jugos fue superior que las demás temperaturas de almacenamiento estudiadas.
Conclusiones
El tratamiento de pasteurización provocó una disminución del 28,5% en la concentración de antocianinas monoméricas totales iniciales de los jugos de arándano. La degradación de las antocianinas durante el almacenamiento, en los jugos de arándanos sin pasteurizar y pasteurizados, se ajustó a un modelo de primer orden, mientras que los modelos de Arrhenius y Eyring se ajustaron a los resultados experimentales de los jugos de arándanos pasteurizados. La estabilidad de las antocianinas, durante el almacenamiento, fue mayor en los jugos de arándanos pasteurizados que en los jugos sin pasteurizar, siendo mayor la estabilidad cuando los jugos pasteurizados se almacenaron a temperaturas de 0°C.
Agradecimientos
Los autores agradecen a la Universidad Nacional de Entre Ríos por el financiamiento de la investigación, en el marco del proyecto PID-UNER 8068 “Diseño de jugo de arándanos con propiedades antioxidantes y probióticas”.