Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Suma Psicológica
versión impresa ISSN 0121-4381
Suma Psicol. v.18 n.1 Bogotá ene./jun. 2011
Mecanismos psicobiológicos y del desarrollo de la reactividad al estrés en roedores y Humanos
Psychobiological and developmental mechanisms for stress reactivity in rodents and humans
Leonardo A. Ortega1, Carolina Rueda Pérez2
1Departamento de Psicología Texas Christian University, Texas, Estados Unidos. Se encuentra ahora en el Departamento de Psicología, Temple University, Pensilvania, Estados Unidos.
2Facultad de Psicología, Universidad Nacional de Colombia, Bogotá, Colombia.
Correspondencia relacionada con este artículo debe ser dirigida a Leonardo A. Ortega.
Correo electrónico: laortegam@temple.edu
Recibido: Diciembre 26 2010 Aceptado: Marzo 14 2011
Resumen
La investigación con modelos animales ha tenido un avance importante sobre el conocimiento de los mecanismos psicobiológicos que subyacen a las diferencias individuales que existen con referencia a la reactividad al estrés. La investigación animal también ha ayudado en la comprensión de los correlatos psicobiológicos de la reactividad al estrés en humanos, al sugerir mecanismos neuroquímicos particulares para la investigación y al producir modelos generales de funcionamiento psicológico aplicables en humanos. En este artículo se describen los elementos neuroquímicos básicos de la reactividad al estrés. Adicionalmente, se utiliza el modelo de epigénesis probabilística para incluir los elementos del desarrollo y genéticos que proveen el contexto necesario para la comprensión de las diferencias individuales en la reactividad al estrés. Finalmente, se describen algunos resultados y potenciales avances en la investigación de la psicobiología del trastorno de estrés postraumático en términos de los conceptos que han surgido desde la investigación animal.
Palabras clave: estrés; diferencias individuales; desarrollo; psicobiología; TEPT; roedores; epigénesis probabilística.
Abstract
Important research advances on the psychobiological mechanisms underlying individual differences for stress reactivity have resulted from research in animal models. Animal research has also shed light on the psychobiological correlates for stress reactivity in humans, providing candidate neurochemical mechanisms for human research and suggesting general theoretical models of psychological functioning across species. In this article, the basic neurochemical elements underlying stress reactivity are described. In addition, the probabilistic epigenesis theoretical model is used to introduce the necessary developmental and genetic context for the understanding of the psychobiology of individual differences in stress reactivity. Finally, some previous research and potential avenues of research in posttraumatic stress disorder are described using the concepts that emerged from animal research.
Keywords: stress, individual differences, development, psychobiology, PTSD, rodents, probabilistic epigenesis.
Existe un amplio rango de variación en las diferencias individuales de cómo reaccionan las personas o los animales ante una situación estresante o qué se percibe como estresante. Una persona puede simplemente notar e ignorar una rata que pasa relativamente cerca de ella en una calle de la ciudad, mientras que otra persona puede asustarse y saltar en la misma situación. Por su parte, una rata puede escapar rápidamente ante la menor señal de un preda-dor, mientras que otra rata podría quedarse y escapar solamente cuando la presencia de un predador sea inminente. Un caso más extremo es el de las personas que sobrevivieron a los campos de concentración durante la Segunda Guerra Mundial. En los campos de concentración se presentaron un conjunto de situaciones enormemente estresantes, tales como la amenaza constante de muerte contra sí mismo o contra miembros de la propia familia, trabajo forzado por largas horas al día, maltrato físico y psicológico, hambre crónica, o ser testigo de violencia o asesinato. Las personas que experimentaron la Segunda Guerra Mundial tienen un riesgo mayor de desarrollar trastorno de estrés postraumático (TEPT) y este riesgo es aún más alto en personas que estuvieron en campos de concentración (Kuch & Cox, 1992). Sin embargo, el efecto de esta experiencia parece haber sido menos extremo para otras personas. Un caso notable fue el de Witold Pilecki, quien fuera soldado del ejército de resistencia de Polonia (Lewis, 1999). Pilecki se internó voluntariamente en un campo de concentración con el fin de registrar las condiciones que existían dentro de estos lugares. De manera notable, fue capaz de notificar a personas de su ejército fuera del campo de concentración y eventualmente logró escapar. Después de esta experiencia continuó con su trabajo militar, aunque unos años después fue ejecutado por soldados rusos. Aunque las características organísmicas y las experiencias particulares que hicieron que Pilecki afrontara esta situación, al parecer de manera relativamente exitosa, son muy difíciles de investigar, dada la poca información existente en la actualidad sobre él, aun así es posible investigar los mecanismos neuroquímicos generales que subyacen el amplio rango de variabilidad comportamental ante una situación estresante con modelos animales y posteriormente extender esa información a la investigación de las diferencias individuales en la reactividad al estrés de humanos.
Una implicación interesante de la investigación sobre las bases biológicas de la reactividad al estrés es la existencia de importantes paralelos mecanísticos entre animales y humanos. Por ejemplo, el sistema biológico que permite la variabilidad de las respuestas de las ratas ante la señal de un predador tiene paralelos en los sistemas biológicos relacionados con las diferencias individuales en la reactividad al estrés en humanos. Como se verá, los paralelos se extienden a lo largo de varios niveles de estudio, como el neuroquímico, genético, y del desarrollo. Adicionalmente, la investigación con modelos animales es relevante para la investigación en problemas psicológicos en humanos dado que, por ejemplo, se ha propuesto que el funcionamiento anormal de los sistemas biológicos de la reactividad al estrés subyacen las diferencias individuales que resultan en personas con más o menos probabilidad de desarrollar condiciones como el TEPT.
Este artículo tiene dos objetivos generales. El primer objetivo es ilustrar las maneras en que la investigación con animales ha iluminado la comprensión de los mecanismos neuroquímicos, genéticos y del desarrollo necesarios que subyacen las diferencias individuales en la reactividad al estrés. En la primera parte se describirán los mecanismos neuroquímicos básicos de la reactividad al estrés. La investigación con animales ha llevado a la descripción detallada de componentes neurales y hormonales que integran el complejo sistema neuroquímico que subyace la reactividad al estrés. En la segunda parte, se introducirán algunos aspectos del contexto genético y del desarrollo que son necesarios para entender las diferencias individuales en la reactividad al estrés. Se utilizará el modelo metateórico de epigénesis probabilística para organizar los estudios relevantes y como ejemplo de un modelo general de funcionamiento psicológico que puede ser utilizado tanto en animales como en humanos. El segundo objetivo general es ilustrar con un ejemplo particular los aportes de la investigación animal a la comprensión de los fenómenos psicobiológicos humanos. Por lo tanto, en la tercera parte del escrito se describirán algunos de los correlatos neuroquímicos del TEPT en términos de los modelos descritos anteriormente desde la investigación animal. La intención del presente artículo es la de describir el complejo conjunto de procesos neuroquímicos que subyacen las diferencias individuales en la reactividad al estrés en términos de modelos que surgieron desde la investigación animal y no de proveer una revisión exhaustiva de los temas revisados. No obstante, se indicarán trabajos de revisión sobre temáticas específicas cuando sea relevante, en caso de que el lector esté interesado en profundizar en un tema particular.
Mecanismos neuroquímicos de la reactividad al estrés
La investigación comparada ha sido fundamental para el descubrimiento y descripción detallada de los procesos psicobiológicos que subyacen la reactividad al estrés en animales y humanos. Por ejemplo, desde una perspectiva histórica, la investigación hecha con cerebros de ovejas o cerdos fue indispensable en las investigaciones clásicas que llevaron a Guillemin y Schally a determinar el control cerebral sobre las hormonas (véase Sapolsky, 2004). En investigaciones más recientes, especialmente con roedores como modelo animal, se ha avanzado considerablemente en la descripción de los circuitos cerebrales, neurotransmisores y hormonas relacionados (i. e., mecanismos neuroquímicos) con la reactividad al estrés. La investigación comparada ha enriquecido muchos aspectos desde la forma en que se ha definido la reactividad al estrés, hasta el conocimiento de los mecanismos neuroquímicos de este complejo fenómeno.
Los organismos tienden a buscar un estado de equilibrio de los distintos procesos necesarios para la supervivencia. Tal equilibrio o estabilidad se denomina homeostasis. No obstante, distintas situaciones en la vida de un organismo (i.e., estresores) pueden afectar su equilibrio homeostático (McEwen, 2007a; McEwen & Wingfeld, 2007). La reactividad al estrés es uno de los mecanismos que subyacen los procesos necesarios para mantener el equilibrio homeostático de un organismo cuando se enfrenta a una situación amenazante o percibida como amenazante. De esta manera, la reactividad al estrés puede definirse como el conjunto organizado de reacciones psicobiológicas frente a un estresor, que le confieren la capacidad al organismo de restablecer la homeostasis de los procesos necesarios para su supervivencia.
La presencia de un estresor resulta en la rápida reorganización dinámica de los comportamientos de un organismo. Por ejemplo, Fanselow (1994) describe los cambios dinámicos en el sistema defensivo de comportamiento de roedores ante la presencia de un predador. Cuando los roedores encuentran señales de un potencial predador, o una situación amenazante o novedosa, tienden a reorganizar el patrón de alimentación y a mostrar comportamientos de aproximación cautelosa (aproximándose estirando completamente el cuerpo). Ante la presencia misma del predador, tienden a mostrar conductas de congelamiento y potenciación de las respuestas de sobresalto. Finalmente, cuando hacen contacto con el predador, presentan conductas de escape o de pelea defensiva. Esta reorganización comportamental está modulada por un conjunto complejo de procesos neuroquímicos, que se describirán brevemente, comenzando por los circuitos cerebrales relevantes, seguido por la descripción de algunos efectos moleculares de la hormona corticosterona.
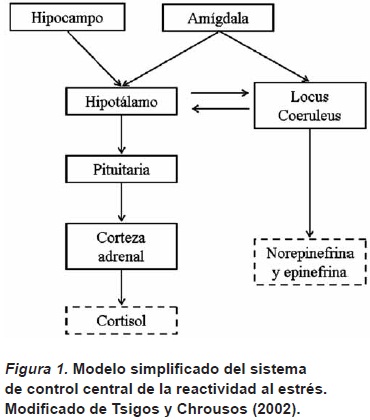
Tsigos y Chrousos (2002) sugieren que el sistema de control central de la reactividad al estrés consiste del hipotálamo y el tallo cerebral, áreas cerebrales que se activan y modulan recíprocamente durante una situación estresante (véase Figura 1). Núcleos noradrenérgicos en el tallo cerebral controlan un conjunto de respuestas autonómicas y neuroendocrinas que cumplen el papel de sistema general de alarma y estimulan las reacciones de "pelear o huir". Por su parte, los núcleos paraventriculares del hipotálamo liberan la hormona liberadora de hormona adrenocorticotrópica y arginina vasopresina en la glándula pituitaria. Este es el primer paso en el funcionamiento del denominado eje hipotalámico-pituitario-adrenal (eje HPA). Una vez que la glándula pituitaria es activada por el hipotálamo, libera la hormona adrenocorticotrópica en la sangre, que eventualmente resulta en la activación de la corteza adrenal en los riñones, en donde se libera la hormona corticosterona (cortisol en humanos).
La corticosterona juega un papel clave en la recuperación del equilibrio homeostático, que se perturba después de la exposición a un estresor. La corticosterona es una hormona corticoide que ejerce su acción en receptores glucocorticoides en el citoplasma de neuronas en varias áreas cerebrales. Una vez que la corticosterona se liga con el receptor glucocorticoide, el receptor se traslada al núcleo de la célula y puede modular la transcripción de genes particulares ya sea activándolos directamente o por medio de la inhibición de otros factores de transcripción. Esto puede resultar en la modulación de varios procesos neuronales, tales como cambios en la estructura celular, en el metabolismo de energía o en la transducción de señales (De Kloet, Joëls & Holsboer, 2005). Como lo señalan De Kloet, Vregdenhil, Oitzl & Joels (1998), la corticosterona presenta dos modos de modulación comportamental. En el primer modo la corticosterona controla la sensibilidad del eje HPA, lo que resulta en la amplia reorganización psicobiológica en respuesta a un estresor. En el segundo modo, la corticosterona tiene funciones de retroalimentación que ayudan en la terminación de la activación del eje HPA, ayudando al organismo a afrontar y recuperarse del estrés, además de promover procesos de aprendizaje y memoria. Algunos de los circuitos cerebrales involucrados en estas funciones son el hipotálamo y el tallo cerebral, el sistema de control central. Otros circuitos cerebrales interactúan con este control central y también son modulados por la corticosterona, lo que resulta en sistemas cerebrales que influencian diferentes aspectos de la reactividad al estrés.
De especial interés son las conexiones con el complejo de la amígdala que controlan la iniciación de los procesos relacionados con el estrés, mientras que áreas en el hipocampo y la corteza prefrontal controlan su terminación. Como se acabó de indicar, el hipotálamo secreta la hormona liberadora de la hormona adrenocorticotrópica en la pituitaria ante un estresor. Adicionalmente, esta hormona se libera en el complejo de la amígdala (Kalin, Takahashi & Chen, 1994), conjunto de áreas que subyacen varios procesos psicológicos relacionados con la reactividad al estrés como la modulación de comportamientos vinculados con el miedo, la modulación emocional de la memoria y facilitación de la atención y percepción de estímulos emocionales (Fanselow & Poulos, 2004; Phelps & LeDoux, 2005). Por su parte, el hipocampo y la corteza prefrontal median la inhibición de la actividad del eje HPA, proceso que implica la activación de estas áreas por medio de receptores glucocorticoides (De Kloet, Vregdenhil, Oitzl & Joels, 1998; Diorio, Viau & Meaney, 1993). El hipocampo es importante en el procesamiento de la información del contexto en donde se presenta un estímulo emocional (e.g., Phillips & LeDoux, 1992), mientras que la corteza prefrontal está relacionada con la extinción de información aprendida sobre eventos emocionales negativos (e.g., Morgan, Romanski & LeDoux, 1993).
El conocimiento derivado de la investigación de los procesos neuroquímicos de roedores involucrados en la reactividad al estrés en condiciones normales, provee un modelo de los componentes neuroquímicos (e.g., circuitos cerebrales, procesos neurohormonales y sistemas de neurotransmisores) involucrados en las reacciones que resultan ante la presencia de un estresor. La caracterización de los componentes neuroquímicos de la reactividad al estrés ha servido para dirigir la investigación de los correlatos neuroquímicos de condiciones patológicas en humanos como el TEPT, según se verá en la sección relacionada con el tema. Aunque es necesario describir los procesos neuroquímicos para la comprensión de las diferencias individuales en las reacciones ante una situación estresante, también es crítico caracterizar el contexto organísmico y del desarrollo en el que se presentan tales procesos. El modelo de epigénesis probabilística incluye explícitamente los procesos de desarrollo y de interacción entre procesos a distintos niveles de análisis del organismo para la comprensión de las diferencias individuales en el comportamiento.
Epigénesis probabilística y reactividad al estrés en roedores
Una aproximación desde la psicología comparada podría también facilitar la comprensión de la psicobiología del estrés al sugerir modelos generales de funcionamiento psicológico que instiguen hipótesis para investigación directa en humanos (Gottlieb & Lickliter, 2004), de manera suplementaria al sugerir mecanismos neuroquímicos particulares, como se describió en la sección anterior. El modelo de epigénesis probabilística se propone como modelo general de funcionamiento psicológico. Una vez se describan las bases conceptuales de la epigénesis probabilística, se discutirá cómo aplicar este modelo a una serie de estudios de diferencias individuales en la reactividad al estrés de roedores.
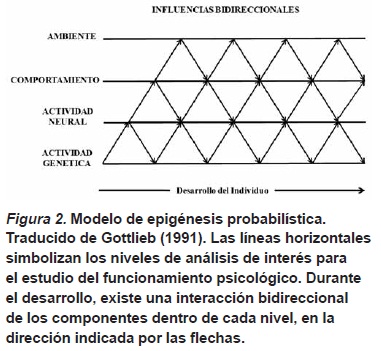
Los mecanismos psicobiológicos que subyacen cualquier comportamiento pueden ser descritos desde distintos niveles de análisis, como los procesos comportamentales, neuroquímicos y genéticos. Importantes avances en la comprensión de los mecanismos asociados con distintos comportamientos en cada nivel de análisis se han logrado desde distintas disciplinas científicas, especialmente en estudios que utilizan modelos animales. Sin embargo, la complejidad de los procesos hace difícil la propuesta de modelos teóricos generales adecuados para la comprensión de las distintas redes de eventos psicobiológicos asociados con la expresión de comportamientos específicos. Un nivel adicional de complejidad se añade cuando se incluye la dimensión temporal (i.e., procesos prenatales y postnatales de desarrollo) del comportamiento. El modelo metateórico de epigénesis probabilística es un modelo general para la organización y comprensión de la complejidad de mecanismos psicobiológicos que subyacen el comportamiento. Este modelo es de extraordinario interés para la ciencia psicológica debido a la manera en que cada una de sus características definitorias tiene implicaciones para la clarificación de problemas fundamentales de la psicología. Dos aspectos esenciales que definen el modelo de epigénesis probabilística serán considerados (Gottlieb, 1991, 1997, 2001).
El primer aspecto de la epigénesis probabilística es la propuesta de que un fenómeno psicobiológico debería explicarse de manera sistémica, en términos de procesos que emergen de la interacción de influencias que pueden describirse en cuatro niveles de análisis de interés para los investigadores en psicología y neurociencia comportamental. El primer nivel de análisis es el ambiente, que se subdivide en sus aspectos físicos, sociales y culturales. Los tres restantes niveles de análisis son funcionales del organismo: comportamientos, actividad neural y la actividad genética (véase Figura 2). Investigadores en distintas áreas del conocimiento tienden a estresar la importancia del nivel de análisis en el que se encuentran trabajando. Por ejemplo, los psicólogos sociales podrían hacer más énfasis en una explicación social del comportamiento mientras que psicólogos en neurociencias podrían hacerlo en las explicaciones biológicas del comportamiento. En su manera más extrema, discusiones entre enfoques centrados en un solo nivel de análisis resultan en pseudoproblemas tales como preguntarse si el ambiente social o los procesos biológicos son más o menos importantes para explicar el comportamiento humano. Desde el punto de vista de la epigénesis probabilística, los procesos, en distintos niveles de análisis, que subyacen el comportamiento se entienden más apropiadamente en términos de actividad funcional o experiencia. Gottlieb (1991; Gottlieb, Wahlstein & Lickliter, 1998) proponen una noción extendida de la experiencia, en donde ésta se entiende como el resultado conjunto de los procesos que afectan el comportamiento desde cualquier nivel de análisis, sea el ambiente o algún nivel organísmico. Es decir, experiencia es definida en términos de la actividad o función de los componentes genéticos, neurales y comportamentales. De esta forma, la explicación de un comportamiento se debería realizar en términos del funcionamiento organísmico, modulado por los aspectos del ambiente. Como el comportamiento emerge del funcionamiento del sistema de eventos a través de componentes en todos los niveles de análisis, no tendría sentido darle prioridad explicativa a uno de los eventos en un nivel de estudio. Adicionalmente, la experiencia podría cumplir tres papeles primordiales en la modulación del comportamiento (Gottlieb et al., 1998): (a) Inducir cambios en la función de los procesos que subyacen un comportamiento particular, (b) Modular los umbrales en los cuales un contexto particular puede afectar funciones organísmicas relevantes para un comportamiento, (c) Mantener o sostener estados de funcionamiento de sistemas genéticos, neurales o comportamentales que fueron previamente inducidos.
El segundo aspecto de la epigénesis probabilística es la propuesta de un modelo de sistemas psicobiológicos en donde el fenómeno psicológico a estudiar es el resultado de las interacciones bidireccionales entre componentes de los cuatro niveles de análisis. Como se representa en la Figura 2, el modelo de epigénesis probabilística indica de manera explícita el conjunto de interacciones, así como su direccionalidad, al nivel del organismo que deberían describirse para entender cómo una experiencia previa (en cualquier momento de ontogenia) resulta en cambios comportamentales en el futuro cercano o lejano. Adicionalmente, dado que el comportamiento es un evento que cambia constantemente, es imprescindible también incluir un componente temporal en la explicación causal (i.e., interacción dinámica). Aunque Gottlieb et al. (1998) hicieron la propuesta de interacciones bidireccionales para el desarrollo comportamental, esta propuesta también puede extenderse al problema de las causas del comportamiento en general. Así, la causa de un comportamiento debería ser descrita en términos de la interacción de al menos dos componentes dentro de los niveles de análisis. Esta noción de causalidad en términos de la descripción de interacciones dinámicas entre al menos dos componentes del sistema organísmico contrasta con aproximaciones explicativas del comportamiento en términos de modelos en los que no existen proposiciones o mecanismos explícitos de acción de los determinantes organísmicos y ambientales de un fenómeno psicológico, lo que resulta en una ventaja clara de la epigénesis probabilística como modelo explicativo para dar cuenta de los complejos fenómenos psicobiológicos.
El énfasis del modelo de epigénesis probabilística es la interacción (i.e., acción conjunta y dinámica) entre componentes particulares de los distintos niveles de análisis, en un momento de la ontogenia particular. De esta forma, los mecanismos que subyacen un fenómeno psicológico no se pueden reducir al efecto de un componente particular sobre el comportamiento (e.g., modulación del eje HPA sobre la reactividad al estrés), sino que se comprenden de manera más adecuada en términos de procesos que emergen de la interacción entre los mecanismos genéticos, neuroquímicos y comportamentales, en un contexto de desarrollo particular. En otras palabras, se hace énfasis en la necesidad de incluir el contexto temporal, ambiental y organísmico para dar cuenta de la emergencia de un fenómeno comportamental. Por ejemplo, en el caso de la reactividad al estrés sería necesario hacer énfasis no solamente en la relación entre mecanismos neuroquímicos particulares (e.g., eje HPA) y un comportamiento (e.g., exploración en un campo abierto novedoso), sino en la forma como la experiencia durante el desarrollo modula la actividad genética, que a su vez puede modular la expresión del comportamiento durante la adultez. Los resultados de un programa de investigación en diferencias individuales de reactividad al estrés en roedores se utilizarán para ejemplificar con estudios empíricos concretos la manera en que el modelo de epigénesis probabilística de Gottlieb es una herramienta significativa en la organización y contextualización de los hallazgos psicobiológicos (información adicional en Meaney, 2001; Weaver, 2009). Se utilizará la aproximación de niveles de análisis para la descripción de las bases neuroquímicas, genéticas y del desarrollo relevantes en estos estudios.
Niveles comportamental y ambiental
En ratas, índices altos de reactividad al estrés se pueden caracterizar por un patrón de comportamientos que incluye bajos niveles de exploración en una situación de campo abierto, aumento en las respuestas de sobresalto, y mayor latencia de consumo de comida presentada en un ambiente nuevo. Influencias ambientales durante el desarrollo prenatal o postnatal resultan en diferencias individuales en la reactividad al estrés. Por ejemplo, crías cuya madre estuvo bajo estrés durante la gestación (Champagne & Meaney, 2006), bajos niveles de cuidado maternal durante la infancia (Caldji et al., 1998; Francis, Diorio, Liu & Meaney, 1999) y condiciones empobrecidas del ambiente durante la pubertad (Champagne & Meaney, 2007) tienden a ser más reactivas al estrés en la adultez. Resaltando el carácter dinámico del desarrollo de la reactividad al estrés, Champagne y Meaney (2007) encontraron que ratas que recibieron niveles bajos de cuidado maternal durante la infancia, y después durante la adolescencia estuvieron en un ambiente enriquecido, presentaban menos reactividad al estrés en la adultez, cuando se comparaban con ratas con similar experiencia temprana pero expuestas posteriormente a ambientes no enriquecidos.
Nivel neural
Perfiles particulares en procesos neuroquímicos fueron también encontrados para las ratas con alta reactividad al estrés. El funcionamiento del eje HPA en ratas que tuvieron menor cuidado maternal durante la infancia y que tienden a manifestar mayores niveles de reactividad al estrés durante la adultez es diferente al de las ratas que experimentaron un mayor cuidado maternal y que presentan baja reactividad al estrés cuando adultas. Las ratas con mayor reactividad al estrés tuvieron concentraciones mayores de la hormona adrenocorticotrópica e incrementos mayores de corticosterona en plasma en situaciones de estrés agudo, cuando se comparan con ratas con baja reactividad al estrés (Liu et al., 1997). Como se indicó anteriormente, el hipocampo es un área cerebral que tiene como una de sus funciones inhibir la actividad del eje HPA, vía neuronas inhibitorias que proyectan del hipocampo hacía el hipotálamo. Existen receptores de glucocorticoides en el hipocampo que son activados por la corticosterona liberada ante la presencia de un estresor. Ratas que expresan mayor reactividad al estrés presentan menor número de receptores de glucocorticoides en el hipocampo que ratas con menores niveles de estrés, medido en términos de la expresión de tales receptores. Es decir, mayores niveles de reactividad al estrés son el resultado de menor inhibición de la respuesta hormonal del eje HPA. Finalmente, la mayor reactividad al estrés resultó en mayor expresión de hormona liberadora de hormona adrenocorticotrópica en la amígdala (Meaney, 2001).
Nivel de actividad genética
Mecanismos de regulación genética subyacen el efecto de la experiencia durante el desarrollo en los receptores de glucocorticoides, como lo sugiere el trabajo de Weaver et al. (2004), quienes encontraron que las ratas que recibieron cuidado maternal empobrecido y subsecuente mayor reactividad al estrés mostraron menores niveles de expresión del gen de receptores de glucocorticoides en el hipocampo. En forma interesante, se demostró que el efecto de cuidado maternal sobre los receptores de glucocorticodes está correlacionado con el mecanismo de regulación genética de metilación del ADN (Weaver, et al., 2007), por lo que se propuso la hipótesis de que éste proceso de regulación genética subyace los cambios de expresión en el gen para receptores de glucocorticoides (Meaney, 2001; Weaver, 2009). El mecanismo de metilación del ADN consiste, de manera general, en la modificación del significado funcional de una secuencia particular de ADN por medio de la adición de un grupo químico funcional denominado grupo metilo, sin que cambie la secuencia misma del ADN (Jaenisch & Bird, 2003). Estos resultados y la hipótesis de regulación genética del gen de receptores de glucocorticoides son remarcables porque sugieren que la experiencia durante el desarrollo puede cambiar la actividad genética de un gen particular, lo que a su vez resulta en cambios en la función del hipocampo, que modula la reactividad al estrés. En otras palabras, las diferencias individuales en reactividad al estrés se deben, en el nivel de actividad genética, a la regulación por la experiencia de la función del gen de receptores de glucocorticoides y no a cambios en la secuencia del gen. Finalmente, las diferencias individuales parecen transmitirse a través de las generaciones, si el ambiente se mantiene constante, dado que el nivel de cuidado maternal que las ratas hembras recibieron durante la infancia tiende a determinar el nivel de cuidado maternal de esas ratas cuando producen sus propias crías (Caldji et al., 1998).
Coherente con la lógica de la epigénesis probabilística, los mecanismos psicobiológicos que subyacen a las diferencias individuales en la reactividad al estrés se comprenden de manera más adecuada como un proceso que emerge de la interacción entre los mecanismos genéticos (metilación del ADN en genes de glucocorticoides), neuroquímicos (modulación del eje HPA por el hipocampo) y comportamentales, enmarcados en un contexto de desarrollo particular (cuidado maternal en la infancia).
Correlatos neuroquímicos del TEPT
El Trastorno de Estrés Postraumático (TEPT) es un desorden de ansiedad que parece resultar de la exposición a un evento traumático. El factor estresante puede involucrar la amenaza de muerte propia o de alguien diferente, la muerte de alguien, o algún tipo de amenaza a la integridad física, sexual o psicológica, que supera las habilidades de afrontamiento del individuo. Entre los síntomas para diagnosticar el TEPT, se encuentra la re-experimentación del trauma original a través de fashbacks o pesadillas, la evitación del estímulo asociado con el trauma, el incremento de activación (e.g., dificultad para dormir y mantenerse dormido, rabia, hipervigilancia). De acuerdo con los criterios del DSM-IV y ICD 9, los síntomas deben durar al menos un mes y causar un impedimento significativo a nivel social, ocupacional o en otra área de funcionamiento importante. Estudios epidemiológicos estiman que, alrededor del 8 al 10% de personas han desarrollado síntomas de TEPT alguna vez en su vida y se estima que alrededor del 25% de personas que experimentan un hecho traumático terminan desarrollando TEPT (Bromet, Sonnega & Kessler, 1998), lo que indica la presencia de diferencias individuales en la respuesta a un hecho traumático.
Desde un punto de vista psicobiológico, el TEPT puede interpretarse como una falla en la regulación del sistema neuroquímico de la reactividad al estrés (Sapolsky, 2004). Es de resaltar que una parte importante de la motivación para estudiar las bases neuroquímicas de la reactividad al estrés en humanos proviene de la investigación animal (McEwen, 2007b). Utilizando como base los modelos generales de reactividad al estrés analizados anteriormente, la descripción de algunos de los correlatos psi-cobiológicos reportados en la investigación con TEPT se harán enmarcándolos desde los niveles de análisis de la epigénesis probabilística.
Nivel neural
Dado que solamente un porcentaje de las personas que experimentan un evento traumático desarrollan TEPT, un segmento importante de la investigación se ha basado en la evaluación de diferencias individuales en la activación cerebral o perfl hormonal de personas que han experimentado un evento traumático. Desde la investigación con animales en reactividad al estrés, se han propuesto circuitos cerebrales y sistemas químicos candidatos que podrían tener una función irregular conectada con el TEPT. Según las descripciones anteriores, los núcleos en el hipotálamo y en el tallo cerebral se han propuesto como el sistema de control central de la reactividad al estrés. Este sistema modula las hormonas relacionadas con el eje HPA, así como la epinefrina y norepinefrina. Por lo tanto, fallas en la regulación de la reactividad al estrés en personas con TEPT debería resultar en perfiles hormonales diferentes a los normales. Conforme con esta hipótesis, alteraciones en el funcionamiento del eje HPA son una característica predominante en la psicobiología del TEPT (Yehuda, 2009). Algunos estudios han mostrado que veteranos de guerra que presentan TEPT muestran un perfl hormonal caracterizado por niveles centrales altos de la hormona liberadora de hormona adrenocorticotrópica (Bremner et al., 1997) y de norepinefrina (Geracioti et al., 2001), cuando se compararon con las personas control. Por otra parte, se ha encontrado que adultos que desarrollaron TEPT después de un evento traumático tienden a mostrar niveles menores de cortisol que personas con similares experiencias pero que no desarrollaron TEPT (e.g., Yehuda, Teicher, Trestman, Levengood & Siever, 1996). En general, estos perfles hormonales diferenciales para personas con TEPT sugieren un funcionamiento anormal del eje HPA, lo que podría estar relacionado con el funcionamiento anormal en circuitos cerebrales. Sin embargo, es importante notar que en humanos no es claro si los perfiles hormonales anormales juegan un papel directo en la función de las estructuras cerebrales que se han estudiado (McEwen, 2007b).
Diferentes estudios han sugerido la potencial importancia de áreas cerebrales que se revelaron como importantes en la investigación animal (Shin, Rauch & Pitman, 2006). En este caso, se hará énfasis en estudios que implicaron el hipocampo, área relacionada con la inhibición del eje HPA y la modulación de los efectos de la experiencia temprana sobre reactividad al estrés en ratas adultas. Estudios que han evaluado la relación entre el hipocampo y el TEPT han tenido resultados contradictorios. Por ejemplo, Bremner et al. (1995), utilizando resonancia magnética, reportaron que veteranos de guerra que desarrollaron TEPT por situaciones de combate presentaron volúmenes significativamente menores del hipocampo izquierdo, pero no del derecho, que las personas control. Adicionalmente, el bajo volumen hipocampal se relacionó con défcits en la memoria verbal a corto plazo. Sin embargo, Bonne et.al. (2001) reportaron posteriormente que, -también utilizando resonancia magnética- no encontraron evidencia de diferencias en el volumen del hipocampo en personas evaluadas seis meses después de un evento traumático. Estos resultados contradictorios resaltan la dificultad en la investigación de correlatos neuroquímicos del TEPT en humanos. En general, es difícil controlar la experiencia durante el desarrollo de los individuos. Bonne et al. (2001) sugieren que la variabilidad entre estudios podría resultar de la diferencia entre el momento de la experiencia traumática y el momento de la evaluación (es posible que sean necesarios más de 6 meses para producir reducción discernible del hipocampo, como se observó en el primer estudio). Otras variables que añaden variabilidad entre estudios podrían ser el abuso de sustancias o el consumo de alcohol, puntajes de coeficientes intelectuales y la edad en la que sucede el evento traumático. Estudios adicionales con diseños experimentales que permitan el control de eventos durante el desarrollo o de fenómenos que inducen variabilidad, así como con tamaños de muestra mayores, son necesarios para explorar la relación entre el hipocampo y el TEPT.
Nivel de actividad genética
Se ha evaluado la relación de varios genes con el TEPT (véase en Broekman, Olff & Boer, 2007; Koenen, 2007). Los estudios existentes se han enfocado en sistemas neuroquímicos como el serotonérgico, dopaminérgico y glucocorticoides, entre otros. En general, la selección de varios genes candidatos para estudio se ha derivado de análisis de los efectos relativos de los genes y el ambiente en la reactividad al estrés en animales (e.g., Gass, Reichardt, Strekalova, Henn & Tronche, 2001). De especial interés son los estudios que se centraron en genes relacionados con cortisol, dada la investigación mencionada que conecta los receptores glucocorticoides en el hipocampo con la modulación de los efectos de la experiencia durante el desarrollo de la reactividad al estrés en ratas. Existen dos estudios que evaluaron el papel de genes relacionados con cortisol: Bachmann, Sedgley, Jackson, Gibson, Young y Torpy (2005) encontraron que variantes de genes relacionados con la sensibilidad al cortisol no parecían ser más frecuentes en personas con síntomas de TEPT. No obstante, la generalidad de estos resultados podría ser limitada debido a que la muestra del estudio fue relativamente pequeña y que no hubo diferencia en los niveles de cortisol de las personas que mostraban síntomas de TEPT versus personas que no los presentaban. Por otra parte, Yehuda, Cai, Golier, Sarapas, Galea, Ising, et al (2009) encontraron que genes relacionados con el receptor de glucocorticoides mostraban menores niveles de expresión en personas que desarrollaron TEPT después de un evento traumático, cuando se compararon con personas que experimentaron el evento pero no desarrollaron TEPT. El reporte de Yehuda et al. (2009) es especialmente interesante porque sugiere que existen mecanismos de regulación genética de los receptores de glucocorticoides para el TEPT en personas adultas. Mecanismos de regulación genética de receptores glucocorticoides, aunque en un gen diferente, subyacen las diferencias individuales en reactividad al estrés en ratas causadas por la experiencia temprana de cuidado maternal, como se describió en la sección anterior.
Nivel comportamental y ambiental
Un número de influencias prenatales puede afectar la reactividad al estrés durante la adultez. Basándose en estudios epidemiológicos, se ha sugerido que un ambiente fetal adverso incrementa el riesgo de desórdenes cardiovasculares, metabólicos, neuroendocrinos y psiquiátricos en la adultez (Seckl & Meaney, 2006). En particular, estrés severo durante el embarazo afecta el eje HPA de los hijos y está asociado con desórdenes neuropsiquiátricos. La presencia de TEPT en las madres parece ser un factor de riesgo para que los hijos desarrollen TEPT, como se señala en un estudio realizado por Yehuda et.al. (2005). Estos autores encontraron que madres que desarrollaron TEPT después de la exposición al ataque del World Trade Center en septiembre 11 del 2001 presentaban menores niveles de cortisol, cuando se comparan con madres que estuvieron expuestas al evento traumático pero que no desarrollaron TEPT. Similarmente, los bebés de las madres con TEPT también mostraron bajos niveles de cortisol en su primer año de vida y estos bajos niveles fueron más aparentes en bebés nacidos de madres que desarrollaron TEPT en su tercer trimestre de embarazo. En otro estudio, también con madres expuestas al ataque del World Trade Center y sus hijos, se reportó que las madres que presentaban mayor susceptibilidad de desarrollar TEPT tienden a tener infantes que se estresan más fácilmente ante la novedad, cuando se comparan con los hijos de las madres que fueron menos propensas a desarrollar TEPT (Brand, Engel, Canfield & Yehuda, 2006). En conjunto, estos estudios resaltan la relevancia de los efectos en el útero como potenciales factores de riesgo biológico putativo para desarrollar TEPT. Adicionalmente, sugieren que los mecanismos psicobiológicos de reactividad al estrés que subyacen la vulnerabilidad y factores de protección relacionados con el TEPT pueden ser transmitidos de una generación a otra, de manera similar, en el sentido del fenómeno mismo y sus correlatos psicobiológicos en el eje HPA, a la transmisión de la reactividad al estrés de ratas madres a las crías.
También se han reportado algunos factores postnatales durante la infancia que se relacionan con un mayor riesgo de desarrollar TEPT en la adultez. Por ejemplo, Koenen, Mofftt, Poulton, Martin y Caspi (2007) examinaron los factores en la temprana niñez asociados con el desarrollo de TEPT en un estudio longitudinal, encontrando que algunas características de la niñez y condiciones ambientales tempranas en la vida incrementan el riesgo de exposición al trauma y de desarrollar TEPT. En particular, se observó la existencia de factores de riesgo para el TEPT como características internalizantes (temperamento difícil, comportamiento antisocial e hiperactividad), historia de dificultades de salud mental (incluyendo reportes maternos de estrés) y adversidad familiar (incluyendo pérdida de un padre). Factores adicionales de riesgo que también se reportaron fueron bajo coeficiente intelectual y estresores ambientales crónicos como el bajo estatus socioeconómico. Además, el efecto del riesgo acumulativo en la niñez fue sustancial, de manera que cerca del 58% de los miembros dentro del cuartil de riesgo más alto para tres de los factores de riesgo presentaron TEPT alrededor de los 26 años, comparado con sólo el 25% de quienes no se encontraban en el rango de riesgo alto.
Finalmente, algunos eventos durante el desarrollo parecen ser buenos predictores del riesgo de desarrollar TEPT. En un estudio realizado con adultos jóvenes que sobrevivieron un desastre marítimo en la adolescencia, se encontró que para los sobrevivientes, a los que se les hizo seguimiento particularmente por ansiedad en los meses siguientes al desastre, la información sobre las experiencias objetivas relacionadas con el desastre y la evolución subjetiva de estas experiencias sirvieron para identificar los individuos con mayor riesgo de desarrollar TEPT. Adicionalmente, una historia de dificultades en la relación social, problemas médicos o de enfermedad en la niñez y tasas de depresión fueron predictores de la duración del TEPT, mientras que un diagnóstico retrospectivo de ansiedad de separación en la niñez, tasas de depresión cinco meses después del desastre y si los sobrevivientes recibieron soporte o ayuda en sus escuelas fueron predictores del número total de síntomas de TEPT durante el peor o único episodio de TEPT. Es decir, la cronicidad y duración de los síntomas de TEPT en las personas que lo desarrollaron se predijo de manera más eficiente al tener en cuenta factores de vulnerabilidad psicológica, física o social antes del desastre, incluyendo factores durante el desarrollo, junto con evaluación de síntomas depresivos cinco meses después del desastre y la oportunidad de recibir soporte en sus escuelas (Udwin, 2000). No obstante la importancia de los eventos del desarrollo postnatal en el riesgo posterior de desarrollar TEPT, la investigación de los correlatos psicobiológicos de tales eventos es bastante joven. Estudios futuros centrados en la función del eje HPA podrían iluminar algunos de los procesos del desarrollo que median el riesgo al TEPT. Por ejemplo, niveles elevados de cortisol inmediatamente después de un evento traumático en niños predicen el desarrollo de TEPT, seis meses más tarde (véase revisión en Pervanidou, 2008). Evidencia de esta naturaleza, en conjunto con los resultados que muestran relaciones entre el TEPT y (a) la regulación genética relacionada con el estrés; (b) las contribuciones prenatales mediadas por cortisol; (c) el riesgo de TEPT de los hijos cuando la madre desarrolló TEPT y, (d) la relevancia de eventos traumáticos durante la infancia, han servido como inspiración para que Seckl y Meaney (2006) especulen que la exposición prenatal, y posiblemente postnatal, a niveles excesivos de cortisol resulta en la programación del cerebro de manera que se aumenta el riesgo de desarrollar TEPT en la adultez. Adicionalmente, Yehuda y Bierer (2009) especularon que tal programación podría estar relacionada con mecanismos de regulación genética, en particular con el mecanismo de metilación del ADN, que se ha propuesto como mediador de los efectos de la experiencia temprana maternal de ratas jóvenes y reactividad al estrés en la adultez.
Comentario final
Desde la investigación animal se han propuesto mecanismos psicobiológicos candidatos para la comprensión de fenómenos comportamentales humanos. En particular, el estudio de la reactividad al estrés en animales ha resultado en modelos psicobiológicos que han sido de gran utilidad para estimular la investigación en humanos y para interpretar sus resultados. Investigaciones recientes sugieren que mecanismos de modulación del eje HPA juegan un papel clave en el desarrollo de las diferencias individuales de la reactividad al estrés. Estos mecanismos han sido descritos a través de distintos niveles de análisis, desde las experiencias en el desarrollo que causan las diferencias individuales, hasta los procesos de regulación genética que hacen posible que las experiencias se traduzcan en funciones características de áreas cerebrales que a su vez subyacen los comportamientos en la adultez. La creciente literatura sobre los efectos del desarrollo, así como los mecanismos de expresión genética en el TEPT, sugiere que los estudios con animales siguen cumpliendo el papel de instigar la investigación de mecanismos psicobiológicos relevantes a fenómenos comportamentales humanos.
En el futuro, el uso de modelos adicionales que surgen desde la investigación comparada podría ayudar a continuar el avance de la investigación en humanos.
En el presente artículo se propone que el modelo de epigénesis probabilística podría ayudar en la búsqueda de los procesos que subyacen los efectos de los eventos del desarrollo en el riesgo para TEPT. De acuerdo con este modelo, un enfoque explícito en la investigación del TEPT en términos de efectos bidireccionales entre componentes en distintos niveles de análisis llevaría a una mejor comprensión de las relaciones entre mecanismos psicobiológicos particulares y un fenómeno comportamental. Precisamente, en el caso de diferencias individuales en la reactividad al estrés en ratas, se logró avanzar de manera importante en la comprensión de los mecanismos psicobiológicos del desarrollo al enfocar la investigación en las interacciones entre procesos de regulación genética, expresión de receptores de glucocorticoides en el hipocampo y eventos del desarrollo específicos (experiencia maternal temprana). De manera similar, es posible que un enfoque centrado en la búsqueda sistemática de interacciones dinámicas de los mecanismos psicobiológicos ayude a clarificar la manera como los complejos procesos organísmicos y las influencias durante la vida causan las diferencias individuales en la reactividad al estrés en los humanos.
Referencias
Bachmann, A. W., Sedgley, T. L., Jackson, R. V., Gibson, J. N., Young, R. M. & Torpy, D. J. (2005). Glucocorticoid receptor polymorphisms and posttraumatic stress disorder. Psychoneuroendocrinology, 30, 297-306. [ Links ]
Bonne, O., Brandes, D., Gilboa, A., Gomori, J. M., Shenton, M. E., Pitman, R. K. & Shalev, A.Y. (2001). Longitudinal MRI study of hippocampal volume in trauma survivors with PTSD. American Journal of Psychiatry, 158, 1248-1251. [ Links ]
Brand, S. R., Engel, S. M., Canfield, R. L. & Yehuda, R. (2006). The effect of maternal PTSD following in utero trauma exposure on behavior and temperament in the 9-month-old infant. Annals of the New York Academy of Sciences, 1071, 454-458. [ Links ]
Bremner, J. D., Randall, P., Scott, T. M., Bronen, R. A., Seibyl, J. P., Southwick, S. M., Delaney, R. C., McCarthy, G., Charney, D. S. & Innis, R. B. (1995). MRI-based measurement of hippocampal volume in patients with combatrelated posttraumatic stress disorder. American Journal of Psychiatry, 152, 973-981. [ Links ]
Bremner, J. D., Licinio, J., Darnell, A., Krystal, J. H., Owens, M. J., Southwick, S. M., Nemeroff, C. B. & Charney, D. S. (1997). Elevated CSF corticotropin-releasing factor concentrations in posttraumatic stress disorder. American Journal of Psychiatry, 154, 624-629. [ Links ]
Broekman, B.F.P., Olff, M. & Boer, F. (2007). The genetic background to PTSD. Neuroscience and Biobehavioral Reviews, 31, 348-362. [ Links ]
Bromet, E., Sonnega, A. & Kessler R. C. (1998). Risk factors for DSM-III-R posttraumatic stress disorder: Findings from the national comorbidity survey. American Journal of Epidemiology, 147, 353-361. [ Links ]
Caldji, C., Tannenbaum, B., Sharma, S., Francis, D., Plotsky, P. M. & Meaney, M. J. (1998). Maternal care during infancy regulates the development of neural systems mediating the expression of behavioral fearfulness in adulthood in the rat. Proceedings of the National Academy of Sciences, 95, 5335-5340. [ Links ]
Champagne, F. A. & Meaney, M. J. (2006). Stress during gestation alters postpartum maternal care and the development of the off-spring in a rodent model. Biological Psychiatry, 59, 1227-1235. [ Links ]
Champagne, F. A. & Meaney, M. J. (2007). Transgenerational effects of social environment on variations in maternal care and behavioral response to novelty. Behavioral Neuroscience, 121, 1353-1363. [ Links ]
De Kloet, E. R., Vregdenhil, E., Oitzl, M. S. & Joels, M. (1998). Brain corticosteroid receptor balance in health and disease. Endocrinology Reviews, 19, 269-301. [ Links ]
De Kloet, E. R., Joëls, M. & Holsboer, F. (2005). Stress and the brain: From adaptation to disease. Nature Reviews Neuroscience, 6, 463-475. [ Links ]
Diorio, D., Viau, V. & Meaney, M. J. (1993). The role of the medial prefrontal cortex (cingulate gyrus) in the regulation of hypothalamicpituitary-adrenal responses to stress. Journal of Neuroscience, 13, 3839-3849. [ Links ]
Fanselow, M. S. (1994). Neural organization of the defensive behavior system responsible for fear. Psychonomic Bulletin and Review, 1, 429-438. [ Links ]
Fanselow, M. S. & Poulos, A. M. (2004). The neuroscience of mammalian associative learning. Annual Review of Psychology, 56, 207-234. [ Links ]
Francis, D., Diorio, J., Liu, D. & Meaney, M. J. (1999). Nongenomic transmission across generations of maternal behavior and stress responses in the rat. Science, 286, 1155-1158. [ Links ]
Gass, P., Reichardt, H. M., Strekalova, T., Henn, F. & Tronche, F. (2001). Mice with targeted mutations of glucocorticoid and mineralocorticoid receptors: Models for depression and anxiety? Physiology & Behavior, 73, 811-825. [ Links ]
Geracioti, T. D., Baker, D., Ekhator, N. N., West, S. A., Hill, K K., Bruce, A. B., Schmidt, D., Rounds-Kugler, B., et al. (2001). CSF No-repinephrine concentrations in posttraumatic stress disorder. American Journal of Psychiatry, 158, 1227-1230. [ Links ]
Gottlieb, G. (1991). The developmental basis of evolutionary change. Journal of Comparative Psychology, 101, 262-271. [ Links ]
Gottlieb, G. (1997). Synthesizing nature-nurture. Hillsdale, NJ: Lawrence Erlbaum Associates. [ Links ]
Gottlieb, G. (2001). The relevance of developmental-psychobiological metatheory to developmental neuropsychology. Developmental Neuropsychology, 19, 1-9. [ Links ]
Gottlieb, G., Wahlsten, D. & Lickliter, R. (1998). The significance of biology for human development: A developmental psychobiological systems view. En W. Damon (Ed.), Handbook of child Psychology: Vol. 1. Theoretical models of human development (pp. 233-273). New York: Wiley. [ Links ]
Gottlieb, G. & Lickliter, R. (2004). The various roles of animal models in understanding human development. Social Development, 13, 311-325. [ Links ]
Jaenisch, R. & Bird, A. (2003). Epigenetic regulation of gene expression: How the genome integrates intrinsic and environmental signals. Nature Genetics, 33, 245-254. [ Links ]
Kalin, N. H., Takahashi, L. K. & Chen, F. L. (1994). Restraint stress increases corticotropin-releasing hormone mRNA content in the amygdala and paraventricular nucleus. Brain Research, 656, 182-186. [ Links ]
Koenen, K. C. (2007). Genetics of posttraumatic stress disorder: Review and recommendations for future studies. Journal of Traumatic Stress, 20, 737-750. [ Links ]
Koenen, K. C., Mofftt, T. E., Poulton, R., Martin, J. & Caspi, A. (2007). Early childhood factors associated with the development of posttraumatic stress disorder: Results from a longitudinal birth cohort. Psychological Medicine, 37, 181-192. [ Links ]
Kuch, K. & Cox, B. J. (1992). Symptoms of PTSD in 124 survivors of the holocaust. American journal of Psychiatry, 149, 337-340. [ Links ]
Lewis, J. E. (1999). The mammoth book of true war stories. USA: Carroll & Grag Publishers. [ Links ]
Liu, D., Tannenbaum, B., Caldji, C., Francis, D., Freedman, A., Sharma, S., Pearson, D., Plotsky, P. M. & Meaney, M. J. (1997). Maternal care, hippocampal glucocorticoid receptor gene expression and hypothalamic-pituitary-adrenal responses to stress. Science, 277, 1659-1662. [ Links ]
McEwen, B. S. (2007a). Definitions and concepts of stress. En G. Fink (Ed.), Encyclopedia of Stress (p.653). USA: Academic Press. [ Links ]
McEwen, B. S. (2007b). Physiology and neurobiology of stress and adaptation: Central role of the brain. Physiology Reviews, 87, 873-904. [ Links ]
McEwen, B. S. & Wingfield, J.C. (2007). Allostasis and Allostatic Load. En G. Fink (Ed.), Encyclopedia of Stress (pp. 135-141). USA: Academic Press. [ Links ]
Meaney, M. J. (2001). Maternal care, gene expression, and the transmission of individual differences in stress reactivity across generations. Annual Review of Neuroscience, 24, 1161-1192. [ Links ]
Morgan, M. A., Romanski, L. M. & LeDoux, J. E. (1993). Extinction of emotional learning: Contribution of medial prefrontal cortex. Neuroscience Letters, 163, 109-113. [ Links ]
Pervanidou, P. P. (2008). Biology of posttraumatic stress disorder in childhood and adolescence. Journal of Neuroendocrinology, 20, 632-638. [ Links ]
Phelps, E. A. & LeDoux, J. E. (2005). Contributions of the amygdala to review emotion processing: From animal models to human behavior. Neuron, 48, 175-187. [ Links ]
Phillips, R. G. & LeDoux, J. E. (1992). Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning. Behavioral Neuroscience, 106, 274-285. [ Links ]
Sapolsky, R. M. (2004). Why zebras don't get ulcers. USA: Owl Books. [ Links ]
Seckl, J. R. & Meaney, M. J. (2006). Glucocorticoid "programming" and PTSD risk. Annals of the New York Academy of Sciences, 1071, 351-378. [ Links ]
Shin, L. M., Rauch, S. L. & Pitman, R. K. (2006). Amygdala, medial prefrontal cortex, and hippocampal function in PTSD. Annals of the New York Academy of Sciences, 1071, 67-79. [ Links ]
Tsigos, C. & Chrousos, G.P. (2002). Hypothalamic-pituitary-adrenal axis, neuroendocrine factors and stress. Journal of Psychosomatic Research, 53, 865-871. [ Links ]
Udwin, O. (2000). Risk Factors for long-term psychological effects of a disaster experienced in adolescence: Predictors of posttraumatic stress disorder. The Journal of Child Psychology and Psychiatry, 41, 969-979. [ Links ]
Weaver, I. C. (2009). Epigenetic effects of glucocorticoids. Seminars in Fetal & Neonatal Medicine, 14, 143-150. [ Links ]
Weaver, I. C., Cervoni, N., Champagne, F. A., D'Alessio, A. C., Sharma, S., Seckl, J. R., Dymov, S., Szyf, M. & Meaney, M. J. (2004). Epigenetic programming by maternal behavior. Nature Neuroscience, 7, 847-854. [ Links ]
Weaver, I. C., D'Alessio A. C., Brown, S. E., Hellstrom, I. C., Dymov, S., Sharma, S., Szyf, M. & Meaney, M. J. (2007). The transcription factor nerve growth factor-inducible protein mediates epigenetic programming: altering epigenetic marks by immediate-early genes. Journal of Neuroscience, 27, 1756-1768. [ Links ]
Yehuda, R. (2009).Status of glucocorticoid alterations in posttraumatic stress disorder. Annals of the New York Academy of Sciences, 1179, 56-69. [ Links ]
Yehuda, R. & Bierer, L. M. (2009). The relevance of epigenetics to PTSD: Implications for the DSM-V. Journal of Traumatic Stress, 22, 427-434. [ Links ]
Yehuda, R., Teicher, M. H., Trestman, R. L., Levengood, R. A. & Siever, L. J. (1996). Cortisol regulation in posttraumatic stress disorder and major depression: A chronobiological analysis. Biological Psychiatry, 40, 79-88. [ Links ]
Yehuda, R., Engel, S. M., Brand, S. R., Seckl, J., Marcus S. M. & Berkowitz, G. S. (2005). Transgenerational effects of posttraumatic stress disorder in babies of mothers exposed to the World Trade Center attacks during pregnancy. Journal of Clinical Endocrinology & Metabolism, 90, 4115-4118. [ Links ]
Yehuda, R., Cai, G., Golier, J. A., Sarapas, C., Galea, S., Ising, M., Rein, T., Schmeidler, J., Müller-Myhsok, B., Holsboer, F. & Buxbaum, J. D. (2009). Gene expression patterns associated with PTSD following exposure to the World Trade Center attacks. Biological Psychiatry, 66, 708-711. [ Links ]