Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Suma Psicológica
versión impresa ISSN 0121-4381
Suma Psicol. v.18 n.2 Bogotá jul./dic. 2011
CAMBIOS NEUROPSICOLÓGICOS ASOCIADOS A ESTIMULACIÓN CEREBRAL PROFUNDA EN ENFERMEDAD DE PARKINSON: REVISIÓN TEÓRICA
NEUROPSYCHOLOGICAL CHANGES ASSOCIATED WITH DEEP BRAIN STIMULATION OF PARKINSON DISEASE: THEORETICAL REVIEW
Pontificia Universidad Javeriana, Colombia
La correspondencia relacionada con este artículo debe ser dirigida a Oscar Mauricio Aguilar. Profesor facultad de Psicología, Pontificia Universidad Javeriana, Bogotá-Colombia. Carrera 5 N° 39-00 Edificio Manuel Briceño, oficina 218. Correo electrónico: oaguilar@javeriana.edu.co
Recibido: Julio 13 2011 Aceptado: Noviembre 1 2011
Resumen
La enfermedad de Parkinson es una patología neurodegenerativa causada por la pérdida de células dopaminergicas en la sustancia negra mesencefálica. Esto produce una disfunción de los núcleos basales que se manifiesta con síntomas motores como temblor, rigidez y bradicinecia, entre otros. Con la estimulación cerebral profunda (ECP) ha resurgido la cirugía como opción terapéutica y es el núcleo subtalámico el área diana predilecta. Los estudios muestran mejoras significativas en los déficits motores, pero no hay claridad sobre los cambios neuropsicológicos de los pacientes sometidos a ECP. Se hace una revisión de los diferentes estudios que han investigado los cambios cognitivos, emocionales y comportamentales, concluyendo que la mayoría de habilidades cognitivas se mantienen o mejoran después de la ECP, pero pueden existir cambios emocionales y comportamentales adversos que están relacionadas con el núcleo cerebral donde se implanta el electrodo y con las características premorbidas de personalidad.
Palabras clave: estimulación cerebral profunda, neurocirugía, enfermedad de Parkinson, núcleo subtalámico, neurociencia cognitiva.
Abstract
Parkinson's disease is a neurodegenerative disorder attributable to midbrain dopaminergic cell loss within the substantia nigra. This causes a dysfunction of the basal ganglia manifested by motor symptoms such as tremor, rigidity, bradykinesia among others. With Deep Brain Stimulation (DBS), neurosurgery has emerged as a therapeutic option, being the subthalamic nucleus its main target area. Studies show significant improvement in motor deficits, but there is no knowledge on the neuropsychological changes in patients after DBS. A review of several studies that have researched the cognitive, emotional and behavioral changes concluded that most cognitive skills are either maintained or improved after DBS, but there may be adverse emotional and behavioral changes that are related to the core brain where the electrode is implanted and with its premorbid personality characteristics.
Keywords: deep brain stimulation, neurosurgery, Parkinson's disease, subthalamic nucleus, neurocogration.
El médico británico James Parkinson en 1817 describió por primera vez los síntomas de una enfermedad que más tarde fue llamada enfermedad de Parkinson (EP), la cual se define como una patología neurodegenerativa que se caracteriza por síntomas como temblor, rigidez, bradicinecia, inestabilidad postural, marcha festinante, rostro inexpresivo, entre otros. Sin embargo, en la actualidad para su diagnóstico clínico es suficiente la presencia de bradicinesia con al menos otros dos síntomas cardinales (Mure et al., 2010; Schmidt, Spiegel & Reith, 2011). En esta patología se encuentran alteraciones cerebrales del cuerpo estriado, núcleo subtalámico y la sustancia negra mesencefálica, generando principalmente una insuficiencia en la producción de una sustancia química conocida como dopamina, pero que además se asocia a la presencia de alteraciones histológicas denominadas como cuerpos de Lewy. Esta sustancia neurotransmisora transmite señales entre la sustancia negra y el cuerpo estriado, regulando el funcionamiento del sistema motor, permitiendo la iniciación y correcta ejecución de los movimientos (Shulman, De Jager & Feany, 2011; Yuang et al., 2010). En consecuencia, la pérdida de dopamina produce patrones anormales de activación nerviosa dentro del cerebro que causan un deterioro del movimiento (Factor & Weiner, 2008; Yuang et al., 2010). Actualmente y por medio de lo observado en neuroimágen funcional, se atribuye esta pérdida a un incremento de la glucosa o de la sangre en los ganglios basales y en el tálamo, generando así muerte neuronal de las células dopaminégicas (Stoessl, 2011).
No obstante en recientes estudios se ha encontrado que la atrofia cerebral va mucho más allá de las estructuras anteriormente mencionadas, lo cual ayuda a entender mejor por qué no en todos los pacientes la enfermedad se manifiesta de la misma manera. Al respecto Schmidt et al. (2011), por medio de resonancia magnética, encontraron atrofia en la protuberancia, en los hemisferios del cerebelo y en los lóbulos frontal y parietal, mencionando que en un corte sagital se observa la protuberancia ventral aplanada, y en un corte axial se evidencia hipodensidad de los pedúnculos cerebelosos. Adicionalmente hay una reducción del área motora suplementaria, área dorsolateral prefrontal izquierda y putamen izquierdo (Stoessl, 2011).
A partir de diferentes estudios, se ha podido confirmar que esta atrofia multisistémica no solo genera síntomas motores, sino que simultáneamente se pueden presentar alteraciones sensoriales, autonómicas y neuropsicológicas. Dentro de las alteraciones sensoriales está el deterioro en el sentido del olfato, de la visión y del dolor. En cuanto a las disfunciones autonómicas puede existir salivación excesiva, intolerancia ortostática, incontinencia urinaria o disfunción sexual (decremento en la libido y problemas en la erección). A nivel neuropsicológico se encuentran una gran variedad de desordenes emocionales, comportamentales y cognitivos, ya que los pacientes pueden manifestar depresión, apatía, ansiedad, conductas impulsivas, psicosis, trastornos visoperceptivos, en velocidad de procesamiento y en funciones ejecutivas (Pandya, Kubu & Giroux, 2008; Robottom & Weiner, 2009; Shulman et al., 2011; Stoessl, 2011). Además, diversos estudios epidemiológicos han mostrado que entre un 30 a 40 % de los pacientes con enfermedad de Parkinson desarrollan un proceso demencial (Aarsland, Zaccai & Brayne, 2005; Emre, 2003).
Tratamiento Farmacológico y Quirúrgico
En cuanto al tratamiento para la enfermedad de Parkinson la primera opción terapéutica es farmacológica, aunque también existen métodos quirúrgicos. El tratamiento más importante se basa en la utilización de Levodopa (Singh, Pillay & Choonara, 2007), sin embargo, su acción terapéutica depende del estadio de la enfermedad, ya que en síntomas de aparición tardía, como la disartria, disfagia y las alteraciones del equilibrio, la respuesta a la L-dopa es reducida (Rowe et al., 2008). Adicionalmente, a medida que la enfermedad progresa pueden presentarse fluctuaciones motoras, discinécias y trastornos psiquiátricos, dando como resultado que un número significativo de pacientes no logre un beneficio razonable en el intento de controlar la enfermedad (Limousin & Martínez-Torres, 2008). Por esta razón, y en conjunto con el avance de la tecnología en neuroimágenes y técnicas neurofisiológicas, así como una mayor comprensión de la fisiopatología de la enfermedad de Parkinson, se ha renovado el interés por los procedimientos quirúrgicos (Lyons & Pahwa, 2008).
Estos procedimientos comenzaron alrededor de 1940 y consistían en lesionar las estructuras cerebrales relacionadas con los movimientos anormales, dentro de las cuales los principales blancos (targets) eran el globo pálido y el tálamo, llevando a la consolidación de procedimientos conocidos como palidotomía y talamotomía (Benabid, 2009). Actualmente, la intervención más común es la estimulación cerebral profunda (ECP) que consiste en la estimulación eléctrica de estructuras subcorticales. Este procedimiento consiste en el uso de un dispositivo médico implantado quirúrgicamente, operado por una batería llamado neuroestimulador que es aproximadamente del tamaño de un cronómetro. Este dispositivo crea un circuito cerrado enviando estimulación eléctrica a áreas específicas del cerebro que controlan el movimiento y bloqueando las señales nerviosas anormales que causan el temblor y los síntomas de la enfermedad de Parkinson (Shils, Alterman & Arle, 2008). En cuanto a la frecuencia del estimulador, las más utilizadas se encuentran entre 130 y 185 Hz, dependiendo de las estructuras en donde se ubique el electrodo y, por supuesto, de las características del paciente (Benabid, 2009). El ajuste de los parámetros de estimulación se logra por lo general en los primeros 6 meses después de la cirugía y no cambia significativamente entre el primer y el tercer año después de la cirugía (Gan et al., 2007).
El sistema de estimulación cerebral profunda consta de tres componentes: el electrodo, la extensión y el neuroestimulador. El electrodo se inserta a través de una pequeña abertura en el cráneo y se implanta en el cerebro; la punta del electrodo se posiciona dentro del área objetivo y el cable aislado se pasa bajo la piel de la cabeza, el cuello y el hombro, conectando el electrodo al neuroestimulador. El neuroestimulador (el "paquete de baterías") es el tercer componente y generalmente se implanta bajo la piel cerca de la clavícula, aunque en algunos casos puede implantarse más abajo en el pecho o bajo la piel sobre el abdomen. Una vez que el sistema está posicionado, el neuroestimulador se enciende y se envían impulsos eléctricos a través del cable de extensión hacía el electrodo dentro del cerebro, lo cual interfiere y bloquea las señales eléctricas anómalas que causan los síntomas de la enfermedad de Parkinson (Shils et al., 2008).
Blancos Quirúrgicos (Targets)
Existen criterios clínicos y neurofisiológicos que definen la elección de una estructura según las manifestaciones motoras del paciente. Además, es importante resaltar que este procedimiento generalmente es bilateral, ya sea en dos etapas o en simultáneo reportando una mejoría hasta del 65.9% en la función motora (Gan et al., 2007; Takafumi et al., 2009). Dentro de los blancos frecuentes están el núcleo subtálamico (NST), el globo pálido interno (GPi), el núcleo pedunculo-pontino (NPP) y las radiaciones prelemniscales (Deogaonkar, Monsalve, Scott, Ahmed & Rezai, 2011; Franzini et al., 2011; Herzog & Deuschl, 2010; Johnson, Lyons & Pahwa, 2008; Limousin et al., 2008; Miocinovic, McIntyre & Vitek, 2008; Weiss, Garonzik, Samdani, Ohara & Len, 2007). Actualmente la estructura en la que se implanta el electrodo con mayor frecuencia es el NST debido a que existe un efecto positivo en una amplia gama de síntomas (bradicinesia, rigidez, temblor y discinesias). La explicación a esta mejoría de los síntomas parte de estudios con modelos animales que muestran que la red neuronal de actividad glutamatérgica del NST está profundamente alterada, por lo que la estimulación puede disminuir la producción de glutamato y, así, reducir en alguna medida la velocidad del proceso neurodegenerativo (Benabid, Chabardes, Mitrofanis & Pollak, 2009; Herzog & Deushl, 2010; Hilker, 2010). Otros estudios han mostrado que la estimulación del GPi mejora la congelación, la torpeza en la marcha, inestabilidad postural, depresión y alteraciones del sueño, aunque produce una mejoría del 33.3% en los síntomas y las dosis de Levodopa aumentan en comparación con la estimulación del NST (Herzog & Deushl, 2010). Recientemente, diferentes investigaciones han propuesto el NPP como nuevo objetivo, debido a que se evidencian mejoras significativas en algunos de los síntomas axiales de la enfermedad, en particular la congelación de la marcha y la frecuencia de las caídas (Hamani, Moro & Lozano, 2010). Para finalizar, se plantea que las radiaciones prelemniscales son una alternativa en pacientes con EP con predominio de temblor y rigidez, sin disquinesias asociadas (Arango & Espinosa, 2005).
Cambios Neuropsicológicos por ECP
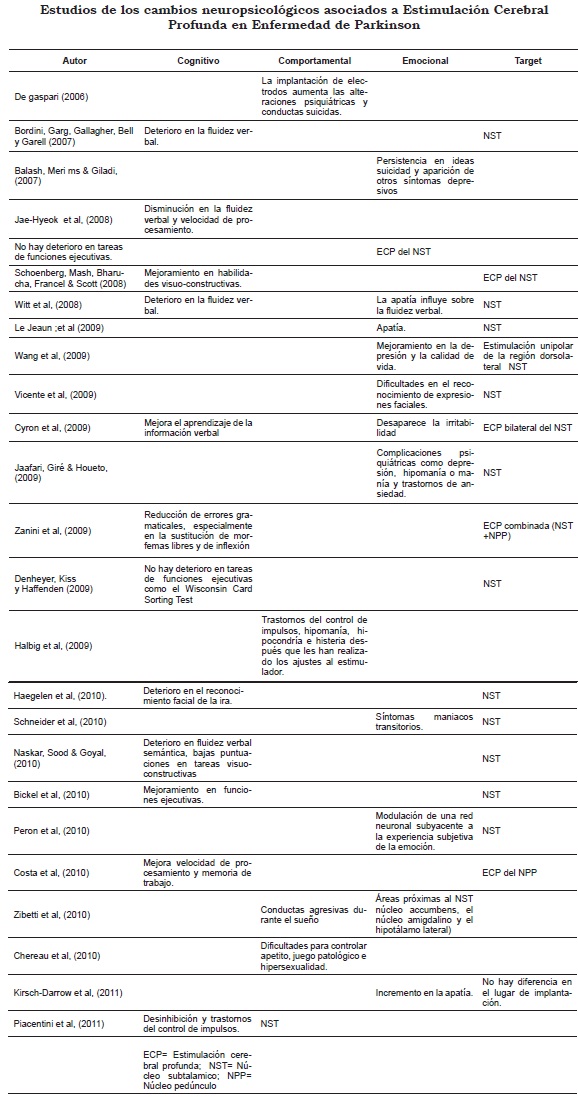
Diferentes estudios han reportado cambios neuropsicológicos en pacientes con enfermedad de Parkinson sometidos a ECP y que en ciertos casos implican mejoría o mantenimiento de las funciones cognitivas, de los procesos emocionales y de la conducta. No obstante, otros estudios están mostrando alteraciones en el perfil neuropsicológico de los pacientes asociado al target escogido para el acto quirúrgico. En ECP del NST Bickel et al. (2010) encontraron desempeños generales que se mantienen constantes en pruebas de función ejecutiva frontal, ya que no evidenciaron deterioro en los resultados de los pacientes durante la ejecución del Wisconsin Card Sorting Test (Denheyer, Kiss & Haffenden, 2009; Jae -Hyeok et al., 2008). También con la ECP bilateral del NST se ha reportado una mejora significativamente en el aprendizaje de información verbal y en las habilidades visuo-constructivas cuando hay un aumento de la amplitud del estimulador (Cyron, Funk, Deletter & Scheufer, 2010; Schoenberg, Mash, Bharucha, Francel & Scott, 2008). En cuanto a la ECP del NPP, se evidencia una mejoría de la memoria de trabajo (MT) debido a su relación con las vías corticoestriadas, las cuales están implicadas en esta función cognitiva. En este tipo de tareas hay una disminución del tiempo de latencia cuando el estimulador está on, lo que indica que facilita la velocidad de procesamiento de la información en el contenido de la MT (Costa et al., 2010). También se ha demostrado que pacientes que se han sometido a la ECP combinada (NST + NPP) tienen una tendencia hacia la reducción de errores gramaticales, especialmente en la sustitución de morfemas libres y de inflexión (Zanini et al., 2009).
En cuanto al comportamiento y a los aspectos emocionales, con la ECP bilateral del NST se ha reportado que desaparece la irritabilidad que se presenta por la enfermedad y, en un estudio, Wang et al. (2009) mostró que la estimulación unipolar en la región dorsolateral del NST puede mejorar los síntomas depresivos comunes en la EP, generando una notable mejora en la calidad de vida.
Sin embargo, pueden surgir complicaciones inmediatamente o hasta varios años después de la cirugía hasta en un 20% de los casos. Algunos de los efectos secundarios observados inmediatamente después de la cirugía son transitorios, como confusión o convulsiones. En otros casos, puede persistir e incluso puede empeorar el estado motor de los pacientes hasta en un 18% de los casos. En cuanto a los efectos adversos a largo plazo, se ha planteado que la estimulación excesiva puede causar una corriente eléctrica que se propague a las estructuras adyacentes provocando síntomas adversos, como por ejemplo disartria, disfonía o disfagia, lo cual es un indicador de la participación de las proyecciones corticobulbares en la explicación de estos efectos secundarios (Tassorelli et al., 2009).
Ahora bien, es importante tener en cuenta que las complicaciones que se pueden presentar después de la ECP no solo se limitan al plano motor, sino que se extienden al plano emocional, cognitivo y comportamental (Cyron, Funk & Deletter, 2010). En cuanto a lo emocional, Jaafari, Giré y Houeto (2009) afirman que la ECP del NST está acompañada de una serie de trastornos que reflejan el efecto nocivo de la estimulación del circuito límbico, manifestándose en complicaciones psiquiátricas como depresión, hipomanía o manía y trastornos de ansiedad, esto porque el NST es una zona sensible que influye en las emociones (Balash, Merims & Giladi, 2007). En cuanto a los episodios depresivos, el principal factor de riesgo se asocia a menudo con un riesgo suicida por descompensación postoperatoria, principalmente en pacientes con historial de depresión y ansiedad (Balash et al., 2007; Gan et al., 2007; Lilleeng & Dietrichs, 2008). También mencionan la persistencia de ideas suicidas como característica distintiva de la depresión posterior a ECP del NST, observando que los síntomas depresivos comienzan casi inmediatamente después de la conmutación de la estimulación con el contacto de los electrodos que se encuentran en el NST central. No obstante, la depresión no sólo puede ser atribuida a la intervención quirúrgica, debido a que las causas pueden estar relacionadas con el estrés por padecer una enfermedad crónica, por la reducción brusca del tratamiento dopaminérgico y por los cambios rápidos en la condición médica que conduce a dificultades en los ajustes familiares y sociales (Gan et al., 2007; Páez, Jofré, Azpiroz & De Bortoli, 2009; Wang et al., 2009).
La ECP también ha estado asociada al incremento en la apatía, encontrándose que aumenta alrededor de los 6 meses posteriores a la cirugía y con una prevalencia mayor en adultos entre 60 y 70 años, sin embargo los estudios no han arrojado diferencias entre los sitios de implantación del electrodo (Kirsch-Darrow et al., 2011). Corroborando lo anterior, Le Jeune et al. (2009) correlacionaron la ECP del NST con cambios en el metabolismo de la glucosa, usando 18FDG-PET, encontrando que 3 meses después de realizada la cirugía, la apatía empeoró significativamente con una correlación positiva entre la variación en las puntuaciones de la apatía y cambios en el metabolismo de la glucosa, especialmente en la circunvolución medial del lóbulo frontal derecho (área de Brodmann [BA] 10) y la circunvolución frontal inferior (BA 46 y BA 47), lo cual confirma el papel del NST en el circuito límbico y asociativo de los seres humanos, siendo una estructura clave en el circuito de la motivación (Drapier et al., 2008).
Conclusiones
Después de la ECP en pacientes con enfermedad de Parkinson se pueden presentar cambios que mejoran o afectan al paciente en aspectos emocionales, cognitivos y comportamentales. Estos cambios están relacionados con la estructura diana en la que se implante el electrodo y con el correcto posicionamiento del mismo, con los parámetros del estimulador, con las características premorbidas del paciente y con los circuitos subcortico-corticales implicados en la estimulación. La mayoría de procedimientos quirúrgicos se centran en el núcleo subtalámico (NST) como target, mostrando el rol fundamental que cumple en procesos emocionales y motivacionales, ya que hace parte del circuito límbico. De este modo, se ha evidenciado un mantenimiento de las funciones cognitivas que preservan los pacientes y mejoras en velocidad de procesamiento, en la latencia de respuesta y en tareas de funciones ejecutivas, especialmente de memoria de trabajo y de flexibilidad cognitiva. Asimismo, se pueden plantear cambios en el comportamiento y cambios emocionales caracterizados por la disminución de la irritabilidad y por disminución de síntomas depresivos, aunque estos están supeditados al área diana donde se encuentra el electrodo.
Por otra parte, se han planteado dificultades en los pacientes posteriores a la ECP que se caracterizan por alteraciones psiquiátricas como depresión, manía, hipomanía y trastornos de ansiedad. También se han descrito alteraciones emocionales como apatía y dificultad en el reconocimiento de expresiones faciales. Asimismo, a nivel comportamental se han encontrado dificultades en el control de impulsos que se manifiestan en cuadros clínicos como agresividad, hiperfagia y juego patológico. En este punto hay que aclarar que estos cambios emocionales y comportamentales están mediados por características premorbidas de personalidad y por trastornos psicopatológicos pre-existentes, razón por la cual se confirma que un criterio fundamental para la inclusión de un paciente en un programa de estimulación cerebral profunda en enfermedad de Parkinson, debe estar mediada por una adecuada valoración neurológica para definir los síntomas motores nucleares, pero principalmente por una muy completa evaluación psicológica y neuropsicológica, que permita estimar el riesgo de cambios indeseados en los pacientes que comprometan su funcionalidad en los diferentes ámbitos que se desenvuelva. Además, sería conveniente hacer investigaciones con poblaciones más amplias, que controlen mejor las diferentes variables neurológicas, neuropsicológicas y psiquiátricas, de tal forma que se puedan potenciar al máximo los efectos benéficos y disminuir a su mínima expresión los efectos secundarios negativos de la ECP.
También se han encontrado alteraciones en el reconocimiento facial de la emociones. Se realizó un estudio con SPECT y PET en la ECP del NST, cuyos resultados arrojaron que existe un deterioro significativo en el reconocimiento de expresiones faciales de ira, en donde se identificó que las estructuras límbicas (corteza orbito frontal, el cíngulo y el complejo hipocampo-amigdalino) están influenciadas por la estimulación, afectando las funciones prefrontales a través de diferentes mecanismos e influyendo en la integración de la información del sistema límbico, ya sea mediante la interrupción de los procesos emocionales dentro de NST o al alterar la función normal del circuito límbico que une el NST, el área tegmental ventral, el núcleo accumbens y las estructuras límbicas neocorticales (Drapier et al., 2008; Haegelen et al., 2010). Con el estimulador on se han observado modificaciones en el metabolismo de la glucosa en la corteza orbitofrontal derecha y en la amígdala, lo que sugiere que la estimulación del NST es responsable de una desincronización de estas dos estructuras (Le Jeune et al., 2009). Al respecto Vicente et al. (2009) encontraron que las personas sometidas a estimulación no solo tienen dificultades para reconocer expresiones en otros, sino para atribuir emociones a su propio estado de ánimo, mencionando que se les dificulta inducir ira o miedo en otras personas. Esto significa que hay una modulación inducida por la estimulación del NST de una red neuronal subyacente a la experiencia subjetiva de la emoción (Peron et al., 2010). A nivel cognitivo, es importante resaltar que ciertos estudios han mostrado que la manipulación eléctrica de los circuitos frontobasales, que se ubican en paralelo en los ganglios de la base, puede dar lugar a cambios de la capacidad cognitiva del paciente produciendo un deterioro en la atención, en la fluidez verbal y en la memoria. De hecho Naskar, Sood y Goyal, (2010) afirman que los cambios cognitivos siguientes a la ECP constituyen un descenso significativo en la fluidez verbal semántica y bajas puntuaciones en visuoconstruccion. Adicionalmente la estimulación parece interrumpir los circuitos fronto-subcorticales subyacentes a las categorías semánticas y/o el acceso a categorías semánticas, ya que se ha encontrado que la función más afectada es la fluidez verbal (Bordini, Garg, Gallagher, Bell & Garell, 2007; Schoenberg et al., 2008). De todos modos, no puede descartarse una posible relación con la apatía, ya que los peores resultados en la fluencia verbal corresponden a pacientes con mayor grado de apatía (De Gaspari et al., 2006; Witt et al., 2008). Es importante mencionar que la disminución de la fluidez verbal se puede presentar al año y medio después de la operación, debido al deterioro de la vía indirecta estriado-tálamo-cortical por la estimulación del NST (Jae-Hyeok et al., 2008). En cuanto a las funciones ejecutivas, se ha encontrado que el desempeño en la prueba Stroop va disminuyendo durante el año siguiente a la intervención quirúrgica, evidenciando una disminución en la velocidad de procesamiento. Además, se ha observado un hipometabolismo en la corteza cingulada anterior derecha (ACC) y el estriado ventral derecho durante el desarrollo de esta tarea (Jae-Hyeok et al., 2008). Por otra parte, en un estudio realizado por Torta et al. (2010), los pacientes se pueden ver afectados en su capacidad para estimar el tiempo de duración de sus acciones, presentando trastornos en la reproducción de tiempo y subestimando el tiempo que lleva determinada acción motora. En último lugar, también se han encontrado cambios en el comportamiento posteriores a la ECP. Se han reportado casos de juego patológico e hipersexualidad. Asimismo, hay pacientes que han subido de peso debido a que ya no son capaces de controlar el apetito y sienten la necesidad de comer constantemente (Chereau et al., 2010). Adicionalmente, se han evidenciado comportamientos perturbadores del sueño, incluyendo puños y patadas durante el sueño. En algunos pacientes el contenido de sus sueños es violento, dentro del cual describen ataques y conductas defensivas (Zibetti et al., 2010). En cuanto a reacciones agresivas se encuentra que son poco frecuentes y suelen deberse al efecto del electrodo sobre áreas próximas al NST, como el núcleo accumbens, el hipotálamo lateral o el núcleo amigdalino. También existen pacientes que han presentado hipomanía, hipocondría e histeria después que les han realizado los ajustes al estimulador. En algunos casos se presenta desinhibición del comportamiento o trastornos del control de impulsos, no obstante estos casos presentaban aspectos de personalidad previos, característicos de trastornos psiquiátricos como manía o bipolaridad (Halbig et al., 2009; Piacentini, Versaci, Romito, Ferre & Albanes, 2011; Ray et al., 2009). También hay estudios que correlacionan la implantación de electrodos con un aumento de conductas suicidas (De Gaspari et al., 2006; Woods et al., 2006; Zahodne et al., 2009).
Referencias
Aarsland, D. Zaccai, J. & Brayne, C. (2005). A systematic review of prevalence studies of dementia in Parkinson's disease. Movement Disorders, 10 (20), 1255-1263. doi: 10.1002/mds.20527. [ Links ]
Arango, G. & Espinosa, J. (2005). Neuromodulación. Guía Neurológica, 7 (7), 211-220. Recuperado de http://www.acnweb.org/index.php?option=com_content&view=article&id=419:neuromodulacion&catid=62:guia-neurologica-7&Itemid=125. [ Links ]
Balash, Y. Merims, D. & Giladi, N. (2007). Suicidal thoughts in patients with Parkinson's disease treated by deep brain stimulation of the subthalamic nuclei: Two case reports and review of the literature. Acta Neuropsychiatrica, 19 (3), 208-210. Recuperado de ISI Web of Knowledge. [ Links ]
Benabid, A. Chabardes, S. Mitrofanis, J. & Pollak, P. (2009). Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease. Lancet neurology, 8 (1), 67-81. doi: 10.1016/S1474-4422(08)70291-6. [ Links ]
Bickel, S., Alvarez, L., Macias, R., Pavon, N., Leon, M., Fernandez, C., ... Litvan, I. (2010). Cognitive and neuropsychiatric effects of subthalamotomy for Parkinson's disease. Parkinsonism & Related Disorders, 16 (8), 535-539. doi: 10.1016/j.parkrel-dis.2010.06.008. [ Links ]
Bordini, B. J., Garg, A., Gallagher, C. L., Bell, B. & Garell, P. C. (2007). Neuropsychological effects of bilateral deep brain stimulation of the subthalamic nucleus in Parkinson's disease. Stereotactic And Functional Neurosurgery, 85 (2-3), 113-120. Recuperado de ISI Web of Knowledge. [ Links ]
Chereau, I., De Chazeron, I., Rieu, I., Derost, P. P., Lemaire, J. J., Llorca, P. M. & Durif, F. (2010). Eating disorders and deep brain stimulation of the subthalamic nucleus in Parkinson's Disease. European Neuropsychopharmacology, 3 (20), S562-S563. Recuperado de ISI Web of Knowledge. [ Links ]
Costa, A., Carlesimo, G. A., Caltagirone, C., Mazzone, P., Pierantozzi, M., Stefani, A. & Peppe, A. (2010). Effects of deep brain stimulation of the peduncolopontine area on working memory tasks in patients with Parkinson's disease. Parkinsonism & Related Disorders, 16 (1), 64-67. doi: 10.1016/j.parkreldis.2009.05.009. [ Links ]
Cyron, D., Funk, M., Deletter, M. A. & Scheufer, K. (2010). Preserved cognition after deep brain stimulation (DBS) in the subthalamic area for Parkinson's disease: A case report. Acta Neurochirurgica, 152 (12), 2097-2100. doi: 10.1007/s00701-010-0755-x. [ Links ]
De Gaspari, D., Siri, C., Di Gioia, M., Antonini, A., Isella, V., Pizzolato, A., ... Pezzoli, G. (2006). Clinical correlates and cognitive under-pinnings of verbal fluency impairment after chronic subthalamic stimulation in Parkinson's disease. Parkinsonism & Related Disorders, 5 (12), 289-295. doi: 10.1016/j.parkreldis.2006.01.001. [ Links ]
Denheyer, M., Kiss, Z. & Haffenden, A. (2009). Behavioral effects of subthalamic deep brain stimulation in Parkinson's disease. Neuropsychologia, 47 (14), 3203-3209. doi: 10.1016/j.neuropsychologia.2009.07.022. [ Links ]
Deogaonkar, M., Monsalve, G., Scott, J., Ahmed, A. & Rezai, A. (2011). Bilateral subthalamic deep brain stimulation after bilateral pal-lidal deep brain stimulation for Parkinson's disease. Stereotact Funct Neurosurg, 89, 123–127. doi: 10.1159/000323375. [ Links ]
Drapier, D., Peron, J., Leray, E., Sauleau, P., Biseul, I., Drapier, S., ... Verin, M. (2008). Emotion recognition impairment and apathy after subthalamic nucleus stimulation in Parkinson's disease have separate neural substrates. Neuropsychologia, 46 (11), 2796-2801. doi: 10.1016/j.neuropsychologia.2008.05.006. [ Links ]
Emre, M. (2003). Dementia associated with Parkinson's disease. Lancet Neurology, 4 (2), 229-237. doi: 10.1016/S1474-4422(03)00351-X. [ Links ]
Factor, S. & Weiner, W. (2008). Parkinson's disease: Diagnosis and clinical management. Toronto: Demos Medical Publishing. [ Links ]
Franzini, A., Cordella, R., Messina, G., Marras, C., Romito, L., Carella, F., Broggi, G. (2011). Deep brain stimulation for movement disorders. Considerations on 276 consecutive patients. Journal of Neural Transmission, 5 (118). doi 10.1007/s00702-011-0656-z. [ Links ]
Gan, J., Xie-Brustolin, J., Mertens, P., Polo, G., Klinger, H., Mollion, H., Benatru, I., & Thobois, S. (2007). Bilateral subthalamic nucleus stimulation in advanced Parkinson's disease: Three years follow-up. Journal of Neurology, 254 (1), 99-106. doi: 10.1007/s00415-006-0297-6. [ Links ]
Haegelen, C., Garcia-Lorenzo, D., Le Jeune, F., Peron, J., Gibaud, B., Riffaud, L., & Morandi, X. (2010). SPECT and PET analysis of subthalamic stimulation in Parkinson's disease: Analysis using a manual segmentation. Journal of Neurology, 257 (3), 375-382. doi: 10.1007/s00415-009-5327-8. [ Links ]
Halbig, T. D., Tse, W., Frisina, P. G., Baker, B. R., Hollander, E., Shapiro, H.,... & Olanow, C. W. (2009). Subthalamic deep brain stimulation and impulse control in Parkinson's disease. European Journal of Neurology, 16 (4), 493-497. Recuperado de ISI Web of Knowledge. [ Links ]
Hamani, C., Moro, E. & Lozano, A. (2010). The pedunculopontine nucleus as a target for deep brain stimulation. Journal of Neural Transmission, 12 (117). doi: 10.1007/s00702-010-0547-8. [ Links ]
Heo, J. H., Lee, K. M., Paek, S. H., Kim, M. J., Lee, J. Y., Kim, J. Y.,... & Jeon, B. S. (2008). The effects of bilateral subthalamic nucleus deep brain stimulation (STN DBS) on cognition in Parkinson disease. Journal Of The Neurological Sciences, 1-2 (273), 19–24. doi: 10.1016/j.jns.2008.06.010. [ Links ]
Herzog, J. & Deuschl, G. (2010). Deep brain stimulation for Parkinson's disease. Nervenarzt, 81 (6), 669-679. Recuperado de SpringerLink. [ Links ]
Hilker, L. (2010). Funktionelle bildgebung der tiefen hirnstimulation bei idiopathischem Parkinson-Syndrom. Nervenarzt, 10 (81), 1204–1207. doi: 10.1007/s00115-010-3027-3. [ Links ]
Jaafari, N., Gire, P. & Houeto, J. L. (2009). Deep brain stimulation, Parkinson's disease and neuropsychiatric complications. Presse medicale, 38 (9), 1335-1342. Recuperado de ISI Web of Knowledge. [ Links ]
Johnson, M. D., Miocinovic, S., McIntyre, C. C. & Vitek, J. L. (2008). Mechanisms and targets of deep brain stimulation in movement disorders. Neurotherapeutics, 2 (5), 294-308. doi: 10.1016/j.nurt. [ Links ]
Kirsch-Darrow, L., Zahodne, L. B., Marsiske, M., Okun, M. S., Foote, K. D. & Bowers, D. (2011). The trajectory of apathy after deep brain stimulation: From pre-surgery to 6 months post-surgery in Parkinson's disease. Parkinsonism & Related Disorders, 17 (3), 182-188. doi: 10.1016/j.parkreldis.2010.12.011. [ Links ]
Le Jeune, F., Drapier, D., Bourguignon, A., Peron, J., Mesbah, H., Drapier, S.,... & Verin, M. (2009). Subthalamic nucleus stimulation in Parkinson disease induces apathy A PET study. Neurology, 73 (21), 1746-1751. doi: 10.1212/WNL.0b013e3181c34b34. [ Links ]
Lilleeng, B. & Dietrichs, E. (2008). Unmasking psychiatric symptoms after STN deep brain stimulation in Parkinson's disease. Acta Neurol Scand, 117, 41-45. Recuperado de ISI Web of Knowledge. [ Links ]
Limousin, P. & Martinez-Torres, I. (2008). Deep brain stimulation for Parkinson's disease. Neurotherapeutics, 5 (2), 309-319. Recuperado de ISI Web of Knowledge. [ Links ]
Lyons, K. & Pahwa, R. (2008). Deep brain stimulation and tremor. Neurotherapeutics, 2 (5), 331-338. doi: 10.1016/j.nurt.2008.01.004. [ Links ]
Mure, H., Hirano, S., Tang, C., Isaias, I., Antonini, A., Ma, Y.,... & Eidelberg, D. (2010). Parkinson's disease tremor-related metabolic network: Characterization, progression, and treatment effects. Neurimage, 54 (2), 1244-1253. Recuperado de ISI Web of Knowledge. [ Links ]
Naskar, S., Sood, S. K., Goyal, V. & Dhara, M. (2010). Mechanism(s) of deep brain stimulation and insights into cognitive outcomes in Parkinson's disease. Brain Research Reviews, 65 (1), 1-13. Recuperado de ScinceDirect. [ Links ]
Páez, A., Jofré, M., Azpiroz, C. & De Bortoli, M. (2008). Anxiety and depression in patients with chronic renal insufficiency undergoing dialysis treatment. Universitas Psychologica, 1 (8), 117-124. Recuperado de http://sparta.javeriana.edu.co/psicologia/publicaciones/mostrar_articulo.php?id=298. [ Links ]
Pandya, M., Kubu, C. & Giroux, M. (2008). Parkinson disease: Not just a movement disorder. Cleveland Clinic Journal of Medicine, 12 (75), 856–864. Recuperado de ISI Web of Knowledge. [ Links ]
Peron, J., Grandjean. D., Le Jeune. F., Sauleau, P., Haegelen. C., Drapier, D.,... & Vérin, M. (2010). Recognition of emotional prosody is altered after subthalamic nucleus deep brain stimulation in Parkinson's disease. Neuropsychologia, 4 (48), 1053-1062. doi: 10.1016/j.neuropsychologia.2009.12.003. [ Links ]
Piacentini, S., Versaci, R., Romito, L., Ferre, F. & Albanese, A. (2011). Behavioral and personality features in patients with lateralized Parkinson's disease. European Journal of Neurology, 18 (5), 772-777. doi: 10.1111/j.1468-1331.2010.03279.x. [ Links ]
Ray, N. J., Jenkinson, N., Brittain, J., Holland, P., Joint, C., Nandi, D., ... & Aziz, T. Z. (2009). The role of the subthalamic nucleus in response inhibition: Evidence from deep brain stimulation for Parkinson's disease. Neuropsychologia, 47 (13), 2828-2834. doi: 10.1016/j.neuropsychologia.2009.06.011. [ Links ]
Robottom, B. J. & Weiner, W. J. (2009). Dementia in Parkinson's disease. Neurobiology of Dementia, (84), 229-244. doi: 10.1016/ S0074-7742(09)00412-7. [ Links ]
Rowe, J., Hughes, L., Ghosh, P., Eckstein, D., Williams-Gray, C., Fallon, S.,... & Owen, A. (2008). Parkinson's disease and dopaminergic therapyçdifferential effects on movement, reward and cognition. Brain, 131, 2094-2105. doi:10.1093/brain/awn112. [ Links ]
Schmidt, K., Spiegel, J. & Reith, W. (2011). Klinische und bildgebende diagnostik bei morbus Parkinson und multisystematrophie. Nervenarzt, 4 (51), 273–277. doi: 10.1007/s00117-010-2095-5. [ Links ]
Schneider, F., Reske, M., Finkelmeyer, A., Wojtecki, L., Timmermann, L., Brosig, T.,... & Schnitzler, A. (2010). Predicting acute affective symptoms after deep brain stimulation surgery in Parkinson's disease. Stereotactic and functional neurosurgery, 88 (6), 367-373. Recuperado de ISI Web of Knowledge. [ Links ]
Schoenberg, M. R., Mash, K. M., Bharucha, K. J., Francel, P. C. & Scott, J. G. (2008). Deep brain stimulation parameters associated with neuropsychological changes in subthalamic nucleus stimulation for refractory Parkinson's disease. Stereotactic And Functional Neurosurgery, 86(6), 337-344. doi: 10.1159/000163554. [ Links ]
Shils, J., Alterman, R. & Arle. J. (2008). Deep brain stimulation fault testing. En D. Tarsy, J. L. Vitek, P. A. Starr, & M. S. Okun (Eds.), Current clinical neurology: Deep brain stimulation in neurological and psychiatric disorders (pp. 473-494). Totowa, NJ: Humana Press. [ Links ]
Shulman, J., De Jager, P. & Feany, M. (2010). Parkinson's disease: Genetics and pathogenesis. Annual Review of Pathology: Mechanisms of Disease, 6, 193–222. doi: 10.1146/annurev-pathol-011110-130242. [ Links ]
Singh, N., Pillay, V. & Choonara, Y. E. (2007). Advances in the treatment of Parkinson's disease. Progress in Neurobiology, 1 (81), 29-44. doi: 10.1016/j.pneurobio.2006.11.009. [ Links ]
Stoessl, A. J. (2011). Neuroimaging in Parkinson's disease. Neurotherapeutics, 8 (1), 72-81. Recuperado de ISI Web of Knowledge. [ Links ]
Takafumi, T., Kajita, Y., Kaneoke, Y., Takebayashi, S., Nakatsubo, D. & Wakabayashi, T. (2009). Staged bilateral deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease. Acta Neurochirurgica, 6 (151), 589-594. doi: 10.1007/ s00701-009-0293-6. [ Links ]
Tassorelli, C., Buscone, S., Sandrini, G., Pacchetti, C., Furnari, A., Zangaglia, R.,... & Martignoni, E. (2009). The role of rehabilitation in deep brain stimulation of the subthalamic nucleus for Parkinson's disease: A pilot study. Parkinsonism & Related Disorders, 15 (9), 675-681. doi: 10.1016/j.parkreldis. 2009.03.006. [ Links ]
Torta, D., Castelli. D., Latini-Corazzini, L., Banche, A., Lopiano, L. & Geminiani, G. (2010). Dissociation between time reproduction of actions and of intervals in patients with Parkinson's disease. Journal of Neurology, 8 (257), 1356-1361. doi: 10.1007/ s00415-010-5532-5. [ Links ]
Vicente, S., Biseul, I., Peron, J., Philippot, P., Drapier, S., Drapier, D.,... & Verin, M. (2009). Subthalamic nucleus stimulation affects subjective emotional experience in Parkinson's disease patients. Neuropsychologia, 47 (8-9), 1928-1937. doi: 10.1016/j. neuropsychologia.2009.03.003. [ Links ]
Wang, X. L., Chang, C. W., Geng, N., Li, N., Wang, J. L., Ma, J.,... Gao, G. D. (2009). Longterm effects of bilateral deep brain stimulation of the subthalamic nucleus on depression in patients with Parkinson's disease. Parkinsonism & Related Disorders, 15 (8), 587-591. doi: 10.1016/j.parkreldis.2009.02.006. [ Links ]
Witt, K., Daniels, C., Reiff, J., Krack, P., Volkmann, J., Pinsker, M. O.,... & Deuschl, G. (2008). Neuropsychological and psychiatric changes after deep brain stimulation for Parkinson's disease: A randomised, multicentre study. Lancet Neurology, 7 (7), 605-614. [ Links ]
Woods, S. P., Rippeth, J. D., Conover, E., Carey, C. L., Parsons, T. D. & Troster, A. I. (2006). Statistical power of studies examining the cognitive effects of subthalamic nucleus deep brain stimulation in Parkinson's disease. Clinical Neuropsychologist, 1 (20), 27-38. doi: 10.1080/13854040500203290. [ Links ]
Yuang, H., Zhang, Z., Liang, L., Shen, Q., Wang, X., Ren, S.,... & Liu, P. (2010). Treatment strategies for Parkinson's disease. Neurosci Bull, 26 (1), 66-76. doi: 10.1007/s12264-010-0302-z. [ Links ]
Zahodne, L. B., Okun, M. S., Foote, K. D., Fernandez, H. H., Rodriguez, R. L., Kirsch-Darrow, L. & Bowers, D. (2009). Cognitive declines one year after unilateral deep brain stimulation surgery in parkinson's disease: A controlled study using reliable change. Clinical Neuropsychologist, 3 (23), 385-405. doi: 10.1 080/13854040802360582. [ Links ]
Zanini, S., Moschella, V., Stefani, A., Peppe, A., Pierantozzi, M., Galati, S.,... Stanzione, P. (2009). Grammar improvement following deep brain stimulation of the subthalamic and the pedunculopontine nuclei in advanced Parkinson's disease: A pilot study. Parkinsonism & Related Disorders, 15 (8), 606-609. Recuperado de ISI Web of Knowledge. [ Links ]
Zibetti, M., Rizzi, L., Colloca, L., Cinquepalmi, A., Angrisano, S., Castelli, L.,... & Lopiano, L. (2010). Probable REM sleep behavior disorder and STN-DBS outcome in Parkinson's Disease. Parkinsonism & Related Disorders, 16 (4), 265-269. doi: 10.1016/j. parkreldis.2010.01.001. [ Links ]
Apéndice