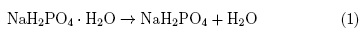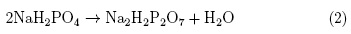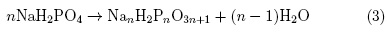Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Momento
versión impresa ISSN 0121-4470
Momento no.52 Bogotá jan./jun. 2016
COMPORTAMIENTO DE LAS FASES DEL NaH2PO4.H2O A ALTAS TEMPERATURAS
PHASE BEHAVIOR OF NaH2PO4.H2O AT HIGH TEMPERATURES
Yeimy Londoño1, Diego Peña-Lara2, Jesús E. Diosa2
1 Programa Alimentos y Electrónica, Universidad del Valle, sedes Palmira y Tulua-Colombia
2 Departamento de Física, Universidad del Valle, Cali - Colombia
Diego Peña-Lara: diego.pena@correounivalle.edu.co
(Recibido: Octubre/2015. Aceptado: Mayo/2016)
Resumen
Hemos usado las técnicas de calorimetría de barrido diferencial (DSC), análisis termo gravimétrico (TGA) y espectroscopia de impedancias (IS) para estudiar el comportamiento de las fases del sistema NaH2PO4H2O a temperaturas por encima de la temperatura ambiente. Los resultados de DSC muestran cinco anomalías endotérmicas con picos alrededor de 70°C, 120°C, 210°C, 325°C y 350°C, durante el primer barrido de calentamiento, pero ninguna anomalía aparece en el siguiente barrido de enfriamiento. Los resultados de TGA revelan que la muestra fresca de NaH2PO4H2O pierde peso cuando es calentada por primera vez a través de las diferentes temperaturas. La resistencia eléctrica de la muestra fresca de NaH2PO4H2O también exhibe fuertes variaciones a través de las anomalías ubicadas alrededor de 70°C y 120°C, indicando que el transporte iónico es favorecido entre 55°C y 108°C y entre 120°C y 150°C. Nosotros discutimos y atribuimos el comportamiento observado en el NaH2PO4H2O a lo largo de todas las temperaturas donde se observan las anomalías, como una consecuencia de procesos de deshidratación de la muestra.Palabras clave: NaH2PO4, Resistencia eléctrica, DSC, TGA.
Abstract
Differential Scanning Calorimetry (DSC), Thermogravimetric Analysis (TGA), and Impedance Spectroscopy (IS) were used to study the phase behavior of the system, NaH2PO4H2O above room temperature. The DSC results show five endothermic anomalies with picks around 70°C, 120°C, 210°C, 325°C, and 350°C, during the first heating run, but any anomaly is show on the subsequent cooling run. The TGA results show that fresh powder of NaH2PO4H2O loss weight when the sample is first heated across the different temperatures. The electrical resistance of fresh sample NaH2PO4H2O also shows strong variation at 70°C and 120°C anomalies, indicating that the ionic transport is enhanced between 55°C and 108°C, and between 120°C and 150°C. We discuss and attributed the observed behavior in NaH2PO4H2O throw the different temperatures, where observed the anomalies, as a consequence of a dehydration process of the sample.
Keywords: NaH2PO4, Electrical Resistance, DSC, TGA.
Introducción
La familia del KDP (MH2PO4; M = Na, K, Cs, Rb y NH4) es interesante por la presencia de enlaces de hidrógeno entre los iones de fosfato (tetraedros) los cuales juegan un papel importante sobre el ordenamiento ferro eléctrico (FE) o antiferroeléctrica (AFE) encontrado en esta familia [1]. En particular, es bien sabido que KH2PO4 exhibe una transición ferro eléctrica de baja temperatura a - 151°C (Tc) [2-4]. Otra propiedad interesante de los compuestos de la familia KDP es que muestran una alta movilidad de protones [1] a temperaturas más altas. El comportamiento de fase de alta temperatura, por ejemplo, ha sido estudiado por muchos investigadores que han utilizado medidas eléctricas [3, 5-7]. En un artículo de revisión, Lee [8] da una buena visión general de todas las fases reportados en KDP: Asó para KH2PO4 por debajo de - 151 ° C indica la existencia de una fase ferro eléctrica, ferroelástica y ortorrómbica; entre - 151°C y 180°C una fase paraeléctrica, paraelástica y tetragonal; la fase entre 180°C y 233°C ha sido sugerida ser monoclínica, mientras que la estructura cristalina de la fase de alta temperatura (233°C < T < 259°C, punto de fusión) no se ha identificado. En cualquier caso, el comportamiento de las fases por arriba de la temperatura ambiente sigue siendo un tema controvertido y aún no hay una idea clara sobre la naturaleza de las transiciones de fase de alta temperatura en el KDP. Incluso se ha sugerido que la alta movilidad protónica observada por encima de 180° C es debido a la aparición de una reacción de deshidratación térmica que favorecería la conducción protónica [8-10], en lugar de una transición de fase estructural.
Los fosfatos condensados preparados por calentamiento del sistema NaH2PO4-H2O y sus correspondientes reacciones químicas han sido también estudiados [11-14]. Dos tipos de diagrama de fases son normalmente usados [8, 11]. Uno muestra la interacción de sustancias formadas por tratamiento térmico de materiales dados inicialmente en atmósferas libres y no necesariamente en condiciones de equilibrio, donde se reportan anomalías alrededor de 34°C, 160°C, 240°C, 300°C, 400°C y 625°C, donde se reporta la formación de diferentes sales. El otro tipo representa la relación entre sustancias como fases estables bajo condiciones de equilibrio y especialmente bajo diferentes presiones de vapor de agua, haciendo que el sistema luzca más simple con anomalías alrededor de 169 ° C, 375 ° C, 443 ° C y 622 ° C. En este trabajo se estudió el comportamiento de las fases del NaH2PO4-H2O utilizando técnicas de calorimetría de barrido diferencial (DSC), termogravimetría (TG) y espectroscopia de impedancias (IS) en aras de aportar nuevas ideas respecto al comportamiento de las fases ya reportadas para esta muestra bajo condiciones diferentes.
Métodos experimentales
Muestras en polvo de NaH2PO4-H2O (Aldrich) fueron usados. El análisis de DSC se realizó con un equipo de TA Instruments DSC 2920 en una atmósfera de nitrógeno (N2) a una presión de 90 psi y las medidas de TG se realizaron con un equipo de TA Instruments TGA 2050 en atmosfera de nitrógeno con un flujo de 50 ml/min partiendo de muestras en polvo sin ningún tratamiento térmico previo. Las medidas de resistencia se realizaron con un impedancímetro Hewlett-Packard 4 192A LCR meter en atmosfera de N2.
Resultados y discusión
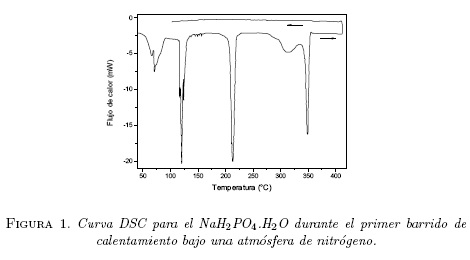
La figura 1 muestra un barrido de calentamiento y enfriamiento en el DSC tomado a una rata de 5°C/min en una muestra fresca de NaH2PO4-H2O para temperaturas por encima de la temperatura ambiente, observándose cinco anomalías endotermicas situadas sucesivamente entre 50°C y 80°C, entre 110°C y 130°C, entre 200°C y 225°C, y dos superpuestas entre 275°C y 360°C.
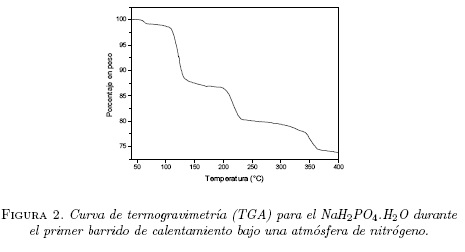
La figura 2 muestra una curva de termogravimetría TG, tomado en una muestra fresca de NaH2PO4-H2O al someterse a una rata de calentamiento de 5°C/min en una atmosfera N2. El termograma muestra efectivamente perdidas de peso de la muestra alrededor de las temperaturas donde fueron observadas las anomalías en el DSC (ver figura 1).
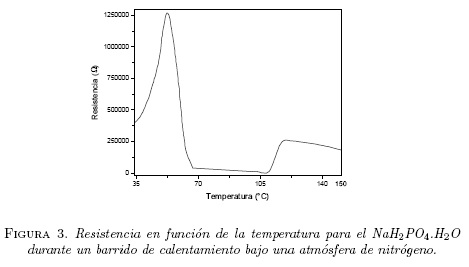
La figura 3 muestra los datos de resistencia como una función de la temperatura para una muestra fresca de NaH2PO4-H2O al calentarse desde 35°C hasta 150°C. Se observa inicialmente un aumento de resistencia desde un valor de 410 kΩ hasta el valor de 1.26 MΩ al llegar a una temperatura de 53°C, para luego caer bruscamente (R = 40 kΩ) hacia los 67°C. Esta caída en la resistencia está relacionada con la perdida pequeña de peso de la muestra observada en la figura 2 y también la anomalía mostrada en el DSC de la figura 1 alrededor de 70°C. A partir de los 67°C hasta aproximadamente 108°C la resistencia decae lentamente. Después de los 108°C la resistencia empieza a incrementarse nuevamente hasta llegar a un valor de 260 kΩ para una temperatura de unos 120° C, luego empieza a decaer lentamente.
Creemos que la anomalía que encontramos alrededor de 70°C en la figura 1, además de la perdida pequeña de peso observada en el termograma TG de la figura 2 y la caída brusca de la resistencia entre 55°C y 67°C corresponde a la perdida de agua superficial de la muestra de NaH2P04-H2O puro, que en el caso de la referencia [11] fue reportada a 34°C y asociada con la deshidratación térmica del monofosfato hidratado:
El comportamiento de la resistencia entre 108°C y 120°C, se relaciona con el pico endotérmico alrededor de 120°C y la correspondiente pérdida de peso observado alrededor de esta temperatura (ver figuras 1 y 2) se debe probablemente a que a 120°C se obtiene ya casi todo el monofosfato deshidratado NaH2PO4 (indicando así que la conductancia eléctrica se activa térmicamente en esta fase) y se logra una conducción iónica alta característica de un electrólito sólido.
Al calentarse el NaH2PO4 por encima de unos 190°C, se observa una anomalía alrededor de 210°C donde el compuesto experimenta una reacción de descomposición parcial en la que pierde peso y bien podría ser la reacción de deshidratación:
en la que se produce el Na2H2P2O7 sugerido en las referencias [11, 12, 14], esta última alrededor de 160°C, pero bajo condiciones externas diferentes a las consideradas en este trabajo. Así en la referencia [13] dicha reacción se produciría alrededor de 230°C y en la referencia [14] alrededor de 223°C. La reacción de deshidratación (2) comenzaría en la superficie de la muestra y es análoga a la observada en otros compuestos de la familia KDP (MH2PO4, M =K, Rb, Cs) [8].
Para temperaturas mayores, entre 275°C y 360°, la muestra se sigue deshidratando y se observan dos anomalías superpuestas con picos alrededor de 325°C y 350°C (figuras 1 y 2). La anomalía observada alrededor de 325°C podría ser debido a la formación de productos intermedios, ecuacioín 3:
para n = 4 y 6, según lo sugerido por Zikun [14] para temperaturas entre 270°C y 340°C. Park et. al. [7, 15, 16] menciona que los procesos de polimerización y descomposición dependen de la temperatura y de productos intermedios inestables. Por lo cual una mezcla de productos intermedios puede ser formado en este rango de temperatura entre 270°C y 340°C [14], y en nuestro caso en el rango de temperaturas entre 275°C y 340°C.
Para temperaturas por arriba de 340°C continua el proceso de deshidratación y se observa una anomalía alrededor de 350°C la cual podría estar relacionada con la formación del producto final NaPO3 sugerido por Zikun [14] alrededor de 352°C, o por la referencia [13] alrededor de 358°C o según la referencia [12] entre 260° a 360°C.
Conclusiones
El comportamiento a altas temperaturas del NaH2P04-H2O fue estudiado por medio de medidas de DSC, TGA y IS en el rango de temperaturas entre 35°C y 400°C. Los resultados de DSC muestran cinco anomalías endotérmicas con picos alrededor de 70°C, 120°C, 210°C, 325°C y 350°C, respectivamente, las cuales están acompañadas de pérdida de peso como lo muestran las medidas de TGA. Lo anterior nos permite concluir y de común acuerdo con otros investigadores [8, 12-14] que todas las anomalías observadas son fruto de procesos de deshidratación las cuales dejan diferentes productos mostrados en las ecuaciones (1), (2) y (3), para finalmente obtener el producto final NaPO3. Finalmente los cambios bruscos observados en nuestras medidas de resistencia están relacionados con las anomalías y el proceso de deshidratación observados.
Agradecimientos
Los autores dan las gracias por el soporte recibido del CEMN, Centro de Excelencia de Nuevos Materiales.
Referencias
[1] K. D. Kreuer, Chem. Mater. 8, 610 (1996). [ Links ]
[2] K.-S. Lee, Solid State Ion. 28-30, 1617 (1988). [ Links ]
[3] J. Grinberg, S. Levin, I. Pelah, and E. Wiener, Solid State Comm. 5, 863 (1967). [ Links ]
[4] E. Rapoport, J. Phys. Chem. Solids 27, 1349 (1966). [ Links ]
[5] M. O'Keeffe and C. T. Perrino, J. Phys. Chem. Solids 28, 211 (1967). [ Links ]
[6] R. Blinc, V. Dimic, D. Kolar, G. Lahajnar, G. Stepisnik, S. Zumer, N. Vene, and D. Hadzi, J. Chem. Phys. 49, 4996 (1968). [ Links ]
[7] J. H. Park, K. S. Lee, J. B. Kim, and J. N. Kim, J. Phys.: Condens. Matter 8, 5491 (1996). [ Links ]
[8] K.-S. Lee, J. Phys. Chem. Solids 57, 333 (1996). [ Links ]
[9] E. Ortiz, R. A. Vargas, and B. E. Mellander, J. Phys. Chem. Solids 59, 305 (1998). [ Links ]
[10] J. H. Park, Phy. Rev. B 69, 054104 (2004). [ Links ]
[11] O. Thilo, Condensed Phosphates and Arsenates, 4, Edit. by H. J. Emeleus y A. G. Sharpe (Academic Press, New York, 1962) pp. 1-75. [ Links ]
[12] A. Ghule, R. Murugan, and H. Chang, Inorg. Chem. 40, 5917 (2001). [ Links ]
[13] D. A. Boysen, Superprotonic Solid Acids: Structure, Properties, and Applications (Ph. D. Thesis of California Institute of Technology, 2004). [ Links ]
[14] Z. Li and T. Tang, Thermochimica Acta 501, 59 (2010). [ Links ]
[15] J. H. Park, K. S. Lee, J. B. Kim, and J. N. Kim, J. Phys.: Condens. Matter 9, 9457 (1997). [ Links ]
[16] J. H. Park, K. S. Lee, and J. N. Kim, J. Phys.: Condens. Matter 10, 9593 (1998). [ Links ]