Introducción
El silicio es un elemento abundante en la corteza terrestre, sin embargo, normalmente se encuentra en forma de silice o silicatos debido a su reactividad con el oxígeno. En disoluciones de silicio, con un pH menor que 9 y una concentración menor a 2 mM de este elemento, la especie principal es Si(OH)4, al aumentar la concentración de silicio se forman oligómeros de esta especie. Una concentración mucho mayor a 2 mM genera coloides que forman un gel al tener un ambiente con pH neutro, debido a la polimerización del Si(OH)4 [1]. Las moléculas de Si(OH)4 reaccionan con dioles de alquilo para formar complejos de silicio, lo cual genera un mayor entendimiento de la interacción con biomoléculas [2].
Estudios de los anos 1980 utilizando condrocitos y epífisis de embriones de polluelos demostraron que el silicio aumenta la síntesis del colágeno dependiendo de la dosis aplicada, así como otros estudios con ácido ortosilicílico también reportaron aumentos en la síntesis de colageno [1 3].
Materiales como implantes con silicio han demostrado tener una mejor afinidad con los huesos que con productos similares sin este elemento, debido a la formación de una capa de apatita en su superficie [4]. Esto se debe a que el silicio juega un papel importante en la síntesis o estabilización del colágeno, el cual tiene funciones estructurales al dar flexibilidad a la piel, cartílagos, tendones y arterias. También, el silicio tiene parte en la calcificación y mineralización de la matriz del hueso [1].
El interés en los nanomateriales de silicio va creciendo debido a sus propiedades electromecánicas, biocompatibilidad, grandes relaciones superficie-volumen, multifuncionalidad y compatibilidad con la tecnología convencional con silicio [5]. También, hay una gran demanda de productos basados en silicio, como por ejemplo nanodots [6], nanocables [7], nanobarras [8], nanocintas [9] y aparecen, además, los puntos cuánticos de silicio [10].
El silicio poroso nanoestructurado presenta propiedades muy interesantes para los materiales que los contienen, ya que se pueden modificar sus características ópticas, eléctricas y químicas para desarrollar sensores químicos y biológicos. La eficacia de diferentes formas de silicio poroso está siendo probada para aplicaciones en medicamentos, enfermedades oculares, imágenes tumorales e ingeniería de tejidos [11].
Las nanopartículas de silicio pueden funcionar tanto para diagnósticos como para terapias, utilizando distintos agentes terapéuticos. Su gran area superficial y volumen interno permite que las nanopartículas puedan contener cargas grandes, además de poder seleccionar varios objetivos a la vez para la entrega de medicamentos mediante el mejoramiento fisicoquímico del tamaño y las propiedades de la superficie. Estas nanopartículas de silicio pueden determinar el destino y la tasa de liberación del medicamento, al mismo tiempo que controlan la biocompatibilidad del mismo para mejorar la eficacia del tratamiento [12]. Las moléculas del medicamento pueden ser introducidas en las nanopartículas de silicio para que el medicamento permanezca protegido y asegurar el control de su liberación [13], lo cual genera vastas ventajas en el sistema de entrega de los medicamentos con ayuda de la tecnología novedosa.
Uso y diseño de las nanoestructuras de Silicio (NESis)
Actualmente ha crecido el interés por la fabricación y caracterización de nanoestructuras de silicio, entre las que se incluye nanohilos, pilares, tubos, conos y partículas, estas se han estudiado ampliamente debido a sus propiedades físicas y aplicaciones únicas en el desarrollo nanoelectroínico, nanofotíonico, fotovoltaico y optoelectrónico [14,15]. Aunado a esto se ha trabajado la elaboración de múltiples dispositivos como baterías, paneles solares, detectores, sistemas termoeléctricos, sensores químico-biológicos, microfluidos, etc., que utilizan dichas estructuras de silicio [16].
Existen diversos métodos para generar estas nanoestructuras entre los que se puede mencionar el método de crecimiento vapor-líquido-solido (VLS), la ablación con laser, la descomposición por evaporación térmica, la deposición de vapor químico, entre otros. Sin embargo, la mayoría de estos requieren largos tiempos de síntesis y altas temperaturas debido a la limitación de su mecanismo de crecimiento [16].
Por lo general la tecnica de ablacion por laser muestra altas tasas de temperatura, alta presión, alto tiempo de enfriamiento y corto tiempo de reacción, por lo que puede generar nanoestructuras difíciles de preparar en condiciones convencionales. La ablación con laser se ha utilizado para producir películas de SiC, mostrando un gran potencial en la creación de muchas nuevas nanoestructuras de Si-C [17].
Al analizar las técnicas de deposición, cabe mencionar que la deposicion de vapor químico de alambre caliente (DVQAC), conocida como una de las nuevas técnicas para la deposición de nanoestructuras de silicio, ha recibido considerable atención para la deposición de materiales de película delgada basados en Si desde el cambio de siglo. En esta se logra una alta uniformidad en las películas de nanoestructuras de silicio que son depositadas [14].
Una de las ventajas mas importantes de la DVQAC es su alta tasa de deposición, lo que permite su participación en la producción industrial a gran escala y de bajo costo. En este proceso de DVQAC, el SiH4 se puede descomponer en átomos de Si y H a temperaturas de filamento de alrededor de 1600 a 1900 °C. Los atomos de Si y H reaccionan con las moléculas originales SiH4 para producir radicales Si2 , H4 y SiH3 , que son responsables del proceso de crecimiento. Como hay un aumento considerable en el interés de la fabricación de nanoestructuras unidimensionales, incluidos aquí los nanohilos, nanoconos y nanotubos, la DVQAC es una alternativa atractiva a la síntesis de nanoestructuras de Si [18].
Por otra parte, los catalizadores metalicos desempeñan un papel primordial en el crecimiento de las nanoestructuras de silicio. Metales como Au, Fe, Cu, Co, Al, In y Ga se utilizan para formar aleaciones de silicio y metal, los cuales tienen una temperatura de fusión mas baja que el silicio (Si ~1100 °C). Entre estos, el Au se convierte en un catalizador favorable ya que forma una aleación de Si-Au al 18,6% que posee un punto de fusión de aproximadamente 363 °C que evita la oxidación en comparación con Al y Fe e induce el crecimiento de las nanoestructuras de Si [14].
El Au también actúa como un candidato prometedor en el proceso de cristalización inducida por el metal (CIM) que promovió la cristalización de silicio amorfo (a-Si). Para el proceso CIM se deposita una fina capa de metal directamente sobre la película de Si y luego se calienta para obtener una estructura de poli-Si. Durante el calentamiento, la difusión de la interfaz de capas de metal-Si induce la formación de estructuras de Si cristalino a una temperatura inferior a la temperatura de cristalización intrínseca de a-Si, que es de 600 °C, se debe considerar que diferentes tipos de metales pueden inducir diferentes grados de cristalización [14].
Además, el Au es resistente a la formación de siliciuros en contraste con Ni y Pt, y previene la oxidación atmosferica en comparacion con Al e In, proporcionando así una mejor calidad de fabricación de nanoestructuras [18].
Sin embargo, el residuo de los mismos metales catalizadores podría inducir una trampa de electrones que reduciría drásticamente la vida útil del portador (Si) y afectaría enormemente el rendimiento de los dispositivos SiNS. No obstante, el desarrollo de la tecnología de crecimiento hidrotermal, tecnología libre de catalizador metílico, puede resolver esos problemas ya que esta no implica el uso de catalizadores. Por el momento, se han realizado muchos intentos para preparar SiNS a través de esta tecnología de crecimiento. Los procesos de incremento hidrotermal se pueden llevar a cabo en diferentes condiciones, seguidas de un grabado con HF para controlar el espesor del revestimiento de sílice [19].
Otra técnica empleada de gran importancia es el grabado químico asistido por metal, este consiste en una técnica simple, rápida y efectiva que permite obtener una amplia gama de nanoestructuras de silicio en una gran superficie, desde nanocables hasta paredes de poro continuo o coalescencia de múltiples alambres, teniendo obleas de silicio completas. En este proceso se puede emplear una solución de HF y AgNO3 u Au donde se genera una deposición rapida del metal el cual genera un grabado de nanoestructuras bien alineadas (o nanohilos) en el Si; si el grabado es asistido por un metal como el oro (Au) con el tiempo el silicio debajo de esta capa se vuelve cada vez mías poroso, y la capa de oro cada vez mías frágil [16].
Biocompatibilidad de las NESis
La evaluación de los posibles riesgos a la salud que puedan presentar los nanomateriales es un tema considerado fundamental en su uso [20]. El silicio elemental no es considerado tóxico para usos biomedicos [21]. Sin embargo, los cambios que sufre el silicio en sus propiedades físicas a nanoescala y el aumento en la reactividad del material, provocan que las posibilidades de una respuesta adversa inesperada sean mayores. El tamaño de la partícula y la dosis de NESis son factores clave en la toxicidad de las mismas, ya que esta aumenta al disminuir el diámetro de partícula [22,23]. Otro factor determinante de toxicidad son las modificaciones superficiales que sufren las NESis posterior a su síntesis; cuando son expuestas a condiciones biológicas, biomoléculas se unen a su superficie, alterando las propiedades y funciones iniciales, por lo que es necesario realizar evaluaciones en ambientes que se asemejen al medio in vivo. Es por esto que algunos autores recomiendan realizar ensayos in vitro para obtener resultados iniciales de toxicidad, viabilidad celular y proliferación [22,24].
Cuando las NESis con terminaciones del tipo Si-H son expuestas a soluciones acuosas, se produce una capa de silicio oxidado. Se ha documentado que el dióxido de silicio aumenta la toxicidad de las NESis y se relaciona con la disrupción de las membranas mitocondriales y la presencia de especies reactivas de oxígeno (ERO) dentro de la célula [25,26]. Las ERO pueden ser originadas cuando la integridad de la membrana mitocondrial ha sido comprometida debido a las interacciones con las nanoestructuras o pueden formarse en la inmediatez de la superficie de las NESis por reacción de Fenton [27]. Esto genera una cascada de reacciones que conducen a un desacoplamiento en la cadena transportadora de electrones, privando a la célula de la producción de ATP mitocondrial, además de una respuesta inflamatoria que termina en muerte celular por apoptosis [23]. Por otro lado, también se ha reportado la toxicidad proveniente de las interacciones entre las NESis con biomoléculas en las proximidades de la célula, fenómeno que da lugar a la formación de sustancias orgánicas tóxicas de larga vida [28]. Un intento para solucionar este inconveniente fue la conjugación del dióxido de silicio superficial con un ligando hidrocarbonado, sin embargo, el resultado fue mayores niveles de especies reactivas de oxígeno y nitrógeno y por tanto un aumento en la toxicidad celular [29]. Por otro lado, lo que si resulta en una disminución del perfil toxico y baja generación de ERO fue la oxidación térmica para nanopartículas de silicio (NPSi) y el cubrimiento con óxidos para nanocables de Si [22]. Otra manera de reducir la toxicidad de las NESis es la oxidación con ozono o la carbonización térmica, pues se forman capas hidrofílicas pasivas que disminuyen su reactividad y el grado de interacciones con las membranas celulares; mientras que aquellas NESis con cargas positivas en su superficie o con propiedades hidrofóbicas interactúan con la bicapa lipídica y provocan daños en la morfología celular [25]. Esto se ejemplifica en estudios donde nanopartículas de silicio con cargas positivas y con superficies hidrofóbicas son capaces de provocar deformaciones en la membrana plasmática de los eritrocitos [29].
Los estudios de hace unos años demuestran que las nanopartículas de silicio que son administradas por vía intravenosa en modelos animales son removidas de la circulación y se acumulan primordialmente en el hígado y el bazo y son por lo tanto degradadas a subproductos que luego son excretados. También se han encontrado pequeñas cantidades en el corazón y riñones [30-32]. El tamaño y forma de partícula también es un factor importante en su biodistribucíon, pues partículas con un aspecto de radio (AR) mayor, son menos degradadas, sin embargo, pueden provocar daños como congestión vascular y necrosis tubular en riñones [33]. En cuanto a las aplicaciones orales de NPSi cargadas con fármacos, los estudios demuestran que transitan el tracto gastrointestinal (GI) sin ser considerablemente absorbidas en revestimiento epitelial intestinal, sin embargo, las moléculas cargo sí son capaces de salir y permear a través del epitelio intestinal [34]. Las NPSis que han sido administradas por vía subcutánea, permaneces en el sitio de inyección por algunas horas antes de ser incorporadas a los sistemas de vasos para su transporte [35]. En general, la literatura demuestra que la conversión de micropartículas porosas de silicio en productos clínicos ha sido buena, lo que establece un precedente positivo para aplicaciones similares con las NESis [36].
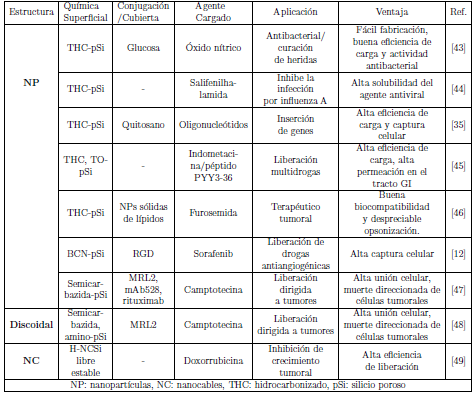
La capacidad que tienen las NESis para atravesar las membranas celulares es una herramienta muy útil para mejorar la entrega de medicamentos, seguimiento celular y detección de especies bioquímicas importantes a nivel celular. Los estudios de la captación de NESis a nivel celular se han hecho manipulando propiedades como las dimensiones de partícula, morfología, composicion superficial y carga neta [37]. La internalización de las NESis está mediada por las interacciones entre la membrana celular y la superficie de la partícula, además, esta ultima se puede modificar para que la partícula siga caminos específicos como por ejemplo la conjugación con folato para el tráfico caveolar [38][12]. A pesar de esto, en la realidad muchos mecanismos endocíticos son los realmente responsables por la integración de las NESis al espacio intracelular (EIC) [39]. Diseñar nano estructuras inteligentes y direccionadas a compartimentos celulares específicos requiere de un conocimiento comprensivo de los mecanismos de endocitosis y trafico intracelular (ver figura 1). El transporte endosomal es altamente influenciado por la forma, lo que puede usarse para incorporar nanoestructuras al EIC; las nanoestructuras con bordes afilados tienden a atravesar y escapar del endosoma con mayor facilidad [40]. Se puede especializar la superficie de las nanopartículas con moléculas que promueven el rompimiento de endolisosomas, para asistir su escape del sistema endolisosomal y aumentar su concentración en el citosol [41].
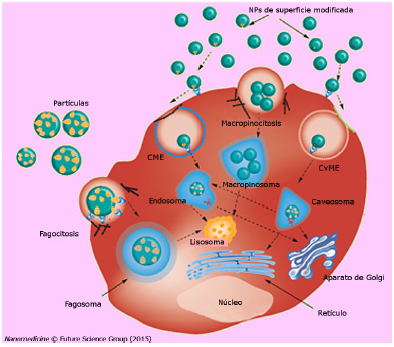
Figura 1 Mecanismo de captura celular de las nanopartículas por endocitosis y transpotadores celulares en células mamíferas. El esquema ilustra brevemente la clasificación del tráfico endocático y diferentes mecanismos de endocitosis. CEM: Endocitosis mediada por clatrina; CvEM: endocitosis mediada por caveolina [35] . Nanomedicine © Future Science Group.
Aplicaciones biomédicas y biotecnológicas
Las NESis son herramientas muy útiles para el direccionamiento y liberación contralada de medicamentos gracias a su gran área superficial, biocompatibilidad y fácil funcionalización. Ha habido investigaciones completas para mejorar la liberación terapéutica de moléculas pequeñas, proteínas, péptidos y genes; modificando el tamaño, porosidad y química superficial es posible ajustar la cinética de liberación, regular la biodistribución y minimizar los efectos citotóxicos [42]. La tabla 1 resume algunos sistemas de liberación controlada de fármacos derivados del uso de NESis y las variaciones fisicoquímicas a las que se les ha sometido.
La adsorción de agentes terapéuticos en las NESis puede ser maximizada a través de modificaciones superficiales que mejoren la unión entre ambas especies. Por ejemplo, con NP se mejoró la adhesión de ARNip luego de una animación superficial. También se logra un efecto similar al aplicar voltaje en partículas cargadas [12]. En el caso de las NPs porosas y los NCs, el tamaño de la molécula cargo, debería ser compatible con el diámetro del poro para que la carga de la partícula se óptima. [50]. La cinética de liberación, depende de la fuerza con que la superficie retenga el agente terapeutico. Un metodo que puede usarse para retardar la tasa liberación de este agente es la cobertura de la partícula con polímeros sensibles, los cuales incluso son capaces de retardar la liberación hasta que la nanoestructura ha alcanzado su blanco extra o intracelular [35,42]. Cuando los agentes farmacológicos se encuentran unidos covalentemente a la nanoestructura, la liberación está relacionada con la tasa de degradación de esta última [51].
Por otro lado, una aplicación importante de los nanocables ha sido la inmovilización de ARNip, péptidos, proteínas y pequeñas moléculas terapéuticas, además de ADN; todo esto realizando aminaciones en la superficie del nanocable. Se han reportado, además, grandes capacidades de carga (hasta 20,8 mg DOX/g NCSi). También se ha reportado perfiles de liberación muy extendidos y de hasta 42 días, debido a la gran reserva de molécula cargo que permiten estas estructuras [49,52].
Normalmente, la penetración en tejido tumoral es complicada, lo que representa un reto para la nanomedicina, pero también una oportunidad. Las NESis, al igual que nanoestructuras a base de lípidos y macromoléculas, presentan un efecto de permeabilidad y retención mejorada, lo que explica la tendencia que tienen a acumularse en la vasculatura fenestrada de los tumores. Esto ha sido aprovechado para vectorizar agentes quimioterapéuticos al aumentar la acumulación de los mismos en los sitios tumorales [53].
Otro tratamiento efectivo para ciertos tipos de cáncer ha sido el uso de terapia fotodinámica, basada en la generación de calor o radicales de oxígeno por materiales sensibles a la luz [54]. La exposición de Si a la luz visible, genera especies excitadas de oxígeno en su superficie a temperaturas fisiológicas [55]. Aprovechando este fenómeno, se han diseñado SiNPs fotosensibles que pueden inducir la muerte en líneas celulares tumorales [54,56]. Los nanomateriales basados en Si también pueden emplearse para inducir hipertermia mediada por radiación cercana al infrarrojo en alguno tejidos cancerosos [57].
Los sensores y sondas construidos a base de Si, son herramientas potencialmente buenas para cumplir los requerimientos como la confiabilidad, baja toxicidad y seguimiento en tiempo real, que son extremadamente importantes para el análisis bioquímico moderno, la elucidación de eventos biológicos y sus mecanismos celulares y moleculares.
Esto gracias a las propiedades que presentan las NPSis como un alta y estable intensidad de fluorescencia [58]. En virtud de estas mismas características, es posible realizar caracterizaciones sistemáticas del bio-comportamiento de las NPSis en los mecanismos de internalización celular, tráfico intracelular y su metabolización, elementos esenciales en la evaluación toxicológica de estos nanomateriales [59-62].
Para ampliar, en 2016 cuando un grupo de investigadores desarrollaron nanocompuestos de silicio, encapsulados en polietilenimina (PEI) que además poseían gran fluorescencia, alta capacidad de unión al ADN (~97%) y una eficiencia de transferencia aceptable (~35 %) en células de carcinoma cervical humano (HeLa). Se pudo seguir entonces la dinámica de los transportadores de Si por medio de la detection de señales fluorescentes azules (Figura 2A, panel superior). La trayectoria entera mostraba a los transportadores moviéndose hacia el espacio perinuclear, lo cual es sumamente ventajoso para llevar material genético al núcleo celular (Figura 2A, panel inferior) [63]. Otro caso reportado ha sido la funcionalización de las NPSis con péptidos cíclicos RGD, que resultan en sondas que permiten monitorear los mecanismos de endocitosis mediados por integrinas (observando por aproximadamente 120 min) [65]. Estas biosondas NPSis-RGD, fueron mías adelante usadas para etiquetar y señalar células musculares de la pared corporal en C. elegans, usando como blanco la integrina PAT-3 (Figura 2B) [62]. Estos trabajos sugieren que las NPSis funcionalizadas con RGD pueden ser utilizadas como una herramienta para la imagenología in vitro e in vivo, lo que tambien ha sido confirmado por investigadores que desarrollaron aplicaciones in vivo relacionadas con cáncer de manera independiente [66,67]. Una manera de mejorar la resolución de estos ensayos es utilizar técnicas de control de tiempo (CT), un ejemplo se ilustra en la figura 2C, donde los cultivos en conjunto A431 (células de carcinoma epidermoide humano) y SKOV3 (celulas de carcinoma de ovario humano) fueron inmunoteñidos, usando fluoresceína - isotiocianato (ITC) y NPSis (respectivamente); el resultado fue que no podían ser separados uno de otro por medio de las imágenes de fluorescencia o componente de vida corta, mientras que solo las células SKOV3 (que fueron tratadas con NPSis) mostraron señales de florescencia en componente de vida larga. Estas demostraciones implican que la técnica basada en NPSis - componente de vida larga tiene un gran potencial para contraste y para imagenología de alta sensibilidad óptica, tan precisa como para el discernimiento de márgenes tumorales durante una cirugía sin alterar tejidos aledaños que puedan presentar autofluorescencia o con cromóforos con fluorescencia de vida corta [64].
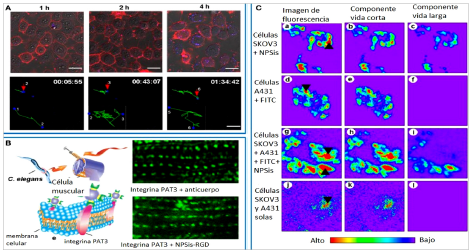
Figura 2 (A) Imágenes confocales de captura celular dependiente del tiempo para nanocomplejos de PEI-NPSis/ADN en células HeLa (panel superior). Panel inferior: rastreo en tiempo real del movimiento de los nanocomplejos en la célula. [63] Copyright (2016) Springer. (B) Ilustración esquematice/, de NPSi - RGD para etiquetar integrina PAT3 (panel izquierdo) y etiquetado especifico de PAT3 a nivel subcelular [62] . Copyright (2017) Springer. (C) Ensayo de fluorescencia con tecnica de control de tiempo para dos cultivos de células cancerosas humanas [64] . Copyright (2017) ACS Publications.
En la última década, se han alcanzado logros emocionantes en el área de los sensores basados en nanomateriales de silicio y nanohíbridos, los cuales han permitido a su vez determinar una gama amplia de especies químicas y biológicas en formas importantemente confiables y sensibles [58]. En esta sección se hará énfasis en los sensores basados en silicio, como lo son el transistor de efecto de campo (FET, siglas en ingles), sensores fluorescentes y los sensores por dispersión Raman en superficie mejorada (SERS, siglas en inglés).
A la fecha, los sensores FET basados en NCSis, para la determinación de numerosas especies, en tiempo real, sin necesidad de marcadores y de manera sensible; incluyendo reactivos químicos y especies bioquímicas relevantes, por ejemplo, iones sodio [68], ácidos nucleicos [69,70], biomarcadores tumorales [71], y proteínas [72] etc. En la figura 3, se ilustra esta aplicación de los NCSis-FET con proteínas, dónde se utilizan las curvas cinéticas de disociación de anticuerpos-antígenos en NCSis modificados. En este caso, los NCs fueron modificados con anti-CA 15-3 para detectar inmunoglobulinas cancerígenas monoclonales antihumano de ratón (15-3 IgG). Los antígenos, se retenían mejor en aquellos NCs que poseían anticuerpos unidos a su estructura, mientras que los NCs no modificados, no retenían el antígeno, luego del lavado con buffer. En adición al uso convencional de estos sensores, otro grupo desarrolló un material híbrido, mezclando NCSis-FET con sistema nanoelectrónico en forma de malla para medir la actividad neuronal. Los dispositivos congelados se insertaron estereotácticamente en cerebros de roedores y permitieron leer potenciales eléctricos de campo local, abriendo una ventana al uso de nanomateriales en el mapeo cerebral [73].
Figura 3 Esquema mostrando la forma de trabajo con un dispositivo NCSis-FET conjugado con anticuerpos vs un blanco sin respuesta inmuno-proteica. (panel izquierdo) Curvas cinéticas para la detección de antígeno CA 15-3 con este mismo dispositivo. (panel derecho) [72] . Copyright (2016) ACS Publications.
En bondad de la fuerte y estable fluorescencia de los nanomateriales de silicio, se han diseñado distintos sensores para la detección de especies químicas y biológicas como glucosa [74], agroquímicos [75], explosivos nitroaromáticos [76]. Otra aplicación importante se logró al dopar nanorods de silicio (NRSis) con europio (Eu@NRSis), para medir las fluctuaciones en el pH intracelular, basándose en detección radiométrica sin necesidad de utilizar mías sustancias químicas [77].
En la figura 4 (panel izquierdo) se ilustra cómo estos sensores exhibieron un amplio espectro de lectura de pH (~ 3-9), observación que es congruente con la regresión linear mostrada en el panel derecho de la misma figura.
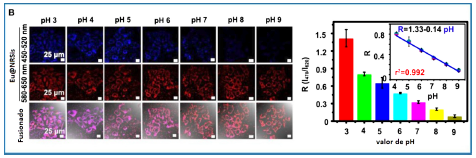
Figura 4 Esquema mostrando la Eu@NRSis para determinación de pH intrecelular. Panel izquierdo: células MCF-7 con distintos valores de pH citosólico y los Eu@NRSis internalizados. Panel derecho: histogramas de la intensidad de fluorescencia (R=I 47 q [77] . Copyright (2017) ACS Publications.
Los SERS, en general, son capaces de amplificar significativamente las debiles señales en espectroscopia Raman (1014~1015) permitiendo explorar señales al nivel de moléculas solas. A diferencia de los SERS donde se utilizan solamente NPs de Au o Ag, aquellos donde se han utilizado matrices nanohíbridas del tipo Au/Ag-NPSis o arreglos con NCSis, en estos últimos se obtiene una mejor reproducibilidad y un realce general de la técnica [78]. Tomando ventaja de estas características, los sustratos o matrices basados en NESis híbridas han permitido el análisis de diversas muestras químicas y biológicas en función de buena sensibilidad y confiabilidad, por ejemplo, en células apoptóticas [79], bacterias [80], iones plomo [81]. Gracias a estas importantes aplicaciones, se han diseñados SERS portátiles con excelentes plataformas analíticas, que pueden convertirse también en herramientas valiosas para el análisis ambiental en campo [58].
Recientes investigaciones [82] han determinado nuevas fuentes de silicio de origen natural. En esta investigación se obtiene micropartículas de sílice del proceso de la biorefinería de los desechos del procesamiento de la piña. En la figura 5 se observan los resultados en la Microscopía Electrónica de Barrido (SEM) para esas muestras.
Se muestra el alto potencial de las micropartículas de sílice para ser empleada en procesos de obtencioín de materiales catalizadores.